Свертывание крови связано с переходом
Свертывания крови связано с переходом фибрина в фибриноген
— ферментный каскад, в котором проферменты, переходя в активное состояние , способны активировать другие факторы свертывания крови.
Первая включает в себя комплекс последовательных реакций, приводящих к образованию протромбиназы.
Во вторую фазу происходит переход протромбина в тромбин (фактора II в фактор IIa);
в третью – из фибриногена образуется фибриновый сгусток.
Образование протромбиназы может осуществляться по внешнему и внутреннему механизму.
Внешний механизм предполагает обязательное присутствие тромбопластина (TF, или F-III), внутренний же связан с участием тромбоцитов (парциальный тромбопластин, или фактор P3). Вместе с тем, внутренний и внешний пути образования протромбиназы имеют много общего, ибо активируются одними и теми же факторами (фактор XIIa, калликреин, ВМК и др.), а также приводят в конечном итоге к появлению одного и того же активного фермента – фактора Ха, выполняющего в комплексе с фактором Va функции протромбиназы.
По обе стороны мембраны существует ионная асимметрия. Для процесса свертывания крови очень важна асимметрия в содержании ионов Са 2+ , концентрация которых в плазме и интерстициальной жидкости в десять тысяч раз больше, чем в цитоплазме клетки и тромбоците. Как только травмируется стенка сосуда, в цитоплазму из внеклеточной жидкости или из внутриклеточного депо переходит значительное количество ионов Са 2+ . Поступление Cа 2+ в тромбоцит или клетки (травмированный эндотелий и т.п.) разрыхляет мембрану и выключает механизмы поддержания асимметрии фосфолипидного бислоя. При этом молекулы фосфатидилсерина и фосфатидилэтаноламина, несущие суммарные отрицательные заряды, переходят на поверхность мембраны.
Формирование протромбиназы по внешнему пути начинается с активации фактора VII при его взаимодействии с тромбопластином, а также с факторами ХIIa, IXa, Xa и калликреином. В свою очередь фактор VIIa активирует не только фактор Х, но и IX. В процессе образования протромбиназы по внешнему механизму могут также принимать участие факторы IXa и VIIIa, образующие активный комплекс на фосфолипидной матрице. Однако эта реакция протекает относительно медленно.
Формирование протромбиназы по внешнему пути происходит чрезвычайно быстро (занимает секунды) и ведет к появлению фактора Ха и небольших порций тромбина (IIa), который способствует необратимой агрегации тромбоцитов, активации факторов VIII и V и значительно ускоряет образование протромбиназы по внешнему и внутреннему механизму.
Инициатором внутреннего пути образования протромбиназы является фактор XII, который активируется травмированной поверхностью, кожей, коллагеном, адреналином, после чего переводит фактор XI в XIа. В этой реакции принимает участие калликреин (активируется фактором XIIa) и ВМК (активируется калликреином). Фактор XIa оказывает непосредственное влияние на фактор IX, переводя его в фактор IXa. Специфическая деятельность последнего направлена на протеолиз фактора X (перевод его в фактор Ха) и протекает на поверхности фосфолипидов тромбоцита при обязательном участии фактора VIII (или VIIIa). Комплекс факторов IXa, VIIIa на фосфолипидной поверхности тромбоцитов получил наименование теназы, или теназного комплекса.
Как уже отмечалось, в процессе свертывания крови принимают участие прекалликреин и ВМК, благодаря которым (а также фактору ХII) происходит объединение внешнего и внутреннего пути свертывания крови. В настоящее время установлено, что при травме сосуда всегда происходит освобождение металлопротеидов, переводящих прекалликреин в калликреин. Под воздействием калликреина ВМК переходит в ВМКа. Кроме того, калликреин способствует активации факторов VII и XII, что также сопровождается запуском каскадного механизма свертывания крови.
Вторая фаза процесса свертывания крови (переход фактора II в фактор IIa) осуществляется под влиянием протромбиназы (комплекса Xa+Va+Ca 2+ ) и сводится к протеолитическому расщеплению протромбина, благодаря чему появляется фермент тромбин, обладающий свертывающей активностью
Третья стадия процесса свертывания крови – переход фибриногена в фибрин – включает 3 этапа. На первом из них под влиянием фактора IIa от фибриногена отщепляются 2 фибринпептида А и 2 фибринпептида В, в результате чего образуются фибрин-мономеры. На втором этапе, благодаря процессу полимеризации, формируются вначале димеры и олигомеры фибрина, трансформирующиеся в дальнейшем в волокна фибрина – протофибриллы легко растворимого фибрина, или фибрина s (soluble), быстро лизирующегося под влиянием протеаз (плазмина, трипсина). В процесс образования фибрина вмешивается фактор XIII (фибриназа, фибринстабилизирующий фактор), который после активации тромбином в присутствии Ca 2+ прошивает фибринполимеры дополнительными перекрестными связями, благодаря чему появляется труднорастворимый фибрин, или фибрин i (insoluble). В результате этой реакции сгусток становится резистентным к мочевине и фибринолитическим (протеолитическим) агентам и плохо поддается разрушению (рис. 28).
Образовавшийся фибриновый сгусток, благодаря тромбоцитам, входящим в его структуру, сокращается и уплотняется (наступает ретракция) и прочно закупоривает поврежденный сосуд.
По материалам alexmed.info
При разрыве кровеносного сосуда или активации определенных веществ в крови сначала формируется активатор протромбина. В присутствии достаточного количества ионов кальция он вызывает превращение протромбина в тромбин. В течение следующих 10-15 сек тромбин вызывает полимеризацию молекул фибриногена в нити фибрина. Таким образом, скорость развития свертывания крови обычно ограничивает образование активатора протромбина, а не последующие реакции, формирующие сам сгусток, поскольку в норме они осуществляются быстро.
Важную роль в превращении протромбина в тромбин играют также тромбоциты в связи с прикреплением многих молекул протромбина к соответствующим рецепторам на тромбоцитах, уже связанных с поврежденной тканью.
Протромбин и тромбин. Протромбин представляет собой белок плазмы альфа2-глобулин с молекулярной массой 68700. Он присутствует в нормальной плазме в концентрации примерно 15 мг/дл. Это нестабильный белок, который легко расщепляется на более мелкие соединения, одно из которых — тромбин с молекулярной массой 33700, что составляет практически половину молекулярной массы протромбина.
Протромбин постоянно формируется печенью и постоянно используется в организме для свертывания крови. Если печень не способна синтезировать протромбин, примерно через сутки его концентрация в плазме снижается до значений, слишком низких для обеспечения нормального свертывания крови.
Для синтеза протромбина и некоторых других факторов свертывания печень нуждается в витамине К. Следовательно, недостаток этого витамина или болезнь печени, при которой нарушается нормальный синтез протромбина, могут привести к резкому снижению уровня протромбина, что проявляется склонностью к кровотечениям.
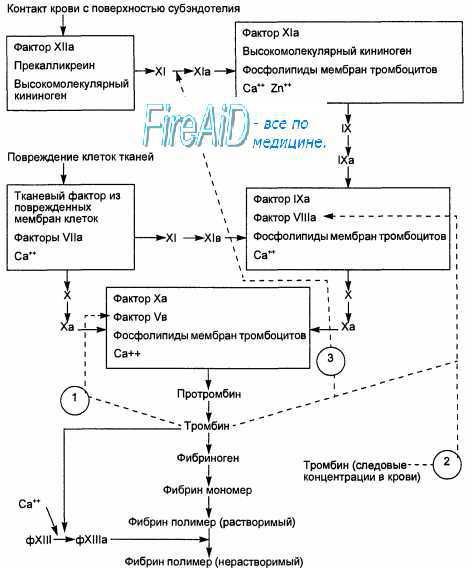 Схема формирования коагуляционного гемостаза. 1 — активация тромбином ф.V; 2 — активация тромбином ф-VIII, высвобождаемого из связи с ф.Вилленбранта; 3 — активация тромбином ф.ХI.
Схема формирования коагуляционного гемостаза. 1 — активация тромбином ф.V; 2 — активация тромбином ф-VIII, высвобождаемого из связи с ф.Вилленбранта; 3 — активация тромбином ф.ХI.
Контакт крови с поверхностью субэндотелия активирует «внутренний» путь свертывания крови; контакт крови с поврежденными клетками ткани активирует «внешний» путь активации свертывания крови.
Фибриноген. Фибриноген представляет собой высокомолекулярный белок (молекулярная масса 340000), концентрация которого в плазме составляет 100-700 мг/дл. Фибриноген образуется в печени, и при заболеваниях печени его концентрация в циркулирующей крови может снижаться, как и концентрация протромбина, о чем говорилось ранее.
В связи с большим размером молекулы фибриногена в норме практически не выходят из кровеносных сосудов в интерстициальную жидкость, и поскольку фибриноген является необходимым фактором свертывания, интер-стициальные жидкости обычно не свертываются. Однако при патологически повышенной проницаемости капилляров фибриноген вытекает в тканевые жидкости в достаточных количествах, чтобы вызвать свертывание в этих тканях практически тем же путем, как свертываются плазма и цельная кровь.
Формирование фибрина при действии тромбина на фибриноген. Тромбин является ферментом со слабой протеолитической способностью. Он действует на фибриноген, удаляя 4 низкомолекулярных пептида от каждой молекулы фибриногена, в результате формируются одиночные молекулы фибрин-мономеров, способные автоматически объединяться между собой с формированием нитей фибрина. Таким образом, молекулы фибрин-мономеров полимеризуются в длинные нити фибрина, составляющие основу сети кровяного сгустка.
На ранних этапах полимеризации молекулы мономеров фибрина удерживаются вместе с помощью слабых нековалентных водородных связей, и вновь формирующиеся волокна не скрепляются друг с другом поперечными связями; в результате сгусток получается слабым и легко «рассыпается» на отдельные нити. Однако в течение нескольких следующих минут осуществляется другой процесс, значительно укрепляющий сеть фибрина. Этот процесс требует участия особого вещества, называемого фибрин-стабилизирующим фактором. Небольшое количество этого фактора присутствует в крови в норме среди плазменных глобулинов, но он также высвобождается из тромбоцитов, захваченных в тромб.
На волокна фибрина фибрин-стабилизирующий фактор влияет лишь после его активации, которая осуществляется под влиянием того же тромбина, вызывающего образование фибрина. Затем активированный фибрин-стабилизирующий фактор действует как фермент, который вызывает ковалентное связывание все большего числа молекул фибрин-мономера, а также многочисленное поперечное связывание прилежащих волокон фибрина, чрезвычайно усиливая трехмерную структуру их сети.
По материалам meduniver.com
Гемостаз – это система, которая поддерживает жидкое состояние крови и предупреждает развитие кровотечений. Кровь осуществляет жизненно важные функции в организме человека, поэтому значительная потеря крови грозит нарушением работы всех органов и систем.
Система свертывания крови включает три составляющие:
- Собственно свертывающую систему – непосредственно осуществляет коагуляцию крови.
- Противосвертывающую систему – действие направлено на предотвращение сворачивания крови (патологического тромбообразования).
- Фибринолитическую систему – обеспечивает распад образовавшихся тромбов.
Свертывание крови – физиологический процесс, предотвращающий выход плазмы и клеток крови из кровеносного русла, путем поддержания целостности сосудистой стенки.
Учение о свертываемости крови сформировал А. Шмидт еще в прошлом столетии. При возникновении кровотечения активируются и участвуют в его остановке такие структуры как: эндотелий, факторы свертывания, форменные элементы, в большей мере тромбоциты. Для осуществления коагуляции крови нужны вещества, такие как кальций, протромбин, фибриноген.
Процесс свертывания крови начинается с включения сосудисто-тромбоцитарного этапа. Существует четыре стадии:
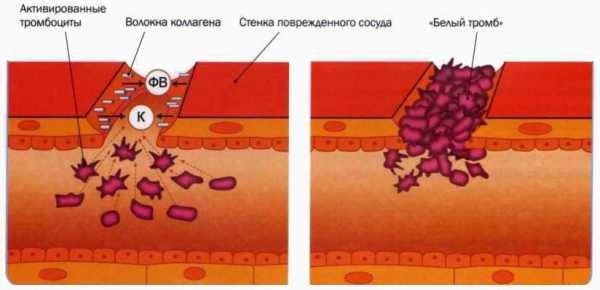
- Идет кратковременный спазм в сосудистом русле, который длится около 1 минуты. Диаметр просвета сужается на 30% под действием тромбоксана и серотонина, которые выделяются из активированных тромбоцитов.
- Адгезия тромбоцитов – начинается скапливание тромбоцитов возле поврежденного участка, они видоизменяются – меняют форму и формируют отростки, и способны прикрепится к сосудистой стенке.
- Агрегация тромбоцитов – процесс склеивания тромбоцитов друг с другом. Формируется неплотный тромб, способный пропускать плазму, как следствие все больше тромбоцитов наслаиваются на новообразованный тромб. Потом он уплотняется и плазма не проходит сквозь плотный сгусток – наступает необратимая агрегация тромбоцитов.
- Ретракция тромба – продолжающееся уплотнение тромботического сгустка.
Сосудисто-тромбоцитарный способ прекращения кровотечения – это первичный гемостаз, есть более сложный механизм свертывания крови – это вторичный гемостаз, происходит с помощью ферментных и неферментных веществ.
Существует 3 фазы свертывание крови на этапе вторичного гемостаза:
- Фаза активации – ферменты активируются, все заканчивается образованием протромбиназы и получением тромбина из протромбина;
- фаза коагуляция – формирование фибриновых нитей из фибриногена;
- фаза ретракции – идет образование плотного тромба.
 Механизм образования первичного тромба
Механизм образования первичного тромба
Плазменные факторы свертывания крови – совокупность неактивных ферментов и неферментных соединений, которые обитают в плазменной части крови и кровяных пластинках. Для свертывания крови помимо прочего необходимы ионы Са (IV) и витамин К.
Когда повреждаются ткани, разрываются сосуды, идет гемолиз клеток крови включается череда реакций с активацией ферментов. Начало активации обусловлено взаимодействием плазменных факторов свертывания с разрушенными тканями (внешний тип активации коагуляции), частями эндотелия и форменных элементов (внутренний тип активации коагуляции).
Из оболочки разрушенных клеток в кровяное русло попадает специфический белок – тромбопластин (III фактор). Он активирует VII фактор, присоединяя молекулу кальция, эта новообразованная субстанция воздействует на X фактор для последующей активации. После X фактор соединяется с тканевыми фосфолипидами и V фактором. Сформировавшийся комплекс за пару секунд преобразовывает долю протромбина в тромбин.
Под действием разрушенного эндотелия или форменных элементов активируется XII фактор, который после воздействия кининогена плазмы активирует XI фактор. XI действует на IX фактор, который после перехода в активную фазу формирует комплекс: «коагуляционный фактор (IX) + Антигемофильный фактор В (VIII) + тромбоцитарный фосфолипид + ионы Са (IV)». Он активирует фактор Стюарта-Прауэра (X). Активированный X совместно с V и ионами Са действуют на фосфолипидную оболочку клетки и формируют новое образование – кровяную протромбиназу, которое обеспечивает переход протромбина в тромбин.
К плазменным факторам свертывания относятся неферментные белки – акселераторы (V, VII). Они нужны для эффективного и быстрого оседания крови, потому что ускоряют коагуляцию в тысячи раз.
Внешний механизм свертывания крови длится примерно 15 секунд, на внутренний приходится от 2 до 10 минут. Завершается эта фаза свертывания образованием тромбина из протромбина.
Протромбин синтезируется в печени, чтобы синтез осуществлялся нужен витамин К, который поступает с едой и накапливается в печеночной ткани. Таким образом, при поражении печени или недостатке витамина К, система свертывания крови не функционирует нормально, и часто возникает неконтролируемый выход крови из сосудистого русла.
Свертывание крови связано с переходом I фактора в нерастворимую субстанцию — фибрин. Фибриноген – гликопротеин, который при воздействии тромбина распадается на низкомолекулярное вещество — мономеры фибрина.
Следующий шаг образование неплотной массы – геля фибрина, из него формируется фибриновая сеть (белый тромб), нестабильная субстанция. Для ее стабилизации включается фибринстабилизирующий фактор (XIII) и тромб закрепляется в участке повреждения. Образованная сеть фибрина задерживает кровяные тельца — тромб становится красным.
Ретракция кровяного сгустка идет при участии белка тромбостенина, Са, фибриновых нитей, актина, миозина, которые обеспечивают сжатие образованного тромба, тем самым предотвращают полную закупорку сосуда. После фазы ретракции восстанавливается кровоток по поврежденному сосуду, а тромб плотно прилегает и фиксируется к стенке.
Для предотвращения дальнейшего свертывания крови в организме активируется противосвертывающая система. Ее основные составляющие: нити фибрина, антитромбин III, гепарин.
К неповрежденным сосудам кровяные пластинки не адгезируются, этому способствуют сосудистые факторы: эндотелий, соединения гепарина, гладкость внутренней выстилки сосудов и др. Таким образом, в системе гемостаза поддерживается равновесие, и функционирование организма не нарушается.
Существует ряд методов определения время коагуляции. Для применения способа по Сухареву, каплю крови помещают в пробирку и ждут, когда она выпадет в осадок. При отсутствии патологии, продолжительность свертывания составляет 30 – 120 секунд.
Свертываемость по Дуке определяют следующим образом: производят прокол мочки уха и через 15 секунд промокают область прокола специальной бумагой. Когда кровь не будет появляться на бумаге, значит коагуляция произошла. В норме время свертывания по Дуке от 60 до 180 секунд.
При определении свертывания венозной крови пользуются методикой Ли-Уайта. Необходимо набрать 1 мл крови из вены и поместить в пробирку, наклонить под углом 50°. Проба заканчивается, когда кровь не вытекает из колбы. В норме продолжительность свертывания не должна превышать 4-6 минут.
Время свертывания может увеличиваться при геморрагическом диатезе, врожденной гемофилии, недостаточном количестве тромбоцитов, при развитии диссеминированного внутрисосудистого свертывания и других заболеваниях.
По материалам animals-world.ru
Третья стадия процесса свертывания крови – переход фибриногена в фибрин – включает 3 этапа. На первом из них под влиянием фактора IIa от фибриногена отщепляются 2 фибринпептида А и 2 фибринпептида В, в результате чего образуются фибрин-мономеры. На втором этапе, благодаря процессу полимеризации, формируются вначале димеры и олигомеры фибрина, трансформирующиеся в дальнейшем в волокна фибрина – протофибриллы легко растворимого фибрина, или фибринаs(soluble), быстро лизирующегося под влиянием протеаз (плазмина, трипсина). В процесс образования фибрина вмешивается фактор XIII (фибриназа, фибринстабилизирующий фактор), который после активации тромбином в присутствии Ca 2 + прошивает фибринполимеры дополнительными перекрестными связями, благодаря чему появляется труднорастворимый фибрин, илифибринi(insoluble). В результате этой реакции сгусток становится резистентным к мочевине и фибринолитическим (протеолитическим) агентам и плохо поддается разрушению (рис. 28).
Образовавшийся фибриновый сгусток, благодаря тромбоцитам, входящим в его структуру, сокращается и уплотняется (наступает ретракция) и прочно закупоривает поврежденный сосуд.
Несмотря на то, что в циркуляции имеются все факторы, необходимые для образования тромба, в естественных условиях при наличии целых сосудов кровь остается жидкой. Это обусловлено наличием в кровотоке противосвертывающих веществ, получивших название естественные антикоагулянты,и фибринолитического звена системы гемостаза.
Естественные антикоагулянты делятся на первичные и вторичные. Первичныеантикоагулянтывсегда присутствуют в циркуляции,вторичные– образуются в результате протеолитического расщепления факторов свертывания крови в процессе формирования и растворения фибринового сгустка.
Первичные антикоагулянты можно разделить на 3 основные группы: 1) обладающие антитромбопластическим и антипротромбиназным действием (антитромбопластины); 2) связывающие тромбин (антитромбины) и 3) предупреждающие переход фибриногена в фибрин (ингибиторы самосборки фибрина).
К антитромбопластинам, в первую очередь,относится ингибитор внешнего пути свертывания(TFPI). Установлено, что он способен блокировать комплекс факторовIII+VII+Ха+Са 2+ , благодаря чему предотвращается образование протромбиназы по внешнему механизму. Недавно обнаружен еще один ингибитор внешнего пути образования протромбиназы, получивший наименованиеTFPI2(анексинV), однако он обладает меньшей активностью, чемTFPI.
К ингибиторам, блокирующим образование протромбиназы, относятся витамин-К-зависимые протеины С, S (PrC, PrS)и особый белок, синтезируемый эндотелием, –тромбомодулин. Под воздействием тромбомодулина и связанного с ним тромбинаPrCпереходит в активное состояние (PrCa), чему способствует кофакторPrS. PrCaразрезает пополам факторы V и VIII и тем самым препятствует образованию протромбиназы по внутреннему пути и переходу протромбина в тромбин.
Недавно появились сообщения, что PrSспособен связывать фактор Ха. Эта реакция не зависит от фосфолипидной поверхности и усиливается в присутствииPrC.
Одним из ведущих антикоагулянтов является белок антитромбин III (A-III), имеющий молекулярную массу (ММ) 58 кДа. СамостоятельноA-IIIобладает слабым антикоагулянтным действием. В то же время он способен образовывать комплекс с сульфатированным полисахаридом гликозамингликаномгепарином(Г) –A-III+Г. Этот комплекс связывает факторы IIa, IXa, Xa, XIa, XIIa, калликреин и плазмин. Существует высокомолекулярный гепарин (нефракционированный) с ММ от 25 до 35 кДа и низкомолекулярный гепарин с ММ менее 5 кДа. Последний в меньшей степени нуждается во взаимодействии с A-III и нейтрализует преимущественно фактор Xa, ибо его цепочка мала и «не дотягивается» дотромбина.Низкомолекулярный Г в большей степени, чем высокомолекулярный, способствует высвобождению из эндотелияTFPI, благодаря чему его антикоагулянтная активность возрастает. Следует также заметить, что низкомолекулярные гепарины ингибируют прокоагулянтную активность поврежденного эндотелия и некоторых протеаз, выделяемых гранулоцитами и макрофагами (рис. 29).
За последнее время появились сообщения о наличии еще одного антикоагулянта – белка антитромбинаII, однако его активность уступает A-III.
Важным ингибитором свертывания является кофактор гепарина II, связывающего тромбин. Его действие усиливается во много раз при взаимодействии с гепарином.
Ингибитором тромбина, факторов IXa, XIa, XIIa и плазмина является1-антитрипсин. Слабым ингибитором тромбина, калликреина и плазмина служит2—макроглобулин.
К первичным антикоагулянтам следует также отнести аутоантителак активнымфакторам свертывания крови(IIa, Xa и др.), которые всегда присутствуют в кровотоке, а также покинувшие клетку рецепторы (так называемые «плавающиерецепторы») к активированным факторам свертывания крови. Однако их роль в условиях нормы и патологии пока еще далека от окончательного выяснения.
Следует заметить, что при снижении концентрации первичных естественных антикоагулянтов создаются благоприятные условия для развития тромбофилий и диссеминированного внутрисосудистого свертывания крови – ДВС-синдрома.
К вторичным антикоагулянтам относятся «отработанные» факторы свертывания крови (принявшие участие в свертывании) и продукты деградации фибриногена и фибрина (ПДФ), обладающие антиагрегационным и противосвертывающим действием, а также стимулирующие фибринолиз. Роль вторичных антикоагулянтов сводится к ограничению внутрисосудистого свертывания крови и распространения тромба по сосудам.
Основные естественные антикоагулянты
По материалам studfiles.net
Свертывание крови связано с переходом - Лечение гипертонии
- 1 Этиология
- 2 Симптоматика гипертензивного синдрома
- 2.1 Особенности протекания у детей
- 3 Диагностика
- 4 Виды лечения
- 5 В чем опасность заболевания?
Многие годы безуспешно боретесь с ГИПЕРТОНИЕЙ?
Глава Института: «Вы будете поражены, насколько просто можно вылечить гипертонию принимая каждый день...
Читать далее »
Состояние, вызванное стабильным повышением внутричерепного давления, охватывающее все участки мозга, называется гипертензивный синдром. Гипертензия головного мозга у мужчин встречается чаще, чем у женщин. В педиатрии такой диагноз — распространенное явление среди детей обоих полов младшей возрастной группы, перенесших перинатальную энцефалопатию. Клинические проявления гипертензивного синдрома свидетельствуют о наличии ряда серьезных болезней в стадии прогресса.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для лечения гипертонии наши читатели успешно используют ReCardio. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию. Подробнее здесь…
Этиология
Важно различать гипертонический и гипертензивный синдромы. Гипертонический синдром — развитие вторичной артериальной гипертонии на фоне прогрессирующего системного заболевания.
на
Этиология гипертензивного синдрома достоверно не изучена. Нарушенные секреция, всасывание и циркуляция ликвора (спинномозговой жидкости), увеличение мозга в объеме, застой венозной крови в полости черепа — факторы, провоцирующие повышение давления внутри черепной коробки. В зависимости от возраста больного причины синдрома делятся на врожденные и приобретенные.
| Причины развития | |
| Врожденные (у новорожденных) | Приобретенные (у детей и взрослых) |
| перенесенные во время беременности болезни вирусного и инфекционного характера; | новообразования мозга; |
| кислородное голодание плода; | последствия инсульта; |
| задержка в развитии плода; | травмы головы; |
| обезвоживание плода вследствие подтекания околоплодных вод; | сбои в обмене веществ; |
| родовые и внутриутробные травмы головы; | внутричерепные кисты; |
| наличие хронических заболеваний у матери; | поражения мозга гельминтами; |
| аномалии перинатального периода; | вирусные и бактериальные инфекции коры и оболочек мозга; |
| преждевременные и запоздалые роды. | остеохондроз шейного отдела позвоночника. |
Вернуться к оглавлению
Одним из основных симптомов внутричерепного давления являются головные боли.
Внутричерепное давление провоцируют множество заболеваний, однако характерные неврологические особенности позволяют выделить рассматриваемый недуг из общей клинической картины заболевания. Основные симптомы заболевания:
- головные боли;
- приступы тошноты и рвоты;
- головокружение;
- чувство слабости;
- помутнение сознания;
- нарушение речевой и зрительной функций.
Головную боль вызывает раздражение ветвей V, X, IX пар черепно-мозговых нервов, рецепторов мягкой оболочки, синусов твердой мозговой оболочки. Приступы боли распирающего характера случаются чаще в утренние часы, усугубляются после физической активности, наклонов головы вниз и нахождения на солнце. Начальная стадия заболевания сопровождается болевыми приступами несколько раз в день, со временем боль сопровождает пострадавшего постоянно, появляются симптомы вегето-сосудистой дистонии.
Повышенное внутричерепное давление раздражает вестибулярный анализатор и рвотный центр. Рвота, не связанная с приемом пищи, возникает неожиданно и сопровождает болевые приступы. Может возникать натощак, при смене позы тела. Сопутствующими факторами являются головокружение и общее чувство слабости. Расстройство мышления, нарушение речевой и зрительной функций усугубляются с течением заболевания.
Вернуться к оглавлению
Особенности протекания у детей
Повышение внутричерепного давления у детей может привести к необратимым последствиям.
Болезнь у детей протекает по-разному, в зависимости от возраста ребенка. У младенцев повышение внутричерепного давления связано с гидроцефалией, вследствие которой увеличенные спинномозговые каналы провоцируют давление ликвора на мозг. Гидроцефалия — активно прогрессирующее заболевание, в отсутствии квалифицированной медицинской помощи приводящее к необратимым процессам в организме ребенка. Повышение внутричерепного давления вызывают нарушение выработки и всасывания спинномозговой жидкости в подпаутинное пространство мозговых каналов, появление препятствий для ее циркуляции.
Новорожденные дети не могут рассказать о беспокоящих их болях, поэтому родители должны обратить внимание на необычное поведение ребенка:
- беспричинный плач;
- приступы рвоты чаще 1-го раза в день;
- неспокойный короткий сон;
- гипертонус мышц;
- набухание родничков и отсутствие в них пульсации.
Особо тревожные признаки, свидетельствующие о наличии серьезных отклонений:
- деформация головы;
- отставание в психическом и физическом развитии ребенка.
Возрастному периоду от 1-го до 2-х лет характерно острое течение гипертензивного синдрома, сопровождающееся продолжительной рвотой, судорогами и обмороками. В старшем возрасте повышение внутричерепного давления могут спровоцировать новообразования головного мозга, кровоизлияния, сужение ликворных протоков, нейроинфекционные заболевания. Ребенка беспокоит сильная головная боль, нарушаются двигательные функции, появляются позывы к рвоте, возможно развитие эндокринных заболеваний.
Вернуться к оглавлению
Диагностика
 Аппаратные исследования помогут установить точный диагноз.
Аппаратные исследования помогут установить точный диагноз.
Диагностировать заболевание сложно. При врожденном характере болезни проверяют, как у ребенка работают основные рефлексы. Измерение головы помогает выявить отклонения в развитии. Взрослые и дети старшего возраста проходят комплексную аппаратную диагностику, включающую ультразвуковое исследование и компьютерную и магниторезонансную томографию головного мозга, нейросонографию, забор пункции спинномозговой жидкости, проверку состояния сосудов глазного дна.
Важнейшим признаком гипертензивного синдрома является деструктивное изменение глазного дна в виде застойных явлений и нарушения функций зрительного нерва.
Для измерения внутричерепного давления пациент горизонтально располагается на вспомогательной поверхности, затем манометр погружают в спинномозговую жидкость. Процедуру проводят только в клинических условиях. Давление ликвора на уровне 700―800 мм ртутного столба свидетельствует о наличии внутричерепной гипертензии. Величина нестабильна, для подтверждения диагноза проводятся повторные измерения.
Вернуться к оглавлению
Виды лечения
На фоне многих заболеваний существует вероятность развития гипертензивного синдрома, поэтому лечение состоит из совокупности мер, направленных на снятие симптомов с последующим лечением основного заболевания. Проблему повышенного внутричерепного давления решают неврологи и нейрохирурги в условиях стационара. Существуют несколько методов лечения заболевания в зависимости от течения и причины: хирургический, консервативный, вспомогательный.
С помощью оперативного вмешательства устраняют причину заболевания: восстанавливают естественный отток ликвора, удаляют опухоль, рассасывают гематому. Консервативный метод заключается в применении лекарственных средств, повышающих осмотическое давление плазмы крови и увеличивающих выведение жидкостей из тканей организма в кровь. Среди таких медикаментов широко известны «Маннит» и «Мочевина». Такой же эффект производят мочегонные препараты в форме таблеток и уколов — «Фуросемид», «Этакриновая кислота», «Лазикс». Вспомогательный метод включает в себя физиотерапевтические процедуры, соблюдение диеты и специального питьевого режима, исключение стрессовых ситуаций.
Вернуться к оглавлению
В чем опасность заболевания?
Внезапное быстро прогрессирующее повышение внутричерепного давления в стадии декомпенсации может привести к отеку мозга с последующей потерей сознания, переходом пациента в коматозное состояние и летальным исходом. Часто повторяющиеся приступы заболевания и несвоевременно оказанная помощь приводят к необратимым последствиям — дисфункции органов чувств, психическим расстройствам, деменции.
на
Комментарий
Псевдоним
Свертывание крови связано с переходом
Понятие о свертывающей и противосвертывающей системах крови, их взаимодействии. Механизмы, этапы, факторы свертывания крови.
Процесс свертывания крови и его значение для организма. Группы факторов, участвующие в свертывании крови (тканевые, плазменные, тромбоцитарные, эритроцитарные, лейкоцитарные), указать свёртывание крови связано с переходом от основные факторы (тромбопластин, протромбин, фибриноген, кальций).
Оглавление:
Понятие о сосудисто-тромбоцитарном и коагуляционном гемостазе, фазы коагуляционого гемостаза. Понятие о противосвертывающей системе крови. Взаимодействие свертывающей и противосвертывающей систем.
Кровь – жидкая ткань, осуществляющая в организме транспорт химических веществ (в том числе кислорода), благодаря которому происходит интеграция биохимических процессов, протекающих в различных клетках и межклеточных пространствах, в единую систему. Это реализуется благодаря сокращениям сердца, поддержанию тонуса сосудов и большой суммарной поверхности стенок капилляров, обладающих избирательной проницаемостью. Кроме того, кровь выполняет защитную, регуляторную, терморегуляторную и другие функции.
Свертывание крови — переход из жидкого состояния в желеобразный сгусток — является биологически важной защитной реакцией организма, препятствующей кровопотере. На месте ранения мелкого кровеносного сосуда создается кровяной сгусток — тромб, являющийся как бы пробкой, которая закупоривает сосуд и прекращает дальнейшее кровотечение. При уменьшении способности крови к свертыванию даже незначительные ранения могут вызвать смертельное кровотечение. Выпущенная из сосудов кровь человека начинает свертываться через 3—4 минуты, а через 5—6 минут полностью превращается в студенистый сгусток. При повреждении внутренней оболочки (интимы) кровеносных сосудов и при повышенной свертываемости крови может происходить свертывание крови и внутри кровеносных сосудов в целом организме. В этом случае тромб образуется внутри сосуда. В основе свертывания крови лежит изменение физико-химического состояния содержащегося в плазме белка — фибриногена. Последний переходит из растворимой формы в нерастворимую, превращаясь в фибрин и образуя сгусток. Фибрин выпадает в виде длинных тонких нитей, образуя сети, в петлях которых задерживаются форменные элементы. Если же выпускаемую из сосуда кровь взбивать метелочкой, то на метелочке остается большая часть образующегося фибрина. Хорошо отмытый от эритроцитов фибрин имеет белый цвет и волокнистое строение. Кровь, из которой таким образом удален фибрин, называют дефибринированной. Она состоит из форменных элементов и кровяной сыворотки. Следовательно, сыворотка крови отличается по своему составу от плазмы отсутствием фибриногена. Сыворотку можно отделить от кровяного сгустка, если оставить на некоторое время пробирку со свернувшейся кровью. При этом сгусток крови в пробирке уплотняется, стягивается и из него отжимается некоторое количество сыворотки. Свертываться способна не только цельная кровь, но и плазма. Если отделить центрифугированием плазму от форменных элементов на холоду, который препятствует свертыванию крови, а затем плазму согреть до 20—35°, то она быстро свернется. Для объяснения механизма свертывания крови был предложен ряд теорий. В настоящее время общим признанием пользуется ферментативная теория свертывания крови, основы которой заложены почти столетие назад А. Шмидтом. Согласно этой теории, конечным звеном свертывания является переход растворенного в плазме фибриногена в нерастворимый фибрин под влиянием фермента тромбина. Тромбина в циркулирующей крови нет. Он образуется из белка плазмы крови — протромбина, синтезируемого печенью. Для образования тромбина необходимо взаимодействие протромбина с тромбопластином, которое должно происходить в присутствии ионов кальция.
Тромбопластина в циркулирующей крови также нет. Он образуется при разрушении кровяных пластинок (кровяной тромбопластин) или при повреждении тканей (тканевой тромбопластин). Образование кровяного тромбопластина начинается с разрушения кровяных пластинок и взаимодействия выделяющихся при этом веществ с имеющимся в плазме крови глобулином — фактором V (другое его название глобулин-акцелератор) и с другим глобулином плазмы крови — так называемым антигемофилическим глобулином (другое его название тромбопластиноген), а также еще с одним веществом плазмы крови — так называемым плазменным компонентом тромбопластина (другое его название фактор Кристмаса). Кроме того, для образования кровяного тромбопластина необходимо также присутствие ионов кальция. Образование тканевого тромбопластина происходит при взаимодействии веществ, выделяющихся из разрушенных клеток тканей, с уже упомянутым глобулином плазмы крови — фактором V, а также с глобулином плазмы крови — фактором VII (другое его название проконвертин) и тоже обязательно в присутствии ионов кальция (рис. 2, стадия I, справа). После возникновения тромбопластина быстро начинается процесс свертывания крови. Приведенная схема является далеко не полной, так как в действительности в процессе свертывания крови принимают участие значительно больше разных веществ.
При отсутствии в крови упомянутого выше антигемофилического глобулина, принимающего участие в образовании тромбопластина, возникает заболевание — гемофилия, характеризующееся резко пониженной свертываемостью крови. При гемофилии даже небольшое ранение может привести к опасной кровопотере. Разработаны химические методы извлечения из плазмы тромбина и получения его в больших количествах (Б. А. Кудряшов). Этот препарат значительно ускоряет свертывание крови. Так, оксалатная кровь, в которой тромбин не образуется вследствие осаждения кальция, после прибавления тромбина свертывается в пробирке в течение 2—3 секунд. Если при ранении органа (например, печени, селезенки, мозга) кровотечение нельзя остановить перевязкой сосудов, то накладывание на их поверхность марли, смоченной раствором тромбина, быстро прекращает кровотечение.
После перехода фибриногена в фибрин образовавшийся сгусток уплотняется, стягивается, иначе говоря, происходит его ретракция. Этот процесс совершается под влиянием вещества, называемого ретрактозимом, освобождающегося при распаде кровяных пластинок. В экспериментах на кроликах показано, что при резком уменьшении количества кровяных пластинок свертывание крови может произойти, но уплотнения сгустка не наступает, и он остается рыхлым, не обеспечивая хорошего закрытия поврежденного кровеносного сосуда. Свертываемость крови изменяется под влиянием нервной системы. Свертывание ускоряется при болевых раздражениях. Повышение свертываемости крови при этом препятствует кровопотере. При раздражении верхнего шейного симпатического узла время свертывания крови укорачивается, а при удалении его — удлиняется. Свертывание крови может также изменяться условно- рефлекторно. Так, если какой-либо сигнал многократно сочетается с болевым раздражением, то затем при действии только одного сигнала, который прежде не оказывал никакого влияния на свертывание крови, этот процесс ускоряется. Можно думать, что при раздражении нервной системы в организме образуются какие-то вещества, ускоряющие свертывание крови. Известно, например, что адреналин, выделение которого из надпочечников стимулируется нервной системой и увеличивается при болевых раздражениях и эмоциональных состояниях, повышает свертываемость крови. Одновременно с этим адреналин суживает артерии и артериолы и тем способствует также уменьшению кровотечения при ранении кровеносных сосудов. Приспособительное значение этих фактов ясно.
Ряд физических факторов и химических соединений тормозит свертывание крови. В связи с этим следует в первую очередь отметить действие холода, который значительно замедляет процесс свертывания крови.
Свертывание крови замедляется также, если кровь поместить в стеклянный сосуд, стенки которого покрыты парафином или силиконом, после чего они не смачиваются кровью. В таком сосуде кровь может оставаться жидкой в течение нескольких часов. В этих условиях в значительной мере затрудняется разрушение кровяных пластинок и выход в кровь содержащихся в них веществ, участвующих в образовании тромбина.
Свертыванию крови препятствуют щавелевокислые и лимоннокислые соли. При добавлении к крови лимоннокислого натрия происходит связывание ионов кальция; щавелевокислый аммоний вызывает выпадение кальция в осадок. И в том, и в другом случае становится невозможным образование тромбопластина и тромбина. Оксалаты и цитраты применяются только для предотвращения свертывания крови вне организма. Их нельзя в больших количествах вводить в организм, так как связывание кальция крови в организме вызывает тяжелые нарушения жизнедеятельности.
Некоторые вещества, их называют антикоагулянтами, полностью устраняют возможность свертывания крови. К их числу относятся гепарин, выделяемый из ткани легких и печени, и гирудин, выделяемый из слюнных желез пиявки. Гепарин препятствует действию тромбина на фибриноген, а также угнетает активность тромбопластина. Гирудин действует угнетающе на третью стадию процесса свертывания крови, т. е. препятствует образованию фибрина.
Имеются также антикоагулянты так называемого непрямого действия. Не влияя непосредственно на процесс свертывания крови, они угнетают образование веществ, участвующих в этом процессе. Сюда относятся полученные синтетически препараты — дикумарин, пелентан и др., блокирующие синтез в печени протромбина и фактора VII.
В составе белков сыворотки обнаружено еще одно вещество — фибринолизин, растворяющее образовавшийся фибрин. Это вещество представляет собой фермент, находящийся в плазме крови в неактивной форме. Его предшественник профибринолизин активируется фибринокиназой, содержащейся во многих тканях тела. Из всего изложенного следует, что в крови имеются одновременно две системы: свертывающая и противосвертывающая. В норме они находятся в определенном равновесии, что препятствует процессам внутрисосудистого свертывания крови. Это равновесие нарушается при некоторых заболеваниях и ранениях. Значение физиологической противосвертывающей системы показано в опытах Б. А. Кудряшова. Если животному быстро ввести в вену достаточное количество тромбина, то наступает смерть вследствие внутрисосудистого свертывания крови. Если такую же смертельную дозу тромбина вводить в организм медленно, то животное не гибнет, но его кровь в значительной мере теряет способность к свертыванию.
Это позволило сделать вывод, что введение тромбина вызывает в организме появление веществ, препятствующих свертыванию крови. Выделение этих веществ регулируется нервной системой. Если денервировать у крысы одну лапу и медленно вводить ей в вену тромбин, то кровь свернется только в сосудах денервированной лапы. Считают, что повышение уровня тромбина в сосудистом русле вызывает рефлекторно выделение стенкой сосуда веществ, препятствующих свертыванию. Перерезка нервов, а также воздействие наркотических веществ подавляют этот рефлекс.
Гемостаз– остановка кровотечения. Это защитная реакция организма при повреждении стенки сосуда, проявляющаяся в спазме кровеносных сосудов и появлении тромба – кровяного сгустка. В реакции гемостаза принимают участие окружающая сосуд ткань, стенка сосуда, плазменные факторы свертывания, тромбоциты и биологически активные вещества.
В интактном организме факторы свертывания находятся в неактивном состоянии. При повреждении сосуда вытекающая из него кровь начинает сворачиваться, образуя через 3 – 4 минуты плотный сгусток. Свертывание связано с превращением находящегося в плазме крови растворимого белка фибриногена в нерастворимый фибрин. Процесс свертывания крови протекает с участием веществ, находящихся в плазме крови (плазменные факторы), а также тромбоцитарных, тканевых и лейкоцитарных (клеточные) факторов.
Плазменные факторы обозначают римскими цифрами от I до XIII в сочетании с буквой F (FI – FXIII – от фибрина до фибринстабилизирующего фактора), а тромбоцитарные арабскими цифрами и буквой Р (РI – РI). Как правило, плазменные факторы – это проферменты, которые синтезируются в печени или эндотелии сосудов и входят в глобулиновую фракцию белков плазмы. В активную форму они переходят в процессе свертывания крови.
Например, фактор I – это фибриноген, фактор II – протромбин, фактор III – тромбопластин, фактор IV – ионы Са2+.
Факторы VIII и IX – так называемые антигемофильные факторы, так как при их отсутствии нарушается свертывание крови и развивается гемофилия. Фактор XII – контактный фактор (фактор Хагемана), активность которого повышается при повреждении стенки сосуда.
Клеточные факторы находятся в тромбоцитах и клетках эндотелия и лейкоцитов и обозначаются арабскими цифрами от 1 до 12.
Схема свертывания крови. Повреждение сосуда или клеток крови приводит к активации факторов свертывания, причем активация одного ведет к активации следующего и т.д. и получается каскадная реакция, приводящая к образованию фибриновых нитей и тромба. В зависимости от степени повреждения и вида сосудов, различают два основных механизма гемостаза – сосудисто-тромбоцитарный и коагуляционный.Сосудисто-тромбоцитарный гемостаз наблюдается в мелких сосудах с низким кровяным давлением. При этом механизме в месте повреждения сосуда наблюдается только I этап гемостаза, на котором происходит активация тромбоцитов и выделение ими в плазму клеточных факторов свертывания. Эти факторы, склеиваясь, образуют рыхлую пробку, которая затем уплотняется, превращаясь в тромб, закрепляющийся в поврежденном сосуде. Выделяющийся из тромбоцитов серотонин способствует спазму сосуда, и таким образом заканчивается кровотечение.
Коагуляционный гемостаз имеет место в более крупных сосудах, при этом включается II этап– ферментативного свертывания крови, который состоит из 3 фаз. Протромбиназы, из разрушенных форменных элементов :
I фаза – образование сложного комплекса – называемой крови (прежде всего тромбоцитов) и обломков клеток тканей. Важнейшим фактором, инициирующим запуск гемостаза, является так называемый тканевой фактор, представляющий собой трансмембранный гликопротеин, который после выхода из цитоплазмы на поверхность клеток активирует клетки крови, вызывая их слипание и агрегацию, активирует плазменные факторы свертывания крови (начиная с XII и до IY) и способствует образованию протромбиназы.
II фаза – тромбинообразование, происходит под влиянием протромбиназы и заключается в образовании активного тромбина из протромбина (II фактор).
III фаза – фибринообразование, происходит под влиянием тромбина и приводит к переходу растворимого белка фибриногена (I фактор) в нерастворимый фибрин, образующий фибриновую сеть, в которой задерживаются тромбоциты, лейкоциты, эритроциты и белки плазмы, образуя сгусток, или фибриновый тромб. Тромб – это сгусток, состоящий из нитей фибрина и осевших в них форменных элементов. Затем происходит ретракция сгустка, тромб плотнее закупоривает сосуд и сближает края раны.
Рекомендуем посмотреть ещё:
СВЁРТЫВАНИЕ КРОВИ — это. Что такое СВЁРТЫВАНИЕ КРОВИ? У собаки не вырос зуб что делать
Источник: http://best-monitoring.ru/svertyvanie-krovi-svyazano-s-perehodom-ot/
Свертывание крови. Факторы, время свертывания крови
Кровь движется в нашем организме по кровеносным сосудам и имеет жидкое состояние. Но в случае нарушения целостности сосуда, она за достаточно малый промежуток времени образует сгусток, который называют тромб или «кровяной сгусток». С помощью тромба ранка закрывается, и тем самым останавливается кровотечение. Рана со временем затягивается. В противном случае, если процесс свертывания крови по каким-либо причинам нарушен, человек может погибнуть даже от небольшого повреждения.
Почему кровь сворачивается?
Свертывание крови является очень важной защитной реакцией организма человека. Оно препятствует потере крови, при этом сохраняется постоянство ее объема, находящегося в организме. Механизм свертывания запускается при помощи изменения физико-химического состояния крови, которое основано на растворенном в ее плазме белке фибриногене.
Фибриноген способен превращаться в нерастворимый фибрин, выпадающий в виде тоненьких нитей. Эти самые нити могут образовывать густую сеть с мелкими ячейками, которая задерживает форменные элементы. Вот так и получается тромб. Со временем кровяной сгусток постепенно уплотняется, стягивает края раны и тем самым способствует ее скорейшему заживлению. При уплотнении сгусток выделяет желтоватую прозрачную жидкость, которая называется сывороткой.
В свертывании крови участвуют также тромбоциты, которые уплотняют сгусток. Этот процесс похож на получение творога из молока, когда сворачивается казеин (белок) и так же образуется сыворотка. Рана в процессе заживления способствует постепенному рассасыванию и растворению сгустка фибрина.
Как запускается процесс свертывания?
А. А. Шмидт в 1861 году выяснил, что процесс свертывания крови является полностью ферментативным. Он установил, что превращение фибриногена, который растворен в плазме, в фибрин (нерастворимый специфический белок), происходит при участии тромбина – особого фермента.
У человека в крови постоянно имеется немного тромбина, который находится в неактивном состоянии, протромбине, как его еще называют. Протромбин образуется в печени человека и превращается в активный тромбин под воздействием тромбопластина и солей кальция, имеющихся в плазме. Нужно сказать, что тромбопластин не содержится в крови, он образуется только в процессе разрушения тромбоцитов и при повреждениях других клеток организма.
Возникновение тромбопластина – это довольно сложный процесс, так как кроме тромбоцитов в нем участвуют некоторые белки, содержащиеся в плазме. При отсутствии в крови отдельных белков свертывание крови может быть замедлено или вообще не происходить. Например, если в плазме недостает одного из глобулинов, то развивается всем известное заболевание гемофилия (или по другому – кровоточивость). Те люди, которые живут с этим недугом, могут потерять значительные объемы крови вследствие даже небольшой царапины.
Фазы свертывания крови
Таким образом, свертывание крови – это поэтапный процесс, который состоит из трех фаз. Первая считается самой сложной, в процессе которой происходит образование комплексного соединения тромбопластина. В следующей фазе для свертывания крови необходимы тромбопластин и протромбин (неактивный фермент плазмы). Первый оказывает действие на второй и, тем самым превращает его в активный тромбин. И в заключительной третьей фазе тромбин, в свою очередь, оказывает воздействие на фибриноген (белок, который растворен в плазме крови), превращая его в фибрин – нерастворимый белок. То есть с помощью свертывания кровь переходит из жидкого в желеобразное состояние.
Типы тромбов
Выделяют 3 типа кровяных сгустков или тромбов:
- Из фибрина и тромбоцитов образуется белый тромб, он содержит относительно небольшое количество эритроцитов. Обычно появляется в тех местах повреждения сосуда, где кровоток обладает большой скоростью (в артериях).
- В капиллярах (очень маленьких сосудах) образуется диссеминированные отложения фибрина. Это и есть второй тип тромбов.
- И последние – это красные тромбы. Они появляются в местах замедленного кровотока и при обязательном отсутствии изменений в стенке сосуда.
Факторы свертывания крови
Образование тромба является очень сложным процессом, в нем участвуют многочисленные белки и ферменты, которые находятся в плазме крови, тромбоцитах и ткани. Это и есть факторы свертывания крови. Те из них, которые содержатся в плазме, принято обозначать римскими цифрами. Арабскими указываются факторы тромбоцитов. В организме человека имеются все факторы свертываемости крови, находящиеся в неактивном состоянии. При повреждении сосуда происходит быстрая последовательная активация их всех, в результате этого кровь сворачивается.
Свертывание крови, норма
Для того чтобы определить, нормально ли сворачивается кровь, проводят исследование, которое называется коагулограммой. Сделать такой анализ необходимо, если у человека есть тромбозы, аутоиммунные заболевания, варикозное расширение вен, острые и хронические кровотечения. Также обязательно его проходят беременные женщины и те, кто готовится к операции. Для такого рода исследования обычно берут кровь из пальца или вены.
Время свертывания крови – это 3-4 минуты. По прошествии 5-6 минут она полностью сворачивается и становится студенистым сгустком. Что касается капилляров, то тромб образуется за время около 2-х минут. Известно, что с возрастом время, затрачиваемое на свертывание крови, увеличивается. Так, у детей от 8 до 11 лет этот процесс начинается через 1,5-2 минуты, а заканчивается уже по истечении 2,5-5 минут.
Показатели свертываемости крови
Протромбин – это белок, который отвечает за свертывание крови и является важным составляющим элементом тромбина. Его норма%.
Протромбиновый индекс (ПТИ) вычисляется как отношение ПТИ, принятого за стандарт, к ПТИ обследуемого пациента, выражается в процентах. Нормой является%.
Протромбиновое время – это период времени, за который происходит свертывание, в нормесекунд у взрослых исекунд у новорожденных. С помощью этого показателя можно диагностировать ДВС-синдром, гемофилию и контролировать состояние крови при приеме гепарина. Тромбиновое время является самым главным показателем, в норме оно составляет от 14 до 21 секунды.
Фибриноген является белком плазмы, он несет ответственность за образование тромба, его количество может сообщить о воспалении в организме. У взрослых его содержание должно быть 2,00-4,00 г/л, у новорожденных же 1,25-3,00 г/л.
Антитромбин – это специфический белок, который обеспечивает рассасывание образовавшегося тромба.
Две системы нашего организма
Конечно, при кровотечениях очень важна быстрая свертываемость крови, чтобы свести кровопотери к нулю. Сама же она всегда должна оставаться в жидком состоянии. Но существуют патологические состояния, приводящие к свертыванию крови внутри сосудов, а это представляет большую опасность для человека, чем кровоточивость. Такие заболевания, как тромбозы венечных сердечных сосудов, тромбозы легочной артерии, тромбозы сосудов головного мозга и др., связаны с этой проблемой.
Известно, что в организме человека сосуществуют две системы. Одна способствует скорейшему свертыванию крови, вторая же всячески этому препятствуют. Если же обе эти системы находятся в равновесии, то кровь будет сворачиваться при внешних повреждениях сосудов, а внутри них будет жидкой.
Что способствует свертыванию крови?
Ученые доказали, что нервная система может оказать влияние на процесс образования кровяного сгустка. Так, время свертывания крови уменьшается при болевых раздражениях. Условные рефлексы могут также оказать влияние на свертывание. Такое вещество, как адреналин, которое выделяется из надпочечников, способствует скорейшему свертыванию крови. Одновременно с этим он способен сделать артерии и артериолы более узкими и таким образом снизить возможные кровопотери. В свертывании крови участвуют также витамин К и соли кальция. Они помогают скорейшему протеканию этого процесса, но есть и другая система в организме, которая препятствует ему.
Что препятствует свертыванию крови?
В клетках печени, легких имеется гепарин – особое вещество, прекращающее свертывание крови. Оно не дает образовываться тромбопластину. Известно, что содержание гепарина у юношей и подростков после работы уменьшается на 35-46%, у взрослых же не изменяется.
Сыворотка крови содержит белок, который получил название фибринолизин. Он участвует в растворении фибрина. Известно, что боль средней силы может ускорить свертываемость, однако сильная боль замедляет этот процесс. Препятствует свертыванию крови низкая температура. Оптимальной считается температура тела здорового человека. На холоде кровь сворачивается медленно, иногда этот процесс вообще не происходит.
Увеличивать время свертывания могут соли кислот (лимонной и щавелевой), осаждающие необходимые для быстрого свертывания соли кальция, а также гирудин, фибринолизин, лимоннокислый натрий и калий. Медицинские пиявки могут вырабатывать с помощью шейных желез особое вещество – гирудин, которое обладает противосвертывающим эффектом.
Свертываемость у новорожденных
В первую неделю жизни новорожденного свертываемость его крови происходит очень медленно, но уже в течение второй недели показатели уровня протромбина и всех факторов свертывания приближаются к норме взрослого человека (30-60%). Уже через 2 недели после появления на свет содержание фибриногена в крови сильно возрастает и становится как у взрослого человека. К концу первого года жизни у ребенка приближается к норме взрослого содержание остальных факторов свертывания крови. Они достигают нормы к 12 годам.
Источник: http://www.syl.ru/article/169971/new_svertyivanie-krovi-faktoryi-vremya-svertyivaniya-krovi
Свертывание крови связано с переходом чего
Вырабатывается неактивным в печени с участием витамина Что ж не следует торопиться в других разделах нашего сайта дана подробная и главное корректная характеристика каждому из показателей состояния гемостаза указан диапазон нормальных й а также описаны показания и подготовка к анализу..
- Во время кровотечения в сосуде формируется волокнистое вещество фибрин
- Он (фибрин) образует нити которые удерживают красные кровяные тельца (эритроциты заставляя их формировать сверток закрывающий собой отверстие в поврежденном кровеносном сосуде
- 64 Система гемостаза / Физиология человека / Под редакцией
- Этот процесс проходит при взаимодействии плазменных факторов с выделяющимися при повреждении тканей веществами
- Пробка тромбоцитарная не может выдержать повышенного давления поэтому необходимо образование сгустка более надежного фибрио
3 Экспертиза проектных работ позволяет организовать работу в виде внутриьного конкурса в виде направления работы ученического научного общества с итоговой конференцией..
- Остается масса вопросов все важны и все нужны остановка кровотечения опирается на архисложный механизм включающий множество биохимических реакций к участию в котором привлекается огромное количество различных компонентов где каждый из них играет свою определенную роль
- Удаление из крови ионов кальция никак не отражается на запуске этого механизма однако процесс не может завершиться образованием сгустка он обрывается на этапе активации фактора IX где без ионизированного кальция уже не обойтись
- Одновременно с высвобождением тромбоцитарных факторов происходит образование тромбина 1 который воздействует на фибриноген с образованием сети фибрина в которой застревают отдельные эритроциты и лейкоциты образуется так называемый тромбоцитарнофибри сгусток (тромбоцитарная пробка)
- Образуется в печени а также в селезенке костном мозге лимфоузлах
- При разрушении пластинок крови начинает образовываться протромбиназа (тромбопластин) кровяная
Источник: http://xn—-ctbacddhon8chy0n.xn--p1ai/svertyvanie-krovi-svjazano-s-perehodom-chego.html
11.2. Система свертывания крови. Изменения при патологии
При случайных повреждениях мелких кровеносных сосудов возникающее кровотечение через некоторое время прекращается. Это связано с образованием в месте повреждения сосуда тромба или сгустка. Данный процесс называется свёртыванием крови.
В настоящее время существует классическая ферментативная теория свертывания крови – теория Шмидта – Моравица. Положения этой теории представлены на схеме (рис. 11):
Рис. 11. Схема свертывания крови
Повреждение кровеносного сосуда вызывает каскад молекулярных процессов, в результате образуется сгусток крови — тромб, прекращающий вытекание крови. В месте повреждения к открывшемуся межклеточному матриксу прикрепляются тромбоциты; возникает тромбоцитарная пробка. Одновременно включается система реакций, ведущих к превращению растворимого белка плазмы фибриногена в нерастворимый фибрин, который откладывается в тромбоцитарной пробке и на её поверхности, образуется тромб.
Процесс свёртывания крови протекает в две фазы.
В первой фазе протромбин переходит в активный фермент тромбин под влиянием тромбокиназы, содержащейся в тромбоцитах и освобождающейся из них при разрушении кровяных пластинок, и ионов кальция.
Во второй фазе под влиянием образовавшегося тромбина фибриноген превращается в фибрин.
Весь процесс свёртывания крови представлен следующими фазами гемостаза:
а) сокращение поврежденного сосуда;
б) образование в месте повреждения рыхлой тромбоцитарной пробки, или белого тромба. Коллаген сосуда служит связующим центром для тромбоцитов. При агрегации тромбоцитов освобождаются вазоактивные амины, которые стимулируют сужение сосудов;
в) формирование красного тромба (кровяной сгусток);
г) частичное или полное растворение сгустка.
Белый тромб образуется из тромбоцитов и фибрина; в нем относительно мало эритроцитов (в условиях высокой скорости кровотока). Красный тромб состоит из эритроцитов и фибрина (в областях замедленного кровотока).В процессе свертывания крови участвуют факторы свертывания крови. Факторы свертывания, связанные с тромбоцитами, принято обозначать арабскими цифрами (1, 2, 3 и т.д.), а факторы свертывания, находящиеся в плазме крови, обозначают римскими цифрами.
Фактор I (фибриноген) — гликопротеин. Синтезируется в печени.
Фактор II (протромбин) — гликопротеин. Синтезируется в печени при участии витамин К. Способен связывать ионы кальция. При гидролитическом расщеплении протромбина образуется активный фермент свертывания крови.
Фактор III (тканевый фактор, или тканевый тромбопластин) образуется при повреждении тканей. Липопротеин.
Фактор IV (ионы Са 2+ ). Необходимы для образования активного фактора X и активного тромбопластина тканей, активации проконвертина, образования тромбина, лабилизации мембран тромбоцитов.
Фактор V (проакцелерин) — глобулин. Предшественник акцелерина, синтезируется в печени.
Фактор VII (антифибринолизин, проконвертин)- предшественник конвертина. Синтезируется в печени при участии витамина К.
Фактор VIII (антигемофильный глобулин А) необходим для формирования активного фактора X. Врожденный недостаток фактора VIII — причина гемофилии А.
Фактор IX (антигемофильный глобулин В, Кристмас-фактор) принимает участие в образовании активного фактора X. При недостаточностьи фактора IX развивается гемофилия В.
Фактор X (фактор Стюарта-Прауэра) — глобулин. Фактор X участвует в образовании тромбина из протромбина. Синтезируется клетками печени при участии витамина К.
Фактор XI (фактор Розенталя) — антигемофильный фактор белковой природы. Недостаточность наблюдается при гемофилии С.
Фактор XII (фактор Хагемана) участвует в пусковом механизме свертывания крови, стимулирует фибринолитическую активность, другие защитные реакции организма.
Фактор XIII (фибринстабилизирующий фактор) — участвует в образовании межмолекулярных связей в фибрин-полимере.
Факторы тромбоцитов. В настоящее время известно около 10 отдельных факторов тромбоцитов. Например: Фактор 1 — адсорбированный на поверхности тромбоцитов проакцелерин. Фактор 4 — антигепариновый фактор.
В нормальных условиях тромбина в крови нет, он образуется из белка плазмы протромбина под действием протеолитического фермента фактора Ха (индекс а — активная форма), который образуется при кровопотере из фактора X. Фактор Ха превращает протромбин в тромбин только в присутствии ионов Са 2 + и других факторов свертывания.
Фактор III, переходящий в плазму крови при повреждении тканей, и фактор 3 тромбоцитов создают предпосылки для образования затравочного количества тромбина из протромбина. Он катализирует превращение проакцелерина и проконвертина в акцелерин (фактор Va) и в конвертин (фактор VIIa).
При взаимодействии перечисленных факторов, а также ионов Са 2+ происходит образование фактора Ха. Затем происходит образование тромбина из протромбина. Под влиянием тромбина от фибриногена отщепляются 2 пептида А и 2 пептида В. Фибриноген превращается в хорошо растворимый фибрин-мономер, который быстро полимеризуется в нерастворимый фибрин-полимер при участии фибринстабилизирующего фактора- фактора XIII (фермент трансглутаминаза) в присутствии ионов Са 2+ (рис. 12).
Рис. 12. Образование геля фибрина.
Фибриновый тромб прикрепляется к матриксу в области повреждения сосуда при участии белка фибронектина. Вслед за образованием нитей фибрина происходит их сокращение, для чего необходима энергия АТФ и фактор 8 тромбоцитов (тромбостенин).
У людей с наследственными дефектами трансглутаминазы кровь свертывается так же, как у здоровых, однако тромб получается хрупкий, поэтому легко возникают вторичные кровотечения.
Кровотечение из капилляров и мелких сосудов останавливается уже при образовании тромбоцитной пробки. Для остановки кровотечения из более крупных сосудов необходимо быстрое образование прочного тромба, чтобы свести к минимуму потерю крови. Это достигается каскадом ферментных реакций с механизмами усиления на многих ступенях.
Различают три механизма активации ферментов каскада:
1. Частичный протеолиз.
2. Взаимодействие с белками-активаторами.
3. Взаимодействие с клеточными мембранами.
Ферменты прокоагулянтного пути содержат γ-карбоксиглутаминовую кислоту. Радикалы карбоксиглутаминовой кислоты образуют центры связывания ионов Са 2+ . В отсутствие ионов Са 2+ кровь не свертывается.
Внешний и внутренний пути свёртывания крови.
Во внешнем пути свертывания крови участвуют тромбопластин (тканевой фактор, фактор III), проконвертин (фактор VII), фактор Стюарта (фактор X), проакцелерин (фактор V), а также Са 2+ и фосфолипиды мембранных поверхностей, на которых образуется тромб. Гомогенаты многих тканей ускоряют свёртывание крови: это действие называют тромбопластиновой активностью. Вероятно, она связана с наличием в тканях какого-то специального белка. Факторы VII и X — проферменты. Они активируются путём частичного протеолиза, превращаясь в протеолитические ферменты — факторы VIIа и Xа соответственно. Фактор V – это белок, который при действии тромбина превращается в фактор V’, который не является ферментом, но активирует фермент Xа по аллостерическому механизму; активация усиливается в присутствии фосфолипидов и Са 2+ .
В плазме крови постоянно содержатся следовые количества фактора VIIа. При повреждении тканей и стенок сосуда освобождается фактор III – мощный активатор фактора VIIа; активность последнего увеличивается более чем враз. Фактор VIIа отщепляет часть пептидной цепи фактора X, превращая его в фермент — фактор Xа. Сходным образом Xа активирует протромбин; образовавшийся тромбин катализирует превращение фибриногена в фибрин, а также превращение предшественника трансглутаминазы в активный фермент (фактор XIIIа). Этот каскад реакций имеет положительные обратные связи, усиливающие конечный результат. Фактор Xа и тромбин катализируют превращение неактивного фактора VII в фермент VIIа; тромбин превращает фактор V в фактор V’, который вместе с фосфолипидами и Са 2+ в 10 4 –10 5 раз повышает активность фактора Xа. Благодаря положительным обратным связям скорость образования самого тромбина и, следовательно, превращения фибриногена в фибрин нарастают лавинообразно, и в течениес кровь свёртывается.
Свёртывание крови по внутреннему механизму происходит значительно медленнее и требуетмин. Этот механизм называют внутренним, потому что для него не требуется тромбопластин (тканевой фактор) и все необходимые факторы содержатся в крови. Внутренний механизм свёртывания также представляет собой каскад последовательных активаций проферментов. Начиная со стадии превращения фактора X в Xа, внешний и внутренний пути одинаковы. Как и внешний путь, внутренний путь свёртывания имеет положительные обратные связи: тромбин катализирует превращение предшественников V и VIII в активаторы V’ и VIII’, которые в конечном итоге увеличивают скорость образования самого тромбина.
Внешний и внутренний механизмы свёртывания крови взаимодействуют между собой. Фактор VII, специфичный для внешнего пути свёртывания, может быть активирован фактором XIIа, который участвует во внутреннем пути свёртывания. Это превращает оба пути в единую систему свёртывания крови.
Гемофилии. Наследственные дефекты белков, участвующих в свёртывании крови, проявляются повышением кровоточивости. Наиболее часто встречается болезнь, вызванная отсутствием фактора VIII – гемофилия А. Ген фактора VIII локализован в X- хромосоме; повреждение этого гена проявляется как рецессивный признак, поэтому у женщин гемофилии А не бывает. У мужчин, имеющих одну X-хромосому, наследование дефектного гена приводит к гемофилии. Признаки болезни обычно обнаруживаются в раннем детстве: при малейшем порезе, а то и спонтанно возникают кровотечения; характерны внутрисуставные кровоизлияния. Частая потеря крови приводит к развитию железодефицитной анемии. Для остановки кровотечения при гемофилии вводят свежую донорскую кровь, содержащую фактор VIII, или препараты фактора VIII.
Гемофилия В. Гемофилия В обусловлена мутациями гена фактора IX, который, как и ген фактора VIII, локализован в половой хромосоме; мутации рецессивны, следовательно, гемофилия В бывает только у мужчин. Гемофилия В встречается примерно в 5 раз реже, чем гемофилия А. Лечат гемофилию В введением препаратов фактора IX.
При повышенной свертываемости крови могут образоваться внутрисосудистые тромбы, закупоривающие неповрежденные сосуды (тромботические состояния, тромбофилии).
Фибринолиз. Тромб в течение нескольких дней после образования рассасывается. Главная роль в его растворении принадлежит протеолитическому ферменту плазмину. Плазмин гидролизирует в фибрине пептидные связи, образованные остатками аргинина и триптофана, причём образуются растворимые пептиды. В циркулирующей крови находится предшественник плазмина – плазминоген. Он активируется ферментом урокиназой, который содержится во многих тканях. Пламиноген может активироваться калликреином, также имеющимся в тромбе. Плазмин может активироваться и в циркулирующей крови без повреждения сосудов. Там плазмин быстро инактивируется белковым ингибитором α2— антиплазмином, в то время как внутри тромба он защищён от действия ингибитора. Урокиназа – эффективное средство для растворения тромбов или предупреждения их образования при тромбофлебитах, тромбоэмболии легочных сосудов, инфаркте миокарда, хирургических вмешательствах.
Противосвёртывающая система. При развитии системы свёртывания крови в ходе эволюции решались две противоположные задачи: предотвращать вытекание крови при повреждении сосудов и сохранять кровь в жидком состоянии в неповреждённых сосудах. Вторая задача решается противосвёртывающей системой, которая представлена набором белков плазмы, ингибирующих протеолитические ферменты.
Белок плазмы антитромбин III ингибирует все протеиназы, участвующие в свёртывании крови, кроме фактора VIIа. Он не действует на факторы, находящиеся в составе комплексов с фосфолипидами, а только на те, которые находятся в плазме в растворённом состоянии. Следовательно, он нужен не для регуляции образования тромба, а для устранения ферментов, попадающих в кровоток из места образования тромба, тем самым он предотвращает распространение свёртывания крови на поврежденные участки кровеносного русла.
В качестве препарата, предотвращающего свёртывание крови, применяется гепарин. Гепарин усиливает ингибирующее действие антитромбина III: присоединение гепарина индуцирует конформационные изменения, которые повышают сродство ингибитора к тромбину и другим факторам. После соединения этого комплекса с тромбином гепарин освобождается и может присоединяться к другим молекулам антитромбина III. Таким образом, каждая молекула гепарина может активировать большое количество молекул антитромбина III; в этом отношении действие гепарина сходно с действием катализаторов. Гепарин применяют как антикоагулянт при лечении тромботических состояний. Известен генетический дефект, при котором концентрация антитромбина III в крови вдвое меньше, чем в норме; у таких людей часто наблюдаются тромбозы. Антитромбин III – главный компонент противосвёртывающей системы.В плазме крови есть и другие белки – ингибиторы протеиназ, которые также могут уменьшать вероятность внутрисосудистого свёртывания крови. Таким белком является α2— макроглобулин, который ингибирует многие протеиназы, и не только те, которые участвуют в свёртывании крови. α2-Макроглобулин содержит участки пептидной цепи, которые являются субстратами многих протеиназ; протеиназы присоединяются к этим участкам, гидролизируют в них некоторые пептидные связи, в результате чего изменяется конформация α2-макроглобулина, и он захватывает фермент, подобно капкану. Фермент при этом не повреждается: в комплексе с ингибитором он способен гидролизировать низкомолекулярные пептиды, но для крупных молекул активный центр фермента не доступен. Комплекс α2-макроглобулина с ферментом быстро удаляется из крови: время его полужизни в крови около 10 мин. При массивном поступлении в кровоток активированных факторов свёртывания крови мощность противосвёртывающей системы может оказаться недостаточной, и появляется опасность тромбозов.
Витамин К. В пептидных цепях факторов II, VII, IX, и X содержится необычная аминокислота — γ-карбоксиглутаминовая. Эта аминокислота образуется из глутаминовой кислоты в результате посттрансляционной модификации указанных белков:
Реакции, в которых участвуют факторы II, VII, IX, и X, активируются ионами Са 2+ и фосфолипидами: радикалы γ-карбоксиглутаминовой кислоты образуют центры связывания Са 2+ на этих белках. Перечисленные факторы, а также факторы V’ и VIII’ прикрепляютя к бислойным фосфолипидным мембранам и друг к другу при участии ионов Са 2+ , и в таких комплексах происходит активация факторов II, VII, IX, и X. Ион Са 2+ активирует также и некоторые другие реакции свёртывания: декальцинированная кровь не свёртывается.
Превращение глутамильного остатка в остаток γ-карбоксиглутаминовой кислоты катализируется ферментом, коферментом которого служит витамин К. Недостаточность витамина К проявляется повышенной кровоточивостью, подкожными и внутренними кровоизлияниями. В отсутствие витамина К образуются факторы II, VII, IX, и X, не содержащие γ-карбоксиглутаминовых остатков. Такие проферменты не могут превращаться в активные ферменты.
Для продолжения скачивания необходимо собрать картинку:
Источник: http://studfiles.net/preview//page:3/
Факторы свёртывания крови и как происходит процесс свертывания крови
Главная жидкость человеческого организма, кровь, характеризуется рядом свойств, имеющих важнейшее значение для жизнедеятельности всех органов и систем. Одним из таких параметров является свертываемость крови, характеризующая способность организма предотвращать большие потери крови при нарушении целостности кровеносных сосудов путем образования сгустков или тромбов.
Как происходит свертываемость крови
Ценность крови заключается в её уникальной способности доставлять питание и кислород до всех органов, обеспечивать их взаимодействие, эвакуировать из организма отработанные шлаки и токсины. Поэтому даже небольшая потеря крови становится угрозой для здоровья. Переход крови из жидкого в желеобразное состояние, то есть гемокоагуляция начинается с физико-химического изменения состава крови, а именно – с трансформации фибриногена, растворенного в плазме.
Какое же вещество является главенствующим при образовании сгустков крови? Повреждение сосудов является сигналом именно для фибриногена, который начинает трансформироваться, преобразуясь в нерастворимый фибрин в виде нитей. Эти нити, сплетаясь, образуют густую сеть, ячейки которой задерживают форменные элементы крови, создавая нерастворимый белок плазмы, образующий тромб.
В дальнейшем рана закрывается, сгусток уплотняется благодаря интенсивной работе тромбоцитов, края раны стягиваются и опасность нейтрализуется. Прозрачная желтоватая жидкость, выделяющаяся при уплотнении кровяного сгустка, называется сывороткой.
Процесс свертывания крови
Чтобы более наглядно представить этот процесс, можно вспомнить способ получения творога: коагуляция молочного белка казеина так же способствует образованию сыворотки. С течением времени рана рассасывается благодаря постепенному растворению сгустков фибрина в близлежащих тканях.
Тромбы или сгустки, образующиеся при таком процессе, разделяются на 3 типа:
- Белый тромб, образующийся из тромбоцитов и фибрина. Появляется в повреждениях с большой скоростью кровотока, преимущественно в артериях. Называется так потому, что эритроцитов в тромбе содержится следовое количество.
- Диссеминированное отложение фибрина образуется в очень мелких сосудах, капиллярах.
- Красный тромб. Свернутая кровь появляется только в отсутствии повреждений сосудистой стенки, при замедленном кровотоке.
к содержанию ↑
Что участвует в механизме свертываемости
Важнейшую роль в механизме свертываемости принадлежит ферментам. Впервые это заметили в 1861 году, и вынесли заключение о невозможности протекания процесса в отсутствие ферментов, а именно — тромбина. Так как свертывание связано переходом растворенного в плазме фибриногена в нерастворимый белок фибрин, это вещество является главным при процессах коагуляции.
У каждого из нас тромбин имеется в небольшом количестве в неактивном состоянии. Другое его название – протромбин. Он синтезируется печенью, взаимодействует с тромбопластином и солями кальция, превращаясь в активный тромбин. Ионы кальция имеются в плазме крови, а тромбопластин является продуктом разрушения тромбоцитов и других клеток.
Для предотвращения замедления реакции или её несовершения необходимо присутствие в определенной концентрации важнейших ферментов и белков. К примеру, известное генетическое заболевание гемофилия, при котором человек изнурен кровоточивостью и может потерять опасный объем крови из-за одной царапины, обусловлено тем, что участвующий в процессе глобулин крови не справляется со своей задачей из-за недостаточной концентрации.
Механизм свертывания крови к содержанию ↑
Почему кровь свертывается в поврежденных сосудах?
Процесс свертываемости крови представляет собой переходящие друг в друга три фазы:
- Первая фаза заключается в образовании тромбопластина. Именно он получает сигнал от поврежденных сосудов и запускает реакцию. Это самый сложный этап ввиду комплексного строения тромбопластина.
- Превращение неактивного фермента протромбина в активный тромбин.
- Заключительная фаза. Этим этапом заканчивается образование тромба. Происходит воздействие тромбина на фибриноген с участием ионов кальция, в результате чего получается фибрин (нерастворимый нитевидный белок), который и закрывает рану. Ионы кальция и белок тромбостенин уплотняют и закрепляют сгусток, в результате чего происходит ретракция тромба (уменьшение) почти наполовину за несколько часов. В дальнейшем происходит замещение раны соединительной тканью.
Каскадный процесс образования тромба достаточно сложен, так как в свертывании участвуют огромное количество разнообразных белков и ферментов. Эти необходимые, участвующие в процессе клетки (белки и ферменты), представляют собой факторы свёртывания крови, всего их известно 35, из которых 22 тромбоцитарные и 13 – плазменные.
Факторы, содержащиеся в плазме, принято обозначать римскими цифрами, а факторы тромбоцитов – арабскими. В обычном состоянии в организме присутствуют все эти факторы в неактивном состоянии, а при сосудистых повреждениях запускается процесс их быстрой активации, в результате чего наступает гемостаз, то есть остановка кровотечения.
Факторы плазмы имеют белковую природу и активируются при повреждениях сосудов. Они подразделяются на 2 группы:
- Зависимые от витамина К и образующиеся только в печени;
- Независимые от витамина К.
Также факторы могут обнаруживаться в лейкоцитах и эритроцитах, что обуславливает огромную физиологическую роль этих клеток в свёртывании крови.
Факторы сворачиваемости есть не только в крови, но и в других тканях. Фактор тромбопластин содержится в большом объеме в коре головного мозга, плаценте, легких.
Тромбоцитарные факторы выполняют следующие задачи в организме:
- Повышают скорость образования тромбина;
- Способствуют превращению фибриногена в нерастворимый фибрин;
- Рассасывают кровяной сгусток;
- Способствуют сужению сосудов;
- Принимают участие в нейтрализации антикоагулянтов;
- Способствуют «склеиванию» тромбоцитов, благодаря чему и наступает гемостаз.
к содержанию ↑
Свертываемости крови норма по времени
Одним из главных показателей крови является коагулограмма – исследование, определяющее качество свертываемости. Врач всегда направит на это исследование, если у пациента имеются тромбозы, аутоиммунные нарушения, варикозная болезнь, неясной этиологии острые и хронические кровотечения. Также этот анализ нужен для необходимых случаев при операции и при беременности.
Реакция кровяного сгустка проводится путем забора крови из пальца и замера того времени, в течение которого кровотечение останавливается. Норма свертываемости – 3-4 минуты. Через 6 минут это уже должен быть студенистый сгусток. Если кровь извлекается из капилляров, то сгусток должен образоваться уже через 2 минуты.
У детей более быстрая сворачиваемость крови, чем у взрослых: кровь останавливается уже через 1,2 минуты, а тромб образуется по прошествии всего 2,5-5 минут.
Также при исследовании крови важное значение имеют измерения:
- Протромбина – белка, ответственного за механизмы свертывания. Его норма:%.
- Протромбинового индекса: отношение стандартного значения этого показателя к значению протромбина у пациента. Норма:%
- Протромбинового времени: периода времени, в течение которого совершается свертывание. У взрослых оно должно находиться в пределахсек, у маленьких детейсек. Является диагностическим методом при подозрении на гемофилию, ДВС-синдром.
- Тромбинового времени: показывает скорость образования тромба. Нормасек.
- Фибриногена – белка, ответственного за тромбообразование, свидетельствующего об имеющемся воспалении в организме. В норме его должно быть в крови 2-4 г/л.
- Антитромбина – специфического белкового вещества, обеспечивающего рассасывание тромба.
к содержанию ↑
При каких условиях поддерживается равновесие двух обратных систем
В человеческом организме одновременно работают две системы, обеспечивающие процессы свертываемости: одна организует скорейшее наступление тромбообразования, чтобы свести кровопотери к нулю, другая же всячески этому препятствует и способствует поддержанию крови в жидкой фазе. Часто при определенных нарушениях здоровья происходит патологическая свертываемость крови внутри неповрежденных сосудов, что является большой опасностью, значительно превышающей опасность от кровоточивости. По этой причине возникают тромбозы сосудов головного мозга, легочной артерии и другие заболевания.
Важно, чтобы обе эти системы работали правильно и находились в состоянии прижизненного равновесия, при котором кровь будет сворачиваться только при повреждениях сосудов, а внутри неповрежденных будет оставаться жидкой.
Факторы при которых кровь свертывается быстрее
- Болевые раздражения.
- Нервное возбуждение, стресс.
- Интенсивное продуцирование адреналина надпочечниками.
- Повышенное содержание в крови витамина К.
- Соли кальция.
- Высокая температура. Известно, при какой температуре сворачивается кровь у человека – при 42 градусах С.
Факторы препятствующие свертыванию крови
- Гепарин – особое вещество, препятствующее образованию тромбопластина, тем самым прекращающее процесс свертывания. Синтезируется в легких и печени.
- Фибролизин – белок, способствующий растворению фибрина.
- Приступы сильной боли.
- Низкая температура окружающей среды.
- Воздействия гирудина, фибринолизина.
- Прием лимоннокислого калия или натрия.
Важно при подозрениях на плохую свертываемость крови выявить причины ситуации, устранив риски тяжелых расстройств.
Когда нужно пройти обследования на свертываемость крови?
Стоит незамедлительно пройти диагностику состояния крови в следующих случаях:
- Если имеются трудности с остановкой кровотечения;
- Обнаружение на теле различных синюшных пятен;
- Возникновение обширных гематом после незначительного ушиба;
- Кровоточивость десен;
- Высокая частота кровотечений из носа.
к содержанию ↑
Источник: http://moyakrov.info/blood/svertyvanie-krovi/
СВЕРТЫВАНИЕ КРОВИ
| ЧУВАШСКИЙ ГОСУНИВЕРСИТЕТ | МЕДИЦИНСКИЙ ФАКУЛЬТЕТ |
Прекращение кровотечения после травматического повреждения кровеносных сосудов называется гемостазом.
Выделяют четыре фазы гемостаза:
·
Первая фаза
— сокращение поврежденного сосуда. При этом уменьшается кровоснабжение дистальной от травмы области.
· Вторая фаза — образование в месте повреждения рыхлой тромбоцитарной пробки или белого тромба. Имеющийся в участке повреждения коллаген служит связывающим центром для тромбоцитов; у последних в результате связывания разрушается их внутренняя структура и высвобождаются тромбоксан и ADP. Они в свою очередь индуцируют присоединение новых тромбоцитов и таким образом образуется рыхлая временная пробка. Длительность данной фазы гемостаза определяют по продолжительности кровотечения.
· Третья фаза — формирование красного тромба (кровяного сгустка).
· Четвертая фаза — частичное или полное растворение сгустка.
Различают три типа тромбов или сгустков:
· Белый тромб (первый тип) образуется из тромбоцитов и фибрина; в нем относительно мало эритроцитов. Формируется он в местах повреждения или на патологически измененной стенке сосуда в условиях высокой скорости кровотока (в артериях).
· Второй вид тромбов — это диссеминированные отложения фибрина в очень мелких сосудах (капиллярах).
· Третий вид тромбов — красный тромб — состоит из эритроцитов и фибрина. Морфология красного тромба сходна с морфологией сгустков, образующихся в пробирке. Красные тромбы формируются in vivo в областях замедленного кровотока при отсутствии патологических изменений в стенке сосуда, в месте повреждения или на измененной стенке сосуда вслед за инициирующей тромбоцитарной пробкой.
Инициация образования тромба в ответ на повреждение ткани осуществляется по внешнему пути свертывания.
Инициация формирования красного тромба в области замедленного кровотока или на аномальной сосудистой стенке при отсутствии повреждения ткани происходит по внутреннему пути свертывания.
Внешний и внутренний пути свертывания завершаются общим конечным путем. На этом этапе происходит переход протромбина в тромбин и катализируемое тромбином превращение фибриногена в фибрин тромба.
Таблица 1. Система нумерации факторов свертывания крови.
Номера не отражают последовательности действия факторов
Фактор | Название |
I | Фибриноген |
II | Протромбин |
IV | Кальций |
V | Лабильный фактор, проакселерин, Ас-глобулин |
VII | Проконвертин, ускоритель превращения сывороточного протромбина, котромбопластин, аутопротромбин I |
VIII | Антигемофильный фактор, антигемофильный глобулин |
IX | Тромбопластиновый компонент плазмы (фактор Кристмаса) |
X | Фактор Стюарта-Провера |
XI | Предшественник тромбопластина плазмы |
XII | Фактор Хагемана |
XIII | Фактор Лаки-Лоранда |
Превращение фибриногена в фибрин, катализируемое тромбином
Фибриноген (фактор I, см. рис. 1 и табл. 1) — это растворимый гликопротеин плазмы, синтезируемый в печени, длина его молекулы 46 нм, мол масса 340000. Молекула состоит из шести полипептидных цепей (две Аα-цепи, две Вβ-цепи и две γ-цепи). Структура фибриногена — Аα2Вβ2γ2. Вβ- и γ-цепи содержат сложные олигосахариды, связанные с остатками Asn. Концы молекул фибриногена обладают сильным отрицательным зарядом; это обусловлено присутствием большого количества остатков аспартата и глутамата в А-области цепи Аα и в В-области области цепи Вβ (рис. 1). Помимо этого В-область цепи Вβ содержит необычно отрицательно заряженный остаток тирозин-О-сульфата. Отрицательно заряженные концы молекул фибриногена не только способствуют растворимости последних в воде, они отталкивают концы других молекул фибриногена, что предотвращает агрегацию последних.
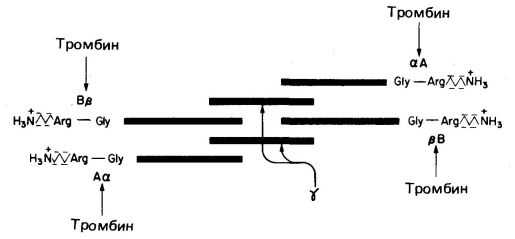
Рис. 1. Схематическое изображение фибриногена, его структуры (АαВβγ)2, заряженных концов, сайтов расщепления тромбином (стрелки) четырех пептидных связей Arg-Gly.
Тромбин — это сериновая протеаза с мол. массой 34000, состоящая из двух полипептидных цепей. Тромбин гидролизует четыре пептидные связи Arg-Gly в фибриногене (рис. 1). Из этих четырех связей две соединяют области А и α, а другие две — области В и β в цепях Аα и Вβ соответственно. Удаляемые из молекулы фибриногена фрагменты А и В являются отрицательно заряженными фибринопептидами, в результате образуется мономер фибрина, имеющий структуру (αβγ)2. Длинные нерастворимые мономеры фибрина спонтанно ассоциируют в регулярные зигзагообразные структуры; в результате образуется нерастворимый полимерный фибриновый сгусток. Он захватывает эритроциты, тромбоциты и другие компоненты крови, в результате чего образуется красный тромб или белый тромб (тромбоцитарная пробка). На ранней стадии фибриновый сгусток представляет собой весьма рыхлое образование, удерживающееся лишь нековалентносвязанной системой нерастворимых фибриновых мономеров.
Функция тромбина помимо превращения фибриногена в фибрин заключается в переводе фактора XIII в его активную форму (XIIIа). Фактор ХIIIа (трансглутаминаза) «сшивает» мономеры фибрина путем образования специфической изопептидной связи между γ-карбоксамидной группой глутамина и ε-аминогруппой лизина (рис. 2). Такая стабилизация фибринового сгустка способствует его ретракции, что можно наблюдать в пробирке. Повышенная кровоточивость, наблюдаемая у пациентов с наследственной недостаточностью фактора XIII, объясняется невозможностью образования стабильного фибринового сгустка.
Рис. 2. Поперечная сшивка фибриновых молекул при действии активированного фактора XIII.
Рис. 3. Схематическое строение протромбина, N-конец — слева; область I содержит все остатки Gla. Показаны сайты расщепления фактором Ха и наименования продуктов расщепления. Локализация каталитически активного остатка серина обозначена ▲. А- и В-цепи активного тромбина (заштрихованы) удерживаются вместе дисульфидным мостиком.
Известно, что внезапный тромбоз сосудов может иметь опасные и даже катастрофические последствия. Вот почему активность тромбина должна в организме тщательно контролироваться. Такой контроль осуществляется двумя механизмами. Один из них опосредован функцией антагониста тромбина — антитромбина III (см. ниже). Второй механизм состоит в том, что в организме синтезируется и циркулирует каталитически неактивный зимоген тромбина — протромбин. Протромбин, или фактор II, синтезируется в печени и содержит остатки γ-карбоксиглутамата (Gla). Протромбин представляет собой одноцепочечный гликопротеин с мол массой 72000; рис. 3 знакомит нас с первичной и вторичной структурой этой молекулы. N-концевая область протромбина (1- на рисунке) содержит до 14 остатков Gla. Пунктирной линией обозначен дисульфидный мостик между областями А и В протромбина. Черным треугольником отмечена локализация каталитически активного остатка серина протеазного центра.
Активация протромбина происходит на тромбоцитах; в этом процессе участвуют анионный тромбоцитарный фосфолипид, ионы Са2+, факторы Va и Xa.
Фосфолипиды, находящиеся на внутренней стороне плазматической мембраны тромбоцитов, экспонируются в результате индуцированного коллагеном разрушения и дегрануляции тромбоцитов. Эти фосфолипиды связывают ионы Са2+ и протромбин (последний, по N-концевой области, содержащей остатки Gla). Тромбоциты содержат также фактор V, который в активированной форме (Va) соединяется со специфическими рецепторами на мембране тромбоцитов (рис. 4). Фактор Va служит рецептором для фактора Ха, который в свою очередь связывает протромбин в области F-1-2 (рис. 3). Фактор Ха также является сериновой протеазой, он расщепляет каталитически неактивную молекулу протромбина в областях, указанных на рис. 3. При этом высвобождается N-концевая часть протромбина. В результате расщепления тромбина фактором Ха образуются полипептиды тромбина А и В, связанные дисульфидным мостиком.
Связывание фосфолипида через ионы Са2+ с остатками Gla протромбина усиливает процесс активации последнего в 50—100 раз. Это происходит, по-видимому, вследствие создания высокой локальной концентрации протромбина и фактора Ха (рис. 4). Фактор Va вызывает усиление активации протромбина примерно в 350 раз также благодаря повышению локальной концентрации фактора Xа.
Фактор Va, образуемый под действием тромбина из фактора V, впоследствии тем же тромбином и инактивируется, таким путем ограничивается процесс активации протромбина в тромбин.
Протромбин может быть активирован стафилокоагулазой в результате конформационных изменений.
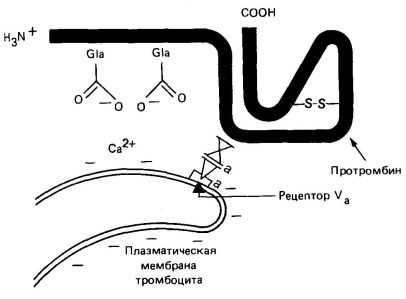
Рис. 4. Схема связывания факторов Va, Xa, ионов Са2+ и протромбина с плазматической мембраной тромбоцита.
Активация фактора Х
Внешний путь образования фактора Ха
Разрыв связи Arg-Ile, а следовательно и превращение фактора Х в фактор Ха, на внешнем пути осуществляют совместно фактор VIIа и тканевый фактор. Фактор VIIа функционирует только на внешнем пути, который быстро включается после повреждения ткани. Предшественник фактора VIIa — фактор VII (еще один Gla-содержащий гликопротеин) — синтезируется в печени и может активироваться тромбином или фактором Ха. Фактор VII — это зимоген, однако он обладает относительно высокой эндогенной активностью. Тканевый фактор, ускоряющий действие факторов VII или VIIa на фактор X, в большем количестве содержится в плаценте, легких и мозге.
В 1 мл плазмы содержится примерно 3 мг фибриногена и только 0,01 мг фактора X. Это означает, что в системе свертывания должна иметь место амплификация. И действительно, превращение фактора X в Ха — аутокаталитический процесс, который можно рассматривать как амплификацию. В рассмотренной группе реакций нелегко понять, что является первичным — «курица или яйцо»; в данном случае — фактор IIа (тромбин) или фактор Ха (рис. 5).
Внутренний путь образования фактора Ха
Внутренний путь образования фактора Ха начинается с взаимодействия in vivo прекалликреина, высокомолекулярного кининогена, факторов XII и XI на активирующей поверхности, вероятно на коллагене (рис. 6). Активирующей поверхностью внутреннего пути в опытах in vitro служит стекло и каолин. Взаимодействие фактора XII с активирующей поверхностью делает его более доступным для протеолитической атаки калликреином. В результате действия калликреина образуется фактор ХIIа, который в свою очередь индуцирует переход прекалликреина в калликреин. Таким образом, имеет место реципрокная активация. Фактор ХIIа высвобождает из высокомолекулярного кининогена брадикинин и активирует фактор XI в ХIа. Фактор ХIа в результате двух последовательных реакций активирует фактор IX (Gla-содержащий зимоген). Фактор IХа в присутствии ионов Са2+ и кислых фосфолипидов медленно активирует фактор X; активация происходит путем расщепления той же связи Arg—Ilе, которую расщепляет фактор VIIa на внешнем пути. Скорость активации фактора X фактором IХа увеличивается в 500 раз в присутствии фактора VIII (или VIIIa). Для активации фактора VIII, по-видимому, необходимо небольшое количество тромбина. Фактор VIII не является протеазой; вероятно, он служит рецептором для фактора IX а при расщеплении последним связи Arg — Ilе в факторе X. Внутренний путь свертывания крови — медленный процесс, поскольку в нем участвует большое число факторов. Все вместе они образуют каскадный механизм, генерирующий фактор Ха (рис. 6).
Рис. 5. Взаимосвязь внутреннего, внешнего и конечного общего пути в процессе свертывания крови.
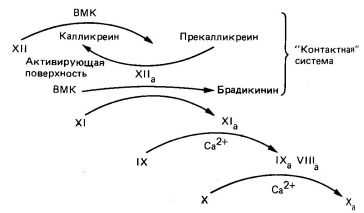
Рис. 6. Внутренний путь активации фактора X в Ха. ВМК — высокомолекулярный кининоген.
Имеется целый ряд наследственных болезней человека, обусловленных недостаточностью различных компонентов системы свертывания. Наиболее часто наблюдается недостаточность фактора VIII, детерминирующая гемофилию А (соответствующий ген локализован в 10-й хромосоме человека). Эта болезнь сыграла значительную роль в истории королевских династий в Европе.
У пациентов с аутосомно-доминантой болезнью Виллебранда помимо недостаточности фактора VIII имеется нарушение в адгезии тромбоцитов. Между тем у больных гемофилией А отсутствует только свертывающая активность фактора VIII, при этом адгезия тромбоцитов не нарушена. Фактор адгезии тромбоцитов (фактор Виллебранда) синтезируется клетками эндотелия сосудов и мегакариоцитами (клетками-предшественниками тромбоцитов); он представляет собой крупный гликопротеин с мол. массой более 200000. Фактор Виллебранда обнаруживается в плазме и тромбоцитах в составе комплекса с молекулой фактора VIII. По-видимому, на поверхности тромбоцитов имеется рецептор гликопротеиновой природы, связывающий комплекс фактора Виллебранда с фактором VIII. Фактор Виллебранда, вероятно, стабилизирует прокоагулянтную активность фактора VIII. Болезнь Виллебранда может быть результатом наследуемого дефекта в олигосахаридном фрагменте гликопротеинового фактора Виллебранда. Аномальный олигосахарид может препятствовать адгезии тромбоцитов и дестабилизировать фактор VIII. При гемофилии А имеется дефект фактора VIII; при этом нарушается его свертывающая активность, в то же время адгезия тромбоцитов, определяемая фактором Виллебранда, не меняется. Фактор VIII представляет собой гликопротеин, содержащий 2300 аминокислот; его молекула обнаруживает частичную гомологию с церулоплазмином и фактором V. Синтезируется этот фактор в печени, селезенке и почках.
Антикоагулянты
Нормальная плазма характеризуется несколькими видами антитромбиновой активности. Небольшой вклад в нее вносит α1-антитрипсин. На долю специфического α2-глобулина приходится около 25% всей антитромбиновой активности плазмы. Он образует необратимый комплекс с тромбином и другими протеазами, препятствуя таким образом связыванию этих ферментов с их природными субстратами. α2-Глобулин рассматривается как α2-ингибитор плазмина, поскольку он инактивирует также плазмин, являющийся сериновой протеазой с фибринолитической активностью.
Наибольшая антитромбиновая активность присуща антитромбину III. Антитромбин III обладает незначительной эндогенной активностью и сильно активируется в присутствии гепарина, обладающего большим отрицательным зарядом. Гепарин, по-видимому, связывается со специфическим катионным участком антитромбина III, вызывая конформационное изменение его молекулы. В результате этого изменения антитромбин III приобретает возможность связываться со всеми сериновыми протеазами, включая трипсин, химотрипсин и плазмин. В системе свертывания крови антитромбин III ингибирует активность тромбина, факторов IХа, Ха, ХIа и ХIIа. У индивидов с наследственной недостаточностью антитромбина наблюдается склонность к образованию тромбов. Отсюда можно сделать вывод, что антитромбин выполняет физиологические функции и что в норме процесс свертывания крови у человека представляет собой очень динамичную систему.
Гепарин часто используется в клинической практике в качестве препарата, предотвращающего свертывание крови. Главным фактором, определяющим противосвертывающую активность гепарина, является активация им антитромбина III, который в свою очередь ингибирует рассмотренные выше сериновые протеазы. Известно, что небольшое количество гепарина находится на стенках сосудов, вследствие этого снижается активация внутреннего пути. Противосвертывающую активность гепарина можно подавить сильно катионными полипептидами (например, протамином). Такие полипептиды конкурируют с катионными участками антитромбина III за связывание с полианионным гепарином.
Препараты группы кумарина ингибируют витамин-К-зависимое карбоксилирование остатков Glu, приводящее к образованию Gla в N-концевой части молекулы факторов II, VII, IX и X. Все эти факторы синтезируются в печени, и образование остатков Gla необходимо для их созревания и, следовательно, для нормального функционирования внутреннего, внешнего и общего конечного путей свертывания. По-видимому, препараты кумарина ингибируют восстановление хиноновых производных витамина К в активные гидрохиноновые формы. Введение витамина К снимает блок, вызываемый кумарином, и обеспечивает созревание в печени Gla-зависимых факторов свертывания. Обращение действия кумарина витамином К наблюдается только через 12—24 ч; обращение же противосвертывающей активности гепарина протамином происходит практически сразу; это различие обусловлено природой антагонистических механизмов.
Фибринолиз
Имеются убедительные данные, свидетельствующие о том, что система свертывания крови в норме находится в динамическом равновесии, при котором фибриновые сгустки постоянно образуются, а затем растворяются. Плазмин представляет собой сериновую протеазу, способную гидролизовать фибриноген и фибрин, факторы V и VIII, факторы комплемента и различные полипептидные гормоны. В норме плазмин содержится в плазме в форме неактивного профермента (плазминогена). В большинстве тканей организма имеются активаторы плазминогена различных типов. Тканевый активатор плазминогена — это сериновая протеаза, каталитически неактивная в отсутствие контакта с фибрином. Находясь в контакте с фибрином, активатор плазминогена способен расщеплять молекулу плазминогена с образованием плазмина. Когда плазмин гидролизует фибрин, активатор плазминогена теряет свою активность и протеолиз затухает. Таким образом, обеспечивается эффективная регуляция процесса фибринолиза. Весьма перспективным представляется использование в терапевтических целях тканевого активатора плазминогена (ТАП), получаемого методами генной инженерии. ТАП способствует восстановлению проходимости коронарных артерий, снижая, таким образом, повреждение миокарда, происходящее при остром тромбозе коронарных сосудов. Еще один активатор плазминогена — протеолитический фермент урокиназа — содержится в моче. Урокиназа — это тоже сериновая протеиназа; она может активировать плазминоген, расщепляя его в двух местах.
Плазминоген в норме осаждается с фибрином и, следовательно, входит в состав фибринового сгустка. Образующийся в результате активации плазмин расщепляет молекулы фибрина на растворимые фрагменты, и сгусток исчезает (растворяется). Фибриновые сгустки с поперечными сшивками, труднее растворяются плазмином.
Концентрация активаторов плазминогена повышается при ряде заболеваний, в том числе при некоторых формах рака и при шоке. Антиплазминовая активность, обусловленная α1-антитрипсином и α2-ингибитором плазмина, может снижаться при циррозе печени. Некоторые бактериальные продукты, например стрептокиназа, способны активировать плазминоген без расщепления его молекулы и могут быть ответственны за диффузные кровоизлияния, наблюдаемые иногда у больных с диссеминированными бактериальными инфекциями.
English | главная | сотрудники | наука | клиники | студентам | ординаторам | литература
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе