 [Апластическая анемия диагностика]
[Апластическая анемия диагностика]
Апластическая анемия
7.4. Апластическая анемия.
Апластическая анемия – разнородная группа гематологических заболеваний, морфологическим признаком которых является панцитопения в периферической крови и глубокая гипоплазия или аплазия миелоидной ткани. Развитие апластической анемии обусловлено большим числом эндогенных и экзогенных факторов, вызывающих качественные и количественные изменениями со стороны стволовой клетки и ее микроокружения.
Эпидемиология.
Апластическая анемия — достаточно редкое заболевание: его средняя частота в Европе и США составляет 4-6 случаев на 1 миллион жителей в год. Чаще всего апластическая анемия развивается у лиц до 20 и старше 65 лет, что может быть связано с преобладанием этиологической роли вирусов у лиц молодого возраста и химических веществ — у пожилых людей. Свое подтверждение эта гипотеза находит в исследованиях, проведенных в Китае и Юго-Восточной Азии. Эти регионы, где частота апластической анемии в 3-4 раза выше среднемировой, характеризуются широким распространением вирусных заболеваний (в особенности гепатита) и использованием в сельском хозяйстве ядохимикалиев без адекватной защиты.
Этиология и патогенез.
Причину апластической анемии удается выявить менее, чем у 50% больных. В зависимости от этиологических факторов выделяют: врожденные (наследственные) и приобретенные формы заболевания.
К врожденным формам относятся анемия Фанкони, амегакариоцитарная аплазия и апластическая анемия, развивающаяся у больных с негаматологической патологией (синдром Дауна). В группу приобретенных входят первичная (этиологический фактор неизвестен) и вторичная апластическая анемия, которая может возникать при воздействии ионизирующей радиации, химических веществ (бензин, толуол), при вирусных инфекциях (гепатиты В и С, ВИЧ-инфекция, вирус Эпштейна-Барр, парвовирусы), иммунных заболеваниях (системная красная волчанка, эозинофильный фасциит), тимоме и др.
В основе патогенеза апластической анемии лежит внутренний дефект кроветворной стволовой клетки, приводящий к нарушению ее пролиферации и дифференцировки. В реализации факторов, приводящих к изменению в стволовой клетке, имеют значение состояние кроветворного микроокружения (стромы костного мозга), а также иммунопатологические воздействия, обусловленные внешними и/или внутренними факторами.
Клиническая картина.
Течение апластической анемии различно: в одних случаях заболевание возникает внезапно и быстро приводит к летальному исходу, в других протекает более латентно, особенно у лиц пожилого возраста.
Наиболее распространенной является приобретенная первичная апластическая анемия. При этой форме чаще страдают мужчины в возрасте 18-20 лет. Длительность заболевания до первичного обращения за врачебной помощью составляет в среднем от 1 до 3 месяцев. При отсутствии своевременной диагностики апластическая анемия характеризуется неуклонным прогрессированием.
Клинические проявления заболевания тесно связаны с выраженностью изменений в периферической крови (анемия, лейко- и нейтропения, тромбоцитопения) и включают 3 синдрома: анемический, геморрагический и инфекционных осложнений. Как правило, первые симптомы обусловлены анемией. Часто одновременно развивается геморрагический синдром различной степени выраженности (кровоизлияния на коже по петехиально-пятнистому типу, носовые, десневые, в более тяжелых случаях — маточные и желудочно-кишечные кровотечения, кровоизлияния в сетчатку и головной мозг). Иногда геморрагический синдром в начале заболевания настолько выражен, что дает повод к ошибочному диагнозу (это более характерно для редкой формы апластической анемии — амегакариоцитарной аплазии). Синдром инфекционных осложнений в начале заболевания возникает редко (при клинически раритетной форме апластической анемии, характеризующейся преимущественным угнетением нейтропоэза). При прогрессировании заболевания инфекционные осложнения (язвенно-некротическое поражение полости рта, миндалин, пневмония, сепсис и др.) доминируют в клинической картине и, наряду с геморрагическим синдромом, являются одной из основных причин летальных исходов.
В некоторых случаях апластическая анемия проявляется одноростковой цитопенией с соответствующей клинической симптоматикой (чаще — парциальная красноклеточная аплазия, реже — амегакариоцитарная аплазия или угнетение нейтропоэза).
При объективном исследовании больных обращает внимание мраморная бледность кожи и видимых слизистых оболочек. Увеличения селезенки, печени и лимфатических узлов не отмечается; более того, наличие органомегалии и лимфоаденопатии исключает апластическую анемию).
Лабораторные данные.
Диагностика апластической анемии основывается на лабораторных показателях (анализ периферической крови) и результатах морфологического исследования костного мозга.
Клинический анализ крови. У 80% больных выявляется трехростковая цитопения: гемоглобин ниже 100 г/л, нейтрофилов менее 1,5х109/л, тромбоцитов менее 100,0х109/л. Анемия, как правило, носит нормо- или гиперхромный характер с выраженным анизоцитозом. Важным является показатель абсолютного количества ретикулоцитов: при апластической анемии у 2/3 больных отмечается ретикулоцитопения.
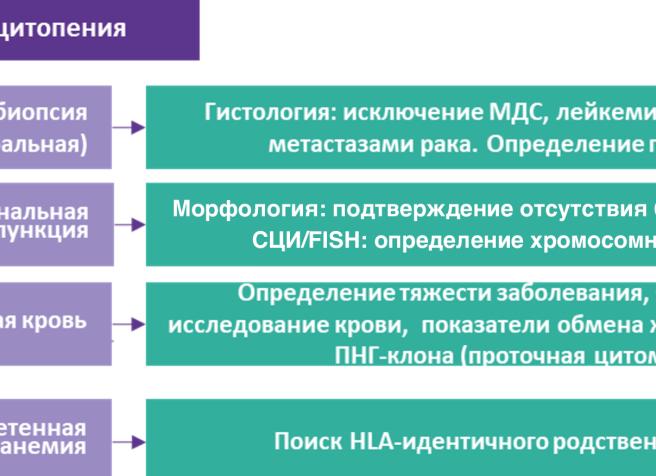
Исследование миелограммы. Апластическая анемия является абсолютным показанием для стернальной пункции. Чаще всего в аспирате костного мозга выявляется снижение клеточности (уменьшение содержания миелокариоцитов) с угнетением всех ростков гемопоэза, относительный лимфоцитоз, умеренная плазмоцитарная реакция. В связи с тем, что поражение костного мозга развивается неравномерно, зоны аплазии чередуются с участками кроветворного костного мозга. В этой связи для окончательного подтверждения диагноза необходимо проведение трепанобиопсии.
Трепанобиопсия костного мозга — основной метод, позволяющий поставить подтвердить диагноз апластической анемии. При тяжелой АА в трепанобиоптате практически весь объем межбалочных пространств заполнен жировой тканью, среди клеток которой встречаются рассеянные лимфоциты, плазматические клетки, единичные тучные клетки и макрофаги с цитоплазмой, содержащей гемосидерин. При гипоплазии миелоидной ткани, которая может быть начальной фазой заболевания, на фоне жировой ткани сохраняются небольшие скопления клеток эритроидного и гранулоцитарного ростков. Мегакариоциты обычно не обнаруживаются, даже если другие ростки кроветворной ткани более или менее сохранены.
Биохимические исследования. Выполнение этих тестов не связано с диагностикой апластической анемии, но необходимо для проведения дифференциального диагноза с другими анемиями (исследование содержания сывороточного железа, свободного билирубина, свободного гемоглобина плазмы), оценки функции печени (если имеются анамнестические данные о гепатите) и почек (для контроля их функцией на фоне лечения).
Иммунологические исследования. Необходимо определение группы крови и резус-фактора, а также совместимости с донором по системе HLA для подбора компонентов крови и костного мозга (при подготовке к миелотрансплантации).
Вирусологические исследования. Обязательным является определение наличия или отсутствия антител к цитомегаловирусу (CMV). Это связано с тем, что больные, не имеющие антител к CMV, должны получать CMV-отрицательные компоненты крови. Кроме того, необходимо проведение исследований на вирусы гепатита A, B, C и ВИЧ-инфекцию.
Рентгенологические исследования. Рентгенография грудной клетки и придаточных пазух необходимы для определения очагов возможной инфекции, а также для динамического контроля при ее возникновении. У больных молодого возраста необходимо проведение рентгенологических исследований костей предплечий и кистей рук для исключения анемии Фанкони.
Ультразвуковая томография. Ультразвуковое исследование органов брюшной полости в первую очередь показано детям и больным молодого возраста для выявления аномалий развития почек, которые характерны для анемии Фанкони. Выявление при ультразвуковом исследовании увеличения селезенки и печени противоречит диагнозу апластической анемии.
Цитогенетические исследования. Цитогенетические исследования необходимы для исключения анемии Фанкони, миелодиспластического синдрома и острого лейкоза, которые характеризуются цитогенетическими аномалиями.
Классификация.
В соответствии с показателями периферической крови и данными трепанобиопсии выделяют следующие формы апластической анемии.
Тяжелая апластическая анемия.
Периферическая кровь (сочетание не менее двух из трех критериев): а)нейтрофилы 0,5-0,2х109/л; б)тромбоциты
studfiles.net
57. Апластические анемии: основные клинические признаки, лабораторная диагностика, критерии диагноза, лечение.
Апластические анемии (АА) – группа патологических состояний, характеризующихся панцитопенией, уменьшением клеточности (абсолютного содержания клеток) костного мозга при содержании бластов менее 5%.
Клиника апластических анемий:
а) приобретенная апластическая анемия: постепенное или острое начало с быстро нарастающей панцитопенией, выраженным анемическим синдромом, тяжелым геморрагическим синдромом и инфекционными осложнениями; иногда заболевание осложняется внутрисосудистым гемолизом (появляются желтушность кожи и видимых слизистых, темная моча, незначительное увеличение печени, тромбозы множественной локализации).
б) анемия Фанкони: чаще начинается в 5-10 лет; вместе с нарушениями гемопоэза характерны низкий рост, врожденные дефекты скелета (микроцефалия, аномалии фаланг пальцев), аномалии мочеполовой системы (подковообразная почка и др.), гипер- или гипопигментация кожи, умственная отсталость
Диагностика апластических анемий:
1. ОАК: панцитопения (эритро-, тромбо-, лейкоцитопения с нейтропенией и относительным лимфоцитозом)
2. Миелограмма: уменьшение количества миелокариоцитов, относительное повышение содержания лимфоцитов, абсолютное снижение количества нейтрофилов, элементов эритропоэза, резкое уменьшение мегакариоцитопоэза
3. Трепанобиопсия с иммунофенотипированием клеток (необходима для установки генеза апластической анемии): жировой костный мозг преобладает над деятельным, очаги кроветворения редки и малоклеточны
Лечение апластических анемий:
1. Госпитализация в гематологический стационар; при резкой нейтропении – изоляция больного в асептический бокс
2. Трансплантация стволовых клеток периферической крови или костного мозга – рекомендуется всем больным до 20 лет, даже при тяжелом течении апластической анемии, особенно показана зависимым от гемотрансфузий больным (у которых нужны переливания крови чаще 1 раза в мес); до трансплантации костного мозга проводят химиотерапию с тотальным облучением тела.
3. Специфическая консервативная терапия – основной метод лечения для больных старше 20 лет при легком течении заболевания или невозможности выполнить трансплантацию костного мозга: антитимоцитарный иммуноглобулин 20 мг/кг/сут в/в капельно 5 дней в асептических условиях; циклоспорин 5 мг/кг/сут внутрь; метилпреднизолон по 2 мг/кг/сут в/в с 1-ого по 14-ый день, затем по 1 мг/кг/сут с 15-ого по 21-ый день; колониестимулирующие факторы — молграмостим 5 мкг/кг/сут п/к до увеличения числа гранулоцитов > 1*109/л.
4. Спленэктомия (наиболее эффективна при нетяжелой апластической анемии)
5. Профилактика и лечение осложнений (анемического синдрома, геморрагического синдрома, инфекционных осложнений, гемосидероза, сердечной и почечной недостаточности и др.)
58. Гемолитические анемии: классификация, механизмы и типы гемолиза, общие
признаки.
Гемолитические анемии (ГА) – группа анемий, обусловленных снижением средней продолжительности жизни эритроцитов в результате их усиленного гемолиза (внутриклеточного, тканевого – чаще всего в селезенке или внеклеточного, внутрисосудистого).
В норме продолжительность жизни эритроцитов 100-120 дней, при гемолитической анемии она укорачивается до 12-14 суток.
Признаки ГА: 1) выраженный ретикулоцитоз в периферической крови (признак хорошей регенераторной способности костного мозга); 2) реактивная гиперплазия красного ростка костного мозга; 3) неконьюгированная гипербилирубинемия; 4) гипергемоглобинемия (при внесосудистом гемолизе).
Классификация ГА:
1. По этиологии:
а) наследственные ГА:
1) мембранопатии — наследственный микросфероцитоз (болезнь Минковского-Шоффара) – снижение количества спектрина клеточной мембраны эритроцитов повышает ее проницаемость для воды и ионов натрия; клетки набухают, из дискоцитов превращаются в микросфероциты, которые гибнут в селезенке, а их гемоглобин поглощается макрофагами (внутриклеточный гемолиз); клинически: анемия, желтушность, спленомегалия, гиперхромный кал, могут быть пигментные камни в желчном пузыре, нарушение костеобразования (из-за очагов кроветворения); ОАК: нормохромная анемия, микросфероциты, ретикулоциты; сниженная осмотическая резистентность эритроцитов в гипотонических растворах (в норме 0,36-0,42); миелограмма: соотношение лейкоциты/эритроциты 1:1-1:2 при норме 3:1-4:1; лечение: спленэктомия
2) ферментопатии — дефицит активности глюкозо-6-фосфатдегидрогеназы эритроцитов; клинически анемия, желтушность и другие признаки гемолиза при воздействии агентов, провоцирующих гемолиз (СА, конские бобы, черника, голубика); ОАК – тельца Гейнца (деградация Hb).
3) гемоглобинопатии – нарушения структуры гемоглобина:
а. количественная – талассемия — из-за наличия мутантного гена происходит торможение синтеза цепей глобина; клинически нарушения скелета (квадратный череп), болезнь Кули (желтуха, гепатоспленомегалия, гипохромная микроцитарная анемия, снижение осмотической резистентности эритроцитов – при гомозиготный вариант) или умеренная гипохромная анемия (при гетерозиготном варианте); в ОАК – много овальных и грушевидных эритроцитов
б. качественная – гемоглобинопатия S (серповидно-клеточная анемия) — в HbS в положении 6 четвертого пептида β-цепи гидрофильная глютаминовая кислота заменена на валин, поэтому гемоглобин начинает кристаллизоваться; клинически – анемия, высокий башенный череп, желтушность; часты осложнения – инфаркты органов, гемолитические кризи, тромботические осложнения в любом возрасте; ОАК – деформированные (вытянутые, серповидные) эритроциты
б) приобретенные ГА:
1) при гиперспленизме
2) иммунные ГА: аутоиммунные, лекарственные и др.
3) обусловленные механическим повреждением эритроцитов: маршевая гемоглобинурия, ГА при протезировании клапанов сердца и сосудов
4) токсические: при укусе змей и пауков, интоксикации рядом металлов (медь), органическими растворителями
5) пароксизмальная ночная гемоглобинурия
2. По серологическому принципу – различные типы аутоиммунных гемолитических анемий (АИГА) – возникают при срыве иммунологической толерантности к неизмененным АГ собственных эритроцитов или к АГ, имеющим сходные с эритроцитами детерминанты
1) АИГА с неполными тепловыми агглютининами – наиболее частый вариант; фиксация IgG и IgA на поверхности эритроцитов с последующей гибелью эритроцитов в селезенке (ее макрофаги имеют рецепторы к Fc-фрагменту иммуноглобулина и осуществляют иммунный фагоцитоз)
Клиника: острое, внезапное начало с появлением слабости, одышки, артралгии, болей в пояснице, повышения температуры тела (из-за распада эритроцитов); больные бледные, характерна спленомегалия, пальпаторно селезенка безболезненна; при частых гемолитических кризах – вторичный токсический гемолитический гепатит; кал темного цвета (повышен стеркобилин), моча светло-желтая (уробилин отсутствует)
Диагностика: нормохромная анемия со значительным снижением гемоглобина (при гемолитическом кризе – до 30-40 г/л), постепенным нарастанием ретикулоцитоза; лейкоцитоз до 10-15*109/л, сдвиг влево до миелоцитов (лейкемоидная реакция миелоидного типа на гемолиз); СОЭ – до 30 мм/ч; тромбоциты в норме или снижены; миелограмма – нормобластический тип кроветворения, иногда с чертами мегалобластического; положительная реакция Кумбса — прямая (выявление фиксированных на эритроцитах антител; при малом количестве Ig может дать отрицательный результат) и непрямая (выявление АТ к эритроцитам в сыворотке крови)
2) АИГА с тепловыми гемолизинами – внутрисосудистое разрушение эритроцитов под действием АТ-гемолизинов в присутствии комплемента.
Клиника: чаще подострое начало; бледность, желтушность кожных покровов, анемический синдром, нормальные резмеры селезенки; на высоте гемолиза может начаться ДВС-синдром, микротромбоз мезентериальных сосудов, развиться полиорганная недостаточность.
Диагностика: гипергемоглобинемия и гемоглобинурия (моча черного цвета); БАК: повышение ЛДГ (из-за разрушения клеток); отрицательная реакция Кумбса; положительная качественная реакция на аутогемолиз (в чистую пробирку наливают 2-3 мл крови без стабилизатора, ставят ее в термостат на 24 часа при температуре 37 С, при этом происходит гемолиз, т.к. аутоантитела в сыворотке при t = 37С фиксируются на поверхности эритроцитов, затем присоединяется комплемент и мембрана эритроцитов разрушается)
3) АИГА с полными холодовыми агглютининами – фиксация холодовых аутоантител на АГ собственных эритроцитах с их последующей внутрикапиллярной агглютинацией при температуре 4-15 С и возникновением синдрома повышенной вязкости (гипервискозности).
Клиника: в холодную погоду наблюдается посинение и отек кожи лица, синюшная кожа рук, ног, ушей, синдром Рейно (вплоть до гангрены), летом симптомы проходят; желтуха отсутствует (гипербилирубинемия не характерна, т.к. происходит не гемолиз, а агглютинация); селезенка не увеличена.
Диагностика: умеренное снижение гемоглобина, невысокий ретикулоцитоз, лейкоцитоз до 10-12*109/л, СОЭ увеличена до 70 мм/час и более; осмотическая резистентность эритроцитов не изменена; реакция Кумбса отрицательная.
4) АИГА с двухфазными гемолизинами Доната-Ландштейнера – фиксация IgG на эритроцитах с участием комплемента при низких температурах с последующим их внутрисосудистым гемолизом после согревания
Клиника: вскоре после переохлаждения появляется головная боль, боли в ногах и поясничной области, чувство «ломоты в теле», озноб, повышается температура тела, рвота, черная моча (гемолитический криз);после криза характерны желтушность кожи, увеличение печени и селезенки, иногда – синдром Рейно и холодовая крапивница.
Диагностика: во время криза – нормохромная анемия с ретикулоцитозом, СОЭ умеренно увеличена, лейкоцитоз; гемоглобинурия; серологический анализ крови: если пробирку с кровью поставить на час в холодильник, а затем согреть в термостате до температуры 37 С, — происходит гемолиз.
Апластическая анемия — Анемии — описание, диагностика
Под апластической анемией понимают состояние, развивающееся вследствие угнетения кроветворения в костном мозге без признаков гемобластоза и характеризующееся панцитопенией. Понятие апластических анемий рассматривается как синдромное, так как преобладание жира в костном мозге при панцитопении в периферической крови встречается при целом ряде заболеваний, различных по своей природе.
Из группы врожденных апластических анемий следует выделить конституциональную анемию Фанкони. К группе приобретенных апластических анемий относят анемии, связанные с приемом больших доз цитостати- ческих препаратов, возникающие после перенесенного острого вирусного гепатита.
Этиология и патогенез апластической анемии
Описываются апластические анемии, возникающие после приема лекарственных средств, не вызывающих. У большинства людей, которые их принимают, изменений в крови. К ним относятся левомицетин, бутадион (фенилбутазон), соединения золота, бутамид (толбутамид), сульфапиридазин (сульфаметоксипиридазин, кинекс), мепротан (мепробамат, андаксин), триметин (триметадион), букарбан (карбутамид), аминазин (хлорпромазин) и др.
Наиболее часто встречаются идиопатические формы апластической анемии, при которых самый тщательный опрос больного не позволяет выяснить причину заболевания.
Принципиально возможны следующие механизмы развития апластической анемии:
1. Уменьшение количества стволовых клеток или их внутренний дефект.
2. Нарушение микроокружения, приводящее к нарушению функции стволовых клеток.
3. Внешние гуморальные или клеточные воздействия, в основном иммунные, нарушающие нормальную функцию стволовой клетки.
Имеются некоторые данные, позволяющие говорить о предрасположенности к развитию аплазии у лиц, принимающих хлорамфиникол. Описаны два случая заболевания апластической анемией однояйцовых близнецов после приема левомицетина, что говорит о возможности генетической предрасположенности к данной патологии. Основываясь на изучении синтеза ДНК in vitro костным мозгом больного, перенесшего хлорамфиниколовую аплазию, и его родственников, было сделано заключение о генетической предрасположенности к хлорамфиниколовой аплазии. Большей чувствительности к левомицетину in vitro костного мозга больного по сравнению с донорским не выявлено, хотя, вероятно, генетическая предрасположенность к действию левомицетина все же существует. Описаны случаи семейной повышенной чувствительности с развитием аплазии у лиц, получающих препараты золота.
Апластическая анемия может возникать в результате воздействия ионизирующей радиации, при этом наблюдается гибель стволовой клетки. Имеется четкая зависимость от дозы.
Механизм возникновения аплазии после вирусной инфекции также недостаточно ясен. Она развивается чаше всего после перенесенного гепатита A или гепатита, не относящегося ни к группе A, ни к группе B.
Известны случаи аплазии после перенесенного инфекционного монокулеоза. Не выяснено, поражает ли вирус непосредственно стволовую клетку или возникает гетероиммунная ситуация: антитела против вируса, фиксированного на стволовой клетке, вызывают гибель этой стволовой клетки.
Имеются некоторые сведения о патогенезе конституциональной формы апластической анемии, или анемии Фанкони. У больных анемией Фанкони помимо панцитопении наблюдаются другие признаки патологии — гиперпигментация, отсутствие или уменьшение больших пальцев рук, отсутствие лучевой кости, изменения в почках, сердце. Наследование болезни аутосомнорецессивное, проявляется у гомозиготных носителей обычно в возрасте старше 5 лет, иногда сразу после рождения.
По данным ученых, при культивировании костного мозга больных анемией Фанкони в период до ее развития резко снижается количество КОЕ-С и КОЕ-Е. Вероятнее всего, при анемии Фанкони имеется дефект в стволовых клетках. Доказано, что ни сыворотка больных анемией Фанкони, ни их лимфоциты не влияют на культуру костного мозга доноров.
Установлен дефект в системе репарации ДНК в фибробластах больных анемией Фанкони. Возможно, что с этим связана легкая повреждаемость хромосом при анемию Фанкони под влиянием ультрафиолетового облучения, малых доз цитостатических препаратов. Высказано предположение, что легкая повреждаемость и мутабильность ДНК приводят как к развитию аплазии, так и к возникновению у этих больных острого лейкоза.
Очень большое количество исследований, особенно за последние годы, посвящено изучению патогенеза идиопатической формы апластической анемии. Установлено, что при апластических анемиях уменьшается количество колониеобразующих клеток как в костном мозге, так и в периферической крови. Наблюдается уменьшение числа как эритроидных, так и гранулоцитарных колоний. Эти данные говорят о поражении тем или иным путем стволовой клетки кроветворения.
В пользу поражения стволовой клетки при апластических анемиях свидетельствует эффективность трансплантации костного мозга от однояйцовых близнецов и братьев или сестер, совместимых по системе HLA. Однако вопрос о том, какого характера нарушения имеются в стволовой клетке, остается открытым. В настоящее время имеются данные в пользу воздействия на стволовую клетку иммунных лимфоцитов. Об иммунной природе апластической анемии свидетельствует отсутствие в ряде случаев эффекта от приживления трансплантированного костного мозга однояйцового близнеца без предварительной иммуннодепрессии.
Большое количество работ посвящено изучению воздействия различных популяций лимфоцитов на стволовую клетку. Доказано, что лимфоциты больных апластической анемией тормозят образование эритроидных колоний донорского костного мозга, а также то, что они могут нарушить дифференциацию и пролиферацию клеток костного мозга. Обнаружено снижение при апластической анемии хелперной функции T-лимфоцитов.
Все приведенные данные подтверждают вероятность участия иммунных механизмов в развитии апластической анемии у значительного количества больных. Однако пока не установлено, какие из этих механизмов являются первичными, а какие присоединяются в ходе заболевания. В настоящее время методы, с помощью которых пытаются разделить апластические анемии на иммунные и неиммунные, очень несовершенны. Возможно что есть разные формы апластических анемий по патогенезу. В одних случаях имеется внутренний дефект стволовой клетки, в других — микроокружения в третьих — подавление кроветворения иммунными лимфоцитами. Однако более вероятно, что значительная часть апластических анемий относится к группе иммунных. Подтверждением этого является обнаружение методом агрегатгемагглютинации у большинства больных апластической анемии на поверхности периферических эритроцитов антител, относящихся к классу IgG. Не исключена возможность участия этих антител в уничтожении стволовой клетки по механизму антителозависимой цитотоксичности, однако возможно, что эти антитела появляются вторично и не имеют никакого отношения к патогенезу апластической анемии.
Клинические проявления апластической анемии
Клинические проявления идиопатической апластической анемии могут быть различными. В одних случаях заболевание начинается остро, очень быстро прогрессирует и почти не поддается никакой терапии. Но чаще всего болезнь начинается исподволь, больной адаптируется к анемии и обращается к врачу только при значительной выраженности панцитопении. Клиническая картина угнетения кроветворения характеризуется анемией различной степени выраженности, тромбоцитопенией со всеми клиническими проявлениями тромбоцитопенического синдрома (кровоподтеки, петехии на коже, носовые, десневые кровотечения, меноррагии). Нередко отмечается нейтропения значительной степени выраженности, следствием которой являются частые пневмония, отит, пиелит и другие воспалительные процессы. Иногда гематомы нагнаиваются. Нередко наблюдается развитие сепсиса. Анемия обусловлена как нарушением образования эритроцитов, так и кровотечениями.
При осмотре обращает на себя внимание выраженная бледность, нередко на коже имеются геморрагии. Характерны воспалительные изменения слизистой оболочки полости рта. При выслушивании сердца часто обнаруживается систолический шум. При идиопатической форме заболевания селезенка не пальпируется. Она может быть увеличена при гемосидерозе, развивающемся в результате массивных трансфузий эритроцитов. Возможно увеличение печени из-за недостаточности кровообращения в связи с анемией.
В одних случаях заболевание быстро прогрессирует и за несколько недель или месяцев приводит к смерти, в других — протекает хронически, с периодическими обострениями и ремиссиями. Иногда наступает полное выздоровление.
Лабораторные показатели при апластической анемии
Выраженность анемии может быть очень значительной. Иногда гемоглобин снижается до 1,24—1,86 ммоль/л (20—30 г/л). Анемия чаще всего нормохромная. Содержание ретикулоцитов колеблется от 0 до 4—5 %. Тяжелые формы заболевания протекают с более низким уровнем ретикулоцитов. Характерна выраженная гранулоцитопения. Иногда количество гранулоцитов снижается до 0,2 Г в 1 л, при этом наиболее часто развиваются инфекционные осложнения. Возможно снижение абсолютного количества моноцитов. Абсолютный уровень лимфоцитов в большинстве случаев остается нормальным. Количество тромбоцитов всегда снижено, иногда их не удается определить при подсчете. При этом удлиняется время кровотечения, развивается геморрагический синдром. У большинства больных СОЭ возрастает до 30—50 мм/ч.
Уменьшается количество миелокариоцитов костного мозга. У части больных отмечается раздражение красного ростка кроветворения. Увеличено количество лимфоцитов, плазматических клеток, тканевых базофилов. Мегакариоциты могут полностью отсутствовать. В костном мозге резко увеличивается количество железа, находящегося как в эритрокариоцитах. так и внеклеточно.
При гистологическом исследовании костного мозга в одних случаях имеет место полное исчезновение костномозговых элементов, в других — наблюдаются небольшие очаги кроветворения на фоне значительного опустошения костного мозга.
Содержание железа сыворотки у большинства больных увеличено, насыщение трансферрина приближается к 100 %. При исследовании феррокинетики с помощью радиоактивного железа выявляется удлинение времени выведения его из плазмы и уменьшение количества железа, включенного в эритроциты. Продолжительность жизни эритроцитов, измеренная с помощью радиоактивного хрома, чаще всего укорочена, реже нормальная. Иногда увеличивается уровень фетального гемоглобина. Исследование методом агрегатгемагглютинации часто дает положительный результат.
Диагностика апластической анемии
Апластическая анемия может быть диагностирована только после гистологического исследования костного мозга. Выявление в периферической крови панцитопении служит основанием для стернальной пункции с целью исключения гемобластозов и B12-дефицитной анемии. Следующим обязательным этапом диагностики является трепанобиопсия. При обнаружении большого количества жира в костном мозге ставится диагноз апластической анемии.
Если при трепанобиопсии обнаруживается нормальное соотношение между кроветворной тканью и жиром или гиперплазия, диагноз апластической анемии отпадает. В этих случаях необходимо прежде всего исключить периферическую форму аутоиммунной панцитопении, для которой характерно наличие антител, направленных против эритроцитов, периферических тромбоцитов и нейтрофильных гранулоцитов. При этом нередко увеличивается селезенка, иногда бывает положительной проба Кумбса, но чаще всего антитела обнаруживаются методом агрегатгемагглютинации. Количество мегакариоцитов в костном мозге нормальное, тогда как при апластической анемии они почти полностью отсутствуют. При периферической панцитопении у пожилых людей и у лиц, перенесших резекцию желудка, следует в первую очередь исключить B12-дефицитную анемию, а у детей — фолиеводефицитную анемию.
Наличие признаков внутрисосудистого гемолиза (гемосидеринурия, увеличение свободного гемоглобина плазмы, появление черной или красной мочи с высоким содержанием белка, ретикулоцитоз) свидетельствует в пользу либо пароксизмальной ночной гемоглобинурии, либо гемолизиновой формы аутоиммунной гемолитической анемии, сочетающейся с нейтропенией и тромбоцитопенией. Правильно поставить диагноз помогает применение пробы Хема, сахарозной пробы в трех вариантах и метода агрегатгемагглютинации.
medicalhandbook.ru