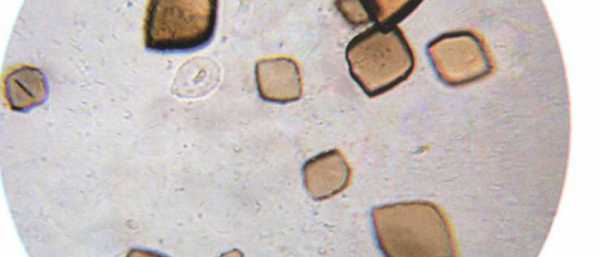
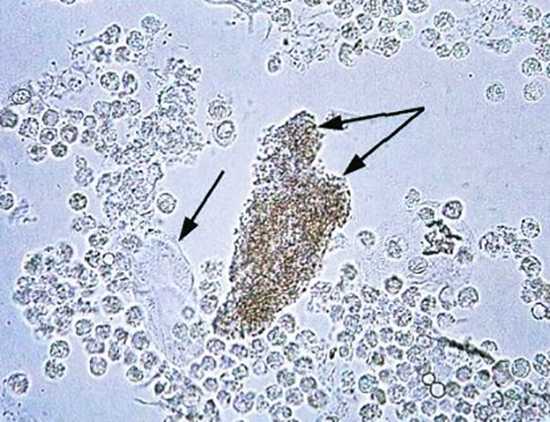
Ядерный сдвиг влево в нейтрофильном ряду встречается при
141. Нейтрофильный лейкоцитоз. Ядерный сдвиг: его виды и характеристика.
Причины: инфекционные факторы, продукты тканевого распада, токсические метаболиты, физические и психические факторы, хронический миелолейкоз.
Эозинофилия – при аллергических и паразитарных заболеваниях, хроническом миелолейкозе.
Важное практическое значение имеет определение степени ядерного сдвига в лейкоцитарной формуле.
По данному критерию выделяют шесть видов нейтрофильного лейкоцитоза:
без ядерного сдвига — увеличение количества зрелых сегментоядерных нейтрофилов на фоне общего лейкоцитоза;
с гипорегенеративным ядерным сдвигом влево — увеличение содержания палочкоядерных форм нейтрофилов (свыше 5 %) на фоне нейтрофилии; характерен для легкого течения ряда инфекций и воспалений;
с регенеративным ядерным сдвигом влево — на фоне нейтрофилии и увеличенного содержания палочкоядерных форм обнаруживаются метамиелоциты; общее количество лейкоцитов, как правило, увеличено; характерен для гнойно-септических процессов;
с гиперрегенеративным ядерным сдвигом влево — характеризуется появлением в гемограмме ещё более молодых форм лейкоцитов (миелоциты и даже отдельные промиелоциты и миелобласты), при этом эозинофилы часто вообще отсутствуют (анэозинофилия). Подобная картина является тревожным показателем, указывающим на неблагоприятное течение инфекционных и гнойно-септических заболеваний;
с дегенеративным ядерным сдвигом влево — повышение содержания палочкоядерных нейтрофилов сопровождается появлением значительного числа деструктивно измененных сегментоядерных форм (пикноз ядер, токсогенная зернистость и вакуолизация цитоплазмы и т. д.). Дегенеративный ядерный сдвиг влево является показателем угнетения функциональной активности костного мозга и может иметь место при тяжелом течении инфекционных заболеваний, при эндогенной интоксикации и т. д.;
с дегенеративным ядерным сдвигом вправо — характеризуется появлением в гемограмме гиперсегментированных (свыше 5 сегментов) нейтрофилов; отмечается при лучевой болезни, злокачественной анемии Аддисона-Бирмера, но в ряде случаев может обнаруживаться и у практически здоровых людей.
142. Лимфоцитоз: абсолютный и относительный. Моноцитоз, эозинофилия и базофилия.
Увеличение лимфоцитов в периферической крови у взрослых более 3,6*109/л расценивается как лимфоцитоз. Начиная с 6 лет количество лимфоцитов постепенно снижается и к 18 годам колеблется в пределах 1,0-4,0.
Относительный и абсолютный лимфоцитоз.
Относительным лимфоцитозом называется увеличение процентного содержания лимфоцитов в лейкоцитарной формуле при нормальном абсолютном их значении в крови. Пример: Имеется в организме массивный гнойно-воспалительный процесс, или умеренный на фоне истощения организма, при этом уровень лейкоцитов в общем клиническом анализе крови будет низким, к примеру 3,5*109/л. За счет чего снизились лейкоциты? В данном случае за счет нейтрофилов, т.к. гнойный процесс, а количество лимфоцитов остается на прежнем уровне. Так вот, в лейкоформуле процент лимфоцитов будет повышен, т.к. количество нейтрофилов уменьшилось, т.е. изменилось соотношение разновидностей лейкоцитов (эозинофилы, базофилы, нейтрофилы, лимфоциты, моноциты). Вот именно такое повышение процентного содержания лимфоцитов в лейкоформуле и называется относительным лимфоцитозом.
Абсолютный лимфоцитоз, в отличие от относительного, связан с увеличением общего количества лимфоцитов в крови и встречается при заболеваниях и патологических состояниях, сопровождающихся усиленной стимуляцией лимфопоэза.
Увеличение лимфоцитов чаще всего носит абсолютный характер и встречается при следующих заболеваниях и патологических состояниях:
Вирусные инфекции: ветряная оспа, краснуха, корь, острый вирусный гепатит, цитомегаловирусная инфекция, ОРВИ и др.
Туберкулез легких и внелегочной туберкулез
Острый и хронический лимфолейкоз
Лимфосаркома
Гипертиреоз
Эозинофилия(более 1500 в 1 мкл) наблюдается при аллергических и паразитарных заболеваниях (гельминтозы, амебиаз), хроническом миелолейкозе.
Базофилия ( больше 150 в 1 мкл) отмечается при микседеме, язвенном колите, хроническом миелолейкозе, после удаления селезенки.
Моноцитоз (более 1000 в 1 мкл) развивается при действии вирусов, МО, простейших (при инфекционном мононуклеозе, краснухе, туберкулезе, малярии), септическом эндокардите, коллагенозах.
Лимфоцитоз вызывают некоторые вирусы (инфекционного мононуклеоза, гепатита, кори), МО (возбудители коклюша, туберкулеза, сифилиса); высокий лимфоцитоз наблюдается при хроническом лимфолейкозе.
105. Ядерный сдвиг нейтрофильных лейкоцитов: определение, виды, гематологическая характеристика. Лейкемоидные реакции.
Сдвиги лейкоцитарной формулы нейтрофилов
При оценке сдвигов лейкоцитарной формулы исходят из того, что в периферической крови могут появляться нейтрофильные лейкоциты разной степени зрелости (метамиелоциты, миелоциты, промиелоциты, миелобласты). При этом определяют (рис.) наличие и степень изменения соотношения зрелых и молодых форм указанных гранулоцитов. Изменения обозначают как сдвиг лейкоцитарной формулы нейтрофилов вправо или влево.
Значение сдвигов лейкоцитарной формулы
Анализ лейкоцитарной формулы (выявление изменений абсолютного содержания нейтрофилов, эозинофилов и других лейкоцитов, оценка направленности и выраженности нейтрофильного сдвига) позволяет определить наличие и вид лейкоцитоза или лейкопении по клеточному составу, степень сдвигов в содержании и соотношении отдельных форм лейкоцитов, возможный механизм их возникновения.
Так, увеличение общего числа лейкоцитов в сочетании с абсолютной нейтрофилией свидетельствует о регенераторном (истинном) нейтрофильном лейкоцитозе. Если повышение общего числа лейкоцитов сопровождается абсолютной нейтро- и эозинофилией, имеет место регенераторный смешанный — нейтрофильно-эозинофильный лейкоцитоз. Снижение общего содержания лейкоцитов в сочетании с абсолютной лимфопенией — признак истинной лимфоцитарной лейкопении и т.д.
Наличие выраженного ядерного сдвига нейтрофилов влево при нейтрофильном лейкоцитозе обычно свидетельствует об истинной (регенераторной) природе этого лейкоцитоза, а отсутствие такого сдвига чаще наблюдается при перераспределительном механизме развития нейтрофильного лейкоцитоза или при нейтрофильной лейкопении.
Лейкемоидные реакции - изменения органах кроветворения и периферической крови, напоминающие лейкозы или другие опухоли кроветворной системы, имеющие временный характер и не преобразуются в ту опухоль, на которую они похожи. Такие реакции могут быть вызваны различного рода инфекциями, интоксикациями, опухолями, метастазами опухолей в костный мозг.
Причины и механизм развития могут отличаться при различных типах реакций: в одних случаях - попадание в кровь незрелых клеточных элементов, в других- повышенная продукция клеток крови либо ограничение выхода клеток в ткани, либо наличие нескольких механизмов одновременно. Лейкемоидные реакции могут касаться изменений в самых разных органах: крови, костном мозге, лимфатических узлах, селезенке.
Лейкемоидные реакции, напоминающие хронический миелолейкоз, сопровождают тяжелые инфекции и интоксикации. Реактивный лейкоцитоз всегда имеет в своей основе тяжелый процесс, сопровождающийся повышением температуры тела, наличием воспалительных очагов, сепсиса, в отличие от оригинального хронического миелолейкоз.
Реакции с преобладанием эозинофилов в крови обычно появляются при аллергических диатезах, сенсебилизациях к медикаментам и паразитам, изредка - при онкозаболеваниях ( лимфосаркомах и лимфогрануломатозах). Такие реакции требуют всестороннего обследования, для исключения гельминтозов и онкозаболеваний системы крови.
Реактивные эритроцитозы очень похожи с эритремией. Причиной эритроцитозов чаще всего являются заболевания легких с понижением оксигенации (кислородонасыщением) крови, врожденные пороки сердца, опухоли почки. В таких случаях необходимо ультразвуковое и компьютерное исследование.
Лейкемоидные реакции по лимфатическому типу чаще всего являются результатом вирусной инфекции.
Лейкемоидные реакции моноритарного типа часто встречаются при туберкулезе, саркоидозе, макроглобулинемии Вальден-стрема, хронических воспалительных процессах. От хронического моноцитоза их отличает наличие признаков какого-либо заболевания, в то время как моноцитарный лейкоз первые несколько лет протекает практически бессимптомно.
106. Лейкопении: виды, причины, механизм развития, диагностическое и прогностическое значение. Агранулоцитоз: причины и механизмы развития, картина крови. Лейкопения — снижение количества лейкоцитов в крови (менее 4,0109). Обусловлена, как правило, уменьшением в крови числа нейтрофилов (нейтропения), реже других форм лейкоцитов, например лимфоцитов, эозинофилов.
Этиологические факторы, вызывающие нейтропению, разнообразны. К ним относятся химические вещества (например, пестициды, нитрокраски, бензол и его производные), в т.ч. лекарственные средства (антибиотики, сульфаниламиды, препараты салициловой кислоты), ионизирующее излучение. Нейтропения часто наблюдается при апластической и В12- и фолиево-дефицитной анемиях, пароксизмальной ночной гемоглобинурии, миелодиспластических синдромах, остром лейкозе, метастазах рака в костный мозг, вирусных заболеваниях, циррозе печени и др.
На основании патогенетических механизмов выделяют 3 основных вида нейтропений: возникающие при уменьшении продукции нейтрофилов в костном мозге; связанные с повышенной деструкцией (потреблением) нейтрофилов и усиленным выведением их из сосудистого русла; перераспределительные. Развитие нейтропений чаще обусловлено несколькими механизмами. Уменьшение продукции нейтрофилов в костном мозге происходит обычно при изменении количества стволовых кроветворных клеток или нарушении их функции. Так, при апластической анемии нейтропения связана с угнетением пролиферации стволовых кроветворных клеток; при В12- и фолиево-дефицитной анемиях отмечается повышенная деструкция нейтрофилов в костном мозге в результате их функциональной неполноценности (так называемый неэффективный гранулоцитопоэз).
В основе нейтропений может лежать перераспределение нейтрофилов в сосудистом русле. В норме часть нейтрофилов после выхода из костного мозга свободно циркулирует в сосудистом русле (циркулирующий пул), другая часть занимает пристеночное положение (маргинальный пул); размеры пулов приблизительно одинаковы. При различных видах шока, малярии, при проведении гемодиализа отмечается переход нейтрофилов из циркулирующего пула в маргинальный.
Нейтропении могут быть приобретенными, наследственными и врожденными. В зависимости от клинической картины, длительности процесса выделяют острую (например, при агранулоцитозе) и хроническую нейтропении, которые могут быть первичными и вторичными.
Хронические приобретенные нейтропении встречаются часто. Их патогенез и прогноз различны. Выделяют хронические идиопатические, иммунные и перераспределительные нейтропении. Хронические идиопатические нейтропении в одних случаях имеют бессимптомное течение, в других — могут наблюдаться тяжелые инфекционные осложнения. К этой группе относится невинная Л.; она встречается редко, характеризуется стабильностью при нормальном составе костного мозга. Инфекционные осложнения отмечаются редко. Необходимо помнить, что такая немотивированная Л. может наблюдаться в начале острого лейкоза, хронического персистирующего гепатита, диффузных заболеваний соединительной ткани и др. Диагноз невинной Л. можно поставить после тщательного исключения перечисленных заболеваний. Пациент должен находиться под наблюдением врача в течение 3—4 лет; кровь исследуется не реже 2 раз в год. Если через 3—4 года картина крови не меняется, диагноз невинной Л. следует считать достоверным.
Хронические иммунные нейтропении обусловлены появлением противолейкоцитарных антител. Нередко удается выявить сенсибилизирующие факторы (лекарственные препараты, вирусная инфекция), отметить связь нейтропении с гемотрансфузиями, беременностью. Частота инфекционных осложнений зависит от степени нейтропении. При хронической иммунной нейтропении увеличена селезенка. На гемограмме отмечается иногда сдвиг лейкоцитарной формулы влево. В костном мозге общее количество миелокариоцитов, как правило, существенно не изменено, однако часто наблюдается значительное уменьшение числа зрелых нейтрофилов при увеличении количества более молодых форм (про- и миелоцитов). К хроническим иммунным нейтропениям могут быть отнесены вторичные Л., наблюдаемые при циррозе печени, диффузных заболеваниях соединительной ткани, злокачественных новообразованиях и др. Хронические перераспределительные нейтропении (так называемые ложные нейтропении) отмечаются при хронических заболеваниях желудочно-кишечного тракта, неврозах, крупозной пневмонии, острых респираторных вирусных инфекциях и др. Перераспределительную нейтропению можно выявить случайно у практически здоровых людей, особенно спортсменов. Она имеет доброкачественное течение.
Наследственные и врожденные нейтропении встречаются очень редко. К ним относятся инфантильный генетический агранулоцитоз (болезнь Костманна), наследственная нейтропения аутосомно-доминантного типа, хроническая доброкачественная нейтропения и другие заболевания, патогенез и клиническая картина которых до конца не изучены.
АГРАНУЛОЦИТОЗ – синдром, характеризующийся глубокой гранулоцитопенией или полным исчезновением из крови гранулоцитов.
Как правило агранулоцитоз характеризуется падением количества гранулоцитов ниже отметки 750 в 1 мкл крови, или количества лейкоцитов ниже отметки 1000 в 1 мкл крови. Чаще всего агранулоцитоз являет собой синдром более обобщенного заболевания. В большинстве случаев имеют место быть:
имунный агранулоцитоз
миелотоксический агранулоцитоз
Миелотоксический агранулоцитоз может быть обьяснен появлением аутоантител. Характерные септические осложнения (например пневмонии, ангины и т.д.) обуславливают клиническую картину заболевания агранулоцитозом.
В случае гаптенового агранулоцитоза число ретикулоцитов, тромоцитов, лимфоцитов составляет норму для конкретного организма, однако ретикулоциты практически отсутствуют в составе крови.
Основные причины агранулоцитоза: Сокращение срока жизни и ускоренная утилизация нейтрофилов, их скопление у стенок сосудов, а так же различные нарушения образований нейтрофилов приводят к агранулоцитозу. Протекание агранулоцитоза может характеризоваться двумя устойчивыми состояниями:
острый агранулоцитоз (развивается в течении нескольких дней);
хронический агранулоцитоз (длится в течении нескольких месяцев или лет).
Чаще бывает, что агранулоцитоз является результатом той или иной гематологической болезни, иногда – изолированная аномалия.
Симптомы агранулоцита: Возбуждаемые грибковыми образованиями и бактериями инфекционные процессы:
неспецифичной симптоматики (неравномерное сердцебиение, общая слабость, увеличенное потоотделение, одышка)
специфичные проявления в зависимости от инфекционного возбудителя и локализации воспаления (поражения кожных покровов, различные виды пневмоний, некротическая ангина и т.п.).
107. Лейкоз: виды, классификация, картина крови при различных видах лейкозов. Лейкозы Все лейкозы (лейкемии) подразделяются на два вида - острые и хронические. Такое деление обуславливается различной способностью лейкозов к росту и развитию разрастающихся клеток.
При остром лейкозе развитие клеток практически отсутствует, в крови накапливается большое количество незрелых клеток на ранней стадии развития. Это приводит к угнетению нормального кроветворения всех ростков. Такие признаки выявляются в крови более чем в 80% случаев.
Хронический лейкоз дает популяцию равившихся гранулоцитарных клеток, которые постепенно замещают нормальные клетки периферической крови.
Следует отметить, что острый лейкоз никогда не перейдет в хронический и наоборот.
Острый лейкоз
Начальная стадия острого лейкоза. Обычно, оценить ее можно только ретроспективно, то есть уже тогда, когда она закончилась. Биохимические показатели крови могут быть как в норме, так и несколько повышены или понижены. Так же может отмечаться легкая слабость, обостряются имевшиеся ранее хронические заболевания, активизируется вирус герпеса, другие бактериальные и вирусные инфекции. Развернутый период острого лейкоза с ярко выраженными клиническими и гематологическими проявлениями, который состоит из обострений и ремиссий и заканчивается либо полной ремиссией (излечением), либо переходом в терминальную стадию. Основным критерием для установления ремиссии служит отсутствие бластных клеток в периферической крови. Излечением может считаться полная клинико-гематологическая ремиссия в течении 5 и более лет.
Терминальная стадия острого лейкоза. Характеризуется отсутствием действия используемых в лечении цитостатиков, полным угнетением системы кроветворения. Некоторые клиники даже на этом этапе берутся за операции по пересадке костного мозга, но все равно летальность в этой стадии крайне велика.
Хронический лейкоз
В отличие от острого, при хроническом лейкозе клетки крови успевают «дозреть», но подавляющее большинство получившихся клеток крови не способно выполнять свою прямую функцию. Поэтому в лабораторных анализах можно увидеть довольно высокое количество лейкоцитов, хотя защитить организм от инфекции они не способны. В случаях, когда количество гранулоцитарных клеток настолько велико, что мешает нормальному кровотоку, больным делают лейкофарез- удаление избытка лейкоцитов, включая опухолевые клетки. Эффект от такой процедуры довольно быстрый, хотя и временный.
Хронический лейкоз может вообще не иметь какой-либо начальной фазы, 50 % больных хроническим лейкозом не имели жалоб на собственное здоровье, лейкоз у них диагностировался по данным анализа крови, выполненного по другому поводу. Даже после постановки диагноза, хронический лейкоз может течь годами, относительно доброкачественно. Такая его фаза называется моноклоновой и характеризуется присутствием одного клона опухолевых клеток. Следующая стадия обусловлена появлением вторичных опухолевых клонов, характеризуется быстрым течением с появлением множества бластов и называется поликлоновой стадией, или стадией бластного криза. 80% больных хроническими лейкозами погибают в стадии бластного криза.
В результате поражения опухолевыми клетками, у больных хроническим лейкозом развиваются сплено- и гепатомегалия (увеличение в размерах селезенки и печени), общая хроническая анемия, генерализовано поражаются лимфатические узлы.
Картина крови
Морфологический субстрат острого лейкоза составляют молодые клетки (бластные формы 2—3-го класса предшественников или клетки 4-го класса), основная масса опухоли при хроническом лейкозе представлена зрелыми и созревающими клетками. Названия разным формам острого лейкоза даны соответственно нормальным гомологичным костно-мозговым предшественникам (лимфобластам, миелобластам и т.д.). Хронические лейкозы обозначают по названию тех зрелых и созревающих клеток, которые характеризуют опухолевую пролиферацию. Морфологические классификации внекостно-мозговых опухолей разделяют их на 2 группы: лимфоргранулематоз (болезнь Ходжкина) и неходжкинские лимфомы. Лейкозные клетки отличаются от нормальных гомологичных клеток рядом морфологических, химических, цитогенетических особенностей. Бластные клетки могут быть значительно увеличены в размере (в 2—3 раза) или уменьшены до размера лимфоцита; характерен анизоцитоз. Контуры ядра нередко деформированы, количество хроматина увеличено и распределено неравномерно. Отмечаются вакуолизация ядра, его сегментация, многоядерность. В костном мозге увеличено количество клеток в стадии митоза. Число нуклеол часто увеличено (до 8 и более), размер их может достигать 1/3—1/2 диаметра ядра. Отмечается повышенная базофилия цитоплазмы, ее вакуолизация. Нередко обнаруживаются выраженная азурофильная зернистость и тельца Ауэра.
108. Современное представление об этиологии, патогенезе лейкозов. Лейкозы (лейкемия) характеризуются системным прогрессирующим разрастанием кроветворных клеток опухолевой природы - лейкозных клеток. Сначала опухолевые клетки разрастаются в органах кроветворения (костный мозг, селезенка, лимфатические узлы), затем гематогенно выселяются в другие органы и ткани, образуя лейкозные (лейкемические) инфильтраты по ходу интерстиция вокруг сосудов, в их стенках; паренхиматозные элементы при этом подвергаются дистрофии, атрофии и погибают. Инфильтрация опухолевыми клетками может быть диффузной (например, лейкозная инфильтрация селезенки, печени, почек, брыжейки), что ведет к резкому увеличению органов и тканей, или очаговой - при образовании опухолевых узлов, прорастающих капсулу органа и окружающие ткани. Обычно опухолевые узлы появляются на фоне диффузной лейкозной инфильтрации, однако они могут возникать первично и быть источником развития диффузной лейкозной инфильтрации.
Для лейкозов весьма характерно появление лейкозных клеток в крови.
Безудержное разрастание лейкозных клеток в органах и тканях, «наводнение» ими крови приводят к анемии и геморрагическому синдрому, тяжелым дистрофическим изменениям паренхиматозных органов. В результате подавления иммунитета при лейкозе развиваются тяжелые язвенно-некротические изменения и осложнения инфекционной природы - сепсис.
Этиология и патогенез. Вопросы этиологии лейкоза и опухолей неразделимы, так как опухолевая природа лейкозов не вызывает сомнений. Лейкозы - полиэтиологические заболевания. В возникновении их могут быть повинны различные факторы, способные вызвать мутацию клеток кроветворной системы.
Среди мутагенов следует назвать вирусы, ионизирующее излучение, ряд химических веществ.
Роль вирусов в развитии лейкоза показана в экспериментах на животных. У человека она доказана для острого эндемического Т-лимфоцитарного лейкоза (ретровирус HTLV-I), волосато-клеточного лейкоза (ретровирус HTLV-II) и для лимфомы Беркитта (ДНК-вирус Эпстайна-Барра).
Известно, что ионизирующее излучение способно вызывать развитие лейкоза (радиационные, или лучевые, лейкозы), причем частота мутаций зависит непосредственно от дозы ионизирующей радиации. После атомного взрыва в Хиросиме и Нагасаки заболеваемость острым лейкозом и хроническим миелозом среди облученных возросла примерно в 7,5 раз. Среди химических веществ, с помощью которых может быть индуцирован лейкоз, большое значение имеют дибензантрацен, бензпирен, метилхолантрен, т. е. бластомогенные вещества.
Патогенез лейкозов связывают с активацией клеточных онкогенов (протоонкогенов) при воздействии различных этиологических факторов, что ведет к нарушению пролиферации и дифференцировки кроветворных клеток и их злокачественной трансформации. У человека зарегистрировано усиление экспрессии ряда протоонкогенов при лейкозах;
Значение наследственных факторов в развитии лейкозов подчеркивается нередко семейным характером заболевания. При изучении кариотипов лейкозных клеток обнаруживаются изменения в наборе их хромосом - хромосомные аберрации. При хроническом миелоидном лейкозе, например, постоянно обнаруживается уменьшение аутосомы 22-й пары хромосом лейкозных клеток. У детей при болезни Дауна, при которой также обнаруживается P- хромосома, лейкоз встречается в 10-15 раз чаще.
Таким образом, мутационная теория патогенеза лейкозов может считаться наиболее вероятной. При этом развитие лейкозов (правда, не всех) подчинено правилам опухолевой прогрессии. Смена моноклоновости лейкозных клеток поликлоновостью лежит в основе появления бластных клеток, выселения их из костного мозга и прогрессирования заболевания - бластного криза.
109. Острые и хронические лейкозы. Лейкемоидный провал. Сходство и отличие хронических лейкозов от лейкемоидных реакций. Острые и хронические лейкозы
Лейкоз (лейкемия, белокровие) — клональная экспансия злокачественных миелоидных или лимфоидных клеток, которую характеризует рост содержания лейкоцитов в циркулирующей крови. В данном контексте клон — это совокупность злокачественных клеток, являющихся потомками одной малигнизированной. Клональная экспансия — патологическое возрастание числа клеток из такой совокупности, которое угнетает образование других клеток крови и блокирует окончательное созревание (дифференциацию) клеток той линии, на одном из этапов которой произошел канцерогенез клеток-предшественниц, обусловивший лейкоз. Иными словами, лейкоз — это нарастающее размножение аномальных лейкоцитов с ростом их содержания в кроветворной ткани, других органах и в циркулирующей крови. Лейкоз — это всегда дедифференциация клеток крови, в результате которой на поверхности лейкоцитов определенного вида появляются антигены, которых нет на поверхности нормальных клеток. При этом антигены, характеризующие нормальную клетку, теряются. Это позволяет определить вид злокачественной клетки посредством исследования озлокачествленных клеток крови с использованием моноклональных антител. Острый лейкоз длится несколько месяцев и сопровождается симптомами, характерными для острого инфекционного заболевания. Кроме того, синдром острого лейкоза характеризуют выраженная анемия, сниженная свертываемость крови и кровотечения, незначительное увеличение лимфатических узлов и селезенки. Хронический лейкоз характеризует течение свыше одного года с постепенным нарастанием симптомов анемии, выраженным увеличением селезенки, печени, лимфатических узлов. В зависимости от того, на какой линии дифференциации клеток крови произошел канцерогенез, выделяют лимфоидный, миелоидный, моноцитарный или мегакариоцитарный виды лейкемии. Кроме того, лейкозы классифицируют в зависимости от степени зрелости злокачественных клеток, а также их размеров. При этом выделяют три вида острой лимфоцитарной лейкемии и семь видов острой миелоидной лейкемии. Этиология лейкозов идентична причинам канцерогенеза. Выделяют следующие маркеры и факторы риска лимфоидного лейкоза: 1. Болезни крови: идиопатическая тромбоцитопения, пароксизмальная ночная гемоглобинурия, устойчивая по отношению к терапии витамином B12, сидеробластная анемия. 2. Злокачественные опухоли: рак молочной железы, яичников, Ходжкинская лимфома, множественная миелома. 3. Наследственные болезни и наследственная предрасположенность: лейкоз у близнеца, атаксия-телеангиэктазия, синдромы Блума, Кляйнфельтера, болезнь фон Реклингхаузена, синдром Вискота-Олдрича, анемия Фанкони и др. 4. Воздействие ионизирующих излучений. 5. Побочный иммуносупрессивный эффект средств для хемотерапии злокачественных заболеваний (алкилирующие препараты и др.). 6. Хронические отравления бензолом, левомицетином. Основной фактор риска миелоидного лейкоза — воздействия ионизирующей радиации. Особенно велика предрасположенность к развитию острого миелоидного лейкоза после воздействия ионизирующей радиации и наличия в генотипе генов системы антигенов лейкоцитов человека Cw3 и Cw4. Врожденный миелоидный лейкоз встречается крайне редко. Диагноз лейкоза обычно представляет собой следствие случайной находки при исследовании мазка крови. Иногда до установления окончательного диагноза лейкоза у больных выявляют анемию, тромбоцитопению и нейтропению. Клональная экспансия малигнизированных клеток при лейкозах обуславливает подавление образования других нормальных клеток крови костным мозгом при невозможности задействовать функциональными системами для достижения конечного полезного приспособительного результата озлокачествленных клеток, заменивших в циркулирующей крови нормальные. Поэтому все виды лейкоза в той или иной степени характеризуют: 1. Расстройства свертывания крови, то есть гипокоагулемия, гиперкоагулемия, распространенный тромбоз микрососудов, 2. Иммунодефицит и низкая сопротивляемость к инфекциям.
«лейкемический провал» — исчезновение промежуточных форм клеток на фоне большого количества бластов;
Отличия: Лейкемоидные реакции моноцитарного типа отмечаются при туберкулезе, ревматизме, септическом эндокардите, ангине. Отличаются от хронического моноцитарного лейкоза тем, что проявляются на фоне какого-то заболевания, в то время как лейкоз долгое время бессимптомен. Сходства Лейкемоидные реакции, напоминающие хронический миелолейкоз, сопровождают тяжелые инфекции и интоксикации.
110. Общие (системные) нарушения в организме при лейкозах: механизм развития анемий, геморрагий, интоксикации, лихорадки, адинамии при лейкозах. Для острых лейкозов и конечной стадии хронических лейкозов характерно глубокое подавление нормального гемопоэза, следствием чего является прогрессирующая анемия. Падение продукции тромбо
цитов сопровождается кровоизлиянием в жизненноважные органы и кровотечениями из носа, десен, кишечника (геморрагический синдром), что усугубляет анемию. При лейкозах нарушаются функции различных органов и систем вследствие появления в них лейкемических инфильтратов приводящих к расстройствам гемодинамики, обменных процессов. В органах и тканях возникают глубокие дистрофические изменения. При прогрессировавши лейкоза нарушаются защитные функции лейкоцитов. Уменьшается содержание лизоцима и миелопероксидазы в гранулоцитах. Снижается их подвижность и фагоцитарная активность. Миелобласты и другие бластные формы вообще не способны к фагоцитозу. Угнетается синтез антител в лимфоцитах. Иммунологическая реактивность организма падает, что может привести к беспрепятственному проникновению инфекции и развитию сепсиса или других инфекционных осложнений. Ослабление защитных свойств лейкоцитов при лейкозе находится в тесной связи с нарушением обменных процессов в них. В лейкоцитах больных лейкозом заметно снижается активность гликогенобразующих ферментов, щелочной фосфатазы и других ферментов. Падает уровень аэробного и анаэробного гликолиза. Смерть при лейкозах может наступить на любой стадии болезни от инфекционных осложнений, в частности от сепсиса, от кровоизлияний в жизненно важные органы, чаще от кровоизлияния в мозг, от кровотечений или прогрессирующей анемии. Применение цитостатаческих препаратов и иных средств лечения продлевает жизнь больных на несколько лет. Терапия лейкозов может вызвать рад осложнений, среди которых отмечают цитостатяческий агранулоцитоз с тромбоцитопенией, поражения печени и почек.
Этиология лейкозов остается невыясненной. Полагают, что
разные виды лейкозов
возникают от различных причин. Существует несколько теорий происхождения лейкозов (генетическая, вирусная, радиационная, химического канцерогенеза и др.). Генетическая теория указывает на возможность наследственного предрасположения к лейкозам. В литературе описаны случаи семейных лейкозов, среди которых чаще выявлялись острые лейкозы и хронический лимфолейкоз. Отмечено также, что у лиц с врожденными хромосомными аномалиями (болезнь Дауна, синдромы Тернера, Клайнфельтера и др.) заболеваемость лейкозом более высокая, чем у здоровых. Очевидно существуют лейкозогенные факторы среды (вирусы, радиация и др.), взаимодействие которых с определенной генетической, конституцией способствует возникновению лейкозов. Вирусная теория основывается на фактах высокой контагиозное куриных лейкозов на птицефермах, очаговости лейкозов крупного рогатого скота (лейкозы домашних птиц и животных человеку не передаются). Лейкозы у кур и мышей можно получить путем перевивки бесклеточного фильтрата лейкозной ткани больного животного здоровому. К настоящему времени известно несколько типов вирусов, вызывающих различные виды лейкозов у животных (вирус Гросса, Раушера и др.). Однако нет достаточно убедительных данных о вирусной этиологии лейкозов человека. Лейкоз неразвивается у грудных детей, питающихся молоком больной лейкозом матери. Но не исключено, что некоторые виды лейкозов человека могут быть вирусного происхождения. Радиационная теория связывает возникновение лейкозов с воздействием ионизирующей радиации. Лейкоз развивался у лабораторных мышей и крыс после облучения их рентгеновскими лучами. Повышенная заболеваемость острым лейкозом и хроническим мелолейкозом отмечена среди населения Хиросимы и Нагасаки, пострадавшего от атомного взрыва. Полагают, что под влиянием ионизирующей радиации происходят хромосомные «поломки»в клетках-предшественницах кроветворения. Патогенез лейкоза. Согласно клоновой теории и патогенеза лейкозов различных раздражителей (вирусы, радиация, канцерогенные вещества н др.) способны вызвать мутацию недифференцированной кроветворной клетки (преимущественно на уровне 2-го и 3-го класса гемопоэза). Мутированная клетка .создает клон себе подобных потомков - .моноклоновое потомство. В частности, одним из диагностических признаков хронического миелолейкоза является наличие в лейкозных клетках мутированном 22-й хромосомы с укороченным длинным плечом, так называемой филадельфийской (Рh') хромосомы. Патологический мутантный клон имеет своей родоначальницей палипотентную клетку предшественницу миелопоэза, о чем свидетельствует присутствие Р-хромосомы во всех делящихся клетках костного мозга (грануловдпарного, эритроидного и мегакариоцитарногр рада). Но пролифератявную активность обнаруживает прежде всего непрофильный росток. Клетки патологического мутантного клона, интенсивно размножаясь, могут давать в потомстве повторные мутации. Это приводит к тому, что возникают разные клоны лейкозных клеток, обладающие разными свойствами, хотя все они изначально произошли из одной клетки. В результате опухоль приобретает поликлоновый злокачественный характер. Отдельные клоны лейкозных клеток уже не подчиняются регулирующим влияниям организма, становятся устойчивыми к средствам его имунной защиты и к цитостатическим лечебным препаратам.
111. Недостаточность кровообращения, определение понятия, этиология, формы недостаточности кровообращения. Основные гемодинамические показатели и проявления. Компенсаторно-приспособительные механизмы. Недостаточность кровообращения
- наличие дисбаланса (несоответствие) между потребностью органа в кислороде, питательных веществах и доставкой этих агентов с кровью. 1. Общая Регионарная 2. Острая хроническая 3. Сердечно-сосудистая смешанная. Сердечная недостаточность (СН) - конечная стадия всех болезней сердца. При: инфекционных заболеваниях, эмболии легочной артерии, кровоизлияниях в перикардиальную полость, может быть кардиогенный шок. Атеросклерозе пороках сердца, гипертонической болезни, коронарной недостаточности Нарушение обменных процессов. Снижение образования энергии. Снижение сократительной способности. Снижение работы сердца Сердечная недостаточность. Миокардиальная форма.
(СИ) - конечная стадия всех болезней сердца. СН - это патологическое состояние, обусловленное неспособностью сердца обеспечивать адекватное кровоснабжение органов и тканей. ОСИ может развиваться при: инфекционных заболеваниях, эмболии легочной артерии, кровоизлиянии в перикардиальную полость, может быть кардиогенный шок. ХСН развивается при: атеросклерозе, пороках сердцагипертонической болезникоронарной недостаточности. три основные формы сердечной недостаточности (патофизиологические варианты): 1. Миокардиальная (обменная, недостаточность от повреждения) - формы - развивается при повреждении миокарда (интоксикация, инфекция - дифтерийный миокардит, атеросклероз, авитаминоз, коронарная недостаточность). Нарушение обменных процессов. Снижение образования энергии. Снижение сократительной способности Снижение работы сердца. Развивается в условиях гипофункции сердца. Может развиться при нормальной или сниженной нагрузке на сердце.2. Недостаточность от перегрузки: а) давлением (при гипертонии большого круга кровообращения); б) Объемом крови (при пороках сердца. Развивается в условиях гиперфункции сердца, в) Смешанная форма - сочетание перегрузки и повреждения (ревматический паикардит, анемии, авитаминоз). Общие черты внутрисердечной гемодинамики при всех формах сердечной недостаточности: 1. Увеличение остаточного систолического объема крови (в результате неполной систолы из-за повреждения миокарда или из-за повышения сопротивления в аорте, чрезмерного притока крови при клапанной недостаточности). 2. Увеличивается диагностическое давление в желудочке, что увеличивает степень растяжения мышечного волокна в диастолу.3. Дилатация сердца - гомогенная дилатация - прирост последующего сокращения сердца в результате увеличения растяжения мышечных волокон (адаптация)- миогеиная фильтрация - снижение сократительной способности сердца, 4. Уменьшение минутного объема крови, увеличение артерно-венозной разницы по кислороду. При некоторых формах недостаточности (при застоной) минутный объем может быть даже увеличен.5. Повышается давление в тех отделах сердца из которых кровь поступает в первично- пораженный желудочек: при левожелудочковой недостаточности повышается давление в левом предсердии, в легочных венах: а) увеличение давления в желудочке в диастолу уменьшает отток из предсердия; б) растяжение атриовентрикулярного свертывания и относительная недостаточность клапана в результате дилатации желудочка, происходит регургитация крови в предсердии в систолу, что ведет к повышению давления в предсердиях. В организме осуществляются компенсаторными механизмами.
112. Сердечная недостаточность. Недостаточность сердца от перегрузки. Этиология, патогенез, проявления. Сердечная недостаточность
Сердечная недостаточность (СН) – это клинический синдром, возникающий по причине снижения сократительной функции сердца, и как следствие заболеваний, протекающих с перегрузкой отделов сердца или с нарушениями процессов метаболизма миокарда.
Это патологическое состояние характеризуется несоответствием сердечного выброса и потребностей организма, и возникает при таких заболеваниях, как инфаркт миокарда, миокардит, аневризма сердца, пороки сердца, гипертоническая болезнь и других.
Хроническая СН имеет три стадии клинических проявлений:
I стадия – начальная, симптомы недостаточности кровообращения (тахикардия, отдышка) возникают лишь при нагрузке.
II стадия – умеренная, при которой симптомы СН выявляются и в покое, но значительных нарушений в функционировании других органов еще не наблюдается.
III стадия – выраженная, СН приводит к поражению сердца (истощение сердечной мышцы, увеличение сердца) и к функциональным и морфологическим изменениям других органов, вследствие длительного кислородного голодания и нарушения питания тканей.
Причины сердечной недостаточности
Некоторые сердечные заболевания, в том числе и пороки сердца, могут долгие годы протекать бессимптомно, без каких либо клинических проявлений, снижающих качество жизни.
Основные причины заболевания:
стрессы различного характера, такие как: физическое перенапряжение, избыток поваренной соли в рационе, экстремальные факторы внешней среды, эмоциональные потрясения;
аритмия;
артериальная гипертензия;
гиперфункция щитовидной железы и беременность, инфекции.
К частым причинам развития сердечной недостаточности относят также инфаркт миокарда, легочную эмболию, различные формы миокардитов, анемию.
Симптомы сердечной недостаточности
При различных формах сердечной недостаточности симптоматика может значительно расходиться по своим характеристикам и степени интенсивности.
- острая левожелудочковая недостаточностьхарактеризуется мучительным чувством внезапной нехватки воздуха, дыхание затруднено, в нижних отделах легких прослушиваются хрипы, как следствие нехватки воздуха – тревожность, холодный пот, кожные покровы бледные с цианозом. Пульс может приобретать характерный «ритм галопа», выявляются тахикардия и повышение АД;
- при острой правожелудочковой недостаточности печень резко и болезненно увеличивается в размерах, выявляется тахикардия. Кожные покровы бледные с синюшностью по периферии, шейные вены видимым образом набухают;
- хроническая недостаточность левого желудочка развивается постепенно с усилением симптоматики. На ранних этапах характеризуется постепенно нарастающей одышкой при обычных нагрузках и склонностью к тахикардии. При прослушивании легких могут быть слышны сухие хрипы, чаще – влажные хрипы в нижних сегментах. При нарастании недостаточности тахикардия приобретает стойкий характер или же легко возникает при нагрузке. Отдышка обычно усиливается в горизонтальном положении, поэтому больные предпочитают спать полусидя;
- хроническая недостаточность правого желудочка чаще всего присоединяется к уже существующей недостаточности левого желудочка. К вышеназванным симптомам добавляются следующие: общая слабость и тяжесть в области печени, отеки голеней в конце дня, которые с развитием заболевания распространяются все выше. Характерные признаки этого типа СН – болезненная увеличенная печень, холодные конечности с цианозом, набухшие шейные вены.
113. Миокардиально-обменная форма сердечной недостаточности (повреждение миокарда). Причины, патогенез. Ишемическая болезнь сердца. Коронарная недостаточность. МИОКАРДИАЛЬНАЯ ФОРМА СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Причины: 1. Коронарная недостаточность 2 Действие токсических факторов на миокард. 3. Действие инфекционных факторов .4. Нарушение эндокринной системы (нарушение минерального, белкового, витаминного обмена). 5. Гипоксические состояния. 6. Аутоиммунные процессы.
ИБС (коронарная недостаточность), дегенеративная болезнь сердца) - состояние, при котором имеется несоответствие между потребностью миокарда и его обеспечением энергетическими и пластическими субстратами (в первую очередь кислорода). Причины гипоксии миокарда: 1. Коронарная недостаточность 2. Метаболические нарушения - некоронарогенные некрозы: нарушения обмена: электролитов, гормонов, иммунные повреждения, инфекции. Классификация ИБС: 1. Стенокардия: стабильная (покоя) нестабильная: впервые возникшая, прогрессирующая (напряженная) 2. Инфаркт миокарда. Клиническая классификация ИБС: 1. Внезапная коронарная смерть (первичная остановка сердца). 2. Стенокардия: а) напряжения:- впервые возникшая стабильная, прогрессирующая; б) спонтанная стенокардия (особая). 3. Инфаркт миокарда: крупноочаговый, мелкоочаговый 4. Постинфарктный кардиосклероз. 5. Нарушения сердечного ритма.6. Сердечная недостаточноть. По течению: с острым течением, с хроническим, скрытой формы (бессимптомные). Этиология: 1. Причины ИБС: 1. Коронарогенные: атеросклероз коронарных сосудов, гипертоническая болезнь, узелковый периартериит, воспалительные и аллергические вакулнты, ревматизм, облитерирующий эндартерноз. 2. Некоронарогенные: спазм в результате действия алкоголя, никотина, психоэмоционального напряжения, физической нагрузки. Коронарная недостаточность и ИБС по механизму развития: 1. Абсолютная - уменьшение поступления к сердцу по коронарным сосудам. 2. Относительная - когда по сосудам доставляется нормальное шш даже увеличенное количество крови, но это не обеспечивает потребности миокарда в условиях его повышенной нагрузки. Патогенез ИБС:1. Коронарный (сосудистый) механизм - органические изменения коронарных сосудов.2. Миокардиогенный механизм - нейроэндокринные расстройства, регуляции и метаболизма в сердце.нервично нарушение на уровне МЦР.З. Смешанный механизм. Прекращение кровотока. Уменьшение на 75% и более Ишемический синдром
Понятие об ядерном сдвиге нейтрофилов
При характеристике нейтрофильного лейкоцитоза необхо- димо учитывать вид ядерного сдвига нейтрофилов.
| |
Нейтрофилия со сдвигом влево характерна для острых гнойных воспалительных процессов, например, гнойного аппен- дицита, гнойного холецистита, перитонита и др. При этом в кровь поступают незрелые лейкоциты: палочкоядерные и юные формы нейтрофилов (метамиелоциты), миелоциты, промиелоциты и да- же бласты (при лейкемических реакциях).
Молодые формы лейкоцитов в крови нейтрофилов не появ-
ляются при физиологических нейтрофилиях (умеренные физио-
логические нагрузки – физические, психоэмоциональные, связан-
ные с приемом пищи, переменой положения тела, нормально
протекающая беременность с 4-5 мес., лактация); а также при су-
дорогах, эпилепсии, слабой воспалительной реакции (поверхно-
стных инфекционных воспалительных процессах, катарах ки-
шечника, абортивных инфекциях, полиартритах, ранних стадиях
неосложненных опухолей, введении лекарств и растворов, внут-
ренних и наружных кровотечениях).
Выделяют следующие виды ядерного сдвига влево: гипо-регенеративный(увеличение процентного содержания палоч- коядерных нейтрофилов); регенеративный(появление метамие- лоцитов и увеличение палочкоядерных); гиперрегенеративный(появление в крови миелоцитов, метамиелоцитов и увеличение палочкоядерных нейтрофилов); лейкемоидный(в мазке обнару- живаются промиелоциты, миелоциты и метамиелоциты).
Небольшой нейтрофильный лейкоцитоз бывает в случаях легкого и умеренного течения острых инфекционных заболева- ний, при некоторых злокачественных опухолях без язвенного распада, иногда после внутривенных вливаний.
Нейтрофильный лейкоцитоз с выраженным сдвигом лейко-
цитарной формулы влево наблюдается при многих тяжело проте-
кающих острых инфекционных заболеваниях (сыпном тифе, диф-
терии, дизентерии, цереброспинальном менингите, роже, сепсисе
и др.), при обострении хронических инфекций (например, тубер-
кулеза легких), в случаях крупозной пневмонии, а также при
гриппозной бронхопневмонии.
При нейтрофильных лейкоцитозах, наблюдающихся при тяжелых инфекционных заболеваниях, интоксикациях, а также лейкопениях может наблюдаться дегенеративныйядерный
сдвиг влево (увеличение процентного содержания палочкоядер- ных нейтрофилов и сегментоядерных нейтрофилов с наличием дегенеративных изменений в их цитоплазме и ядрах). Данный сдвиг отражает терминальную стадию угнетения гранулоцитопо- эза после его предшествующей запредельной стимуляции.
Числовым выражением ядерного сдвига является индекс ядерного сдвига (ИЯС, или индекс Н.Н. Боброва).
И.Я.С.
палочкоядерные
етамиелоциты
иелоциты
K(%)
сегментоядерные(%)
(в норме этот индекс равен 0,05-0,10).
На основании И.Я.С. можно оценивать степень тяжести воспалительного процесса. Увеличение ИЯС до 0,2-0,4 указывает на легкую степень, до 0,6-0,8 – на среднюю степень, более 0,8 – на тяжелую степень воспалительного процесса.
Легкая и средняя степень индекса ядерного сдвига отмеча-
ется в случае недостаточности вирулентности возбудителя или
поверхностно локализующегося очага воспаления и свободного
выхода гноя наружу, легких случаях острых инфекций и прото-
зойных заболеваний – ангины, малярии во время приступа, на-
гноительных заболеваниях глаз, ушей, зева, вскрытия абсцесса,
местном нагноении раны, затяжном сепсисе, эндокардите, распа-
де опухоли.
Тяжелая степень индекса ядерного сдвига отмечается при
обширных воспалительных процессах, вызванных высокопато-
генными микроорганизмами.
Ядерный нейтрофильный сдвиг вправовозникает при первичном угнетении миелопоэза – апластических состояниях, мегалобластическом кроветворении. Сопровождается гиперсег- ментацией ядер нейтрофилов и дегенеративными изменениями их цитоплазмы. Могут наблюдаться при мегалобластических со- стояниях, апластических анемиях.
| |
болеваниях. При этом, кроме зрелых базофилов, в крови обнару- живается значительное количество базофильных миелоцитов.
Базофилия может развиваться при аллергических заболева- ниях, аутоиммунных заболеваниях (неспецифический язвенный колит), гипофункции щитовидной железы.
| |
Особенно высокая эозинофилия характерна для поражения эхинококком и трихинеллами. При трихинеллезе содержание эо-
зинофилов в крови может достигать 30-50% и более. При кишеч- ных глистах эозинофилия редко превышает 8-12%. Эозинофилия с одновременной анемией наблюдается при наличии кровососу- щих паразитов.
Эозинофилия отмечается при бронхиальной астме (особенно в промежутках между приступами и в начале их), сенной лихо-
радке, крапивнице, сывороточной болезни. Поэтому наличие большого количества эозинофилов может быть использовано для дифференцирования бронхиальной астмы от сердечной астмы, а также от бронхитов с приступами удушья, напоминающих брон- хиальную астму.
При аллергических заболеваниях и реакциях эозинофилы выполняют транспортную и антитоксическую функции. Они пе-
реносят продукты распада белка, обладающие антигенными свойствами, предотвращая местное скопление антигенов, а также обладают способностью к активному фагоцитозу.
Эозинофилия встречается нередко у лиц с повышенной воз- будимостью парасимпатического отдела вегетативной нервной системы, при ряде кожных заболеваний, по-видимому, аллерги- ческого характера (псориаз, хроническая экзема и др.).
При острых инфекционных заболеваниях начинающееся по- вышение количества лимфоцитов наряду с появлением эозино-
филов является благоприятным признаком, предвещающим вы-
здоровление. В первые дни после выздоровления процент эози- нофилов продолжает нарастать и может на короткое время пре- высить нормальный уровень (постинфекционная эозинофилия).
При скарлатине, остром ревматическом полиартрите, ост-
ром гломерулонефрите также наблюдается незначительная (6-
8%) эозинофилия. Эозинофилию отмечают при злокачественных
опухолях, в некоторых случаях висцерального сифилиса.
Эозинофилия как постоянный признак сопутствует хрони-
ческому миелоидному лейкозу. При этом значительно увеличива-
ется абсолютное количество эозинофилов в крови, процент же их,
ввиду резкого увеличения общего количества лейкоцитов, оста-
ется нормальным или даже понижается.
Лимфоцитоз.Увеличение числа лимфоцитов в крови (3
109/л) называется лимфоцитозом.
Различают абсолютное и относительное увеличение числа
лимфоцитов в крови (лимфоцитоз). В последнем случае имеется
лишь увеличение процента лимфоцитов в лейкоцитарной форму-
ле без повышения их общего количества. Чаще встречается отно-
сительный лимфоцитоз, который наблюдается при всех нейтро-
пениях: при брюшном тифе, при анемии Бирмера, гриппе, неко-
торых хронических спленомегалиях, Базедовой болезни, Аддисо-
новой болезни, алейкии, некоторых авитаминозах, голодании,
алиментарной дистрофии, в период выздоровления после перене-
сенных острых инфекционных заболеваний, после различных
профилактических прививок.
Абсолютный лимфоцитоз чаще обусловлен иммунными от-
ветами на инфекционные и неинфекционные антигены и супер-
антигены, поликлональные иммуностимуляторы. Выраженный
лимфоцитоз возникает при всех инфекциях, характеризующихся
внутриклеточным персистированием возбудителей, а также ауто-
иммунных процессах.
Увеличение лимфоцитов в крови наблюдается при доброка-
чественном течении туберкулеза, при хроническом и доброкаче-
ственном течении сифилиса, после подкожного впрыскивания
адреналина, при коклюше (одновременно с выраженным лейко-
цитозом).
Лимфоцитоз отмечают при некоторых редких формах яз-
венной некротической ангины, так называемой лимфоцитарной
ангины, при которой помимо высокого процента лимфоцитов в крови могут встречаться и юные формы их вплоть до лимфобла- стов.
| |
Моноцитоз.Увеличение числа моноцитов в крови (>0,7
109/л) называется моноцитозом. Моноциты обладают способно- стью к движению и фагоцитозу, однако эти свойства у моноцитов
выражены в меньшей степени, чем у нейтрофилов.
Увеличение количества моноцитов в крови является показа-
телем защитной реакции системы мононуклеарных фагоцитов.
Увеличение процента моноцитов в лейкоцитарной формуле
при нормальном или слегка повышенном общем количестве лей-
коцитов наблюдается в периоде выздоровления после перенесен-
ных острых инфекционных болезней, после приступа возвратно-
го тифа, во время приступа малярии, часто при хронической или
скрытой малярии, иногда при злокачественных опухолях.
Моноцитоз часто сопровождает глистные инвазии, хрониче-
ски протекающие инфекции с наличием гранулематозного воспа-
ления (сифилис, туберкулез, сепсис), брюшной тиф и другие
сальмонеллезы, хронически протекающий септический эндокар-
дит. Моноцитоз наблюдается, как правило, при синдроме Банти,
при моноцитарной ангине, наблюдающейся у молодых людей и
характеризующейся длительным повышением температуры, уве-
личением печени и селезенки, ангиной и резким моноцитозом (до
20-40 % и выше).
ЛЕЙКОПЕНИИ
| |
Лейкопения может быть физиологической (leucopenia
innocens – конституциональная лейкопения), встречающаяся у 2-
12% здоровых индивидуумов европеоидной расы и патологиче-
ской.
В основе развития лейкопений лежат следующие механиз-
мы:
- снижение продукции лейкоцитов и выхода их из кост-
ного мозга в кровь (угнетение лейкопоэза вследствие токсическо- го воздействия на лейкопоэтическую ткань или поражение ее, на- пример, опухолевыми метастазами);
- усиленное разрушение лейкоцитов в периферической крови, костном мозге химическими, лекарственными вещества- ми, иммунными факторами;
- активация апоптоза;
- увеличение выхода лейкоцитов (хоуминг) в ткани для
выполнения функций;
- перераспределение пулов лейкоцитов в сосудах.
Лейкопению наблюдают при так называемой алейкии (при панмиелофтизе), которая развивается в результате поражения ко- стного мозга при сепсисе, под влиянием химических ядов (бен- зол), при лучевой болезни, при употреблении в пищу перезимо- вавших в поле злаков, при некоторых авитаминозах, алиментар- ной дистрофии.
Угнетение лейкопоэтической функции костного мозга явля-
ется преобладающим в патогенезе лейкопении. При этом наряду
с тяжелой анемией и сильным понижением числа тромбоцитов в
крови наблюдается резкое понижение числа лейкоцитов, иногда
до нескольких сотен клеточных элементов в 1 мл крови.
Небольшая лейкопения наблюдается иногда и после профи- лактического введения противотифозной вакцины.
Лейкопения за счет уменьшения количества нейтрофилов (нейтропения) отмечается при брюшном тифе гриппе, оспе, кори на высоте лихорадки, краснухе, иногда – при милиарном тубер- кулезе.
Появление значительного лейкоцитоза при гриппе должно
вызвать подозрение на осложнение пневмонией.
При аутоиммунных лейкопениях сочетаются ускоренная ги-
бель клеток-предшественников, а также аутоиммунный цитолиз
зрелых лейкоцитов в крови и тканях.
Лимфопения при стрессе связана с ускоренным хоумингом
и с активацией апоптотической гибели лимфоцитов в органах
лимфопоэза. Ускорение апоптотичсекой гибели лимфоцитов от-
мечается при ВИЧ-инфекции.
Развитие лейкопении возможно после первичного лейкоци-
тоза в результате активной гибели лейкоцитов в гнойных очагах
и исчерпания ресурсов гранулопоэза. Так, при остром приступе
малярии вначале отмечается небольшой нейтрофильный лейко-
цитоз, быстро переходящий в лейкопению.
Наибольшее практическое значение среди лейкопений име- ет нейтропения(количество нейтрофилов ниже 2 х 109/л). Уменьшение процента нейтрофилов в лейкоцитарной формуле указывает на абсолютную нейтропению в том случае, если общее число лейкоцитов не увеличено.
При лейкоцитозе уменьшение процента нейтрофилов может говорить лишь об относительной нейтропении. Как правило, нейтропения наблюдается наряду с лейкопенией.
За редкими исключениями истинная лейкопения возникает за счет абсолютного уменьшения числа нейтрофилов крови. Уменьшение количества нейтрофилов в крови является последст- вием тяжелого повреждения костного мозга.
Уменьшение продукции нейтрофилов может быть вызвано инфекционными заболеваниями. Очень часто нейтропения отме-
чается при брюшном тифе. В первые несколько дней от начала болезни наблюдается небольшой нейтрофильный лейкоцитоз, ко- торый, быстро сменяется лейкопенией.
Также нейтропения характерна для вирусных заболеваний: гриппа, вирусного гепатита, краснухи, ветряной оспы и др. При малярии нейтропения обнаруживается лежду периодами лиха- радки. Нейтропения с лимфопенией характерна для ВИЧ- инфекции.
Гранулоцитопоэз угнетает ионизирующее излучение, при
этом в крови надлюдается панцитопения. Миелотоксическим
действием на костный мозг обладают химические вещества: про-
изводные бензола, нитрозосоединения, пестициды, продукты пе-
регонки нефти и др. Нейтропения развивается при употреблении
в пищу перезимовавших в поле злаков. Цитостатические препа-
раты могут вызывать нейтропению путем повреждения ДНК или
нарушения ее синтеза. Подобным образом действуют некоторые
лекарственные препараты: антигистаминные, левомицетин и др.
В основе нейтропений могут лежать аллергические реакции
II типа по классификации Джелла и Кумбса.
При дефиците витамина В12 и фолиевой кислоты в результа- те нарушения синтеза ДНК продуцируются ненормальные пред- шественники гранулоцитов, которые гибнут в костном мозге –
неэфективный гранулоцитопоэз. При этом число лейкоцитов дос- тигает (2-4) 109/л крови. Нейтропения является постоянным симптомом наряду с уменьшением числа эритроцитов и тромбо- цитов.
Нейтропения часто развивается в финале сепсиса и свиде- тельствует об истощении костномозговой функции, являясь не- благоприятным прогностическим признаком.
Белковое голодание, дефицит витаминов, микроэлементов
также вызывает уменьшение образования гранулоцитов в кост-
ном мозге. Вытеснение нормального ростка кроветворения про-
исходит при метастазах рака в костный мозг, острых лейкозах.
Резкое снижение нейтрофилов в крови наблюдается при синдро-
ме «ленивых лейкоцитов». При этом нарушена подвижность лей-
коцитов и снижен их выход из костного мозга.
Лейкопения иногда встречается при приеме лекарственных
препаратов (больших доз бутадиона, сульфаниламидов, барбиту-
ратов, новарсенола). Во многих случаях причиной этой медика-
ментозной лейкопении является выработка в организме аутоанти-
тел против собственных гранулоцитов, что может привести к
почти полному исчезновению зернистых лейкоцитов в крови (аг- ранулоцитоз).
Повышенное разрушение нейтрофилов может быть связано с гаптеновым или аутоиммунным мезанизмами (см. далее им- мунный агранулоцитоз), реже вследствие идиосинкразии – гене- тически обусловленной гиперчувствительности к лекарственному препарату, в основе которой лежат дефекты ферментных систем метаболизма лекарств.
Часто при ряде заболеваний, сопровождающихся спленоме- галией, нейтропения обусловлена секвестрацией и повышенным
| |
Перераспределительная нейтропения наблюдается при ана- филактическом шоке, инфекциях с выраженной эндотоксемией, при гемодиализе. Во время сеансов гемодиализа при контакте крови с диализной мембраной активируется комплемент (С3), вследствие чего происходит скопление их в сосудах легких.
Перераспределительная лейкопения развивается при так на- зываемом гемоклазическом кризе при введении в кровь чужерод- ного белка. Таков же механизм лейкопении при анафилактиче- ском шоке. Причиной перераспределительной лейкопении в этих случаях следует считать расширение сосудов брюшной полости, замедление тока крови и накопление в этих сосудах огромного числа лейкоцитов.
Иногда нейтропения бывает наследственного характера вследствие генетического дефекта образования нейтрофилов.
Опасным видом лейкопении является агранулоцитоз– крайняя степень нейтропении – клинико-гематологический син- дром, характеризующийся резким снижением в периферической крови количества лейкоцитов менее 1,0 × 109/л или гранулоцитов менее 0,75 × 109/л вплоть до полного их исчезновения. Различают три формы агранулоцитоза: миелотоксический, иммунный и идиопатический (когда причина развития болезни не установле- на).
Миелотоксический агранулоцитоз развивается при воздей- ствии на костный мозг некоторых факторов, угнетающих грану-
лоцитопоэз. Подавляются клетки-предшественницы миелопоэза, снижается их пролиферативная активность, нарушается диффе- ренциация клеток гранулоцитарного ряда. Причинами развития миелотоксического агранулоцитоза может быть прием некоторых лекарств: цитостатиков, аминазина, бутадиона, сульфаниламидов, левомицетина, действие бензола и его производных, воздействие ионизирующей радиации, вирусные инфекции (инфекционный мононуклеоз, грипп).
В периферической крови уменьшается количество лейкоци-
тов. Значительно уменьшается число нейтрофилов, отсутствуют
эозинофилы, базофилы, уменьшается количество моноцитов,
тромбоцитопения. Ретикулоциты отсутствуют, количество эрит-
роцитов снижено. В костном мозге снижается общее количество
клеток. При миелотоксическом агранулоцитозе, в отличие от им-
мунного агранулоцитоза, чаще поражаются все три ростка кост-
ного мозга (белый, красный, тромбоцитарный). При тяжелой
форме миелотоксического агранулоцитоза может наступить пол-
ное опустошение костного мозга (аплазия, или панмиелофтиз).
Иммунный агранулоцитоз обусловлен появлением образо-
вания антител. Он может быть гаптеновым и аутоиммунным (Но-
вицкий В.В., Гольдберг Е.Д., Уразова О.И., 2009).
Гаптеновый агранулоциоз развивается при приеме лекарств,
являющихся гаптенами: анальгина, бутадиона, барбитуратов,
противотуберкулезных средств и др. Лекарственные препараты,
являющиеся гаптенами, соединяются на поверхности нейтрофила
с белком и превращаются в полноценный антиген. Модифициро-
ванные белки распознаются лимфоцитами, развиваются реакции
антителозависимой клеточной цитотоксичности, комплемент-
опосредованный лизис (аллергические реакции II типа по Джеллу
и кумбсу).
Гаптеновые агранулоцитозы протекают с тяжелой клиниче-
ской картиной (язвенно-некротические поражения слизистых по-
лости рта, некротические ангины, энтеропатии, высокая темпера-
тура, резкая слабость), в 10% случаях бывают летальными. При
гаптеновых агранулоцитозах из периферической крови полно-
стью исчезают гранулоциты, моноциты. Поэтому уже в первые
дни болезни присоединяются тяжелые инфекционные осложне-
ния.
При аутоиммунных агранулоцитозах появляются антитела к специфическим антигенам нейтрофилов. Аутоиммунный аграну- лоцитоз не связан с действием лекарственных препаратов и раз- вивается при различных аутоиммунных процессах, системной красной волчанке, ревматоидном артрите, гломерулонефрите, а также хроническом лимфолейкозе и др. При аутоиммунном агра- нулоцитозе образуются аутоантитела к лейкоцитам. В перифери- ческой крови уменьшается количество гранулоцитов и моноци- тов, в костном мозге снижается общее количество клеток. Часто аутоиммунный агранулоцитоз сочетается с аутоиммунными ане- мией и тромбоцитопенией. Однако возможно развитие изолиро- ванной формы, при которой эритроцитарный и тромбоцитарный ростки сохранены. При выходе из иммунного агранулоцитоза в периферической крови сначала появляются плазматические клет- ки, единичные миелоциты, одновременно или на день раньше – моноцитоз, а затем – зрелые гранулоциты. Количество их быстро увеличивается, в течение недели состав крови нормализуется.
Независимо от происхождения, при агранулоцитозе отмеча- ется симптомокомплекс, связанный со снижением резистентно-
сти к бактериальной и грибковой инфекции: боль в горле, вплоть доя тяжелой ангины, лихорадка, воспаление слизистых оболочек рта, носа, ротоглотки, носоглотки, иногда – глаз, половых орга- нов. Возможно появление пиодермии и поверхностных микозов.
Эозинопения(снижение относительного уровня эозинофи- лов менее 1 % или абсолютного количества менее 0,09 х109/л)на- блюдается при введении стероидных гормонов, стрессе, гипер- кортицизме, в послеприступном периоде анафилактических забо- леваний, в первые дни инфаркта миокарда, в период разгара мно- гих инфекционных заболеваний и т.д.
Уменьшение процента эозинофилов в крови или полное ис- чезновение их из крови наблюдается, как правило, почти при всех острых инфекционных заболеваниях в разгаре болезни.
Эозинопения при многих хронических инфекционных забо- леваниях и интоксикациях считается неблагоприятным призна- ком, указывающим на тяжесть интоксикации.
Эозинопения может наблюдаться при тяжелом течении тех заболеваний, которые при более легком течении сопровождаются эозинофилией (например, при глистных инвазиях, вызывающих
тяжелую анемию и истощение организма). То же самое имеет ме- сто, если эти заболевания осложняются каким-либо нагноитель- ным процессом. В период разгара аллергической реакции количе- ство эозинофилов и базофилов крови может снижаться, так как эти клетки скапливаются в зоне аллергических реакций.
Эозинопения отмечается при анемии Бирмера в периоде
обострения болезни до начала лечения, а также при острой форме
лейкоза.
| |
В основе развития лимфопении может быть хоуминг лим-
фоцитов в ткани, их апоптоз при стрессе, гиперкортицизме под
влиянием высоких доз глюкокортикоидов.
Относительная лимфопения наблюдается при лейкемиче- ском миелолейкозе, при котором процент лимфоцитов может равняться 1-2 и даже меньше, но абсолютное количество их не- редко значительно увеличено; при значительных нейтрофильных лейкоцитозах, например, при крупозной пневмонии, сепсисе и т. д.
Моноцитопения(уменьшение количества моноцитов в кро- ви менее 0,15х109/л) отмечается при тяжелых септических забо- леваниях, при миелоидных и лимфатических лейкозах она явля- ется относительной.
Классически абсолютное количество лейкоцитов определя- ют путем подсчета в камере Горяева. Имеющиеся автоматические счетчики работают на принципе скачка импеданса при просасы- вании клетки через отверстие в кристалле, внутри которого соз- дано электромагнитное поле, или по принципу темнопольного эффекта.
Изменение количества нейтрофилов в лейкоцитарной формуле
Нейтрофилы имеют несколько подвидов, в зависимости от степени зрелости. Различают их при микроскопии и подсчете лейкоцитарной формулы.
Виды нейтрофилов:
— юные нейтрофилы — самая молодая форма, в крови появляются редко, только при наличии воспаления;
— палочкоядерные нейтрофилы — имеют большое ядро в виде буквы С, S или Z;
— сегментноядерные нейтрофилы — ядро имеет от 3 до 7 сегментов, разделенных тонкими перетяжками.
Нарушения нормального соотношения нейтрофилов бывают нескольких видов.
Ядерный сдвиг нейтрофилов влево — состояние, когда в крови появляется много молодых, а именно юных и палочкоядерных нейтрофилов, а также появляются дегенеративные формы нейтрофилов. Такое состояние обычно характерно для:
— интоксикаций;
— инфекционных заболеваний;
— воспалительных процессов;
— злокачественных опухолей.
При этом различают два вида сдвига нейтрофилов влево — регенеративный и дегенеративный.
Регенеративный сдвиг нейтрофилов — это значит, что увеличивается количество палочкоядерных и юных нейтрофилов на фоне лейкоцитоза. Это говорит о повышенной деятельности костного мозга, который, как известно, является органом кроветворения. Такое состояние организма характерно для гнойно-септических и воспалительных процессов (пневмония, аппендицит).
При дегенеративном сдвиге увеличивается количество только палочкоядерных нейтрофилов; при этом появляются дегенеративные изменения в клетках. Это говорит о том, что функция кроветворения (костного мозга) угнетена.
Если одновременно у больного наблюдается лейкоцитоз — повышение количества лейкоцитов, то у него может быть:
— токсическая дизентерия;
— острый перитонит;
— сальмонеллез;
— уремическая или диабетическая кома.
Дегенеративный сдвиг нейтрофилов на фоне лейкопении говорит о развитии:
— лимфопаратифозных заболеваний;
— вирусных инфекций.
Существует еще одна форма ядерного сдвига нейтрофилов влево, при которой в крови появляются незрелые формы лейкоцитов (миелоцитов, промиелоцитов или даже их предшественников — миелобластов). Все это происходит на фоне резкого лейкоцитоза. Такой сдвиг формулы крови говорит о вероятном наличии:
— туберкулеза;
— злокачественных опухолей (рак желудка, толстой кишки, молочной железы);
— инфекционного заболевания.
Специалистам известна формула вычисления тяжести заболевания по соотношению лейкоцитов (нейтрофилов) в организме, поскольку каждый вид выполняет свои функции. Отношение молодых форм нейтрофилов к зрелым составляет величину, называемую «индексом сдвига».
Этот индекс рассчитывается по формуле:
индекс сдвига нейтрофилов = (М + Ю + П) / С,
в которой М — количество миелоцитов, Ю — количество юных нейтрофилов, П — количество палочкоядерных нейтрофилов, С — количество сегментированных нейтрофилов.
Нормальный индекс сдвига нейтрофилов выражается в величинах 0,05—0,08. Его изменение в ту или иную сторону указывает на степень тяжести болезни:
• при индексе 1,0 и более — тяжелая степень;
• в пределах 0,3— 1,0 — болезнь средней степени тяжести;
• при индексе 0,3 и меньше — степень заболевания легкая.
Ядерный сдвиг нейтрофилов вправо — состояние крови, когда в ней преобладают нейтрофилы зрелых форм, содержащие вместо трех сегментов пять или шесть. В таких случаях индекс сдвига становится меньше нижней границы нормы — менее 0,04.
Ради справедливости следует сразу сказать, что ядерный сдвиг нейтрофилов вправо встречается у пятой части практически здорового населения. Однако в ряде случаев он может быть признаком аномалий, в частности ситуация требует дальнейшей проверки из-за подозрения на наличие:
— лучевой болезни;
— полицетемии и эритремии;
— В12-дефицитной анемии (аддисонобирмеровской анемии).
Читайте о диагностике анемии в статье «Диагностика анемии. Какие анализы стоит сдавать?».
Если ядерный сдвиг нейтрофилов вправо обнаруживается в период инфекционного или воспалительного заболевания, это является хорошим признаком: организм человека активно борется и велика вероятность скорого и благополучного выздоровления.
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе