Укажите количество субъединиц в молекуле лактатдегидрогеназы
Лактатдегидрогеназа: структура. НАГЛЯДНАЯ БИОХИМИЯ. Ян Кольман, Клаус-Генрих Рем, Юрген Вирт
Лактатдегидрогеназа: структура
В этом разделе в качестве примера взаимосвязи структуры и функции фермента более подробно рассмотрена лактатдегидрогеназа [ЛДГ (LDH), КФ 1.1.1.27].
А. Лактатдегидрогеназа: структура
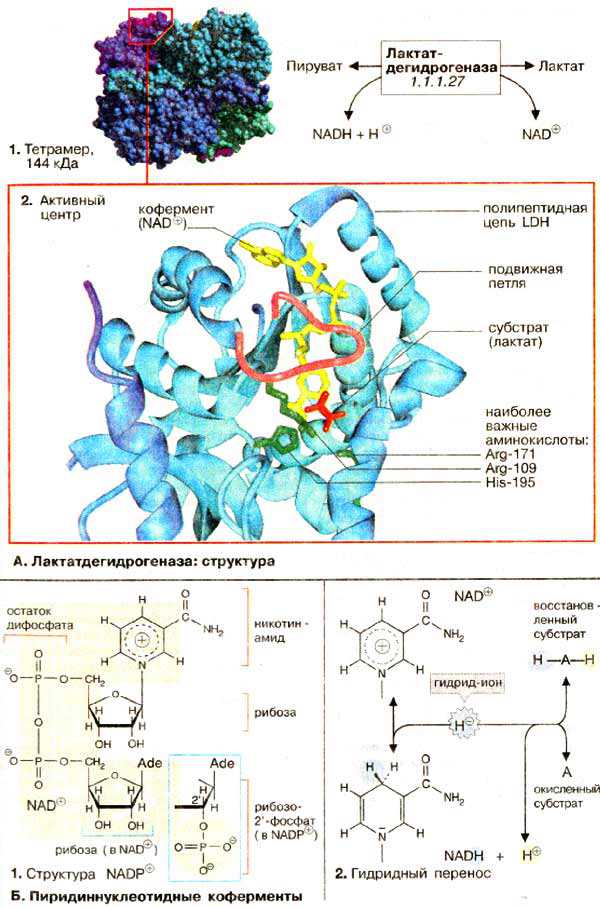
Активной формой лактатдегидрогеназы (молекулярная масса 144 кДа) является тетрамер из 4 субъединиц (1) Каждая субъединица образована пептидной цепью из 334 аминокислот (36 кДа). В тетрамере субъединицы занимают эквивалентные положения (1); каждый мономер содержит активный центр.
В организме млекопитающих имеются два различных типа субъединиц ЛДГ (H и M), незначительно различающиеся по аминокислотной последовательности; они могут ассоциировать в тетрамер случайным образом. Поэтому известно 5 различных изоферментов ЛДГ. В мышце сердца содержатся преимущественно тетрамеры, состоящие из Н-субъединиц (H от англ. heart), в ЛДГ печени и скелетных мышц преобладают М-мономеры.
Активный центр в субъединице ЛДГ схематически показан на рис. 2. При этом пептидный остов белка изображен в виде ленты (светло-голубой), дополнительно представлены молекулы: субстрата — лактата (красного цвета), кофермента НАД+ (желтого цвета) и три боковые цепи аминокислот (зеленого цвета), которые участвуют непосредственно в катализе. Кроме того, выделена пептидная петля (малинового цвета), образованная аминокислотными остатками 98-111. В отсутствие субстрата и кофермента эта структура раскрыта, что обеспечивает свободный доступ к субстратсвязывающему участку (не показано). На рисунке представлен блокированный активный центр в комплексе фермент-лактат-НАД+. Детали каталитического цикла лактатдегидрогеназы обсуждаются в следующем разделе.
Б. Пиридиннуклеотидные коферменты
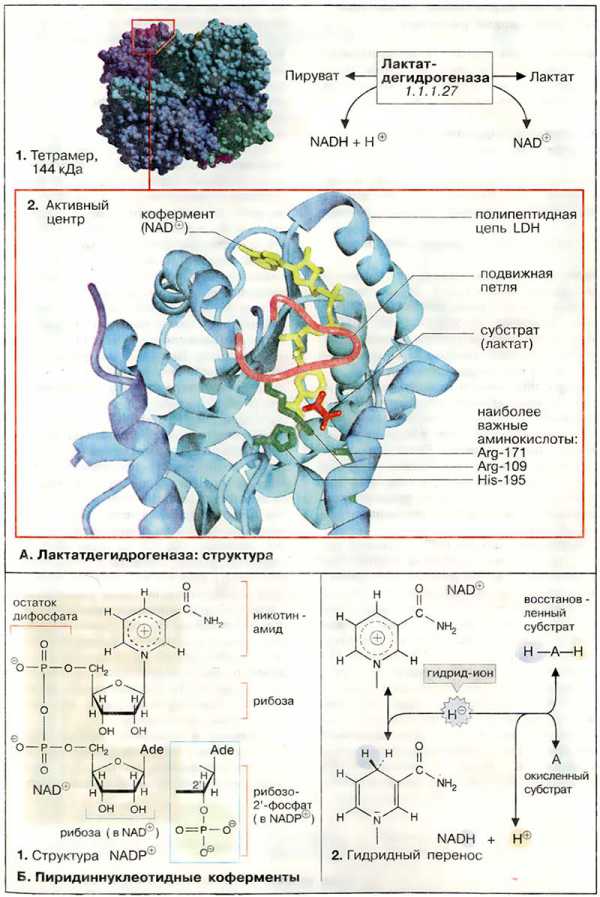
Все дегидрогеназы нуждаются в коферменте для переноса восстановительных эквивалентов (см. с. 108). Наиболее широко распространены коферменты динуклеотидного типа (см. с. 86), в котором два нуклеозид-5'-монофосфата соединены фосфоангидридной связью. ЛДГ и многие другие дегидрогеназы нуждаются в никотинамидадениндинуклеотиде, сокращенно НАД+ (NAD+) (1). Обе нуклеотидных группы НАД+ построены из 5'-АМФ и нуклеотида, содержащего в качестве основания амид никотиновой кислоты (см. с. 354). Структурно (но не функционально) похожим коферментом является НАДФ+ (NADP+), в котором 2'-ОН-группы рибозы аденина дополнительно связаны с фосфатом. Несмотря на близкое структурное родство НАД+ и НАДФ+ осуществляют различные функции в обмене веществ (см. с. 114).
В окислительно-восстановительных реакциях пиридиннуклеотидного кофермента участвует только никотинамидное кольцо (2). Никотинамид является амидом пиридин-3-карбоновой (никотиновой) кислоты. В окисленной форме кольцо имеет ароматический характер и несет положительный заряд. По этой причине кофермент в окисленном состоянии обозначают как НАД+. При окислении лактата дегидрогеназа отщепляет от субстрата (Ah3) два атома водорода [т. е. два электрона и два протона (2, середина)]. Однако на НАД+ переносится только гидрид-ион (H-, два электрона и один протон). Акцептором гидрид-иона является атом углерода в пара-положении к атому азота кольца НАД+. В этом месте образуется алифатическая СН2-группа, перестраиваются двойные связи кольца и исчезает положительный заряд (2, внизу). При окислении или восстановлении никотинамидного кольца изменяются также спектральные характеристики кофермента. Поэтому за реакцией можно легко следить фотометрически (см. с. 106).
Второй протон высвобождается в среду и, следовательно, правильное наименование восстановленной формы кофермента NADH + H+, а не NADh3.
 ___
___ А. Лактатдегидрогеназа: структура
Активной формой лактатдегидрогеназы (молекулярная масса 144 кДа) является тетраметр из 4 субъединиц (1). Каждая субъединица образована пептидной цепью из 334 аминокислот (36 кДа). В тетрамере субъединицы занимают эквивалентные положения (1); каждый мономер содержит активный центр.В организме млекопитающих имеются два различных типа субъединиц ЛДГ (Н и М), незначительно различающиеся по аминокислотной последовательности; они могут ассоциировать в тетрамер случайным образом. Поэтому известно 5 различных изоферментов ЛДГ. В мышце сердца содержатся преимущественно тетрамеры, состоящие из Н-субъединиц (Н от англ. heart), в ЛДГ печени и скелетных мышц преобладают М-мономеры.
Активный центр в субъединице ЛДГ схематически показан на рис. 2. При этом пептидный остов белка изображён в виде ленты (светло-голубой), дополнительно представлены молекулы: субстрата — лактата (красного цвета), кофермента НАД+ (жёлтого цвета) и три боковые цепи аминокислот (зелёного цвета), которые участвуют непосредственно в катализе. Кроме того, выделена пептидная петля (малинового цвета), образованная аминокислотными остатками 98-111. В отсутствие субстрата и кофермента эта структура раскрыта, что обеспечивает свободный доступ к субстратсвязывающему участку (не показано). На рисунке представлен блокированный активный центр в комплексе фермент-лактат-НАД+. Детали каталитического цикла лактатдегидрогеназы обсуждаются в следующем разделе.
Статьи раздела «Лактатдегидрогеназа: структура»:
— Следущая статья | — Вернуться в раздел
Page 2
Обмен гемоглобина: — обмен железа, — синтез гема, — гемоглобин, его типы, — миоглобин, — гемоглобиновые болезни, — регуляция оксигенации, — механизм газообмена, — катаболизм гема, — желтухи взрослых, — желтухи детей, — наследственные желтухи.
Ферменты лактатдегидрогеназа и изоферменты ЛДГ
Лактатдегидрогеназа (ЛДГ). Катализирует обратимую реакцию образования лактата. Фермент является тетрамером и имеет 5 изоформ. Наиболее богаты этим ферментом клетки сердца, печени, почек, скелетной мускулатуры, эритроциты. Физиологическое повышение активности ЛДГ наблюдается при беременности. При инфаркте миокарда повышение активности ЛДГ может быть значительным. При коронарной недостаточности (но без инфаркта), застойных явлениях в печени ЛДГ почти не повышается. При инфаркте миокарда активность ЛДГ и АСТ значительно повышена, билирубин же остается в пределах нормы.
При инфаркте легкого повышение активности ЛДГ сравнимо с таковым при инфаркте миокарда, но сочетается с нормальной активностью АСТ и повышенным билирубином. При гепатитах легкой и средней тяжести активность ЛДГ повышена только в первые дни и быстро снижается до нормы. При тяжелых гепатитах активность ЛДГ повышена значительно и длительно. При поражениях печени ЛДГ повышается вследствие длительной механической желтухи. ЛДГ повышается также при гемолитических анемиях. Изоферменты лактатдегидрогеназы (ЛДГ). Молекула ЛДГ обладает четвертичной структурой и состоит из четырех субединиц. При этом вариантов субъединиц только два – Н и М. Такая структура делает возможным существование пяти изоферментов. На электрофореграмме подвижность изоферментов различна.
Изоферменты обозначаются цифрами: ЛДГ-1 (самый подвижный), ЛДГ-2, ЛДГ-3, ЛДГ-4 и ЛДГ-5 (наименее подвижный). Изофермент ЛДГ-1, являющийся гомомером НННН, содержится в больших количествах в миокарде, в цитоплазме эритроцитов, а также в корковом веществе почек. ЛДГ-3 (гетеромер ННММ) более характерен для эпителия лёгочных альвеол. ЛДГ-5 (гомомер ММММ) присутствует в клетках поперечно-полосатой скелетной мускулатуры и в гепатоцитах. Благодаря большой активности ЛДГ в эритроцитах даже следы гемолиза в сыворотке крови приводят к ложно завышенным результатам теста на ЛДГ. ЛДГ служит маркером гликолиза.
Повышение активности изофермента ЛДГ-1 в течение первых трёх суток после приступа загрудинных болей, особенно когда болевой синдром не купируется нитроглицерином, позволяет говорить об инфаркте миокарда. Наиболее высока диагностическая ценность теста на ЛДГ-1 в первые 16-20 часов после приступа, когда активность ЛДГ-1 в сыворотке крови уже повышена, а тотальная активность ЛДГ еще в норме. При инфаркте миокарда изофермент ЛДГ-1 первым среди изоферментов ЛДГ повышается и последним возвращается к норме – его активность может оставаться высокой и после того, как общая активность ЛДГ уже вернулась в рамки референтных значений. При незначительных зонах некроза в миокарде активность ЛДГ-1 увеличивается, а тотальная ЛДГ все время остается в норме.
Определение общей активности лактатдегидрогеназы (к.Ф. 1.1.1.27) и ее изоферментов.
Лактатдегидрогеназа (L-лактат; НАД-оксидоредуктаза) - гликолитический (цитозольный цинксодержащий) фермент (молекулярная масса 135 000 Д), обратимо катализирующий окисление L-лактата в пировиноградную кислоту. Окисленный никотинадениндинуклеотид используется в качестве кофермента и является акцептором водорода.
Схема реакции:
Ch4CHOHCOOН HAД+ Ch4COCOOН+ HAД·H+H+
лактат лактатдегидрогеназа пируват
Фермент широко распространен в организме человека. По степени убывания активности энзима органы и ткани могут быть расположены в следующем порядке: почки, сердце, скелетные мышцы, поджелудочная железа, селезенка, печень, легкие, сыворотка крови. В последней обнаружено несколько различных изоферментов, обладающих одинаковыми каталитическими свойствами. Каждый из изоферментов представляет собой тетрамер, образованный субъединицами Н (heart) и М (muscle). Полипептидная цепь обеих субъединиц содержит 330 аминокислотных остатков; различия в их последовательности в субъединицах обнаружены на протяжении более чем 25% длины полипептидной цепи. Свойства ферментов ЛДГ определяются особенностями входящих в них субъединиц. Изменения в строении белковой части изоферментов обусловливают их различные физико-химические свойства (в частности, неодинаковую электрофоретическую подвижность). В плазме (сыворотке) крови выявлено пять изоферментов лактатдегидрогеназы ЛДГ1 (HHHH) - 14-26%, ЛДГ2 (НННМ) - 29-39%, ЛДГ3 (ННММ) - 20-26%, ЛДГ4 (НМММ) - 8-16%, ЛДГ5 (ММММ) - 6-16%. Они располагаются в геле в порядке убывания электрофоретической подвижности.
Субъединица М обнаруживается главным образом в тканях с анаэробным метаболизмом, в то время как субъединица Н присутствует в тканях с преобладанием аэробных процессов. Изофермент ЛДГ1 осуществляет окисление лактата в пируват в тканях с аэробным типом метаболизма (миокард, мозг, почки, эритроциты, тромбоциты), а ЛДГ5, напротив, пирувата в лактат в тканях с высоким уровнем гликолиза (скелетные мышцы, печень).
Шестой изофермент лактатдегидрогеназы (ЛДГ-Х) встречается в яичках взрослых особей наряду с пятью изоферментами, которые обнаруживаются в других тканях. ЛДГ-Х является тетрамером, состоящим из 4 идентичных Х-субъединиц, которые отличаются по аминокислотному составу от Н- и М-субъединиц. Этот изофермент, видимо, связан со сперматогенезом, так как 80% активности лактатдегидрогеназы сперматозоидов обусловлено этим изоферментом.
Методы определения общей активности ЛДГ подразделяются на две основные группы: 1) кинетические, базирующиеся на оптическом тесте Bap6ypга (оптическом эффекте, связанном с превращением НАД+ в НАД • Н, и наоборот); 2) методы, в которых определяется количество образовавшегося продукта или потребляемого субстрата после фиксированного инкубационного периода (методы конечной точки).
Для изучения изоферментного спектра лактатдегидрогеназы используются способы, базирующиеся на:
-фракционировании методом зонального электрофореза или хроматографии (изоферменты ЛДГ нумеруются соответственно электрофоретической подвижности по отношению к аноду) с последующим тетразольным окрашиванием фракций и денситометрическим учетом картины разделения;
- дифференцированном неселективном и селективном ингибировании изоферментов ЛДГ: пируватом (ЛДГ1 более чувствительна к его влиянию, чем ЛДГ5), лактатом, оксалатом (более ингибирует ЛДГ1, чем ЛДГ5), мочевиной (инактивирует ЛДГ5);
- различии в тепловой стабильности изоферментов (ЛДГ1 ) различии в тепловой стабильности изоферментов
- применении антител (к ЛДГ1 и ЛДГ5): иммунохимические тесты и некоторые другие.
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе