Оптический когерентный томограф
Спектральная оптическая когерентная томография: принципы и возможности метода
Для цитирования: Свирин А.В., Кийко Ю.И., Обруч Б.В., Богомолов А.В. Спектральная оптическая когерентная томография: принципы и возможности метода // РМЖ. Клиническая офтальмология. 2009. №2. С. 50
Spectral optic coherent tomography: principles and possibilities (Literary review)
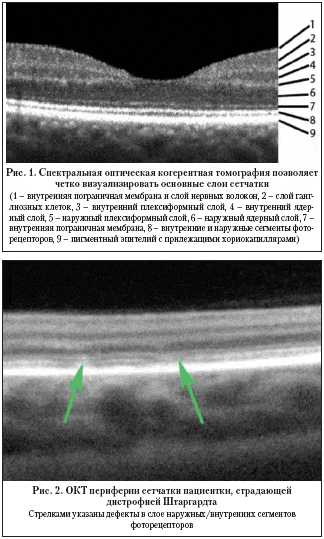
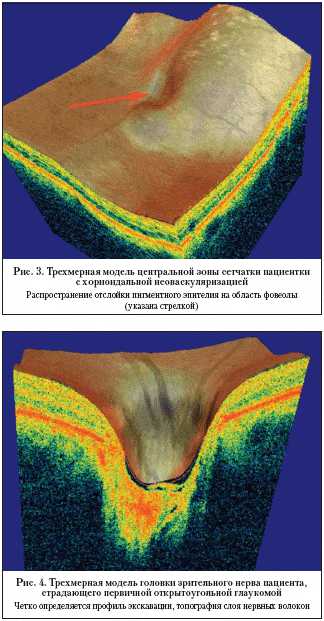
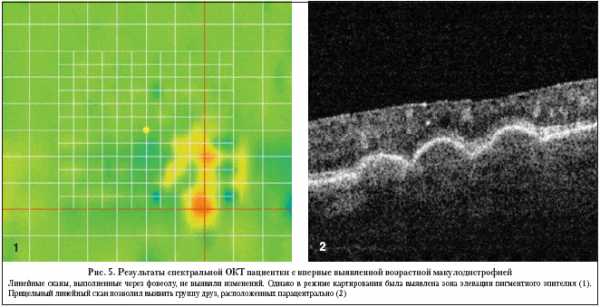
and possibilities (Literary review) A.V. Svirin, Yu.I. Kiiko*, B.V. Obruch, A.V. Bogomolov Russian State Medical University of Roszdrav, *FGU VCGPH of Roszdrav, Moscow Authors discuss principles, diagnostic possibilities and types of new examination method – spectral optic coherent tomography which information value exceeds the OCT’s. Оптическая когерентная томография (ОКТ) широко используется в современной медицине. Это неинвазивный и высокоточный метод исследования, с помощью которого стало возможным получать изображение поперечного среза исследуемых тканей in vivo. ОКТ была разработана в Массачусетском технологическом университете в конце 80–х годов ХХ века. ОКТ нашла применение во многих отраслях медицины – в гастроэнтерологии, кардиологии, урологии, дерматологии, стоматологии. Однако наибольшую популярность новая методика завоевала в диагностике заболеваний глаза. Самый известный прибор, реализующий технологию ОКТ в офтальмологии – Stratus OCT (Carl Zeiss Meditec) на данный момент был продан в количестве, превышающем 6 тыс. экземпляров. В мире насчитывается более тысячи статей и научных трудов, посвященных применению ОКТ в диагностике заболеваний глаза. Принципы метода Суть ОКТ заключается в измерении времени задержки светового луча, отраженного от исследуемой ткани. Поскольку современное оборудование не позволяет непосредственно измерять этот параметр на столь малых пространственных отрезках, работа ОКТ построена на принципах световой интерферометрии. До недавнего времени основой всех когерентных томографов был интерферометр Михельсона (time–domain OCT). Источником света в нем является суперлюминесцентный диод, позволяющий получать луч низкой когерентности. С помощью делителя световой пучок расщепляется на две равные части, одна из которых направляется на исследуемую структуру, вторая – на подвижное зеркало (опорное плечо). Исследователь путем смещения рабочей части прибора добивается того, чтобы расстояние до обоих объектов было одинаковым. После этого отраженные лучи суммируются, что вызывает эффект интерференции, регистрируемый фотодетектором. Полученная амплитуда интерферировавшей световой волны характеризует отражающую способность конкретной точки исследуемого объекта. Затем опорное плечо смещается и выполняется исследование следующей точки. В итоге формируется одномерный А–скан (axial scan). Получаемое путем суммирования нескольких А–сканов двухмерное изображение, по аналогии с ультразвуковым исследованием, называется В–сканом. Расстояние между точками А–скана определяет продольное (аксиальное) разрешение, между соседними А–сканами – поперечное. Основным фактором, ограничивающим возможности Time–domain OCT, является наличие механического элемента системы – подвижного зеркала опорного плеча. От точности и скорости его смещения напрямую зависят аксиальное разрешение и время сканирования. Максимальная продольная разрешающая способность ОКТ, полученная в лабораторных условиях, составляет 2–3 мкм. Этот результат достигнут на неподвижных объектах с использованием в качестве источника света фемтосекундного лазера. Однако коммерческий вариант данной системы не был реализован ввиду ее высокой стоимости. Максимальная разрешающая способность Time–domain ОКТ в клинике представлена в последней модификации Stratus OCT и составляет 8–10 мкм при скорости сканирования 400 А–сканов в секунду. Стандартное исследование, состоящее из 512 А–сканов, занимает, таким образом, более 1 секунды. Спектральная ОКТ Коренной перелом в технологии оптической когерентной томографии произошел с внедрением в практику спектральных интерферометров, использующих преобразование Фурье (spectral/Fourier domain). Их отличием от интерферометра Михельсона является наличие спектрометра и высокоскоростной CCD – камеры (CCD – charge–coupled device, русскоязычный аналог термина – ПЗС (прибор зарядовой связи). Источником света является широкополосный суперлюминесцентный диод, позволяющий получить низкокогерентный луч, содержащий несколько длин волн. Как и в time–domain OCT, световой импульс делится на две равные части, одна из которых отражается от фиксированного опорного плеча (зеркала), вторая – от исследуемого объекта. Затем сигналы суммируются, а проинтерферировавший луч света раскладывается на составные части спектра, которые одномоментно фиксируются CCD–камерой. Полученный спектр интерференции состоит из совокупности световых волн, отраженных от различных по глубине участков исследуемого объекта. Затем из полученного массива данных путем математического преобразования Фурье выделяются частотные составляющие, из которых формируется А–скан. Таким образом, получение линейного скана происходит не путем последовательного измерения отражающих свойств каждой отдельной точки пространства, а одномоментно. Глубина сканирования при этом равна зоне когерентности. Подобный принцип исследования позволяет преодолеть ограничивающие факторы, связанные со скоростью и точностью движения механических частей интерферометра, поскольку опорное плечо остается во время исследования неподвижным. Скорость сканирования спектральных ОКТ зависит от быстроты работы CCD–камеры и математического преобразователя, а аксиальная разрешающая способность – от чувствительности спектрометра. Поперечное разрешение всех типов ОКТ ограничивается аберрациями оптической системы глаза. Благодаря принципу своей работы, спектральные ОКТ позволяют выполнять более 25 тыс. линейных сканов в секунду, превосходя по этому параметру оптические томографы предыдущего поколения более чем в 60 раз (некоторые модели – в 120 раз). Аксиальная разрешающая способность находится в пределах 3–8 мкм, поперечная – 10–15 мкм. К моменту написания статьи на мировом рынке было представлено 5 моделей спектральных оптических когерентных томографов c возможностью исследования заднего отрезка глаза: 1) RTVue–100 фирмы Optovue (США) – позволил совместить в одном приборе возможности исследования как переднего, так и заднего отрезка глазного яблока; 2) 3D OCT–1000 (Topcon) – обладает функциями фундус–камеры и сопоставления фотоснимка глазного дна с ОКТ изображением; 3) CIRRUS HD OCT (Carl Zeiss); 4) Soct Copernicus и Soct Copernicus HR совместного производства Reichert (США) – Optopol (Польша). Soct Copernicus HR обладает на сегодняшний день максимальной заявленной скоростью сканирования (55000 А–сканов в секунду) и аксиальным разрешением (3 мкм). Также под маркой Soct разработан спектральный ОКТ для исследования переднего отрезка глаза; 5) Spectralis HRA+OCT (Heidelberg Engineering) – ОКТ–приставка к лазерному сканирующему ангиографу HRA. Первым коммерческим прибором, в котором были реализованы возможности спектральной ОКТ глаза, стал RTVu–100 фирмы Optovue (США). Компания объявила о начале его производства в конце 2006 г. Именно этот прибор мы используем в работе нашей клиники, поэтому в дальнейшем основные технические характеристики и протоколы обследования приводятся исходя из возможностей RTVu–100. Улучшенные диагностические возможности Значительный прирост скорости и точности метода качественно изменил роль оптической когерентной томографии в диагностике заболеваний глаза. Чтобы понять всю значимость этих изменений, рассмотрим спектральную ОКТ с точки зрения ее клинического применения. Одной из самых главных проблем, возникающих при использовании томографов предыдущего поколения, является чувствительность метода к микродвижениям глазного яблока. Наибольшие погрешности вызывают так называемые микросаккады – непроизвольные быстрые движения с амплитудой 2–10 угловых мин и интервалом от 100 мс. Одно стандартное исследование на Stratus OCT (512 А–сканов) длится 1,28 сек. – за это время глазное яблоко 10–14 раз меняет свое положение. Подобный эффект негативно сказывается на конечной томограмме. Для нейтрализации появляющихся артефактов применяются методы графического сглаживания. Они эффективно выравнивают изображение, но могут скрывать локальные изменения, что вносит дополнительные затруднения в интерпретацию результатов. Спектральные когерентные томографы в отличие от time–domain OCT позволяют получить стандартный линейный профиль (1024 А–сканов) в среднем за 0,04 сек. За этот промежуток времени глазное яблоко не успевает совершить значимых движений, а значит, конечный В–скан максимально соответствует истинной структуре изучаемого объекта. Высокое разрешение позволяет четко идентифицировать все слои сетчатки и внутренние слои сосудистой оболочки. Диагностический поиск производится на уровне отдельных структур и групп клеток (рис. 1). Четкая визуализация комплекса «пигментный эпителий – слой фоторецепторов – наружная пограничная мембрана» способствует раннему выявлению ретино–хориоидальной патологии. В качестве примера на рисунке 2 представлена ОКТ периферической зоны сетчатки пациента, страдающего дистрофией Штаргардта. Высокая разрешающая способность метода позволяет выявить патологические изменения в слое наружных сегментов фоторецепторов. Трехмерная визуализация Однако главным отличием спектральных ОКТ стала возможность трехмерной визуализации объекта (участок сетчатки, головка зрительного нерва, роговица и проч.). Высокая скорость сканирования позволяет выполнить большое количество А–сканов (более 50 000) участка ткани фиксированной площади за 1–2 с. На основе этих данных программное обеспечение восстанавливает трехмерную структуру объекта. Полученное 3D–изображение позволяет оценить профиль поверхности изучаемой структуры, ее внутреннюю топографию. Возможна четкая визуализация границ патологических образований, наблюдение за их динамикой. Также эта функция незаменима в поиске небольших по размерам изменений, вероятность попадания которых в одиночный линейный скан мала. На рисунке 3 продемонстрирована трехмерная структура центральной зоны сетчатки пациентки с хориоидальной неоваскуляризацией. 3D–томограмма позволяет оценить вовлеченность фовеолы в патологический процесс и проследить динамику изменений. Трехмерная модель головки зрительного нерва (ГЗН) открывает новые возможности в оценке профиля экскавации при глаукоме (рис. 4). RTVu–100 позволяет выполнять морфометрию ГЗН, сходную по структуре получаемых данных с HRT. При этом определение границ диска зрительного нерва производится на основе 3D–изображения, что позволяет наносить его контур, основываясь на структурных особенностях ГЗН. Функции картирования Возможность исследования толщины сетчатки и ее слоев на определенном участке впервые была реализована в Stratus OCT. Итогом выполнения стандартного протокола является карта, представляющая полученные результаты графически и в абсолютных значениях. Методы картирования нашли широкое применение как в практической, так и в научно–исследовательской работе. Спектральная оптическая томография предоставляет новые возможности построения карт глазных структур. Прежде всего высокая скорость сканирования повышает их точность, поскольку на единицу площади приходится большее количество А–сканов. Кроме того, выполнение стандартного протокола исследования занимает не более 1 с, следовательно, движения глазного яблока оказывают минимальное воздействие на конечный результат. Высокая разрешающая способность позволяет четко идентифицировать границы между слоями сетчатки в автоматическом режиме. В результате становится возможным получать не только карту толщины сетчатки, но и ее отдельных слоев (слой ганглиозных клеток и нервных волокон, фоторецепторных клеток, пигментного эпителия). На рисунке 5–1 представлена карта элевации пигментного эпителия сетчатки пациентки с впервые диагностированной ВМД. Линейные сканы центральной зоны сетчатки не выявили патологических изменений. Однако методом картирования парацентрально были обнаружены участки локальной элевации пигментнго эпителия. Линейный скан, выполненный прицельно, позволил выявить расположенные на периферии друзы (рис. 5–2). Карта толщины слоя нервных волокон и ганглиозных клеток сетчатки расширяет возможности прибора в диагностике атрофий зрительного нерва, в том числе глаукомного генеза. Можно провести параллель в структуре получаемых результатов с поляриметрическими методами (хотя в последних определяется только толщина слоя нервных волокон без учета слоя ганглиозных клеток). Заключение К сожалению, в рамках одной статьи невозможно описать все новые возможности, которые предоставляет исследователю спектральная оптическая когерентная томография. Еще предстоит выработать комплекс диагностических критериев для основных групп заболеваний заднего отрезка глаза, оценить точность получаемых результатов относительно приборов, использующих другие физические принципы (сканирующие лазерные офтальмоскопы, лазерные поляриметры и т.п.). Однако уже сейчас можно утверждать, что спектральная оптическая когерентная томография является качественно новым методом диагностики заболеваний глаз. Ее информативность значительно превосходит ОКТ предыдущего поколения за счет возросшей разрешающей способности и высокой скорости исследования. Метод позволяет получить исчерпывающее представление об ультраструктуре произвольного участка сетчатки и головки зрительного нерва. Разнонаправленность получаемых результатов, широкие возможности диагностики и динамического наблюдения различных глазных заболеваний делают спектральную оптическую когерентную томографию одним из наиболее точных и универсальных методов морфологического исследования в офтальмологии.
Поделитесь статьей в социальных сетях
Предыдущая статья
Следующая статья
Основные принципы работы оптического когерентного томографа

Содержание:
Ультразвуковые методы широко используются в офтальмологии для качественной оценки структур глаза и измерения расстояний между ними. Основным достоинством ультразвуковых методов в офтальмологии является их способность глубоко проникать в непрозрачные биологические ткани. Для получения изображения требуется контакт улавливающего отраженные ультразвуковые волны датчика с глазом непосредственно или через эммерсионную среду. Кроме того, разрешающая способность ультразвуковых методов напрямую зависит от используемой частоты. На практике наиболее часто используют ультразвуковые приборы, работающие на частоте 10 МГц, что обеспечивает пространственную разрешающую способность около 150 мкм. Недавно разработанные высокочастотные ультразвуковые системы обеспечивают пространственное разрешение до 20 мкм, однако их проникающая способность ограничена 4-5 мм, что делает возможным их клиническое применение лишь для оценки переднего отрезка глаза.
Оптические методы измерений и получения изображений зависят от проникновения и отражения световых длин волн в средах глаза и не требуют непосредственного контакта с глазом. Таким образом, обследование становится комфортным для пациента и исключает возможность передачи микроорганизмов через датчик прибора. Кроме того, оптические методы измерений позволяют добиться более высокой пространственной разрешающей способности, чем ультразвуковые. Современные ОКТ позволяют получить в 10 раз лучшее пространственное разрешение исследуемого объекта, чем стандартная ультразвуковая установка. Глаз является идеальным органом для исследования с помощью ОКТ, благодаря прозрачности его оптических сред. Томографические измерения микроструктуры сетчатки глаза основаны на принципе интерферометрии с низкой когерентностью.
Метод ОКТ базируется на принципах световой интерферометрии, основы которой были описаны И. Ньютоном. В последние годы интерферометры широко используются для высокоточных измерений в волоконной оптике и оптикоэлектронике. Схематичное изображение интерферометра представлено на рисунке 1.
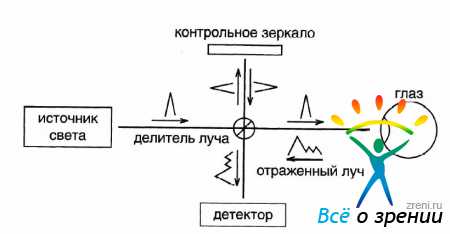
Рисунок 1. Схематическое изображение интерферометра.
Оптический луч от лазерного или светового источника направляется на полупрозрачное зеркало, которое делит его на два луча — измеряющий и контрольный.
- Измеряющий луч направляется в глаз, где отражается от исследуемых структур и возвращается на детектор с различной временной задержкой, зависящей от свойств изучаемых микроструктур к абсорбции, рассеиванию и отражению света, т.е. от оптической плотности.
- Второй луч, отраженный от контрольного зеркала с регулируемой позицией, также возвращается на детектор.
Простейший вариант измерения, который может быть выполнен с помощью ОКТ — осевое, аналогичное ультразвуковому А-скану. Интенсивность и спектр отраженных от структур глаза сигналов широко варьирует в зависимости от оптических свойств тканей, однако на границах разнородных тканей, как правило, имеются различные коэффициенты отражения. Толщина тканей может быть вычислена измерительным модулем прибора, исходя из времени задержки отраженного сигнала, умноженной на скорость света в ткани. Скорость света в ткани в свою очередь определяется индексом ее рефракции. Таким образом, оценка толщины структур методом ОКТ основана на предполагаемых или известных значениях коэффициентов преломления света структурами глаза.
Поскольку световой луч может быть точно сфокусирован в определенной точке пространства, его поперечное смещение также может быть легко определено. Это создает основу для трехмерного пространственного изображения структур глаза на основе обработки программой компьютера отраженного сигнала при его продольном и поперечном перемещении.
Для более четкой дифференцировки тканей их изображения могут быть окрашены с использованием стандартной цветовой шкалы типа «радуги»: слабо отражающие структуры выглядят окрашенными в черный и голубой цвета; хорошо отражающие — в белый и красный. Необходимо отметить, что окрашенная томограмма отражает реальное соотношение структур с различными оптическими свойствами, но не обозначает их настоящую морфологическую границу. Таким образом, при интерпретации окрашенных томограмм не стоит рассчитывать на воспроизведение на скане реальной картины гистоморфологии.
Для получения картины структур тканей глаза с высоким разрешением крайне важно нивелировать влияние искажений вносимых непроизвольными движениями глаз при колебании артериального давления, тремором и микросаккадами. Эту роль выполняет система компьютерной обработки видеоизображений, компенсирующая осевое смещение воспроизводимой томограммы.
Последняя модель оптического когерентного томографа ОСТ-3 «Stratus» производится фирмой «Zeiss-Meditec» (Германия-США).
В состав томографа входит интерферометр, обеспечивающий получение информации о структурах сетчатки путем измерения времени задержки светового эхосигнала, возникающего в результате отражения и рассеивания света различными микроструктурами сетчатки. Томограф ОСТ-3, в котором в качестве источника света используется сверхлюминесцентный диод, проецирует на сетчатку глаза широкополосный пучок света в диапазоне, близком к инфракрасному. Интерферометр томографа ОСТ-3 с помощью электронных схем получает, собирает, обрабатывает и сохраняет информацию о задержке эхосигналов от сетчатки. При каждом проходе сканирования томограф получает от 128 до 768 отсчетов в продольном (аксиальном) диапазоне, т.е. А-сканов. Каждый А-скан состоит из 1024 элементов данных, соответствующих диапазону глубин до 2 мм и более. Таким образом, для реконструкции изображения (томограммы) поперечного среза сетчатки глаза томограф ОСТ-3 использует от 131072 до 786432 элементов данных. Томограммы отражаются в реальном времени с помощью цветовой шкалы, представляющей количество света, рассеянного тканями на разной глубине сетчатки. Пользователь может выбрать отдельные томограммы и сохранить их в системе для последующего анализа.
Томограф ОСТ-3 позволяет получать изображения поперечных срезов внутренней структуры сетчатки глаза с аксиальным разрешением менее 10 микрон и поперечным разрешением 20 микрон. Программный пакет томографа содержит 18 протоколов сканирования и 18 протоколов анализа. Они позволяют анализировать диск зрительного нерва, слой нервных волокон и макулярную область сетчатки с помощью одного прибора. Томограф можно использовать для
- выявления и контроля течения глаукомы,
- заболеваний сетчатки
- и стекловидного тела.
Статья из книги: Биомикроретинометрия | Родин А.С.
Группа Виварий | статьи | Оптическая когере...
18 АВГУСТА 2016
Оптическая когерентная томография (OКT) – это новая технология визуализации поперечного сечения с высоким разрешением. ОКТ аналогична ультразвуковой визуализации, за исключением того, что вместо звука применяется свет. Использование этой технологии в сочетании с катетерами и эндоскопами позволяет выполнить внутрипросветную визуализацию органов и систем в высоком разрешении. ОКТ можно использовать в качестве разновидности оптической биопсии. В отличие от обычной гистопатологии, где требуется удаление образца ткани и обработка для микроскопического исследования, эта технология может обеспечить изображение поперечного сечения структуры ткани in situ и в режиме реального времени. ОКТ может быть использована в том случае, когда стандартная эксцизионная биопсия является опасной или невозможной; для того, чтобы уменьшить ошибки выборки, связанные с эксцизионной биопсией; для направления интервенционных процедур. В этой статье мы рассмотрим технологию ОКТ и опишем потенциал ее биомедицинского и клинического применения.
Введение
ОКТ была впервые продемонстрирована в 1991 году [1]. Оптические изображения выполнялись in vitro в сетчатке глаза человека и в атеросклеротических бляшках в качестве примеров изображений прозрачных, слабо рассеивающих сред, а также непрозрачных, высоко рассеивающих сред. ОКТ изначально применялась для визуализации глаза и на сегодня показала наибольший клинический эффект в офтальмологии. Впервые томограмма in vivo диска зрительного нерва и макулы человека была продемонстрирована в 1993 году [2; 3]. ОКТ позволяет бесконтактно, неинвазивно визуализировать передний отдел глаза, а также морфологические особенности человеческой сетчатки, включая фовеа и диск зрительного нерва [4‑7]. Работая в сотрудничестве с New England Eye Center, наша группа обследовала более 10 тысяч пациентов. Технология была передана в промышленное производство и предложена для коммерческого использования в сфере офтальмологической диагностики в 1996 году («Хамфри Систем», Дублин, Калифорния). За последние несколько лет были проведены многочисленные клинические исследования.
В последнее время совершенствование технологии позволило получать изображения непрозрачных тканей, что открывает возможности применения ОКТ в широком диапазоне медицинских специальностей [8‑11]. Глубина изображения ограничивается оптическим затуханием рассеяния и поглощения ткани. Тем не менее, в большинстве тканей можно получить изображения до 2‑3 мм глубиной. Это тот же масштаб, который, как правило, достигается с помощью обычной биопсии и гистологии. Хотя глубина визуализации не так глубока, как с помощью ультразвука, разрешение ОКТ от 10 и до 100 раз больше, чем при стандартном клиническом ультразвуке. С помощью этой технологии были получены изображения in vitro артериальной патологии, где может быть дифференцирована морфология бляшек [11; 12]. ОКТ-визуализация также проводилась in vitro для исследований в дерматологии, гастроэнтерологии, урологии, гинекологии, хирургии, нейрохирургии, ревматологии [9; 13‑28], а также in vivo для визуализации развивающихся биологических образцов (Xenopus laevis, Rana pipiens и Brachyodanio rerio головастиков и эмбрионов) [29‑31]. ОКТ представляет интерес для применения в биологии развития, поскольку позволяет повторно визуализировать развитие морфологии без необходимости жертвовать образцом.
ОКТ-технология интенсивно развивается. Высокоскоростные изображения в реальном времени продемонстрировали фиксацию изменений со скоростью нескольких кадров в секунду [15; 32; 33]. Высокое и сверхвысокое разрешения ОКТ-визуализации продемонстрировано с помощью новых лазерных источников света. Достигнуто осевое разрешение свыше 1 мкм [34‑36]. На клеточном уровне ОКТ-визуализация недавно продемонстрирована в биологии развития образцов [37]. Оптическая томография с использованием катетеров, эндоскопов и лапароскопов позволяет выполнить внутреннюю визуализацию [38; 39]. Такая визуализация желудочно-кишечного тракта, легких и мочевыводящих путей, а также артериальных изображений продемонстрирована in vivo на моделях животных [15; 28; 40]. Сообщалось о предварительных исследованиях ОКТ с помощью эндоскопа у людей [41; 42]. В настоящее время многими исследовательскими группами осуществляются предварительные клинические исследования.
В целом существует три типа клинических ситуаций, где, на наш взгляд, ОКТ может быть успешно применена: 1. Обычная эксцизионная биопсия является опасной или невозможной. 2. Обычная биопсия имеет неприемлемо высокий ложный отрицательный процент из‑за ошибок выборки. 3. Для руководства в хирургических интервенционных процедурах.
В данной статье мы рассмотрим основные концепты ОКТ-технологии и обсудим ее возможные приложения в биомедицинских исследованиях и клинической медицине.
Оптическая когерентная томография в сравнении с ультразвуком
ОКТ-изображение в чем‑то аналогично визуализации УЗИ в режиме B-mode, за исключением того, что вместо звука используется свет. Учитывая аналогию ОКТ и УЗИ, целесообразно начать с рассмотрения факторов, которые определяют сходство ОКТ- и УЗИ-визуализаций. Чтобы выполнить изображение поперечного сечения или томографии, в первую очередь необходимо измерить внутреннюю структуру материалов или тканей вдоль одной оси или в продольном сечении. В ОКТ первым шагом в построении томографического изображения является измерение осевого расстояния или информация о дальности в материале или ткани. Существует несколько различных вариантов осуществления ОКТ, но, в сущности, визуализация выполняется путем измерения времени задержки эха и интенсивности рассеянного света или света, обратноотраженного от внутренней микроструктуры материалов / тканей.
Ультразвуковое исследование является хорошим клиническим методом визуализации и широко используется, начиная от визуализации внутренних органов и систем, транслюминальной эндоскопической визуализации и основанных на применении катетера внутрисосудистых изображений. В УЗИ звуковая волна высокой частоты запускается в материал или ткань, создавая изображение с помощью зонда ультразвукового преобразователя [43‑47]. Звуковая волна распространяется в материале или ткани и обратно рассеивается или отражается от внутренних структур, имеющих различные акустические свойства. Частота звуковой волны определяет разрешение изображения в ультразвуке, где более высокие частоты создают более высокое разрешение. Вместе с тем распространение звуковой волны также приводит к ее ослаблению, и более высокие частоты уменьшают глубину визуализации. Временной режим или эхо-структура отраженных звуковых волн обнаруживаются с помощью ультразвукового зонда и диапазонов / размеров внутренних структур, определяемых из‑за задержки эхо-сигнала. Этот принцип сходен с тем, который используется в авиационных радиолокаторах дальности.
В ОКТ измерение расстояния и микроструктуры выполняются световыми волнами, которые обратно отражаются и обратно рассеиваются от различных микроструктур внутри материала или ткани [1]. С целью иллюстрации можно визуализировать операцию ОКТ, представляя, что световой пучок состоит из коротких оптических импульсов. Тем не менее, важно отметить, что, хотя ОКТ может быть выполнена с использованием короткого импульса света, большинство таких систем работают с использованием непрерывного излучения световых волн с низкой длиной когерентности. Кроме того, продемонстрирован целый ряд иных подходов к ОКТ, когда измеряются спектральные свойства низкокогерентного света или используется быстро настраиваемый узкополосный свет.
Когда пучок света или звука направляется на ткани, он обратно рассеивается или отражается от конструкций, имеющих разные акустические или оптические свойства, а также от границы между структурами. Размеры различных структур могут быть определены путем измерения эхо-времени, необходимого для звука или света, чтобы быть обратно отраженным или рассеянным от различных структур при различных осевых (продольных) расстояниях. В ультразвуке осевое измерение расстояния или диапазона называется сканированием в режиме A-mode. Принципиальное различие между ультразвуком и оптическим изображением состоит в том, что скорость распространения света примерно в миллион раз выше, чем скорость звука. Поскольку расстояние в пределах материала или ткани определяется путем измерения эхо-временной задержки обратнорассеивающихся или обратноотраженных световых волн, это означает, что для измерения расстояния с помощью света требуется ультрабыстрое временное разрешение.
Два наиболее важных параметра для характеристики качества изображения – это разрешение и глубина изображения. Разрешение ультразвуковых изображений напрямую зависит от частоты или длины используемых звуковых волн [43‑47]. В типичных клинических ультразвуковых системах используются звуковые частоты волн в режиме десяти мегагерц (МГц) и выхода пространственного разрешения в 150 мкм. Ультразвуковое исследование обладает тем преимуществом, что звуковые волны на этой частоте легко передаются в большинстве биологических тканей и, следовательно, позволяют получать изображения структур до нескольких десятков сантиметров вглубину внутри тела. Частота звука является важным параметром в ультразвуковой визуализации, поскольку позволяет оптимизировать разрешение изображения для данного применения в зависимости от глубины проникновения изображения. Высокая частота УЗИ была разработана и широко исследована в лабораторных приложениях, а также некоторых клинических приложениях. Решения от 15 до 20 мкм были достигнуты с частотами 100 МГц и выше. Тем не менее, высокие частоты ультразвука значительно ослабляются в биологических тканях, и затухание увеличивается примерно пропорционально частоте. Таким образом, высокая частота ультразвуковой визуализации ограничена глубиной всего лишь нескольких миллиметров.
Важно также отметить, что поперечное разрешение ультразвука регулируется возможностью фокусировки звуковых волн, и в целом звук труднее фокусируется, чем свет, так как поперечное разрешение для ультразвука ниже, чем для ОКТ. Современные технологии обработки оптических изображений имеют разрешение в пределах от 1 до 15 мкм. По сути, высокое разрешение оптической томографии позволяет визуализировать такие функции, как ткани архитектурной морфологии, а также некоторые клеточные особенности. Главный недостаток оптических изображений в том, что в большинстве биологических тканей свет сильно рассеивается. Кроме тканей глаза, в иных тканях пределы оптического рассеяния изображения достигаются при глубине проникновения 2‑3 мм.
Наконец, полезно отметить, что ОКТ, ультразвук и микроскопия имеют различные механизмы контрастности изображения. Ультразвуковые изображения различны из‑за несоответствия акустического импеданса ультразвука, рассеивающегося между различными тканями. Это создает различия в интенсивности отраженных или рассеивающихся звуковых волн. Изображение ОКТ использует свет и чувствительно к различиям в показателе преломления оптического рассеяния в различных тканях. Наконец, в микроскопии изображения генерируются различиями в любом оптическом отражении или прохождении через тонкие секции. В гистопатологии большое разнообразие пятен может быть использовано для селективного повышения контрастности между различными структурами. Таким образом, ОКТ отличается от ультразвука или гистопатологии, и необходимы исследования, чтобы установить основу для интерпретации ОКТ с точки зрения клинически значимых патологий.
Биомедицинская визуализация с использованием оптической когерентной томографии Особенности ОКТ, свидетельствующие о важной роли этой технологии для биомедицинских изображений, таковы: 1. ОКТ создает изображение с осевым разрешением от 1 до 15 мкм, что на один-два порядка выше, чем при обычном УЗИ. Эта разрешающая способность приближается к гистопатологии, что позволяет исследовать архитектурную морфологию и некоторые клеточные функции. В отличие от УЗИ, томография может быть выполнена непосредственно по воздуху, не требуя прямого контакта с тканью или преобразовательной средой. 2. Формирование изображений может выполняться на месте, без необходимости иссекать образец. Это позволяет визуализировать структуры, в которых биопсия опасна или невозможна, а также способствует более полному охвату, что уменьшает ошибки выборки, связанные с эксцизионной биопсией. 3. Формирование изображений может выполняться в реальном времени, без необходимости обработки образца, как и в обычной биопсии и гистопатологических исследованиях. Это позволяет мониторить патологии на экране и сохранять изображение с высоким разрешением на носителе. Изображения в режиме реального времени можно включить в диагностику в реальном времени, а также соединить эту информацию с хирургией, что позволяет использовать ОКТ для хирургического руководства. 4. ОКТ как технология, основанная на оптоволокне, может быть соединена с широким спектром инструментов, включая катетеры, эндоскопы, лапароскопы и хирургические зонды. Это позволяет визуализировать органы и системы внутри тела.
5. И, наконец, ОКТ компактна и портативна, что является важным фактором для клинически жизнеспособного устройства.
Оптическая визуализация в офтальмологии
Изначально ОКТ применялась для визуализации тканей глаза [3‑7]. На сегодня технология показала наибольший клинический эффект именно в офтальмологии. Например, ОКТ-изображения нормальной сетчатки человека [5]. Ее изображение шириной в 250 пикселей получено с использованием излучения с длиной волны 800 нм и с разрешением 10 мкм. Изображение показывает поперечное сечение сетчатки с беспрецедентно высоким разрешением и позволяет подробно дифференцировать структуры. Хотя сетчатка почти прозрачна и имеет чрезвычайно низкое оптическое обратное рассеяние, высокая чувствительность метода позволяет визуализировать даже чрезвычайно слабые возможности обратного рассеяния, такие как переходы витреальной сетчатки. В ОКТ-изображении пигментный эпителий сетчатки и хориоидея, значительно насыщенные сосудами, видны как сильно рассеивающиеся структуры. Слой нервных волокон сетчатки виден как рассеивающий слой, исходящий из диска зрительного нерва и утончающийся с приближением к фовеа. С помощью ОКТ можно измерять общую толщину, а также толщину слоя нервных волокон сетчатки. Поскольку эти изображения имеют разрешение 10 мкм, возможно остаточное движение глаз пациента на первой-второй секунде времени, необходимого для измерения. Однако, поскольку ОКТ измеряет абсолютное положение, обработка изображений может быть использована для измерения осевого движения глаз и коррекции артефактов движения [3].
Были проведены клинические исследования возможности использовать ОКТ для диагностики и мониторинга заболеваний сетчатки, таких как глаукома, отек макулы, макулярного отверстия, центральная серозная хориоретинопатия, возрастноя дегенерация желтого пятна, эпиретинальных мембран, оптических дисков, фовеа и опухолей хориоидеи [5, 53‑59]. Кроме того, способность ОКТ выполнять визуализацию в реальном времени также используется для изучения динамических характеристик сетчатки, включая лазерные травмы сетчатки [60]. Изображения могут быть проанализированы в количественном аспекте и обработаны с помощью интеллектуальных алгоритмов для извлечения функций, например, сетчатки или толщины слоя нервных волокон сетчатки [61‑64]. Чтобы предоставить томографические данные для интерпретации в альтернативных формах, были разработаны карты и дисплей-методы.
ОКТ особенно перспективна для диагностики и мониторинга таких заболеваний, как глаукома или отек макулы, связанный с диабетической ретинопатией, поскольку может обеспечить количественную информацию патологии сетчатки, которая является индикатором прогрессирования заболевания. Оптическая томография также перспективна для выявления и диагностики ранних стадий заболевания еще до того, как появляются физические симптомы и происходит необратимая потеря зрения.
Обсуждение
Маловероятно, что ОКТ может заменить эксцизионную биопсию и гистологию. Тем не менее, с точки зрения скрининга и диагностики новообразований, мы ожидаем, что ОКТ может быть использована, чтобы направлять стандартную эксцизионную биопсию для уменьшения ошибок выборки и ложноотрицательных результатов. Это может повысить точность биопсии, а также уменьшить само количество биопсий, что дает экономию. После проведения более обширных клинических исследований ОКТ может быть использована для диагностики ранних неопластических изменений в определенных ситуациях. Данное приложение более сложно, так как предполагает постановку диагноза на основе ОКТ, а не обычной патологии, и возможно только в ограниченных клинических ситуациях. Если такие приложения будут успешными, то с помощью ОКТ можно будет получать диагностическую информацию для моментального принятия решения о лечении, отыскать сценарии, при которых ОКТ может быть использована в режиме реального времени для хирургического руководства. Интеграция диагностики и лечения может улучшить исход и уменьшить количество посещений пациентов, позволяя снизить расходы на здравоохранение.
Авторы: Джеймс Г. Фудзимото, Костас Питри, Стивен Боппарт, Марк Бжезинский
ДРУГИЕ СТАТЬИОКТ глаза (оптическая когерентная томография)
Оптическая когерентная томография — бесконтактный метод исследования структур глаза, основой которого является низкокогерентная интерферометрия. В результате обследования врач получает 2-х или трехмерное изображение глазного дна.
Метод базируется на принципе низкогеретной интерферометрии. На исследуемую область направляется излучение, которое проходя через ту или иную ткань организма отражается особым образом — в зависимости от оптических ее свойств. Томограф оценивает параметры световых сигналов, которые отражаются от тканей и формируют изображения глаза в поперечном срезе. Разрешение составляет около 10 мк., что позволяет получить снимки хорошего качества.
Этот метод схож с тем, который применяют УЗИ-диагностике при А-режиме. Но в ходе окт глаза используют когерентное инфракрасное излучение с длиной волны 820 нм., а не звуковую волну.

Как проводится томография глаз
Оптическая когерентная томография глаза не предполагает специальной подготовки. Единственная особенность состоит в том, что пациенту закапывают капли-медриатики непосредственно перед тем, как провести такое обследование. Искусственное расширение зрачка дает возможность получить более качественные снимки.
До сканирования необходимо настроить оборудование. Пациента просят сесть напротив томографа и задержать взгляд на мерцающей красной точке. Затем камеру располагают всё ближе до того момента, пока сетчатка глаза не появится на экране. Теперь нужно зафиксировать камеру и настроить чёткость. В том случае, когда пациент в силу особенностей зрения не может сфокусироваться на красной точке, применяют внешний свет. От обследуемого требуется смотреть вперёд и не моргать.
После этого томограф проводит сканирование, которое длится до 2.5 секунд. Цифровые фотографии попадают в компьютер врача, где их очищают от шума и происходит расшифровка.
Показания
Показаниями к проведению обследования считается наличие у пациента:
- помутнений роговицы различной этиологии;
- передних увеопатий;
- тракционного витреомакулярного синдрома;
- разрыва, дистрофии и отека макулы;
- пигментного ретинита
- глаукомы;
- дистрофических изменений сетчатки;
- заболеваний зрительного нерва;
- тромбоза центральной вены сетчатки.
Кроме того, ОКТ использую после лечения методом рефракционной хирургии для контроля восстановления.
Особенности метода
Исследование не назначают людям, которые затрудняются удерживать взгляд в неподвижности во время работы томографа. Когда имеет место помутнение сред глаза, то лучше рассмотреть другие варианты диагностики, потому что метод томографии не сможет предоставить снимки высокого качества. ОКТ стоит отложить на время, если пациенту недавно проводили гониоскопию или офтальмоскопию с применением контактной среды. Проводить обследования на томографе можно после того, как раствор полностью вымоется из области конъюнктивы.
Как “читают” снимки
Интерпретацию полученных изображений проводит врач. Он оценивает внешний контур глазных структур, состояние тканей самих по себе и их взаимодействие с соседними. Также по снимкам можно сделать вывод об ухудшении оптических свойств некоторых сред, локализации новообразований. В ходе ОКТ врач производит все необходимые замеры: толщину клеточных слоёв, объёмы тех или иных структур. В итоге получается полноценная карта интересующей области глаза.
- Оптическая когерентная томография роговицы помогает узнать ее толщину по всей поверхности бесконтактным способом, что в некоторых ситуациях является предпочтительным. Например, при повреждении роговичного слоя.
- Оптическая когерентная томография сетчатки предоставляет качественные снимки всех ретинальных слоёв и позволяет диагностировать состояние макулы. Различные патологии этой области (в том числе разрывы) характеры для людей пожилого возраста. Преимущество окт сетчатки глаза в возможности увидеть признаки заболевания на раннем этапе.
- Хорошо просматривается на томограммах зрительный нерв. Врачи имеют возможность определить его толщину, уточнить состояние нервных волокон.
Большое количество клинических случаев описано в книге “Оптическая когерентная томография + ангиография глаза”, автором которой стал российский офтальмолог Б.М. Азнабаев.
Важную роль в интерпретации снимков играет квалификация врача. От того, насколько правильно будут прочитаны снимки, описаны все патологические очаги и установлено их расположение зависит точность конечного диагноза и эффективность лечения.
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе