Условия образования гемоглобина
Особенности структуры гемоглобина. Формы гемоглобина. Свойства гемоглобина. Этапы образования гемоглобина.
Главный белок эритроцитов – гемоглобин (Нb), он включает в свой состав гем с катионом железа, а его глобин содержит 4 полипептидных цепи.
Среди аминокислот глобина преобладают лейцин, валин, лизин (на их долю приходится до 1/3 всех мономеров). В норме уровень Нb в крови у мужчин – 130-160г/л, у женщин – 120-140 г/л. В разные периоды жизни зародыша и ребёнка активно работают различные гены, ответственные за синтез нескольких полипептидных цепей глобина. Выделяют 6 субъединиц: α, β, γ, δ, ε, ζ (альфа, бета, гамма, дельта, эпсилон, дзета соответственно). Первая и последняя из них содержат по 141, а остальные по 146 аминокислотных остатков. Друг от друга они отличаются не только количеством мономеров, но и их составом. Принцип образования вторичной структуры у всех цепей однотипен: они сильно (до 75% длины) спирализованы за счёт водородных связей. Компактная укладка в пространстве подобного образования приводит к возникновению третичной структуры; причем при этом создаётся карман, куда и вкладывается гем. Возникший комплекс сохраняется с помощью приблизительно 60 гидрофобных взаимодействий между белком и простетической группой. Подобная глобула объединяется с 3 сходными субъединицами, образуя четвертичную структуру. Получается белок, составленный из 4 полипептидных цепей (гетерогенный тетрамер), имеющий форму тетраэдра. Высокая растворимость Нb сохраняется только при наличии различных пар цепей. Если же происходит объединение одинаковых, — следует быстрая денатурация, укорачивающая жизнь эритроцита.
В зависимости от характера включённых протомеров различают следующие виды нормальных гемоглобинов. В первые 20 суток существования эмбриона в ретикулоцитах образуется Hb P (Primitive) в виде двух вариантов: Hb Gower 1, состоящий из дзета- и эпсилон-цепей, соединенных попарно, и Hb Gower 2, в котором дзета-последовательности уже заменены на альфа. Переключение генеза одного вида структуры на другой осуществляется медленно: вначале появляются отдельные клетки, продуцирующие иной вариант. Они дают стимул клонам новых клеток, синтезирующих другой вид полипептида. Позднее эритробласты начинают преобладать и постепенно вытесняют старые. На 8-й неделе жизни зародыша включается синтез гемоглобина F=α2γ2, по мере же приближения акта родов появляются ретикулоциты, содержащие HbA=α2β2. У новорожденных на его долю приходится 20-30%, у здорового взрослого человека его вклад составляет 96–98% от общей массы этого белка. Кроме того, в отдельных эритроцитах присутствуют гемоглобины HbA2=α2δ2 (1,5 – 3%) и фетальный HbF (обычно не больше 2%). Однако в некоторых регионах, в том числе и у аборигенов Забайкалья концентрация последнего вида повышена до 4% (в норме).
Формы гемоглобина
Описаны следующие формы данного гемопротеида, получающиеся после взаимодействия, в первую очередь, с газами и другими соединениями.
Образовавшийся карбоксигемоглобин не способен присоединять к себе кислород, а угарного газа может связывать 4 молекулы.
Свойства гемоглобина
Все известные гемопротеиды (Раздел I) близки по строению не только простетической группы, но и апопротеина. Определённая общность в пространственной укладке обусловливает и сходство в функционировании – взаимодействии с газами, в основном с кислородом, СО2, СО, NО. Главное свойство гемоглобина – способность обратимо присоединять в лёгких (до 94%) и эффективно отдавать в тканях кислород. Но поистине уникальным для того белка является сочетание прочности связывания кислорода при высоких его парциальных напряжениях и лёгкости диссоциации этого комплекса в области пониженных давлений. Кроме того скорость распада оксигемоглобина зависит от температуры, pH среды. При накоплении углекислоты, лактата и других кислых продуктов происходит более быстрая отдача кислорода (эффект Бора). Также действует и лихорадка. При алкалозе, гипотермии следует обратное смещение, улучшаются условия насыщения Hb кислородом в лёгких, но полнота выхода газа в ткани уменьшается. Подобное явление наблюдается при гипервентиляции, замерзании и т.д. Попадая в условия острой гипоксии, эритроциты активируют гликолиз, что сопровождается увеличением содержания 2,3-ДФГК, которая снижает сродство гемопротеида к кислороду, активирует дезоксигенацию крови в тканях. Интересно, что фетальный гемоглобин с ДФГК не взаимодействует, сохраняя поэтому повышенное сродство к кислороду и артериальной, и венозной крови.
Этапы образования гемоглобина
Синтез гемоглобина, как любого другого белка, требует наличия матрицы (иРНК), которая продуцируется в ядре. Эритроцит, как известно, не имеет никаких органоидов; следовательно, формирование гемовых протеинов возможно лишь в клетках-предшественниках (эритробластах, заканчиваясь в ретикулоцитах). Этот процесс у эмбрионов осуществляется в печени, селезенке, а у взрослых в костном мозге плоских костей, в которых кроветворные стволовые клетки непрерывно размножаются и генерируют предшественников всех типов клеток крови (эритроцитов, лейкоцитов, тромбоцитов). Формирование первых регулируется эритропоэтином почек. Параллельно с генезом глобина происходит образование гема, облигатным компонентом которого служат катионы железа.
ПОИСК
В 1937 г. М. В. Хилл разработал оригинальный метод измерения кислорода, выделяемого изолированными хлоропластами. Суспензию хлоропластов смешивают в темноте с гемоглобином и помещают в трубку Тунберга. Затем под вакуумом удаляют находящийся в растворе кислород и освещают препарат. Кислород, выделяющийся в ходе фотосинтетических процессов, вступает в реакцию с гемоглобином. Образование оксигемоглобина, которое сопровождается изменением спектральных характеристик раствора, прослеживают спектрометрически. Метод обладает хорошим быстродействием, но он наиболее чувствителен к изменениям парциального давления кислорода в сравнительно узком диапазоне — от 2,66 до 40 кПа (2—30 мм рт. ст.). Недостаток метода заключается также в том, что помимо изменения спектральных характеристик гемоглобина в ходе реакции образования оксигемоглобина освещение суспензии существенно влияет на оптические параметры самих хлоропластов. Это может исказить данные экспериментов. Кроме того, гемоглобин, адсорбируясь на мембранах хлоропластов, несколько изменяет кинетику процессов выделения кислорода. [c.193] Образование гемоглобина, составная часть 11 ферментов [c.278]Комплексные соединения широко распространены в природе, играют важную роль в биологических процессах. Достаточно упомянуть гемоглобин крови (комплексообразователь Ре +) и хлорофилл зеленых растений (комплексообразователь Mg + ), витамин В12 (комплексообразователь Со + ). Комплексные соединения и комп-лексообразование находят самое разнообразное практическое применение. Образование комплексов используется при умягчении жесткой воды и растворении камней в почках важнейшую роль играют комплексные соединения в химическом анализе, производстве металлов и т. д. [c.76]
Оксид углерода (СО). Ядовитый газ, не имеющий запаха и цвета. Образуется при горении богатой смеси (а< I) вследствие недостатка кислорода для полного окисления топлива. Его концентрация в выпускных газах двигателей с принудительным воспламенением может достигать 6% по объему. В дизелях всегда имеется избыток кислорода (а > 1), и концентрация оксида углерода составляет 0,2—0,3%. Сохраняется в атмосфере около 3—4 месяцев. Предельно допустимые концентрации в воздухе рабочих помещений —20 мг/м в населенных пунктах — 3 мг/ м (максимальная разовая) и 1 мг/м — среднесуточная. Оксид углерода, соединяясь с гемоглобином крови, дает устойчивое соединение — карбоксигемоглобин, затрудняющий процесс газообмена в клетках, что приводит к кислородному голоданию (сродство гемоглобина с оксидом углерода примерно в 210 раз выше его сродства с кислородом). Поэтому прямое воздействие состоит в уменьшении способности крови переносить кислород. Процесс образования карбоксигемоглобина обратимый. После прекращения вдыхания оксида углерода кровь пострадавшего начинает очищаться от него наполовину за каждые 3—4 часа. [c.329]
Молекула гемоглобина построена как тетрамер из двух аналогичных глобинов (полипептидных цепей) неодинаковой длины. В центре белка находится простетическая группа, образованная [c.359]
Активация молекулярного кислорода за счет комплексообразования имеет большое биохимическое значение. Классическим примером является присоединение кислорода к гемоглобину (см. стр. 625). Образование комплексов с участием молекул N2 в качестве лигандов играет важную роль при фиксации атмосферного азота клубеньковыми растениями, а также в процессе каталитического синтеза аммиака. По-видимому, в естественных условиях (обычные температура и давление) биохимическое связывание атмосферного азота осуществляется с участием комплексов Ре и Мо. [c.464]
Результат опыта. Прибавление- насыщенного раствора сульфата аммония к гидрофобному золю немедленно вызывает его коагуляцию — в пробирке наблюдается образование и оседание осадка дисперсной фазы золя. Прибавление к раствору альбумина или гемоглобина насыщенного раствора сульфата аммония не вызывает коагуляции — обе пробирки остаются без изменений. Следовательно, гидрофильные коллоиды обладают большей устойчивостью к электролитной коагуляции. [c.231]
Однако наиболее мощными буферными системами крови являются так называемые гемоглобиновые буферы, которые составляют примерно 75% всей буферной емкости крови. Сущность действия этих буферных систем заключается в следующем. Кислые продукты обмена веществ взаимодействуют с калиевой солью гемоглобина с образованием эквивалентного количества их калиевых солей и свободного гемоглобина, обладающего свойствами слабой органической кислоты. Таким образом, подкисления крови ие происходит. [c.216]
Каталитическими свойствами обладают ионы металлов и образованные ими комплексные соединения. В природе катализаторы, являющиеся комплексными соединениями, выполняют важные функции. Например, комплексное соединение кобальта (витамин В12) необходимо для процессов кроветворения металлопорфирины железа входят в состав гемоглобина и ряда ферментов. [c.298]
Окись углерода очень ядовита. Ее токсическое действие объясняется образованием стойкого соединения с гемоглобином крови, в результате чего кровь теряет способность передавать кислород тканям организма. [c.89]
Мягкие кислоты связывают мягкие основания за счет ковалентных связей, жесткие кислоты связывают жесткие основания за счет ионной связи с образованием устойчивых соединений. Это обстоятельство используется в практических целях. В частности, она объясняет, почему алюминий встречается в природе в виде оксида, гидроксида и силикатов, кальций —в виде карбоната медь, ртуть — в виде сульфидов. Металлы переходных элементов VIH группы периодической системы, как мягкие кислоты, катализируют реакции, в которых принимают участие умеренно мягкие основания (оксид углерода). Другие более мягкие основания (соединения мышьяка и фосфора) служёт каталитическими ядами, так как они образуют более прочные соединения с этими металлами и блокируют их активные центры. Этим же объясняется ядовитость СО для человека. СО образует с Ре (II) гемоглобина крови более устойчивое соединение, чем кислород. Аналогичную роль играют ионы тяжелых металлов (РЬ +, Hg + и др.), которые, взаимодействуя с SH-группами физиологически важных соединений, выключают их функцию. [c.287]
Окись углерода — бесцветный газ, не имеющий запаха, малорастворим в воде. Крайне ядовита. Небольшие количества СО. попадающие в воздух и вдыхаемые человеком, вызывают головокружение, тошноту. Вдыхание воздуха, содержащего 0,3% СО, может быстро вызвать смерть. Ядовитое действие окиси углерода объясняется образованием стойкого соединения ее с гемоглобином крови, вследствие чего кровь теряет способность передавать кислород тканям организма. [c.436]
В самой общей форме характер действия металлических ионов на ферментные системы можно разделить на следующие виды 1) образование специфической структуры активного центра 2) образование структуры в системе активный центр-субстрат 3) поляризация групп активного центра и субстрата. Благодаря этому могут осуществляться процессы 1) воздействия на определенные группы субстрата — атаки молекул воды и других у ферментов типа гидролаз и фосфорилаз 2) процессы переноса (электронов и групп атомов) 3) процессы фиксации и переноса без глубоких изменений в переносимой молекуле (перенос кислорода гемоглобином). [c.363]
Ряд белковых макромолекул могут соединяться друг с другом с образованием относительно крупных структур. Примером является гемоглобин, представляющий собой систему из четырех макромолекул. Именно такое сочетание компонентов гемоглобина обеспечивает присоединение и последующий транспорт кислорода в организме. [c.426]
Оксид углерода —очень ядовитый газ, он образуется при неполном сгорании бензина. Его токсичность обусловлена тем, что он прочно связывается с гемоглобином крови, и поэтому препятствует переносу кислорода и диоксида углерода в организме. Хотя в больших городах концентрация. оксида углерода возрастает вследствие развития автомобильного транспорта, суммарный его уровень в природе остается приблизительно постоянным, благодаря тому что некоторые почвенные организмы способны окислять его до диоксида углерода — естественной составляющей атмосферы Земли. В последние годы ставятся опыты по выводу выхлопных газов автомобилей через горелки с катализаторами, в которых происходит полное сгорание оксида углерода с образованием диоксида углерода [c.333]
В последние годы М. Перутц, Д. Кендрью и другие исследователи установили, что для части глобулярных белков четвертичная структура создается отнюдь не образованием нескольких пластов субъединиц, а за счет их своеобразного расположения в пространстве. Так, четвертичная структура гемоглобина очень проста и симметрична четыре субъединицы расположены как бы на вершинах тетраэдра. [c.179]
Некоторые белковые макромолекулы могут соединяться друг с другом и образовывать относительно крупные агрегаты. Подобные полимерные образования белков, где мономерами являются макромолекулы белка, называются четвертичными структурами. Примером такого белка является гемоглобин, который представляет комплекс из четырех макромолекул (рис. 4). Оказывается, что только при такой структуре гемоглобин способен присоединять и транспортировать кислород в организме. [c.20]
Биологические функции никеля еще мало исследованы. Есть основания считать его микроэлементом. В организмах никель активирует многие ферменты, усиливает синтез серосодержащих аминокислот. При одновременном присутствии железа и никеля улучшается образование гемоглобина в крови животных. [c.431]
Окись азота также дает свои электроны (в частности, и непарный электрон) на образования комплексов с заселением вакансий центрального атома. Молекулы кислорода соединяются с гемоглобином с участием своих непарных антисвязевых электронов. [c.210]
При недостатке меди в продуктах питания у животных развивается заболевание — лизуха (потеря аппетита, уменьшение веса, анемия, гибель). Введение чрезмерных количеств меди вызывает острые отравления (гемолиз, деструкцию головного мозга, печени, ночек и нарушения процесса кроветворения). Особенно большое значение имеет медь для процессов кроветворения. В отсутствие меди невозможно образование гемоглобина. Она активирует реакцию образования гема железа и таким образом мобилизует резервы железа из крови. В процессе синтеза гемоглобина медь совместно с железом образует медь — железо — нуклеопротеиновые комплексы — предшественники гемоглобина. Образование такого комплекса, как считают, снижает энергию активации реакции образования гемоглобина. Присутствие меди необходимо для образования не только гемоглобина, но и других гемоиорфкринов. Концентрируясь в костном мозге, медь принимает непосредственное участие в эритропоэзе в присутствии меди ускоряется созревание ретикулоцитов и их превращение в эритроциты. Имеются данные о том, что в минимальных дозах она препятствует возникновению инфекционных заболеваний у человека и принимает участие в процессах пигментации, влияя на образование меланина. В старости волосы седеющего человека содержат меньше меди, чем в молодом возрасте. При анемиях (анемия Адиссона — Бальмера) уровень меди в крови растет, а в депонирующих органах падает, т. е. явление обратное акобальтозу. При постгеморрагической анемии уровень меди в крови снижается параллельно содержанию железа. Результаты некоторых опытов указывают на накопление меди в раковых опухолях. [c.284]
М.203, Кар бокси гемоглобииообразователн при 1 0 1а, 1,ании в организм связывают красящий пигмент крови — гемоглобин— образованием нового соединения — [г )бо,ч.сигемоглобнна, который ие способен присоединять кислород и переносить его к тканям. [c.67]
При генетическом дефекте глюкозо-6-фосфат-дегидрогеназы и приеме некоторых лекарств, являющихся сильными окислителями, потенциала глутатионовой защиты может оказаться недостаточно. Это приводит к увеличению содержания в клетках активных форм кислорода, вызывающих окисление SH-rpynn молекул гемоглобина. Образование [c.313]
Оксид углерода не оказывает, по-видимому, никакого воз действия на поверхности материалов, жизнедеятельность выс ших растений. Большие концентрации его могут вызвать фи знологические и патологические изменения, а также смерть Это токсичный газ, вызывающий головную боль, головокруже ние, рвоту, одышку, замедленное дыхание, судорогу, гибель Поэтому установлены его жесткие предельно допустимые кон центрации в воздухе рабочих помещений — 20 мг/м , населен ных пунктов — 3 мг/м максимально разовая, 1 мг/м средне суточная. Оксид углерода, соединяясь с гемоглобином, образу ет карбоксигемоглобин СОНЬ. Сродство гемоглобина с оксидом углерода примерно в 210 раз выше его сродства с кислородом Процесс образования в крови СОНЬ — обратимый. Оксид угле рода после прекращения его вдыхания постепенно выделяется, и кровь человека очищается от него наполовину за каждые 3— [c.21]
Как уже упоминалось, сомнительно, чтобы большинство элементов входило в первичные соединения нефти. Однако ванадий, медь, никель и отчасти железо образуют особую группу. Эти металлы способны давать комплексы с ниррольными пигментами, происходящими из хлорофилла и гемоглобина, с образованием устойчивых соединений, растворимых в нефти, [c.45]
Метаболизм аминокислот, жирных кислот. Синтез гемоглобина, участвует в поддержании уровня глюкозы в крови Образование красных кровяных клеток, работа нервной ситемы [c.271]
Гемоглобин представляет собой образование из четырех миоглобино-подобных молекул (рис. 20-26). Структуры молекул миоглобина и гемоглобина удалось установить лишь в последнее десятилетие методом дифракции рентгеновских лучей. Было показано, что четыре компонента- [c.261]
Таким образом, глобин предохраняет железо гема от окисления и делает возможным образование оксигенерированного гемоглобина. [c.144]
Ассоциация биологически важных молекул с образованием комплексов лежит в основе построения надмолекулярных структур клетки и является важным этапом в функционировании белков и нуклеиновых кислот в живых организмах. Например, перенос кислорода из легких в различные органы, потребляющие кислород, происходит с помощью специального белка, содержащегося в красных кровяных тельцах — эритроцитах, так называемого гемоглобина, который способен образовывать комплекс с кислородом. В легких происходит ассоциация кислорода с гемоглобином (НЬ) с образованием комплекса НЬ+ + Оа ч НЬОа. В органах, потребляющих кислород, комплексдиссо- циирует, и выделившийся кислород расходуется на реакции окисления. [c.226]
Кобальт — жизненно важный для человека и животных элемент. Участвует в процессах кровотворения, образования гемоглобина. Является составной частью одного из витаминов (В ). [c.549]
Химические свойства. Кислород, как и фтор, образует соединения со всеми элементами, кроме гелия, неона и аргона. Достаточно большая энергия связи между атомами в молекуле О2 проявляется в высоких значениях энергии активации (см. рис. 40) реакций с участием кислорода, что требует предварительного нагревания или введения катализатора для их осуществления. Так, фосфор сгорает в кислороде (с образованием РгРз) прн нагревании до 60°С, сера (в SO2) — до 250, водород (в Н2О) —выше 300 и графит (в СО2) — до 750°С. Но некоторые вещества (многие металлы, N0, гемоглобин крови) взаимодействуют с кислородом и при комнатной температуре. [c.231]
Наиболее мощными буферными системами крови являются гемо-глобиновый и оксигемоглобиновый буферы, которые составляют примерно 75% всей буферной емкости крови. Буферные свойства гемоглобина по своему механизму действия идентичны белковым буферным системам кислые продукты обмена веществ взаимодействуют с калиевой солью гемоглобина с образованием эквивалентного количества их калиевых солей и свободного гемоглобина, обладающего свойством слабой органической кислоты. Кроме того, система окси-гемоглобин — гемоглобин участвует в еще одном своеобразном механизме поддержания постоянства pH крови. Как известно, венозная кровь содержит большие количества углекислоты в виде бикарбонатов, а также СО2, связанной с гемоглобином. Через легкие углекислота выделяется в воздух однако сдвига pH крови в щелочную сторону не происходит, так как образующийся оксигемоглобин является более сильной кислотой, чем гемоглобин. В тканях, в артериальной крови под влиянием низкого парциального давления кислорода оксигемоглобин диссоциирует и кислород диффундирует в ткани. Образующийся при этом гемоглобин, однако, не обусловливает изменения pH крови в щелочную сторону, так как в кровь из тканей поступает углекислота. [c.82]
Наиболее знакомый нам гемоглобин — металлопротеин со значительно большей молекулярной массой, чем миоглобин, состоит из двух пар субъединиц, в каждой из которых имеется по одному атому железа (см. гл. 13), заключенному в порфириновый цикл. Как и все переносчики О2, гемоглобин может существовать в двух формах диоксигенированной (диоксиформа) и оксигенированной (оксиформа). В первой из них железо (II) — высокоспиновый ион (s = 3/2), он не входит в порфириновое окно (или полость ), а возвышается над ним. Во второй форме (после присоединения кислорода) по перпендикулярной схеме Fe (И) характеризуется нулевым спином (s = 0) и находится в плоскости, образованной четырьмя атомами пиррольного азота. По-видимому, размеры иона Fe + в высокоспиновом и низкоспиновом состояниях разные и координационное число меняется от 5 до 6—7. Поглощение кислорода гемоглобином происходит при определенном pH раствора, в котором растворен кислород. [c.570]
Железо — второй по распространенности в природе металл, после алюминия. Промышленное значение в качестве железных руд имеют главным образом красный железняк РегОз и магнитный железняк Рез04. По запасу железных руд наша страна занимает первое место в мире. Они залегают на Урале, в Курской области, в Криворожье и в других местах. Железо входит в состав растительных и животных организмов. Оно содержится в гемоглобине крови, переносящем кислород из легких в ткани, и необходимо для образования в растениях хлорофилла, хотя в состав его не входит. При недостатке железа в почве растения перестают образовывать хлорофилл и утрачивают зеленую окраску. [c.157]
При сжатии пленок, образованных глобулярными белками (например, альбумином, глобулином, гемоглобином, трипсином и др.), вплоть до давления около 20 мН/м изотермы двухмерного давления вполне обратимы. При несколько большем сжатии пленок, когда площадь на одну аминокислотную группу составляет приближенно 0,17 нм , дву. с-мерное давление резко возрастает и в пленках происходят необратимые изменения они могут приобретать специфическую нерастворимость и своеобразные структурно-механические (реологические) свойства во многом связанные с изменением конформации и структуры белковых молекул. Более сильное сжатие пленом (до 0,05—0,1 нм на группу) приводит к их коллапсу — образованию складок (а возможно, и по-лимолекулярпых слоев) и отрыву от поверхности. [c.66]
47. Виды гемоглобина и его соединения, их физиологическое значение.
Гемоглобин относится к числу важнейших дыхательных белков, принимающих участие в переносе кислорода от легких к тканям. Он является основным компонентом эритроцитов крови, в каждом из них содержится примерно 280 млн молекул гемоглобина.
Гемоглобин является сложным белком, который относится к классу хромопротеинов и состоит из двух компонентов:
железосодержащего гема – 4 %;
белка глобина – 96 %.
Гем является комплексным соединением порфирина с железом. Это соединение довольно неустойчивое и легко превращается либо в гематин, либо в гемин. Строение гема идентично для гемоглобина всех видов животных. Отличия связаны со свойствами белкового компонента, который представлен двумя парами полипептидных цепей. Различают HbA, HbF, HbP формы гемоглобина.
В крови взрослого человека содержится до 95–98 % гемоглобина HbA. Его молекула включает в себя 2 α– и 2 β-полипептидные цепи. Фетальный гемоглобин в норме встречается только у новорожденных. Кроме нормальных типов гемоглобина, существуют и аномальные, которые вырабатываются под влиянием генных мутаций на уровне структурных и регуляторных генов.
Внутри эритроцита молекулы гемоглобина распространяются по-разному. Вблизи мембраны они лежат к ней перпендикулярно, что улучшает взаимодействие гемоглобина с кислородом. В центре клетки они лежат более хаотично. У мужчин в норме содержание гемоглобина примерно 130–160 г/л, а у женщин – 120–140 г/л.
Выделяют четыре формы гемоглобина:
Оксигемоглобин - содержит двухвалентное железо и способен связывать кислород. Он переносит газ к тканям и органам.
Метгемоглобин - содержит трехвалентное железо, не вступает в обратимую реакцию с кислородом и обеспечивает его транспорт.
Карбоксигемоглобин - образует соединение с угарным газом. Он обладает высоким сродством с окисью углерода, поэтому комплекс распадается медленно. Это обусловливает высокую ядовитость угарного газа.
Миоглобин - по структуре близок к гемоглобину и находится в мышцах, особенно в сердечной. Он связывает кислород, образуя депо, которое используется организмом при снижении кислородной емкости крови. За счет миоглобина происходит обеспечение кислородом работающих мышц.
Гемоглобин выполняет дыхательную и буферную функции. 1 моль гемоглобина способен связать 4 моля кислорода, а 1 г – 1,345 мл газа. Кислородная емкость крови – максимальное количество кислорода, которое может находиться в 100 мл крови. При выполнении дыхательной функции молекула гемоглобина изменяется в размерах. Соотношение между гемоглобином и оксигемоглобином зависит от степени парциального давления в крови. Буферная функция связана с регуляцией pH крови.
У взрослых процесс образования эритроцитов – эритропоэз, происходит в красном костном мозге плоских костей. Они образуются из ядерных стволовых клеток, проходя стадии проэритробласта, эритробласта, нормобласта, ретикулоцитов II, III, IV. Этот процесс происходит в эритробластических островках, содержащих эритроидные клетки и макрофаги костного мозга. Макрофаги выполняют следующие функции:
Фагоцитируют вышедшие из нормобластов ядра.
Обеспечивают эритробласты ферритином, содержащим железо.
Выделяют эритропоэтины.
Создают благоприятные условия для развития эритробластов.
Созревание эритроцитов занимает около 5 дней. Из костного мозга в кровь поступают ретикулоциты, дозревающие до эритроцитов в течение суток. По их количеству в крови судят об интенсивности эритропоэза. В сутки образуется 60-80 тысяч эритроцитов на каждый микролитр крови. Т.е. ежесуточно обновляется около 1,5% эритроцитов.
Основным гуморальным регулятором эритропоэза является гормон эритропоэтин. В основном он образуется в почках. Небольшое его количество синтезируется макрофагами. Интенсивность синтеза эритропоэтина зависит от содержания кислорода в тканях почек. При их достаточной оксигенации ген, регулирующий синтез эритропоэтина, блокируется. При недостатке кислорода, он активируется ферментами. Начинается усиленный синтез эритропоэтина. Стимулируют его синтез в почках адреналин, норадреналин, глюкокортикоиды, андрогены. Поэтому количество эритроцитов в крови возрастает в горах, при кровопотерях, стрессе и т.д. Торможение эритропоэза осуществляется его ингибиторами. Они образуются при увеличении количества эритроцитов выше нормы, повышенном содержании кислорода в крови. Эстрогены также тормозят эритропоэз. Поэтому в крови женщин эритроцитов меньше, чем у мужчин. Важное значение для эритропоэза имеют витамины В6, В12 и фолиевая кислота. Витамин В12 называют внешним фактором кроветворения. Однако для его всасывания в кишечнике необходим внутренний фактор Кастла, вырабатываемый слизистой желудка. При его отсутствии развивается злокачественная анемия.
Гранулоциты и моноциты образуются из миелобластов через стадии промиелоцита, эозинофильных, нейтрофильных, базофильных миелоцитов или монобластов. Из монобластов сразу образуется моноциты, а из миелоцитовмелоцитов метамиелоциты, затем палочкоядерные гранулоциты и, наконец, сегментоядерные клетки. Гранулоцитопоэз стимулируют гранулоцитарные колониестимуцлирующие факторы (КСФ-Г), а моноцитопоэз – моноцитарный колониестимулирующий фактор (КСФ-М). Угнетают гранулоцитопоэз кейлоны, выделяющиеся зрелыми нейтрофилами. Кейлоны тормозят синтез ДНК в стволовых клетках белого ростка костного мозга. Задерживают созревание гранулоцитов и моноцитов простагландины Е, интерфероны.
Строение гемоглобина и влияние его концентрации в крови на состояние здоровья человека
Гемоглобином называется сложный белок, состоящий из двух компонентов — белка глобина и соединения железа — геммы. Атомы железа придают крови красный оттенок. Это и есть строение гемоглобина.
Гемоглобин, который не связан с эритроцитами, очень токсичен и провоцирует развитие острой недостаточности почек.
Данное вещество участвует в процессах транспорта кислорода и углекислого газа между системой дыхания и другими тканями и органами в организме человека, а также поддерживает кислотный баланс крови.
Это важно! При недостаточной концентрации гемоглобина нарушается перенос кислорода, поэтому клетки страдают от его недостатка, нарушается их работа и обмен веществ в них.
Известные формы
При соединении гемоглобина с глюкозой формируется гликозированный гемоглобин. Повышение его концентрации начинается при избыточном содержании глюкозы в крови, например, при сахарном диабете.
Всемирная Организация Здравоохранения официально признала анализы на уровень гликозированного гемоглобина самым эффективными методами диагностики сахарного диабета. Пациентам с такой патологией требуется диагностировать строение гемоглобина, биохимия для них проводится не реже одного раза в три месяца.
Специалисты выделяют ещё один тип гемоглобина — это фетальный гемоглобин, который отличается от нормального по своему строению и функциям. Данное вещество характерно для новорожденных, а содержание его в крови может доходить до 80%. К первому году жизни ребенка фетальный гемоглобин разрушается и почти целиком заменяется характерным для взрослых людей гемоглобином. Фетальный гемоглобин считается нормой для детей, но у взрослого человека его наличие говорит о развитии тяжелых заболеваний.
Строение гемоглобина
В состав молекул гемоглобина входят четыре субъединицы. Каждой из них соответствует конкретная полипептидная нить, которая соединяется с гемом. На эти четыре субъединицы приходится две а- и две р- цепи. Всего гемоглобин содержит 574 единицы аминокислоты.
Это важно! Спиральные отрезки цепей занимают 75% белковой молекулы, они соединяются между собой не спиральными участками разной протяженности. Последующее усложнение структуры молекул развивается из-за изгибов и свертывания спиралек, поэтому формируется необычная форма в структуре каждой полипептидной цепи.
Плотная оболочка четырех субъединиц в пространстве является четвертичной структурой молекулы. Отдельные субъединицы держатся вместе благодаря электростатическому взаимодействию, и за счет формирования некоторых водородных связей. Специфические функции определяют строение, свойства гемоглобина.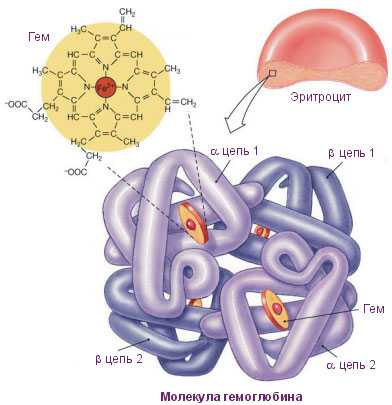
Гемоглобин реализует перенос кислорода, а концентрация этого вещества в крови разных животных зависит от количества и величины эритроцитов.
Понижение и повышение содержания гемоглобина, симптомы
Малокровие — это патологическое состояние, когда в крови снижается содержание эритроцитов — функционально полноценных кровяных клеток. Количественно это отклонение выражается степень уменьшения показателей гемоглобина в крови — это железосодержащий пигмент, придающий крови красную окраску.
Для пациента с недостатком гемоглобина характерен следующий внешний облик: бледность кожи на всем теле и побледнение видимых слизистых поверхностей.
При уменьшении концентрации по причине недостаточного поступления витамина В12 типичным является нарушение слизистой поверхности языка или по-другому глоссит — когда зык становится будто полированным, сильно болит и имеет ярко-красный оттенок. При некоторых разновидностях анемии с понижение концентрации гемоглобина из-за большого разрушения массы эритроцитов кожный покров начинает желтеть.
Это важно! На первых стадиях развития патологии клиническая симптоматика может проявляться слишком слабо или вообще не давать о себе знать. Малокровие сопутствует большому количеству болезней и часто бывает только одним из симптомов.
Также уровень гемоглобина в крови может подниматься, что также не хорошо для организма. Высокие показатели вещества формируются у людей, живущих в горах или у профессиональных альпинистов. Высокий гемоглобин для них норма, потому что он считается реакцией человеческого организма в качестве компенсации — так проходит приспособление к нехватке кислорода, содержащегося в воздухе при нормальных условиях.
Высокий гемоглобин является недостатком концентрации в крови витамина В12 и фолиевой кислоты. Такое нарушение носит злокачественный характер.
Процесс восстановления нормы гемоглобина при его повышении проводится при помощи терапии витамином В12. Если вовремя и правильно проводить терапию, то прогнозы отклонений становятся благоприятными. При запоздалом лечении, на полгода и дольше, симптоматика нарушения работы нервной системы может приобрести хроническое течение и остаться на всю последующую жизнь.
Высокая концентрация гемоглобина вызывает развитие сердечнососудистых болезней, для лечения которых потребуется применение медикаментов, которые способствуют разжижению крови и препятствуют образованию тромбов.
Оцените статью: (Пока нет голосов) Loading ...
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе