Оптическая когерентная томография
Оптическая когерентная томография: технология, ставшая реальностью
Оптическая когерентная томография (ОКТ) впервые была применена для визуализации глазного яблока более 20 лет назад и до сих пор остается незаменимым методом диагностики в офтальмологии. С помощью ОКТ стало возможно неинвазивно получать оптические срезы тканей с разрешением выше, чем у любого другого метода визуализации. Динамическое развитие метода привело к повышению его чувствительности, разрешающей способности, скорости сканирования. В настоящее время ОКТ активно применяется для диагностики, мониторинга и скринига заболеваний глазного яблока, а также для выполнения научных исследований. Совмещение современных технологий ОКТ и фотоакустических, спектроскопических, поляризационных, допплеро- и ангиографических, эластографических методов дало возможность оценивать не только морфологию тканей, но и их функциональное (физиологическое) и метаболическое состояние. Появились операционные микроскопы с функцией интраоперационного выполнения ОКТ. Представленные устройства могут быть использованы для визуализации как переднего, так и заднего отрезка глаза. В данном обзоре рассматривается развитие метода ОКТ, представлены данные о современных ОКТ-приборах в зависимости от их технологических характеристик и возможностей. Описаны методы функциональной ОКТ. Для цитирования: Захарова М.А., Куроедов А.В. Оптическая когерентная томография: технология, ставшая реальностью // РМЖ. Клиническая офтальмология. 2015. № 4. С. 204–211.Для цитирования: Захарова М.А., Куроедов А.В. Оптическая когерентная томография: технология, ставшая реальностью // РМЖ. Клиническая офтальмология. 2015. №4. С. 204-211
Optic coherent tomography - technology which became a reality Zaharova M.A., Kuroedov A.V. Mandryka Medicine and Clinical Center The Russian National Research Medical University named after N.I. Pirogov, Moscow Optical Coherence Tomography (OCT) was first applied for imaging of the eye more than two decades ago and still remains an irreplaceable method of diagnosis in ophthalmology. By OCT one can noninvasively obtain images of tissue with a resolution higher than by any other imaging method. Currently, the OCT is actively used for diagnosing, monitoring and screening of eye diseases as well as for scientific research. The combination of modern technology and optical coherence tomography with photoacoustic, spectroscopic, polarization, doppler and angiographic, elastographic methods made it possible to evaluate not only the morphology of the tissue, but also their physiological and metabolic functions. Recently microscopes with intraoperative function of the optical coherence tomography have appeared. These devices can be used for imaging of an anterior and posterior segment of the eye. In this review development of the method of optical coherence tomography is discussed, information on the current OCT devices depending on their technical characteristics and capabilities is provided. Key words: оptical coherence tomography (OCT), functional optical coherence tomography, intraoperative optical coherence tomography. For citation: Zaharova M.A., Kuroedov A.V. Optic coherent tomography - technology which became a reality. // RMJ. Clinical ophthalomology. 2015. № 4. P. 204–211.Статья посвящена применению оптической когерентной томографии в офтальмологии
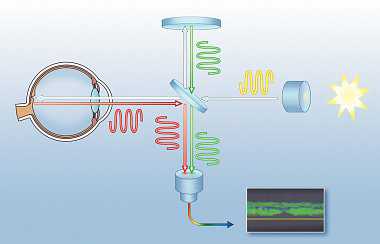 Оптическая когерентная томография (ОКТ) – это метод диагностики, который позволяет с высокой разрешающей способностью получать томографические срезы внутренних биологических систем. Название метода впервые приводится в работе коллектива из Массачусетского технологического университета, опубликованной в Science в 1991 г. Авторами были представлены томографические изображения, демонстрирующие in vitro перипапиллярную зону сетчатки и коронарную артерию [1]. Первые прижизненные исследования сетчатки и переднего отрезка глаза с помощью ОКТ были опубликованы в 1993 и 1994 гг. соответственно [2, 3]. В следующем году вышел ряд работ, посвященных применению метода для диагностики и мониторинга заболеваний макулярной области (в т. ч. отека макулы при сахарном диабете, макулярных отверстий, серозной хориоретинопатии) и глаукомы [5–10]. В 1994 г. разработанная технология ОКТ была передана зарубежному подразделению фирмы Carl Zeiss Inc. (Hamphrey Instruments, Dublin, США), и уже в 1996 г. была создана первая серийная система ОКТ, предназначенная для офтальмологической практики. Принцип метода ОКТ заключается в том, что световая волна направляется в ткани, где распространяется и отражается или рассеивается от внутренних слоев, которые имеют различные свойства. Получаемые томографические образы – это, по сути, зависимость интенсивности рассеянного или отраженного от структур внутри тканей сигнала от расстояния до них. Процесс построения изображений можно рассматривать следующим образом: на ткань направляется сигнал от источника, и последовательно измеряется интенсивность возвращающегося сигнала через определенные промежутки времени. Так как скорость распространения сигнала известна, то по этому показателю и времени его прохождения определяется расстояние. Таким образом, получается одномерная томограмма (А-скан). Если последовательно смещаться по одной из оси (вертикальной, горизонтальной, косой) и повторять предыдущие измерения, то можно получить двухмерную томограмму. Если последовательно смещаться еще по одной оси, то можно получить набор таких срезов, или объемную томограмму [10]. В ОКТ-системах применяется интерферометрия слабой когерентности. Интерферометрические методы позволяют значительно повысить чувствительность, т. к. с их помощью измеряется амплитуда отраженного сигнала, а не его интенсивность. Основными количественными характеристиками ОКТ-приборов являются осевое (глубинное, аксиальное, вдоль А-сканов) и поперечное (между А-сканами) разрешение, а также скорость сканирования (число А-сканов за 1 с). В первых ОКТ-приборах использовался последовательный (временной) метод построения изображения (time-domain optical coherence tomography, TD-OC) (табл. 1). В основе этого метода лежит принцип работы интерферометра, предложенный А.А. Михельсоном (1852–1931 гг.). Луч света низкой когерентности от суперлюминесцентного светодиода разделяется на 2 пучка, один из которых отражается исследуемым объектом (глазом), в то время как другой проходит по референтному (сравнительному) пути внутри прибора и отражается специальным зеркалом, положение которого регулируется исследователем. При равенстве длины луча, отраженного от исследуемой ткани, и луча от зеркала возникает явление интерференции, регистрируемое светодиодом. Каждая точка измерения соответствует одному А-скану. Получаемые одиночные А-сканы суммируются, в результате чего формируется двухмерное изображение. Осевое разрешение коммерческих приборов первого поколения (TD-OCT) составляет 8–10 мкм при скорости сканирования 400 А-сканов/с. К сожалению, наличие подвижного зеркала увеличивает время исследования и снижает разрешающую способность прибора. Кроме этого, движения глаз, неизбежно возникающие при данной длительности сканирования, или плохая фиксация во время исследования приводят к формированию артефактов, которые требуют цифровой обработки и могут скрывать важные патологические особенности в тканях. В 2001 г. была представлена новая технология – ОКТ сверхвысокого разрешения (Ultrahigh-resolution OCT, UHR-OCT), с помощью которой стало возможно получать изображения роговицы и сетчатки с осевым разрешением 2–3 мкм [12]. В качестве источника света использовался фемтосекундный титан-сапфировый лазер (Ti:Al2O3 laser). По сравнению со стандартным разрешением, составляющим 8–10 мкм, ОКТ высокого разрешения стала давать более качественную визуализацию слоев сетчатки in vivo. Новая технология позволяла дифференцировать границы между внутренними и наружными слоями фоторецепторов, а также наружную пограничную мембрану [13, 14]. Несмотря на улучшение разрешающей способности, применение UHR-OCT требовало дорогостоящего и специализированного лазерного оснащения, что не позволяло использовать его в широкой клинической практике [15]. С внедрением спектральных интерферометров, использующих преобразование Фурье (Spectral domain, SD; Fouirier domain, FD), технологический процесс приобрел ряд преимуществ по сравнению с использованием традиционных временных ОКТ (табл. 1). Хотя методика была известна еще с 1995 г., она не применялась для получения изображений сетчатки почти до начала 2000-х гг. Это связано с появлением в 2003 г. высокоскоростных камер (charge-coupled device, ССD) [16, 17]. Источником света в SD-OCT является широкополосный суперлюминесцентный диод, позволяющий получить низкокогерентный луч, содержащий несколько длин волн. Как и в традиционной, в спектральной ОКТ луч света разделяется на 2 пучка, один из которых отражается от исследуемого объекта (глаза), а второй – от фиксированного зеркала. На выходе интерферометра свет пространственно разлагается по спектру, и весь спектр регистрируется высокоскоростной CCD-камерой. Затем с помощью математического преобразования Фурье происходят обработка спектра интерференции и формирование линейного А-скана. В отличие от традиционной ОКТ, где линейный А-скан получается за счет последовательного измерения отражающих свойств каждой отдельной точки, в спектральной ОКТ линейный А-скан формируется за счет одномоментного измерения лучей, отраженных от каждой отдельной точки [17, 19]. Осевое разрешение современных спектральных ОКТ-приборов достигает 3–7 мкм, а скорость сканирования – более 40 тыс. А-сканов/с. Безусловно, основным преимуществом SD-OCT является его высокая скорость сканирования. Во-первых, она позволяет значительно улучшить качество получаемых изображений путем уменьшения артефактов, возникающих при движениях глаз во время исследования. К слову, стандартный линейный профиль (1024 А-сканов) можно получить в среднем всего за 0,04 с. За это время глазное яблоко совершает только микросаккадные движения с амплитудой в несколько угловых секунд, не влияющих на процесс исследования [19]. Во-вторых, стала возможна 3D-реконструкция изображения, позволяющая оценить профиль исследуемой структуры и ее топографию. Получение множества изображений одновременно при спектральной ОКТ дало возможность диагностики небольших по размерам патологических очагов. Так, при TD-OCT макула отображается по данным 6 радиальных сканов в противовес 128–200 сканам аналогичной области при выполнении SD-OCT [20]. Благодаря высокому разрешению можно четко визуализировать слои сетчатки и внутренние слои сосудистой оболочки. Итогом выполнения стандартного исследования SD-OCT является протокол, представляющий полученные результаты как графически, так и в абсолютных значениях. Первый коммерческий спектральный оптический когерентный томограф был разработан в 2006 г., им стал RTVue 100 (Optovue, США).
Оптическая когерентная томография (ОКТ) – это метод диагностики, который позволяет с высокой разрешающей способностью получать томографические срезы внутренних биологических систем. Название метода впервые приводится в работе коллектива из Массачусетского технологического университета, опубликованной в Science в 1991 г. Авторами были представлены томографические изображения, демонстрирующие in vitro перипапиллярную зону сетчатки и коронарную артерию [1]. Первые прижизненные исследования сетчатки и переднего отрезка глаза с помощью ОКТ были опубликованы в 1993 и 1994 гг. соответственно [2, 3]. В следующем году вышел ряд работ, посвященных применению метода для диагностики и мониторинга заболеваний макулярной области (в т. ч. отека макулы при сахарном диабете, макулярных отверстий, серозной хориоретинопатии) и глаукомы [5–10]. В 1994 г. разработанная технология ОКТ была передана зарубежному подразделению фирмы Carl Zeiss Inc. (Hamphrey Instruments, Dublin, США), и уже в 1996 г. была создана первая серийная система ОКТ, предназначенная для офтальмологической практики. Принцип метода ОКТ заключается в том, что световая волна направляется в ткани, где распространяется и отражается или рассеивается от внутренних слоев, которые имеют различные свойства. Получаемые томографические образы – это, по сути, зависимость интенсивности рассеянного или отраженного от структур внутри тканей сигнала от расстояния до них. Процесс построения изображений можно рассматривать следующим образом: на ткань направляется сигнал от источника, и последовательно измеряется интенсивность возвращающегося сигнала через определенные промежутки времени. Так как скорость распространения сигнала известна, то по этому показателю и времени его прохождения определяется расстояние. Таким образом, получается одномерная томограмма (А-скан). Если последовательно смещаться по одной из оси (вертикальной, горизонтальной, косой) и повторять предыдущие измерения, то можно получить двухмерную томограмму. Если последовательно смещаться еще по одной оси, то можно получить набор таких срезов, или объемную томограмму [10]. В ОКТ-системах применяется интерферометрия слабой когерентности. Интерферометрические методы позволяют значительно повысить чувствительность, т. к. с их помощью измеряется амплитуда отраженного сигнала, а не его интенсивность. Основными количественными характеристиками ОКТ-приборов являются осевое (глубинное, аксиальное, вдоль А-сканов) и поперечное (между А-сканами) разрешение, а также скорость сканирования (число А-сканов за 1 с). В первых ОКТ-приборах использовался последовательный (временной) метод построения изображения (time-domain optical coherence tomography, TD-OC) (табл. 1). В основе этого метода лежит принцип работы интерферометра, предложенный А.А. Михельсоном (1852–1931 гг.). Луч света низкой когерентности от суперлюминесцентного светодиода разделяется на 2 пучка, один из которых отражается исследуемым объектом (глазом), в то время как другой проходит по референтному (сравнительному) пути внутри прибора и отражается специальным зеркалом, положение которого регулируется исследователем. При равенстве длины луча, отраженного от исследуемой ткани, и луча от зеркала возникает явление интерференции, регистрируемое светодиодом. Каждая точка измерения соответствует одному А-скану. Получаемые одиночные А-сканы суммируются, в результате чего формируется двухмерное изображение. Осевое разрешение коммерческих приборов первого поколения (TD-OCT) составляет 8–10 мкм при скорости сканирования 400 А-сканов/с. К сожалению, наличие подвижного зеркала увеличивает время исследования и снижает разрешающую способность прибора. Кроме этого, движения глаз, неизбежно возникающие при данной длительности сканирования, или плохая фиксация во время исследования приводят к формированию артефактов, которые требуют цифровой обработки и могут скрывать важные патологические особенности в тканях. В 2001 г. была представлена новая технология – ОКТ сверхвысокого разрешения (Ultrahigh-resolution OCT, UHR-OCT), с помощью которой стало возможно получать изображения роговицы и сетчатки с осевым разрешением 2–3 мкм [12]. В качестве источника света использовался фемтосекундный титан-сапфировый лазер (Ti:Al2O3 laser). По сравнению со стандартным разрешением, составляющим 8–10 мкм, ОКТ высокого разрешения стала давать более качественную визуализацию слоев сетчатки in vivo. Новая технология позволяла дифференцировать границы между внутренними и наружными слоями фоторецепторов, а также наружную пограничную мембрану [13, 14]. Несмотря на улучшение разрешающей способности, применение UHR-OCT требовало дорогостоящего и специализированного лазерного оснащения, что не позволяло использовать его в широкой клинической практике [15]. С внедрением спектральных интерферометров, использующих преобразование Фурье (Spectral domain, SD; Fouirier domain, FD), технологический процесс приобрел ряд преимуществ по сравнению с использованием традиционных временных ОКТ (табл. 1). Хотя методика была известна еще с 1995 г., она не применялась для получения изображений сетчатки почти до начала 2000-х гг. Это связано с появлением в 2003 г. высокоскоростных камер (charge-coupled device, ССD) [16, 17]. Источником света в SD-OCT является широкополосный суперлюминесцентный диод, позволяющий получить низкокогерентный луч, содержащий несколько длин волн. Как и в традиционной, в спектральной ОКТ луч света разделяется на 2 пучка, один из которых отражается от исследуемого объекта (глаза), а второй – от фиксированного зеркала. На выходе интерферометра свет пространственно разлагается по спектру, и весь спектр регистрируется высокоскоростной CCD-камерой. Затем с помощью математического преобразования Фурье происходят обработка спектра интерференции и формирование линейного А-скана. В отличие от традиционной ОКТ, где линейный А-скан получается за счет последовательного измерения отражающих свойств каждой отдельной точки, в спектральной ОКТ линейный А-скан формируется за счет одномоментного измерения лучей, отраженных от каждой отдельной точки [17, 19]. Осевое разрешение современных спектральных ОКТ-приборов достигает 3–7 мкм, а скорость сканирования – более 40 тыс. А-сканов/с. Безусловно, основным преимуществом SD-OCT является его высокая скорость сканирования. Во-первых, она позволяет значительно улучшить качество получаемых изображений путем уменьшения артефактов, возникающих при движениях глаз во время исследования. К слову, стандартный линейный профиль (1024 А-сканов) можно получить в среднем всего за 0,04 с. За это время глазное яблоко совершает только микросаккадные движения с амплитудой в несколько угловых секунд, не влияющих на процесс исследования [19]. Во-вторых, стала возможна 3D-реконструкция изображения, позволяющая оценить профиль исследуемой структуры и ее топографию. Получение множества изображений одновременно при спектральной ОКТ дало возможность диагностики небольших по размерам патологических очагов. Так, при TD-OCT макула отображается по данным 6 радиальных сканов в противовес 128–200 сканам аналогичной области при выполнении SD-OCT [20]. Благодаря высокому разрешению можно четко визуализировать слои сетчатки и внутренние слои сосудистой оболочки. Итогом выполнения стандартного исследования SD-OCT является протокол, представляющий полученные результаты как графически, так и в абсолютных значениях. Первый коммерческий спектральный оптический когерентный томограф был разработан в 2006 г., им стал RTVue 100 (Optovue, США).
Литература
1. Huang D., Swanson E.A., Lin C.P. et al. Optical coherence tomography // Science. 1991. Vol. 254. № 5035. P. 1178–1181.2. Swanson E.A., Izatt J.A., Hee M.R. et al. In-vivo retinal imaging by optical coherence tomography // Opt Lett. 1993. Vol. 18. № 21. P. 1864–1866.3. Fercher A.F., Hitzenberger C.K., Drexler W., Kamp G., Sattmann H. In-Vivo optical coherence tomography // Am J Ophthalmol. 1993. Vol. 116. № 1. P. 113–115.4. Izatt J.A., Hee M.R., Swanson E.A., Lin C.P., Huang D., Schuman J.S., Puliafito C.A., Fujimoto J.G. Micrometer-scale resolution imaging of the anterior eye in vivo with optical coherence tomography // Arch Ophthalmol. 1994. Vol. 112. № 12. P. 1584–1589.5. Puliafito C.A., Hee M.R., Lin C.P., Reichel E., Schuman J.S., Duker J.S., Izatt J.A., Swanson E.A., Fujimoto J.G. Imaging of macular diseases with optical coherence tomography // Ophthalmology. 1995. Vol. 102. № 2. P. 217–229.6. Schuman J.S., Hee M.R., Arya A.V., Pedut-Kloizman T., Puliafito C.A., Fujimoto J.G., Swanson E.A. Optical coherence tomography: a new tool for glaucoma diagnosis // Curr Opin Ophthalmol. 1995. Vol. 6. № 2. P. 89–95.7. Schuman J.S., Hee M.R., Puliafito C.A., Wong C., Pedut-Kloizman T., Lin C.P., Hertzmark E., Izatt .JA., Swanson E.A., Fujimoto J.G. Quantification of nerve fiber layer thickness in normal and glaucomatous eyes using optical coherence tomography // Arch Ophthalmol. 1995. Vol. 113. № 5. P. 586–596.8. Hee M.R., Puliafito C.A., Wong C., Duker J.S., Reichel E., Schuman J.S., Swanson E.A., Fujimoto J.G. Optical coherence tomography of macular holes // Ophthalmology. 1995 Vol. 102. № 5. P. 748–756.9. Hee M.R., Puliafito C.A., Wong C., Reichel E., Duker J.S., Schuman J.S., Swanson E.A., Fujimoto J.G. Optical coherence tomography of central serous chorioretinopathy // Am J Ophthalmol.1995. Vol. 120. № 1. P. 65–74.10. Hee M.R., Puliafito C.A., Wong C., Duker J.S., Reichel E., Rutledge B., Schuman J.S., Swanson E.A., Fujimoto J.G. Quantitative assessment of macular edema with optical coherence tomography // Arch Ophthalmol. 1995. Vol. 113. № 8. P. 1019–1029.11. Висковатых А.В., Пожар В.Э., Пустовойт В.И. Разработка оптического когерентного томографа для офтальмологии на быстроперестраиваемых акустооптических фильтрах // Сборник материалов III Евразийского конгресса по медицинской физике и инженерии «Медицинская физика – 2010». 2010. Т. 4. C. 68–70. М., 2010 [Viskovatykh A.V. Pozhar V.E., Pustovoyt V.I. The development of optical coherence tomography for ophthalmology at the acoustooptical filters // Collection of materials of the 3rd Eurasian Congress on Medical Physics and Engineering «Medical Physics 2010». 2010. № 4. P. 68–70 (in Russian)].12. Drexler W., Morgner U., Ghanta R.K., Kartner F.X., Schuman J.S., Fujimoto J.G. Ultrahigh-resolution ophthalmic optical coherence tomography // Nat Med. 2001. Vol. 7. № 4. P. 502–507.13. Drexler W., Sattmann H., Hermann B. et al. Enhanced visualization of macular pathology with the use of ultrahigh-resolution optical coherence tomography // Arch Ophthalmol. 2003. Vol. 121. P. 695–706.14. Ko T.H., Fujimoto J.G., Schuman J.S. et al. Comparison of ultrahigh and standard resolution optical coherence tomography for imaging of macular pathology // Arch Ophthalmol. 2004. Vol. 111. P. 2033–2043.15. Ko T.H., Adler D.C., Fujimoto J.G. et al. Ultrahigh resolution optical coherence tomography imaging with a broadband superluminescent diode light source // Opt Express. 2004. Vol. 12. P. 2112–2119.16. Fercher A.F., Hitzenberger C.K., Kamp G., El-Zaiat S.Y. Measurement of intraocular distances by backscattering spectral interfereometry // Opt Commun. 1995. Vol. 117. P. 43–48.17. Choma M.A., Sarunic M.V., Yang C.H., Izatt J.A. Sensitivity advantage of swept source and Fourier domain optical coherence tomography // Opt Express. 2003. Vol. 11. № 18. P. 2183–2189.18. Астахов Ю.С., Белехова С.Г. Оптическая когерентная томография: как все начиналось и современные диагностические возможности методики // Офтальмологические ведомости. 2014. Т. 7. № 2. C. 60–68. [Astakhov Yu.S., Belekhova S.G. Optical coherence tomography: how it all began and advanced diagnostic capabilities technique // Oftalmologicheskie vedomosti. 2014. № 7 (2). P. 60–68 (in Russian)].19. Свирин А.В., Кийко Ю.И., Обруч Б.В., Богомолов А.В. Спектральная когерентная оптическая томография: принципы и возможности метода // Клиническая офтальмология. 2009. Т. 10. № 2. C. 50–53 [Svirin A.V., Kiyko Yu.I., Obruch B.V., Bogomolov A.V. Spectral optic coherent tomography: principles and possibilities (Literary review) // Clinical Ophthalmology. 2009. № 10 (2). P. 50–53 (in Russian)].20. Kiernan D.F., Hariprasad S.M., Chin E.K., Kiernan C.L, Rago J., Mieler W.F. Prospective comparison of cirrus and stratus оptical coherence tomography for quantifying retinal thickness // Am J Ophthalmol. 2009. Vol. 147. № 2. P. 267–275.21. Wang R.K. Signal degradation by multiple scattering in optical coherence tomography of dense tissue: a monte carlo study towards optical clearing of biotissues // Phys Med Biol. 2002. Vol. 47. № 13. P. 2281–2299.22. Povazay B., Bizheva K., Hermann B. et al. Enhanced visualization of choroidal vessels using ultrahigh resolution ophthalmic OCT at 1050 nm // Opt Express. 2003. Vol. 11. № 17. P. 1980–1986.23. Spaide R.F., Koizumi H., Pozzoni M.C. et al. Enhanced depth imaging spectral-domain optical coherence tomography // Am J Ophthalmol. 2008. Vol. 146. P. 496–500.24. Margolis R., Spaide R.F. A pilot study of enhanced depth imaging optical coherence tomography of the choroid in normal eyes // Am J Ophthalmol. 2009. Vol. 147. P. 811–815.25. Ho J., Castro D.P., Castro L.C., Chen Y., Liu J., Mattox C., Krishnan C., Fujimoto J.G., Schuman J.S., Duker J.S. Clinical assessment of mirror artifacts in spectral-domain optical coherence tomography // Invest Ophthalmol Vis Sci. 2010. Vol. 51. № 7. P. 3714–3720.26. Anand R. Enhanced depth optical coherence tomographyiImaging - a review // Delhi J Ophthalmol. 2014. Vol. 24. № 3. P. 181–187.27. Rahman W., Chen F.K., Yeoh J. et al. Repeatability of manual subfoveal choroidal thickness measurements in healthy subjects using the technique of enhanced depth imaging optical coherence tomography // Invest Ophthalmol Vis Sci. 2011. Vol. 52. № 5. P. 2267–2271.28. Park S.C., Brumm J., Furlanetto R.L., Netto C., Liu Y., Tello C., Liebmann J.M., Ritch R. Lamina cribrosa depth in different stages of glaucoma // Invest Ophthalmol Vis Sci. 2015. Vol. 56. № 3. P. 2059–2064.29. Park S.C., Hsu A.T., Su D., Simonson J.L., Al-Jumayli M., Liu Y., Liebmann J.M., Ritch R. Factors associated with focal lamina cribrosa defects in glaucoma // Invest Ophthalmol Vis Sci. 2013. Vol. 54. № 13. P. 8401–8407.30. Faridi O.S., Park S.C., Kabadi R., Su D., De Moraes C.G., Liebmann J.M., Ritch R. Effect of focal lamina cribrosa defect on glaucomatous visual field progression // Ophthalmology. 2014 Vol. 121. № 8. P. 1524–1530.31. Potsaid B., Baumann B., Huang D., Barry S., Cable A.E., Schuman J.S., Duker J.S., Fujimoto J.G. Ultrahigh speed 1050nm swept source / Fourier domain OCT retinal and anterior segment imaging at 100,000 to 400,000 axial scans per second // Opt Express 2010. Vol. 18. № 19. P. 20029–20048.32. Adhi M., Liu J.J., Qavi A.H., Grulkowski I., Fujimoto J.G., Duker J.S. Enhanced visualization of the choroido-scleral interface using swept-source OCT // Ophthalmic Surg Lasers Imaging Retina. 2013. Vol. 44. P. 40–42.33. Mansouri K., Medeiros F.A., Marchase N. et al. Assessment of choroidal thickness and volume during the water drinking test by swept-source optical coherence tomography // Ophthalmology. 2013. Vol. 120. № 12. P. 2508–2516.34. Mansouri K., Nuyen B., Weinreb R.N. Improved visualization of deep ocular structures in glaucoma using high penetration optical coherence tomography // Expert Rev Med Devices. 2013. Vol. 10. № 5. P. 621–628.35. Takayama K., Hangai M., Kimura Y. et al. Three-dimensional imaging of lamina cribrosa defects in glaucoma using sweptsource optical coherence tomography // Invest Ophthalmol Vis Sci. 2013. Vol. 54. № 7. P. 4798–4807.36. Park H.Y., Shin H.Y., Park C.K. Imaging the posterior segment of the eye using swept-source optical coherence tomography in myopic glaucoma eyes: comparison with enhanced-depth imaging // Am J Ophthalmol. 2014. Vol. 157. № 3. P. 550–557.37. Michalewska Z., Michalewski J., Adelman R.A., Zawislak E., Nawrocki J. Choroidal thickness measured with swept source optical coherence tomography before and after vitrectomy with internal limiting membrane peeling for idiopathic epiretinal membranes // Retina. 2015. Vol. 35. № 3. P. 487–491.38. Lopilly Park H.Y., Lee N.Y., Choi J.A., Park C.K. Measurement of scleral thickness using swept-source optical coherence tomography in patients with open-angle glaucoma and myopia // Am J Ophthalmol. 2014. Vol. 157. № 4. P. 876–884.39. Omodaka K., Horii T., Takahashi S., Kikawa T., Matsumoto A., Shiga Y., Maruyama K., Yuasa T., Akiba M., Nakazawa T. 3D Evaluation of the Lamina Cribrosa with Swept-Source Optical Coherence Tomography in Normal Tension Glaucoma // PLoS One. 2015 Apr 15. Vol. 10 (4). e0122347.40. Mansouri K., Nuyen B., Weinreb R. Improved visualization of deep ocular structures in glaucoma using high penetration optical coherence tomography // Expert Rev Med Devices. 2013. Vol. 10. № 5. P. 621–628.41. Binder S. Optical coherence tomography/ophthalmology: Intraoperative OCT improves ophthalmic surgery // BioOpticsWorld. 2015. Vol. 2. P. 14–17.42. Zhang Z.E., Povazay B., Laufer J., Aneesh A., Hofer B., Pedley B., Glittenberg C., Treeby B., Cox B., Beard P., Drexler W. Multimodal photoacoustic and optical coherence tomography scanner using an all optical detection scheme for 3D morphological skin imaging // Biomed Opt Express. 2011. Vol. 2. № 8. P. 2202–2215.43. Morgner U., Drexler W., Ka..rtner F. X., Li X. D., Pitris C., Ippen E. P., and Fujimoto J. G. Spectroscopic optical coherence tomography // Opt Lett. 2000. Vol. 25. № 2. P. 111–113.44. Leitgeb R., Wojtkowski M., Kowalczyk A., Hitzenberger C. K., Sticker M., Ferche A. F. Spectral measurement of absorption by spectroscopic frequency-domain optical coherence tomography // Opt Lett. 2000. Vol. 25. № 11. P. 820–822.45. Pircher M., Hitzenberger C.K., Schmidt-Erfurth U. Polarization sensitive optical coherence tomography in the human eye // Progress in Retinal and Eye Research. 2011. Vol. 30. № 6. P. 431–451.46. Geitzinger E., Pircher M., Geitzenauer W., Ahlers C., Baumann B., Michels S., Schmidt-Erfurth U., Hitzenberger C.K. Retinal pigment epithelium segmentation by polarization sensitive optical coherence tomography // Opt Express. 2008. Vol. 16. P. 16410–16422.47. Pircher M., Goetzinger E., Leitgeb R., Hitzenberger C.K. Transversal phase resolved polarization sensitive optical coherence tomography // Phys Med Biol. 2004. Vol. 49. P. 1257–1263.48. Mansouri K., Nuyen B., N Weinreb R. Improved visualization of deep ocular structures in glaucoma using high penetration optical coherence tomography // Expert Rev Med Devices. 2013. Vol. 10. № 5. P. 621–628.49. Geitzinger E., Pircher M., Hitzenberger C.K. High speed spectral domain polarization sensitive optical coherence tomography of the human retina // Opt Express. 2005. Vol. 13. P. 10217–10229.50. Ahlers C., Gotzinger E., Pircher M., Golbaz I., Prager F., Schutze C., Baumann B., Hitzenberger C.K., Schmidt-Erfurth U. Imaging of the retinal pigment epithelium in age-related macular degeneration using polarization-sensitive optical coherence tomography // Invest Ophthalmol Vis Sci. 2010. Vol. 51. P. 2149–2157.51. Geitzinger E., Baumann B., Pircher M., Hitzenberger C.K. Polarization maintaining fiber based ultra-high resolution spectral domain polarization sensitive optical coherence tomography // Opt Express. 2009. Vol. 17. P. 22704–22717.52. Lammer J., Bolz M., Baumann B., Geitzinger E., Pircher M., Hitzenberger C., Schmidt-Erfurth U. 2010. Automated Detection and Quantification of Hard Exudates in Diabetic Macular Edema Using Polarization Sensitive Optical Coherence Tomography // ARVO abstract 4660/D935.53. Schmitt J. OCT elastography: imaging microscopic deformation and strain of tissue // Opt Express. 1998. Vol. 3. № 6. P. 199–211.54. Ford M.R., Roy A.S., Rollins A.M. and Dupps W.J.Jr. Serial biomechanical comparison of edematous,normal, and collagen crosslinked human donor corneas using optical coherence elastography // J Cataract Refract Surg. 2014. Vol. 40. № 6. P. 1041–1047.55. Leitgeb R., Schmetterer L.F., Wojtkowski M., Hitzenberger C.K., Sticker M., Fercher A.F. Flow velocity measurements by frequency domain short coherence interferometry. Proc. SPIE. 2002. P. 16–21.56. Wang Y., Bower B.A., Izatt J.A., Tan O., Huang D. In vivo total retinal blood flow measurement by Fourier domain Doppler optical coherence tomography // J Biomed Opt. 2007. Vol. 12. P. 412–415.57. Wang R. K., Ma Z., Real-time flow imaging by removing texture pattern artifacts in spectral-domain optical Doppler tomography // Opt. Lett. 2006. Vol. 31. № 20. P. 3001–3003.58. Wang R. K., Lee A. Doppler optical micro-angiography for volumetric imaging of vascular perfusion in vivo // Opt Express. 2009. Vol. 17. № 11. P. 8926–8940.59. Wang Y., Bower B. A., Izatt J. A., Tan O., Huang D. Retinal blood flow measurement by circumpapillary Fourier domain Doppler optical coherence tomography // J Biomed Opt. 2008. Vol. 13. № 6. P. 640–643.60. Wang Y., Fawzi A., Tan O., Gil-Flamer J., Huang D. Retinal blood flow detection in diabetic patients by Doppler Fourier domain optical coherence tomography // Opt Express. 2009. Vol. 17. № 5. P. 4061–4073.61. Jia Y., Tan O., Tokayer J., Potsaid B., Wang Y., Liu J.J., Kraus M.F., Subhash H., Fujimoto J.G., Hornegger J., Huang D. Split-spectrum amplitude-decorrelation angiography with optical coherence tomography // Opt Express. 2012. Vol. 20. № 4. P. 4710–4725.62. Jia Y., Wei E., Wang X., Zhang X., Morrison J.C., Parikh M., Lombardi L.H., Gattey D.M., Armour R.L., Edmunds B., Kraus M.F., Fujimoto J.G., Huang D. Optical coherence tomography angiography of optic disc perfusion in glaucoma // Ophthalmology. 2014. Vol. 121. № 7. P. 1322–1332.63. Bizheva K., Pflug R., Hermann B., Povazay B., Sattmann H., Anger E., Reitsamer H., Popov S., Tylor J.R., Unterhuber A., Qui P., Ahnlet P.K., Drexler W. Optophysiology: depth resolved probing of retinal physiology with functional ultrahigh resolution optical coherence tomography // PNAS (Proceedings of the National Academy of Sciences of America ). 2006. Vol. 103. № 13. P. 5066–5071.64. Tumlinson A.R., Hermann B., Hofer B., Považay B., Margrain T.H., Binns A.M., Drexler W., Techniques for extraction of depth-resolved in vivo human retinal intrinsic optical signals with optical coherence tomography // Jpn. J. Ophthalmol. 2009. Vol. 53. P. 315–326.
Поделитесь статьей в социальных сетях
Предыдущая статья
Следующая статья
Что это за процедура — оптическая когерентная томография, и для чего она нужна?
 Оптическая когерентная томография (ОКТ) – процедура, не предполагающая инвазивного вмешательства.
Оптическая когерентная томография (ОКТ) – процедура, не предполагающая инвазивного вмешательства.
Метод применяется для оценки состояния слизистых оболочек, зубов, тонких слоев кожи, а также находит применение в офтальмологии.
В этом случае специалист может быстро диагностировать вид и стадию развития патологии.
Оптическая когерентная томография: что это?
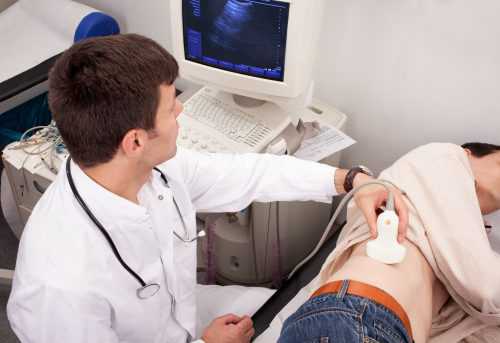
Технически оптическая когерентная томография напоминает процедуру ультразвукового обследования органов зрения.
Но при проведении ОКТ глаз подвергается воздействию не ультразвуковых, а инфракрасных волн (при этом длина волны составляет примерно 1 микрометр).
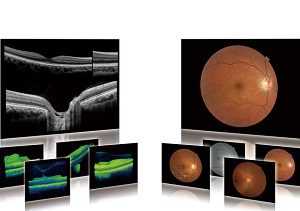 Оптическая когерентная томография – относительно новый способ офтальмологической диагностики, позволяющий точно установить заболевания, затрагивающие глазное дно.
Оптическая когерентная томография – относительно новый способ офтальмологической диагностики, позволяющий точно установить заболевания, затрагивающие глазное дно.
При этом нет необходимости использовать контрастирующее вещество, а это большое преимущество в клинических случаях, когда любые внешние воздействия на пораженный орган зрения могут быть критичными.
Впервые данный метод был применен офтальмологом Карменом Пулиафито (США) в 1995 году, а уже спустя менее двух лет оборудование, используемое для проведения ОКТ, поставлялось во многие офтальмологические клиники по всему миру компанией Carl Zeiss Meditec.
Такие инструменты дают офтальмологам возможность изучать особенности пораженных тканей на микроскопическом уровне, а метод эффективен для изучения переднего отрезка глаза и глазного дна.
Во всех остальных случаях офтальмолог получает четкую клиническую картину.
Полученные результаты сохраняются в базе данных томографа (в дальнейшем эти статистические данные используются для сравнения между разными пациентами).
Пока такой способ используется только для обследования области заднего полюса, но некоторые производители офтальмологических диагностических приборов уже анонсировали технологии, которые позволят производить обследование сетчатки полностью.
Для проведения ОКТ используется инструмент под названием интерферометр Майкельсона.
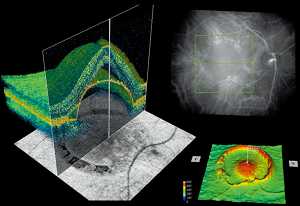 Издаваемое им излучение по-разному отражается от разных тканей организма, и в ходе обследования считывается время задержки испускаемого светового потока, а также его интенсивность при прохождении через ткани органов зрения.
Издаваемое им излучение по-разному отражается от разных тканей организма, и в ходе обследования считывается время задержки испускаемого светового потока, а также его интенсивность при прохождении через ткани органов зрения.
Луч в зависимости от поставленных целей может характеризоваться разной длиной волны. При диагностике переднего отрезка глазного яблока прибор настраивают таким образом, чтобы он испускал волну длиной 1310 нанометров.
Если необходимо обследовать сетчатку – длина волны уменьшается до 830 нанометров.
Направленный на ткани глаза луч делится на два пучка: один отражается от специального офтальмологического зеркала и считается контрольным, а второй пучок направлен непосредственно на ткани глаза.
После того, как оба луча отразились – они движутся в обратном направлении и попадают на рабочую поверхность фотодетектора, формируя интерференционную картину, которая сохраняется в томографе и после обработки выводится в виде понятных специалисту данных.
Такая информация отображается в виде изображения, на котором ткани с наиболее высокой степенью отражения будут иметь светлые цвета. При низкой степени отражения участки будут показаны темные «холодные» цвета.
Высокая светоотражающая способность характерна для нервных волокон и пигментных областей, в то время как стекловидное тело, будучи прозрачным, практически не отражает световой луч и на томограмме оно будет иметь черный цвет.
Процедура выполняется дважды: в поперечной и продольной осях, что в результате позволяет получить информативное трехмерное изображение.
Какие заболевания выявляются на томографе?
Оптическая когерентная томография позволяет выявить наличие таких заболеваний, как:
- глаукома;
- разрывы макулы;
- отслоение сетчатки;
- ретинопатия диабетического происхождения;
- формирование эпиретинальной мембраны;
- аномалии в строении диска зрительного нерва, а также его отеки и атрофические процессы;
- тромбозы;
- макулярный отек кистоидного характера;
- приобретенные и наследственные патологии сетчатки дегенеративного характера;
- изъязвления роговой оболочки;
- кератиты.
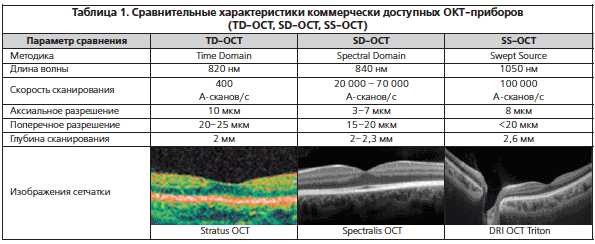
При глаукоме ОКТ позволяет оценить, как функционируют дренажные системы глаза и определить угол передней камеры.
Особенности проведения диагностики
Обследуемый в ходе проведения оптической когерентной томографии садится перед томографом и фокусирует взгляд на специальной отметке, после чего специалист включает прибор и проводит сканирование органов зрения.
В результате томограф выдает протоколы, карты и таблицы, которые после расшифровки показывают наличие тех или иных патологий.
 Информация выдается в двух видах: как визуальная картина и как цифровые показатели, которые отклоняются от среднестатистических нормальных при нарушениях в органах зрения.
Информация выдается в двух видах: как визуальная картина и как цифровые показатели, которые отклоняются от среднестатистических нормальных при нарушениях в органах зрения.
Со временем в памяти устройства формируется большая база данных, отражающая среднестатистические показатели уже обследованных до этого больных и здоровых органов зрения.
При сравнении показателей прибор определяет, являются ли изменения у пациента патологическими или их можно считать нормальными.
Часто метод ОКТ используется именно для диагностики глаукомы и выявить, прогрессирует ли заболевание или не развивается.
Точность и эффективность метода увеличивается при проведении дополнительных сопутствующих обследований, в частности – флюоресцентной ангиографией сетчатки.
Стоимость процедуры в российских клиниках
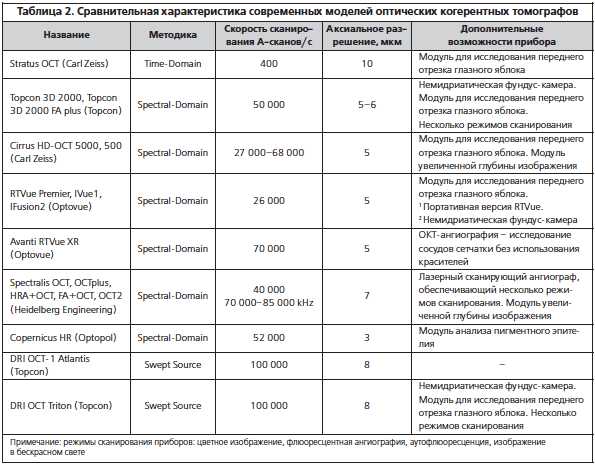
Оптическая когерентная томография – это платная процедура, стоимость которой практически одинакова во всех регионах и мало зависит от уровня сервиса клиники, но варьируется в зависимости от того, какая часть глазного яблока будет обследоваться: 
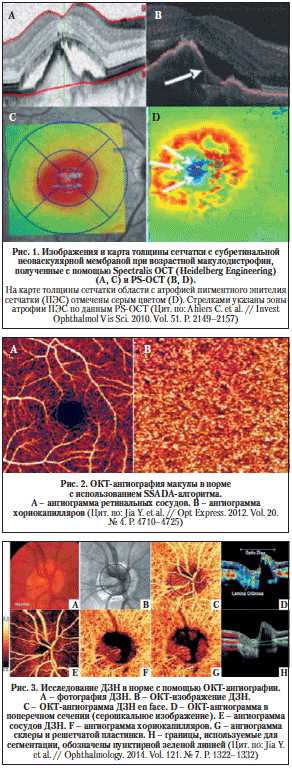
- ОКТ в составе диагностического комплекса – самый дорогой вариант. Такая процедура стоит в районе 2 000 рублей (в данном случае предполагается исследование нервных волокон сетчатки, зрительного нерва и переднего отрезка глаза, а также будет производиться трехмерное обследование макулы с построением ее визуального изображения);
- томография переднего отдела стоит не более 800 рублей;
- за исследование макулы придется заплатить от 600 до 700 рублей.
Полезное видео
Из данного видео вы узнаете, что представляет собой оптическая когерентная томография и какие заболевания можно выявить с ее помощью:
Оптическая когерентная томография (ОКТ) применяется для оценки состояния слизистых оболочек, зубов, тонких слоев кожи, а также находит применение в офтальмологии.
Это относительно новый способ офтальмологической диагностики, позволяющий точно установить заболевания, затрагивающие глазное дно. В этом случае специалист может быстро диагностировать вид и стадию развития патологии.
Вконтакте
Google+
Одноклассники
Статья была полезной? Оцените материал и автора! (Пока оценок нет) Загрузка... А если у вас есть вопросы или есть опыт и хочется высказаться по данной теме - пишите в комментариях ниже.Оптическая когерентная томография сетчатки
Современное обследование зрения производится с применением высокотехнологичного оборудования. Один из методов оценки состояния глаз и их функции — исследование на оптическом когерентном томографе. Неинвазивный (применяемый без игл и других инструментов) способ предполагает анализ отражения когерентного излучения биологическими составляющими области воздействия. Томография, в данном случае оптическая и когерентная, – инструмент контроля течения различных глазных заболеваний (и не только их).
Что представляет собой данная методика
Приборы ОКТ (оптической когерентной томографии) имеют большое разрешение: меньше 10 микрон. Это позволяет получать изображения сетчатки, капилляров, пигментного эпителия и других тканей. Сканирование слоев выявляет внутренние изменения, определяет размер и форму очагов патологии. Выявляются скрытые отечности, рубцы, кровоизлияния, дистрофия, ишемия, воспаления. Обычная офтальмология не дает такой детализации. Когерентный томограф помогает диагностировать нарушения в окончательной форме, что дополняет традиционный метод.
Некоторые системы глазных клиник используют ОКТ еще с 2010 года.
Зрительная функция человека – не единственная сфера применения аппарата. Исследовательские возможности распространяются на слои кожи и слизистых оболочек, ткани области зубов.
Оптическая когерентная томография, или ОКТ, является ценным методом по следующим причинам:
- неинвазивность и безопасность;
- высокая информативность;
- возможность повторять процедуру.
Принцип работы томографа, с физической точки зрения, аналогичен работе ультразвукового оборудования (УЗИ). Разница состоит в диапазоне применяемых волн. В ОКТ биологические ткани зондируют оптическим инфракрасным (порядка 1 мкм), а не акустическим излучением. Исследования с помощью ОКТ в офтальмологии помогли получить важные данные о строении глаз и возможных патологических процессах.
Показания и противопоказания
ОКТ – безопасный метод диагностики. Он применяется даже к таким больным, которые имеют противопоказания относительно других высокоточных форм обследований. Существует перечень заболеваний, при которых врач назначает процедуру:
- тромбоз сосудов;
- предположительная или подтвержденная глаукома;
- ретинопатия (поражение сосудов сетчатки) при диабете;
- ретинопатия при гипертонии;
- опухоли;
- исследование разрывов сетчатки;
- инвазия глаза (паразиты, глисты).
При необходимости детального обследования глаза такой тип сканирования рекомендуется пациентам в пожилом возрасте. Его можно повторять неоднократно. Заболевания диагностируются на ранних стадиях, выявляются мельчайшие дефекты.
Немногочисленные противопоказания все-таки присутствуют. Поэтому томография, во всяком случае, оптическая когерентная томография, проводится лишь в клинике. Нельзя обследовать на ОКТ в следующих случаях:
- неспособность фокусировать взгляд;
- психические болезни, при которых контакт с пациентом затруднен;
- бессознательное состояние;
- ткани глаза содержат остатки других процедур, что изменяет биологическую среду. В этом случае обследование переносят на другой день.
Оптической когерентной томографии и ее применению противопоказания, связанные с имплантатами, не препятствуют, как при некоторых инвазивных методах. Это объясняется тем, что облучение, магнитное поле отсутствуют, поэтому не могут влиять на работу кардиостимулятора и подобных устройств.
Подготовка
Оптическая томография отличается тем, что при отсутствии противопоказаний у пациента, подготовка к обследованию не нужна.
Факторы, влияющие на результат
Иногда процедуре ОКТ предшествует офтальмоскопия, гониоскопия, использование линзы Гольдмана. В конъюнктивальной полости остается контактная среда. Процедура возможна лишь после полного ее вымывания. Непрозрачность сред в органе зрения может снизить качество изображения.
Как проходит процедура и последующий уход
Оптический когерентный исследовательский томограф размещается в специальном кабинете. Аппарат оснащен сканером с объективом, из которого пучки инфракрасного излучения направляются в глаз. Результирующая картина выводится на монитор послойно, а из сигналов формируют таблицы. По ним делают вывод о состоянии сетчатки.
Этапы процедуры следующие.
- Пациент, сидящий в кабинете оптической когерентной томографии, должен сфокусировать взгляд на указанной точке. Обязательное условие достаточной информативности исследования – расширение зрачков. Для достижения такого эффекта используются специальные капли.
- От человека требуется двухминутная неподвижность на период сканирования. Камера будет приближаться. Когерентная томография сетчатки или обследование нерва требуют настройки аппарата на максимальные резкость и четкость.
- Результат обрабатывается аппаратом и попадает на монитор.
- Врач-офтальмолог делает выводы о состоянии структур тканей. Заключение, отражающее наличие или отсутствие патологических процессов, составляется в течение получаса. При этом специалист сопоставляет полученный результат с нормой.
Процедура оптической когерентной томографии глаза с применением сканера возможна лишь в специализированной клинике. Пациенту рекомендуется позаботиться о том, чтобы сопровождающий человек доставил его домой после процедуры. Нужно иметь в виду, что зрачки останутся расширенными некоторое время, пока действует препарат. При этом наблюдается повышенная световая чувствительность. Временный эффект вскоре исчезает, и состояние глаз приходит в норму.
Диагностируемые заболевания
Томография с аппаратом ОКТ эффективна при исследовании макулы (центральной зоны сетчатки). Диагностируются следующие заболевания:
- макулярное отверстие и отек;
- витреоретинальный тракционный синдром;
- отслойка сетчатки, пигментного эпителия (серозная, геморрагическая);
- макулярная дегенерация;
- диабетическая ретинопатия.
ОКТ позволяет оценивать очаги, обнаруживая их даже на ранних стадиях болезни. Производится объективный анализ возможности медикаментозного, хирургического и других форм лечения.
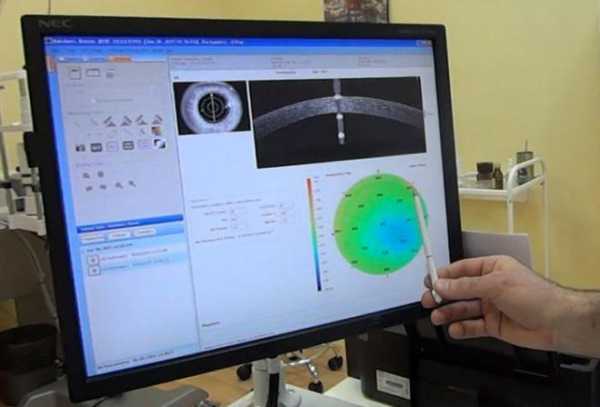
К примеру, глаукома выявляется путем определения состояний ретинального слоя нервных волокон и диска зрительного нерва. Изменения структур приводят к функциональным нарушениям. На основании диагностированной формы поражения определяется тактика лечения.
Исследуя застойный диск, различают степень светоотражения, свидетельствующую о наличии дегенерации ткани. Такой диагноз сопровождается повышенным внутричерепным давлением.
Структуры переднего отрезка органа зрения также осматриваются с помощью ОКТ. Аппарат позволяет оценить толщину центра роговицы. Диагностируются практически все болезни глаз с анализом всех их участков. Высокая информативность достигается при исследовании следующих зон:
- роговицы;
- сетчатки;
- зрительного нерва;
- передней и задней камер;
- нервных волокон и пигментного эпителия.
Приведем пример. Наследственное заболевание сетчатки – пигментный ретинит – может привести к значительному ухудшению зрения и даже слепоте. Вовремя обнаруженные признаки болезни и назначение адекватного лечения способны предотвратить прогрессирование недуга. ОКТ дает возможность измерить толщину слоя нервных волокон при исследовании зрительного нерва, а также угол их наклона к сетчатке. Результаты когерентной томографии – оценка равномерности толщины ткани, наличие или отсутствие очагов патологии.
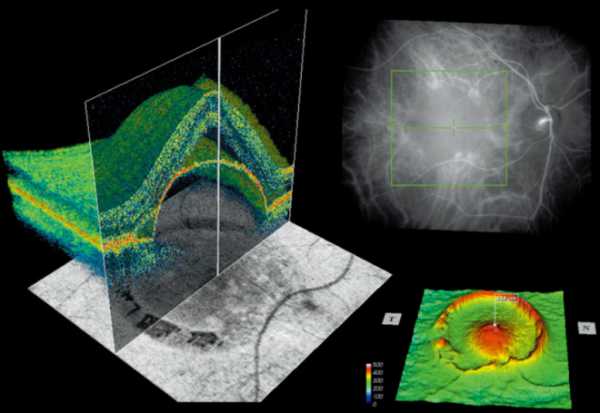
Преимущества метода
Оптический исследовательский томограф может выполнять диагностику в любое время без предварительной подготовки больного. Пациент может свободно питаться и проявлять физическую активность.
Кроме перечисленных, метод обладает следующими достоинствами:
- дает исчерпывающую информацию;
- неинвазивная процедура проходит с использованием сканера, который не соприкасается с глазным яблоком;
- обследование непродолжительно по времени;
- процедуру можно повторять неоднократно в связи с ее безопасностью;
- возможно изучение любого отрезка глаза;
- ОКТ отслеживает эффективность терапии и процедур.
Комплексная методика ОКТ позволяет давать оценку всем участкам органов зрения. С помощью цветного и трехмерного изображения получают точные данные о самых малых повреждениях.
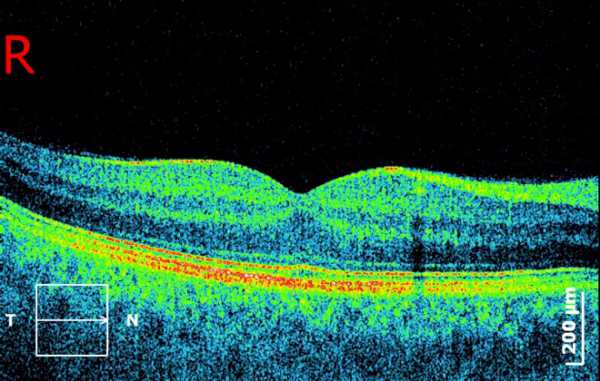
Осложнения
Обследование проводится с применением маломощного инфракрасного излучения, что практически исключает вредное воздействие на ткани. Соматические состояния пациента также не вносят ограничений в процедуру. Травмирование исключено.
Стоимость
В связи с дороговизной оборудования медицинских центров, оснащенных ОКТ, насчитываются единицы (даже в крупных городах). Стоимость услуги формируется в зависимости от сложности исследования и объема работ. Полная процедура обследования одного органа зрения стоит порядка 2 000 рублей. Сетчатку можно проверить за 800 рублей. При сканировании обоих глаз сумма увеличивается вдвое.
Альтернативные методы
Информацию, получаемую посредством ОКТ, частично могут дать следующие аналоги:
- Гейдельбергский ретинальный томограф – лазерная система, измеряющая головку зрительного нерва, результаты замеров представляются в трехмерном виде;
- ФАГ – флуоресцентная ангиография, применяемая для исследования глазных сосудов, капилляров и других компонентов. Предварительно проводят контрастирование флуоресцеином;
- ультразвуковая биомикроскопия – методика, предназначенная для диагностики периферии сетчатки и стекловидного тела;
- ИОЛ-Мастер – биометрический прибор, измеряющий параметры глаз: длину, кривизну роговицы, глубину камеры.
Оптическая когерентная томография
Оптическая когерентная томография (optical coherence tomography), или ОКТ (OCT) - современный неинвазивный бесконтактный метод, который позволяет визуализировать различные структуры глаза с более высоким разрешением (от 1 до 15 микрон), чем ультразвуковое исследование. ОКТ является своего рода видом оптической биопсии, благодаря которой не требуется удаления участка ткани и его микроскопического исследования.
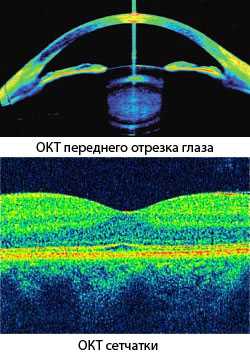
Впервые использовать концепцию оптической когерентной томографии в офтальмологии предложил американcкий ученый-офтальмолог Кармен Пулиафито в 1995 году. Позже, в 1996-1997 гг., первый прибор был внедрен в клиническую практику фирмой Carl Zeiss Meditec. В настоящее время при помощи этих устройств возможно проведение диагностики заболеваний глазного дна и переднего отрезка глаза на микроскопическом уровне.
Обследование основано на том, что ткани организма в зависимости от структуры по-разному могут отражать световые волны. При его проведении измеряется время задержки отраженного света и его интенсивность после прохождения через ткани глаза. Учитывая очень высокую скорость световой волны, прямое измерение этих показателей невозможно. Для этого в томографах используется интерферометр Майкельсона.
Низкокогерентный луч света инфракрасного спектра с длиной волны 830 нм (для визуализации сетчатки) или 1310 нм (для диагностики переднего отрезка глаза) разделяется на два пучка, один из которых направляется к исследуемым тканям, а другой (контрольный) – к специальному зеркалу. Отражаясь, оба воспринимаются фотодетектором, образуя интерференционную картину. Она, в свою очередь, анализируется программным обеспечением, и результаты представляются в виде псевдоизображения, где в соответствии с предустановленной шкалой участки с высокой степенью отражения света окрашиваются в «теплые» (красный) цвета, с низкой – в «холодные» вплоть до черного.
Более высокой светоотражающей способностью обладает слой нервных волокон и пигментного эпителия, средней – плексиформный и ядерный слои сетчатки. Стекловидное тело оптически прозрачно и в норме имеет на томограмме черный цвет. Для получения трехмерного изображения сканирование проводится в продольном и поперечном направлениях. Проведение ОКТ может быть затруднено наличием отека роговицы, помутнением оптических сред, кровоизлияниями.
ОКТ позволяет определить и оценить: • морфологические изменения сетчатки и слоя нервных волокон, толщину этих структур; • различные параметры диска зрительного нерва;
• анатомические структуры переднего отрезка глаза и их пространственное взаимоотношение.
Для проведения обследования пациенту необходимо зафиксировать взгляд на специальной метке обследуемым глазом, а при невозможности сделать это – другим, лучше видящим. Оператор выполняет несколько сканирований, а затем выбирает лучшее по качеству и информативности изображение.
Результаты обследования приводятся в виде различных протоколов, карт и таблиц, позволяющих визуально и количественно определять изменения. Для сравнения используется нормативная база данных, вложенная в память производителями томографа. В ней указано в процентах относительное количество здоровых людей, которые имеют аналогичные показатели обследуемых тканей. Соответственно, чем реже они встречаются в популяции, тем больше вероятность, что данные изменения являются признаком патологии.
ОКТ может проводиться для диагностики и оценки эффективности лечения таких заболеваний заднего отрезка глаза, как макулярные разрывы; наследственные и приобретенные дегенеративные изменения сетчатки (в том числе ВМД); диабетическая ретинопатия; глаукома; атрофия, отек и аномалии ДЗН; тромбоз ЦВС; кистоидный макулярный отек; пролиферативная витреоретинопатия; эпиретинальная мембрана; отслойка сетчатки.
ОКТ переднего отрезка глаза выполняется при глубоких кератитах и язвах роговицы, оценке угла передней камеры и функционирования дренажных устройств при глаукоме, оценке роговицы до и после проведения LASIK, установке интрастромальных колец, ФИОЛ и кератопластике.
Автор: Врач-офтальмолог Е. Н. Удодов, г. Минск, Беларусь. Дата публикации (обновления): 17.01.2018
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе