 [Гемоглобин формула структурная]
[Гемоглобин формула структурная]
Гемоглобин: строение, свойства, количество в крови, методики определения.
Основные функции эритроцитов обусловлены наличием в их составе белка хромопротеида —гемоглобина.
Мол. масса гемоглобина человека равна 68 800. Гемоглобин состоит из белковой (глобин) и железосодержащей (гем) частей; на одну молекулу глобина приходится 4 молекулы гема.
В крови здорового человека содержание гемоглобина составляет 120— 165 г/л (120—150 г/л у женщин, 130—160 г/л у мужчин). У беременных содержание гемоглобина может понижаться до 110 г/л.
Основные функции гемоглобина:
-
транспорт О2и СО2(дыхательных газов)
-
буфер
-
связывание токсичных веществ
Гемоглобин человека и различных животных имеет разное строение. Это касается белковой части — глобина, а гем у всех представителей животного мира имеет одну и ту же структуру.
Гем состоит из молекулы порфирина, в центре которой расположен ионFe2+, способный присоединять О2. Структура белковой части гемоглобина человека неоднородна,благодаря чему белковая часть разделяется на ряд фракций.
Большая часть гемоглобина взрослого человека (95—98 %) состоит из фракции А (от лат.adultus — взрослый); от 2 до 3 % всего гемоглобина приходится на фракцию А2; наконец, в эритроцитах взрослого человека находится так называемый фетальный гемоглобин (от лат.foetus— плод), или гемоглобинF,содержание которого в норме редко превышает 1—2 %. Гемоглобины А и А2 обнаруживают практически во всех эритроцитах, тогда как гемоглобин F присутствует в них не всегда.
Гемоглобин Fсодержится преимущественно у плода. К моменту рождения ребенка на его долю приходится 70 — 90 %. ГемоглобинFимеет большее сродство к О2, чем гемоглобин А, что позволяет тканям плода не испытывать гипоксии, несмотря на низкое напряжение кислорода в его крови.
Эта приспособительная реакция объясняется тем, что гемоглобин F труднее вступает в связь с 2,3-дифосфоглицериновой кислотой, которая уменьшает способность гемоглобина переходить в оксигемоглобин, а следовательно, и обеспечивать легкую отдачу О2 тканям.
Кроме так называемых нормальных, существуют более 300 аномальных гемоглобинов, встречающихся при различных заболеваниях системы крови. Все они отличаются друг от друга строением глобина.
Виды гемоглобина в зависимости от состояния гема и глобина:
-
оксигемоглобин (НbО2) — присоединивший четыре молекулы О2 (в артериальной крови -98 %, в венозной -65 %).
-
дезоксигемоглобин(ННb) — гемоглобин, отдавший кислород (в артериальной крови ~2 %, в венозной -35 %). Синонимы: восстановленный, peдуцированный.
-
метгемоглобин(MetHb) — имеет окисленные атомы железа (Fe3+), не присоединяющие О2 (в норме менее 3 %).
-
карбгемоглобин(НbСО2) — присоединяет СО2к глобину (находится в венозной крови); Синонимы: карбогемоглобин.
-
карбоксигемоглобин (НbСО) — СО имеет сродство к Нbв240 раз выше, чем О2, и блокирует присоединение О2 (например, если в крови Рсо = 0,5 мм рт. ст., то 50 % гемоглобина будет связано с СО);
В артериальной крови преобладает содержание ННbО2, от чего ее цвет приобретает алую окраску. В венозной крови до 35 % всего гемоглобина приходится на ННb.
СО2 связывается с Нbчерез аминную группу, образуя карбгемоглобин (ННbСО2), благодаря чему переносится от 10 до 20 % всего транспортируемого кровью СО2.
При отравлении угарным газом (СО), чтобы заменить Нb
Вопрос 6. Строение гема, производные гемоглобина
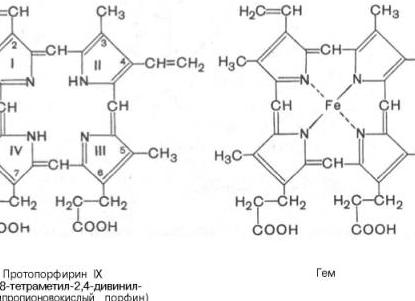
В состав молекулы гемоглобина входят 4 одинаковые гемовые группы. Гем представляет собой порфирин, содержащий центрально расположенный ион Fe2+. Является производным порфина, который представляет собой конденсированную систему из 4 пирролов, соединенных между собой метиновыми мостиками (-СН=). В зависимости от строения заместителей в порфине различают несколько разновидностей гемов.
-
гем IX – наиболее распространенная разновидность гема. Производным порфина в нем является протопорфирин IX (1,3,5,8 – тетраметил-2,4 – дивинил – 6, 7 – дипропионовокислый порфин);
-
гем а (формилпорфирин). Гем а вместо метильной группы содержит формильный остаток в восьмом положении (-СНО) и вместо одной винильной группы (во втором положении) изопреноидную цепь. Гем а входит в состав цитохромоксидазы;
-
гем с, в котором с винильными (-СН=СН2) группами в положениях 2 и 4 связаны остатки цистеина. Входит в состав цитохрома С;
-
гем представляет собой железодигидропорфирин 4.
Гем является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы, цитохромов, фермента триптофанпироллазы, катализируещего окисление троптофана в формилкинуренин.
Координационное число для атомов железа равно 6. В геме железо связано двумя ковалентными связями с атомами азота двух пиррольных колец и двумя координационными связями с атомами азота остальных пиррольных колец. Пятая и шестая координационные связи железа распределяются по-разному, в зависимости от того в состав какой белковой молекулы входит гем, в зависимости от её функций. Так, например, в цитохромах 5 и 6 координационные связи железа соединены с остатками гистидина и метионина. Такое расположение гема в цитохромах, необходимо для выполнения их специфической функции – переноса электронов в дыхательной цепи. Переходы Fe3++ е= Fe2+; Fe2+-е= Fe3+ создают возможность перебрасывать электроны от одного цитохрома к другому.
Рассмотрим подробнее расположение гема в составе гемоглобина (миоглобина). Гем расположен в щели между спиралями Е и F; его полярные пропионатные группы ориентированы к поверхности глобулы, а остальная часть находится внутри структуры и окружена не полярными остатками, за исключением His F8 и His F7. Пятое координационное положение атома железа занято атомом азота гетероциклического кольца проксимального гистидина His F8. Дистальный гистидин (His F7) расположен по другую сторону гемого кольца, почти напротив His F8, но шестое координационное положение атома железа остаётся свободным. Из двух не использованных координационных связей одна идет на соединение с белком, а вторая – на соединение с различными лигандами (физиологическими – кислород, вода и чужеродными – диоксид углерода, цианид и т.д.).
Производные гемоглобина
Гемоглобин взаимодействует с различными лигандами, для этого предназначена шестая координационная связь железа в геме. К производными гемоглобина относят:
-
оксигемоглобин HbО2 – соединение молекулярного кислорода с гемоглобином. Чтобы подчеркнуть тот факт, что валентность железа при этом связывании не меняется, реакцию называют не окислением, а оксигенацией; обратный процесс называется дезоксигенацией. Когда хотят специально отметить, что гемоглобин не связан с кислородом, его называют дезоксигемоглобином;
-
карбоксигемоглобин HbСО. Валентность железа в результате присоединения угарного газа (моноксида углерода – СО) также остается II. СО связывается с гемом примерно в двести раз прочнее, чем связь гем- О2. Не большая часть молекул гемоглобина (1%) в нормальных условиях связывает СО. У курильщиков же к вечеру эта величина достигает 20%. При отравлении монооксидом углерода наступает смерть от удушья, недостаточного снабжения тканей кислородом.
-
метгемоглобин (HbОН). Он не связывает молекулярный кислород. Атом железа в его молекуле находится в степени окисления 3+. Метгемоглобин образуется при воздействии на гемоглобин окислителей (оксидов азота, метиленового синего, хлоратов). В крови человека метгемоглобин находится в незначительных количествах, но при некоторых заболеваниях (например, нарушение синтеза ГЛ-6-фосфатДГ), либо при отравлении окислителями его содержание возрастает, что может быть причиной летального исхода, так как метгемоглобин не способен к переносу кислорода от легких к тканям;
-
цианметгемоглобин (HbСN) – метгемоглобин оказывает и положительное действие. Он связывает СN- с образованием цианметгемоглобина и спасает организм от смертельного действия цианидов. Поэтому для лечения отравлений цианидами применяют метгемоглобинообразователи (тот же нитрит Na);
-
карбгемоглобин образуется, когда гемоглобин связывается с СО2. Однако СО2 присоединяется не к гему, а к NН2 – группам глобина:
HbNh3 + CO2= HbNHCOO- + H+
Причем дезоксигемоглобин связывает больше СО2, чем оксигемоглобин. Образование карбгемоглобина используется для выведения СО2 из тканей к легким. Этим путем выводится 10-15% СО2.
Вопрос 7. Механизм насыщения гемоглобина кислородом
За счет шестой координационной связи к атому железа присоединяется молекула кислорода с образованием оксигемоглобина. Пиррольные кольца гема расположены в одной плоскости в то время как атом железа несколько выступает из этой плоскости. Присоединение кислорода «выпрямляет» молекулу гема: железо перемещается в плоскость пиррольных колец на 0,06 нм, так как диаметр координационной сферы атома железа уменьшается. Гемоглобин связывает 4 молекулы кислорода (по одной молекуле на гем в каждой субъединице). Оксигенерирование сопровождается значительными конформационными изменениями в гемоглобине. Перемещаясь в плоскость пиррольных колец, Fe, соединенное в 5 координационном положении с остатком HisF8 «тянет» пептидную цепь на себя. Происходит изменение конформации этой цепи и связанных с ней других полипептидных цепей, поскольку один протомер соединен многими связями с другими протомерами. Это явление называют коопреативностью изменения конформации протомеров. Изменения конформации таковы, что первоначальное связывание О2 с одной субъединицей ускоряет связывание молекул кислорода с отстальными субъединицами. Это явление известно как гомотропный положительный кооперативный эффект (гомотропный, потому что участвует только кислород). Именно это обуславливает сигмовидный характер кривой насыщения гемоглобина кислородом. Четвертая молекула кислорода присоединяется к гемоглобину в 300 раз легче, чем первая молекула. Чтобы составить себе более ясное представление об этом механизме, целесообразно рассматривать структуру гемоглобина в виде двух гетеродимеров, образованных и — субъединицами: 1 1 и 2 2. Незначительный сдвиг атома железа приводит к тому, что одна / пара субъединиц, поворачивается относительно другой / — пары. При этом между субъединицами разрушаются нековалентные связи, обусловленные электростатическими взаимодействиями. Один набор связей между димерами замещается на другой, происходит их относительная ротация.
Четвертичная структура частично оксигенерированного гемоглобина описывается как Т-состояние (от англ. Taut –напряжение), полностью оксигенерированному гемоглобину (HbО2) отвечает R – состояние (relaxed- релаксирование). Состояние характеризуется меньшим сродством к кислороду, вероятности перехода из Т- формы в R-форму повышается по мере последовательного оксигенерирования каждой из 4 гемогрупп. Солевые мостики (нековалентные связи) по мере присоединения кислорода разрушаются, увеличивая вероятность перехода из Т – формы в R- форму (состояние высокого сродства).
Гемоглобин. Формы гемоглобина
Гемоглобин (Нb) составляет около 95 % белка эритроцитов. Один эритроцит содержит 280 млн молекул гемоглобина. Hb относится к сложным белкам – хромопротеидам. В его состав входит железосодержащая простетическая группа — гем (4 %) и простой белок типа альбумина — глобин (96 %). Молекула Hb – тетрамер, состоящий из 4 субъединиц – полипептидных цепей глобина (2 цепи α и 2 цепей β, γ, δ, ε, ζ в разных комбинациях), каждая из которых ковалентно связана с одной молекулой гема. Гем (небелковая пигментная группа) построен из 4 молекул пиррола, образующих порфириновое кольцо, в центре которого находится атом железа (Fe2+). Основная функция Hb – перенос O2. Синтез Hb происходит на ранних стадиях развития эритробластов. Синтез глобина и гема протекает в эритроидных клетках независимо друг от друга. У всех видов животных гем одинаков; различия свойств Нb обусловливаются особенностями строения белковой части его молекулы, т. е. глобина. У взрослого человека в норме в крови содержится три типа гемоглобина: НbА (96–98 %); НbА2 (2–3 %) и НbF (1–2 %). Глобин человека состоит из 574 остатков различных аминокислот, образующих четыре попарно одинаковые полипептидные цепи: две α-цепи — по 141 аминокислотному остатку и две β-цепи — по 146 остатков аминокислот. Общая формула молекулы гемоглобина человека — НbА-α2β2. В состав НbА2 входят две α и две δ-цепи (α2δ2), а НbF — две α- и две γ-цепи (α2γ2). Синтез цепей гемоглобина обусловливается структурными генами, ответственными за каждую цепь, и генами-регуляторами, осуществляющими переключение синтеза одной цепи на синтез другой. На ранних стадиях эмбриогенеза (с 19-го дня по 6-ю неделю) синтезируются в основном эмбриональные гемоглобины – HbP (Гоуэр1 (ξ2ε2), Гоуэр2 (α2ε2) и Портлад (ξ2γ2)). В течение указанного времени кроветворение постепенно переключается с желточного мешка на печень. При этом выключается синтез ξ- и ε-цепей и включается синтез γ-, β-, δ-цепей. К 4-му месяцу эритроциты печеночного происхождения доминируют в циркулирующей крови и содержат фетальный гемоглобин (HbF). Гемоглобины различаются по биохимическим, физико-химическим, иммунобиологическим свойствам. Так, НbF по сравнению с НbА более устойчив к щелочам, менее — к температурным влияниям, обладает более высоким сродством к кислороду и способен быстрее отдавать углекислоту. К моменту рождения имеются оба типа Нb (НbF и НbА). Затем «фетальный» Нb постепенно сменяется «взрослым». Иногда у взрослых может обнаруживаться минимальное (до 2 %) количество НbF, что не имеет патологического значения. При мутациях в структурных генах, контролирующих синтез Нb, когда заменяются аминокислоты, в полипептидных цепях глобина образуются аномальные гемоглобины. Известно более 400 аномальных Нb, для которых характерны нарушения первичной структуры той или иной полипептидной цепи НbА (гемоглобинопатии, или гемоглобинозы). Основными видами таких Hb являются: – серповидно-клеточный гемоглобин (НbS) — возникает при замене глютаминовой кислоты на валин в β-цепи; в этом случае развивается серповидно-клеточная анемия; – метгемоглобины (около 5 разновидностей) образуются, если гистидин заменяется на тирозин; в этом случае окисление Нb в метгемоглобин, постоянно происходящее в норме, становится необратимым.
Количество гемоглобина в крови является важным клиническим показателем дыхательной функции крови. Оно измеряется в граммах на литр крови:
Лошади – в среднем 80-140 г/л, КРС – 90-120 г/л, Свиньи – 90-110 г/л, Овцы – 70-110 г/л, Птицы – 80-130 г/л, Пушные звери – 120-170 г/л, Человек – 120-170 г/л. Формы гемоглобина: Оксигемоглобин – соединение с O2. Карбогемоглобин (HbCO2) – соединение с CO2. Метгемоглобин (MetHb) – Hb, содержащий Fe гема в трёхвалентной форме (Fe3+); не переносит О2. Образуется в результате воздействия на эритроциты сильных окислителей (нитраты, нитриты, парацетамол, никотин, сульфаниламиды, лидокаин). Карбоксигемоглобин – соединение с CO. Гликозилированный Hb – Hb, модифицированный ковалентным присоединением к нему глюкозы (норма 5,8-6,2%). К одним из первых признаков сахарного диабета относят увеличение в 2-3 раза количества гликозилированного Hb. Солянокислый гематин – результат взаимодействия ферментов и соляной кислоты желудочного сока с Hb. Окрашивает дно эрозий и язв в коричневый цвет и придаёт рвотным массам при желудочном кровотечении вид «кофейной гущи». Кристаллы гемоглобина у животных имеют видовые особенности, что используется для идентификации крови или её следов в судебной ветеринарии и медицине (солянокислый гематин в пробе Тейхмана). Гемоглобин высоко токсичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. Например, особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
2. Гемоглобин, его структура, свойства, разновидности, соединения и функции
Одной из важнейших функций крови является перенос поглощаемого в легких кислорода к органам и тканям и транспорт углекислого газа в обратном направлении.
Ключевую роль в этом процессе играют эритроциты, благодаря содержанию в них красного кровяного пигмента ― гемоглобина.
Внутриэритроцитарная локализация Нb:
-
Обеспечивает уменьшение вязкости крови.
-
Уменьшает онкотическое давление, предотвращая потерю воды тканями.
-
Предупреждает потерю Нb при фильтрации крови в почках.
По химической природе ― это хромопротеид, состоящий из белка глобина (96%) и простетическая группы гема (4%). Гема содержится 4 группы. Он представляет собой протопорфирин, в центре которого расположен ион Fe++.
Ключевую роль в деятельности Нb играет ион Fe++.
Функции гемоглобина:
-
Транспорт О2 в виде оксигемоглобина (HHbO2). Одна молекула Нb присоединяет 4 молекулы кислорода. 1 г Нb связывает 1,34 мл О2.
-
Транспорт СО2.
-
Участвует в поддержании кислотно-щелочного состояния (гемоглобиновый буфер).
Соединения Нb:
1. Оксигемоглобин (НHbО2). Гемоглобин, присоединивший 4О2. В артериальной крови его содержится около 98%, а в венозной — около 60%. После отдачи О2 НHb получил название восстановленный, редуцированный гемоглобин или дезоксигемоглобин). Гемоглобин обладает высоким сродством к кислороду.
2. Карбогемоглобин (НHbСО2) ― соединение гемоглобина с СО2.
3. Метгемоглобин (MetHb). Образуется под влиянием сильных оки-слителей (перманганат калия, анилин, нитриты, пирогаллол и др). При этом Fe++ превращается в Fe+++. Соединение прочное.
4. Карбоксигемоглобин (НHbCО) ― соединение гемоглобина с угарным газом (СО). Соединение в 150 — 200 раз прочнее НHbО2. При содержании во вдыхаемом воздухе 0,1% СО 80% Нb превращается в карбоксигемоглобин. При содержании 1% ― гибель через несколько минут.
Физиологическими соединениями Hb являются оксигемоглобин и карбогемоглобин.
Миоглобин ― дыхательный пигмент или мышечный гемоглобин ― содержится в скелетных мышцах, миокарде. Обладает большим сродством к кислороду по сравнению с гемоглобином. Связывает до 14%О2 в организме. Его роль заключается в обеспечении кислородом мышцу в период ее сокращения, когда происходит пережатие капилляров и кровоток через ткань прекращается. В этот период главным источником кислорода является миоглобин, который затем в фазу расслабления мышц и восстановления кровотока опять «запасается» кислородом.
Синтез Нb происходит в эритробластах и нормобластах в костном мозге.
Состояние сниженного количества Hb в единице объема крови (чаще всего при одновременном снижении количества эритроцитов) получило название анемия.
Анемия для мужчин при содержании Hb меньше 130 г/л, для женщин ― меньше 120 г/л (при беременности ― меньше 110 г/л).
Разновидности Hb:
-
HbP ― (примитивный) ― на 7—12 неделе внутриутробного развития.
-
HbF ― фетальный (плодный) ― на 9-й неделе внутриутробного развития.
-
HbA ― гемоглобин взрослых ― появляется перед рождением.
НbF ― обладает большим сродством с О2 и насыщается на 60% при таком рО2 , когда HbA матери только на 30%. Благодаря данному свойству HbF вполне обеспечивает кислородом ткани плода в условиях сравнительно низкого рО2 в артериальной крови плода. В течение 1 года жизни HbF почти полностью заменяется HbA.
В норме содержание Hb в крови мужчин колеблется в пределах 130 — 160 г/л , в крови женщин ― 115 ― 145 г/л. Общее содержание Hb в крови 700 г.