 [Эрадикационная терапия схемы]
[Эрадикационная терапия схемы]
Современные аспекты эрадикации Helicobacter pylori
Helicobacter pylori — одна из самых распространенных инфекций в мире. Эти бактерии играют ключевую роль в развитии гастрита, язвенной болезни, В-клеточной лимфомы и рака желудка. Эрадикационная терапия считается успешной, если обеспечивает частоту излечения более 80%.
Резистентность к антибиотикам
Резистентность к антибиотикам — ведущий фактор неудачной терапии первой и второй линии. Резистентность варьирует в разных странах, есть также региональные различия (табл.). Это объясняет, почему невозможно предложить стандартизированную терапию, которая могла бы быть применена во всем мире. Кроме того, устойчивость непрерывно изменяется вследствие злоупотребления антибиотиками для лечения других заболеваний и вследствие миграции населения. Ряд авторов считают, что периодически должны проводиться исследования чувствительности к антибиотикам, чтобы использовать в лечении антибиотики с более низкой резистентностью. Консенсус Маастрихт III (2005) также подчеркивает роль устойчивости к антибиотикам при выборе терапии не только первой, но и второй линии [15]. Фактически тройная терапия, которая включает кларитромицин, должна назначаться только в тех регионах, где резистентность к этому антибиотику не превышает 15–20%. Широкое использование кларитромицина для лечения инфекций дыхательных путей, особенно у детей, и метронидазола в гинекологии и при паразитарных инвазиях в развивающихся странах увеличило первичную устойчивость H. pylori к этим двум антибиотикам. Резистентность к метронидазолу в некоторых регионах достигает 100%. В развитых странах, после проведенных исследований, в качестве замены кларитромицина и метронидазола предложены фторхинолоны, к которым H. pylori все еще имеет низкую резистентность. Однако H. pylori может легко развить устойчивость к фторхинолонам, так что они могут быть полезны только в ближайшее время.
Терапия первой линии
Следует подчеркнуть, что в связи с ростом лекарственной резистентности H. pylori к антибиотикам для эрадикации целесообразно применять оригинальные ингибиторы протонной помпы (эзомепразол) и оригинальный кларитромицин (Клацид).
Ингибиторы протонной помпы (ИПП) в основе тройной схемы были терапией первой линии в течение более десяти лет. Согласно Маастрихт III [15] традиционное лечение первой линии — ИПП (два раза в день), амоксициллин (1 г два раза в день) и кларитромицин (500 мг два раза в день) назначают в течение 10 дней. Современный метаанализ [4] продемонстрировал, что 10-дневная и 14-дневная тройная терапия давали большую частоту эрадикации, чем 7-дневный курс лечения. XXII ежегодная конференция европейской группы по изучению Helicobacter (EHSG), прошедшая в сентябре 2009 г. в г. Порту (Португалия), подтвердила лидирующие позиции тройной терапии для эрадикации H. pylori [18].
Маастрихт III (2005) рекомендовал четырехкомпонентную схему в качестве альтернативной терапии первой линии [15]. Для лечения по этой схеме используются следующие препараты: ИПП в стандартной дозе 2 раза в день + Де-нол (висмута трикалия дицитрат) 120 мг 4 раза в день + амоксициллин 1000 мг 2 раза в день + кларитромицин 500 мг 2 раза в день в течение 10 дней. С учетом роста резистентности к кларитромицину четырехкомпонентная терапия в настоящее время занимает лидирующие позиции.
В 2008 г. Европейской группой по изучению H. pylori последовательная терапия была рекомендована в качестве терапии первой линии: 5 дней — ИПП + амоксициллин 1000 мг 2 раза в день; затем 5 дней — ИПП + кларитромицин 500 мг 2 раза в день + тинидазол 500 мг 2 раза в день [20]. Исследования показывают, что последовательная терапия ведет к эрадикации в 90%, то есть превосходит эффективность стандартной тройной терапии. Частота побочных эффектов и отсутствие комплаенса при этом такие же, как при тройной терапии.
В метаанализе 10 клинических исследований 2747 пациентов [12] последовательная терапия оказалась эффективнее стандартной тройной терапии для эрадикации инфекции H. pylori у пациентов, впервые проходящих лечение. Частота эрадикации H. pylori была 93,4% (91,3–95,5%) при последовательной терапии (n = 1363) и 76,9% (71,0–82,8%) при стандартной тройной терапии (n = 1384). Большинство пациентов, включенных в эти исследования, были итальянцами, поэтому необходимо дальнейшее международное исследование. Частота эрадикации у кларитромицин-резистентных пациентов при последовательной терапии составила 83,3%, тройной терапии — 25,9% (отношение шансов (ОШ) 10,21; достоверный интервал (ДИ) 3,01–34,58; р < 0,001) [7].
Терапия второй линии
Европейское исследование показало, что комбинация ИПП (два раза в день) c левофлоксацином (500 мг два раза в день) и амоксициллином (1 г два раза в день) эффективна в качестве терапии второй линии и может иметь меньше побочных эффектов, чем традиционная квадротерапия [9]. Частота эрадикации по этой схеме в качестве терапии второй линии — 77% [8]. Схема с левофлоксацином в настоящее время занимает ведущие позиции в качестве терапии второй линии.
Квадротерапия (ИПП два раза в день, висмут 120 мг четыре раза в день, метронидазол 250 мг четыре раза в день, тетрациклин 500 мг четыре раза в день) в России не должна применяться широко в связи с тотальной резистентностью к метронидазолу.
Терапия третьей линии
XXII конференция Европейской группы по изучению H. pylori (EHSG), прошедшая в Порту (Португалия) в сентябре 2009 г., рекомендовала в качестве терапии третьей линии схему — ИПП (два раза в день), амоксициллин (1 г два раза в день) и рифабутин (150 мг два раза в день) в течение 10 дней [18]. Резистентность к рифабутину также возможна, и, поскольку он входит в терапию первой линии туберкулеза, его использование должно быть ограничено. Недавно выполнено немецкое исследование более чем у 100 пациентов с по крайней мере одной предыдущей неудачной эрадикацией и резистентностью H. pylori к метронидазолу и кларитромицину. У этих больных тройная терапия с эзомепразолом (40 мг), моксифлоксацином (400 мг) и рифабутином (300 мг 1 раз в день) в течение 7 дней дала частоту эрадикации 77,7% [21].
Дополнительная терапия
Возникновение побочных эффектов может уменьшить комплаенс пациентов и ведет к возникновению резистентности бактерий. Это стимулировало множество работ по поиску альтернативных вариантов лечения H. pylori. Недавнее исследование показало, что дополнение терапии пробиотическими штаммами Bacillus и Streptococcus faecium увеличивает комплаенс, уменьшает частоту побочных эффектов и увеличивает частоту эрадикации [10]. Наиболее изученные пробиотики — продуцирующие молочную кислоту бактерии рода Lactobacillus [14]. Пробиотики играют роль в стабилизации барьерной функции желудка и уменьшают воспаление слизистой оболочки [14]. Некоторые пробиотики, такие как Lactobacilli и Bifidobacteria, выделяют бактериоцины, которые могут ингибировать рост H. pylori и уменьшать ее адгезию к эпителиоцитам желудка [19]. Частота эрадикации при применении пробиотиков увеличивалась не всегда, но частота побочных эффектов, особенно диареи, тошноты и нарушения вкуса уменьшалась значительно [19]. Крупный метаанализ стандартной тройной терапии с пробиотиками и без них показал значительное сокращение побочных эффектов и небольшое увеличение частоты эрадикации [17]. В метаанализе 8 рандоминизированных исследований частота эрадикации H. pylori при сочетании тройной терапии с лактобактериями составила 82,26%, без пробиотиков — 76,97% (р = 0,01). Общая частота побочных эффектов не отличалась. Однако при добавлении лактобактерий уменьшалась частота диареи, вздутия живота и нарушения вкуса [22]. Таким образом, применение пробиотиков (например, Линекса) может увеличить частоту эрадикации и уменьшить побочные эффекты.
Терапия будущего
Терапевтическая вакцинация могла бы спасти миллионы жизней, была бы более рентабельна и имела бы меньшее количество потенциальных осложнений, чем назначение антимикробных средств. Первые исследования в моделях на животных продемонстрировали эффективность иммунизации и дали большие надежды на создание человеческой вакцины [1]. Однако разработка вакцины против этого уникального микроорганизма оказалась очень трудной. Первоначально полагалось, что вакцинация должна проводиться перорально, потому что H. pylori — неинвазивный патоген. Однако, из-за кислого содержимого желудка, найти вакцину, которая смогла бы пройти эту среду и сохранить эффективность, оказалось проблематично. Другая трудность развития оральных вакцин — возможность дополнительного стимулирования иммунной системы [1]. При тестировании на людях оральной терапевтической вакцины, которая состояла из рекомбинанта апоэнзима уреазы H. pylori и термолабильного токсина Escherichia coli, у большого количества пациентов возникла диарея. Однако у этих пациентов уменьшилась бактериальная нагрузка H. pylori [16]. Развитие знаний об иммуногенности H. pylori поможет в разработке коммерчески доступной вакцины.
Заключение
XXII конференция EHSG (Порту, Португалия, сентябрь 2009 г.) [18] по-прежнему рекомендует тройную терапию в течение 10 дней в качестве ведущей схемы эрадикации H. pylori. Альтернативой тройной терапии является четырехкомпонентная схема с ИПП, Де-нолом, амоксициллином и кларитромицином. Резистентность H. pylori к антибиотикам — возрастающая проблема, поэтому ее частота должна исследоваться на региональном и международном уровне. Терапия, основанная на левофлоксацине, эффективна в качестве терапии второй линии с меньшим количеством побочных эффектов в сравнении с квадротерапией. Схемы с рифабутином — терапия третьей линии в клинически сложных случаях.
Литература
-
Aebischer T., Schmitt A., Walduck A. K. et al. Helicobacter pylori vaccine development; facing the challenge // Int. J. Med. Microbiol. 2005. V. 295, № 3. P. 343–353.
-
Bang S. Y., Han D. S., Eun C. S. et al. Changing patterns of antibiotic resistance of Helicobacter pylori in patients with peptic ulcer disease // Korean J. Gastroenterol. 2007. V. 50. P. 356–362.
-
Boyanova L., Gergova G., Nikolov R. et al. Prevalence and evolution of Helicobacter pylori resistance to 6 antibacterial agents over 12 years and correlation between susceptibility testing methods // Diagn. Microbiol. Infect. Dis. 2008. V. 60, № 2. P. 409–415.
-
Calvet X., Garcia N., Lopez T. et al. A meta-analysis of shorl versus long therapy with a proton pump inhibitor, clarithromycin and either metronidazole or amoxicillin for treating Helicobacter pylori infection // Aliment. Pharmacol. Ther. 2000. V. 14, № 4. P. 603–609.
-
Chisholm S. A., Teare E. L., Davies K. et al. Surveillance of primary antibiotic resistance of Helicobacter pylori at centers in England and Wales over a six-year period (2000–2005) // Euro Surveill. 2007. № 12. P. E3–E4.
-
De Francesco V., Zullo A., Hassan С. et al. The prolongation of triple therapy for Helicobacter pylori does not allow reaching therapeutic outcome of sequential scheme: a prospective, randomised study // Dig. Liver. Dis. 2004. V. 36, № 3. P. 322–326.
-
Gatta L., Vakil N., Leandro G. et al. Sequential Therapy or Triple Therapy for Helicobacter pylori Infection: Systematic Review and Meta-Analysis of Randomized Controlled Trials in Adults and Children // Am. J. Gastroenterol. 2009. Oct 20. [Epub ahead of print.]
-
Gisbert J. P., Bermejo F., Castro-Fernandez M. et al. H. pylori Study Group of the Asociacion Espanola de Gastroenterologia. Second-line rescue therapy with levofloxacin alter H. pylori treatment failure: a Spanish multicenter study of 300 patients // Am. J. Gastroenterol. 2008. V. 103, № 1. P. 71–76.
-
Gisbert J. P., De la Morena F. Systematic review and meta-analysis: levofloxacin-based rescue regimens after Helicobacter pylori treatment failure // Aliment. Pharmacol. Ther. 2006. V. 23, № 1. P. 35–44.
-
Gotteland M., Brunser O., Cruchet S. Systematic review: are probiotics useful in controlling gastric colonization by Helicobacter pylori? Aliment. Pharmacol. Ther. 2006. V. 23, № 10. P. 1077–1086.
-
Hu C. T., Wu C. C., Lin C. Y. et al. Resistance rate to antibiotics of Helicobacter pylori isolates in eastern Taiwan // J. Gastroenterol. Hepatol. 2007. V. 22, № 7. P. 720–723.
-
Jafri N. S., Hornung C. A., Howden C. W. Meta-analysis: sequential therapy appears superior to standard therapy for Helicobacter pylori infection in patients naive to treatment // Ann. Intern. Med. 2008. V. 19, № 4. P. 243–248.
-
Kobayashi I., Murakami K., Kato M. et al. Changing antimicrobial susceptibility epidemiology of Helicobacter pylori strains in Japan between 2002 and 2005 // J. Clin. Microbiol. 2007. V. 45, № 10. P. 4006–4010.
-
Lesbros-Pantoflickova D., Corthesy-Theulaz I., Blum A. L. Helicobacter pylori and probiotics // J. Nutr. 2007. V. 137, № 8. P. 812S–818S.
-
Malfertheiner P., Megraud F., O’Morain C. et al. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report // Gut. 2007. V. 56, № 7. P. 772–781.
-
Michetti P., Kreiss C., Kotloff K. L. et al. Oral immunization with urease and Escherichia coli heat-labile enterotoxin is safe and immunogenic in Helicobacter pylori-infected adults // Gastroenterology. 1999. V. 116, № 6. P. 804–812.
-
Nista E. C., Candelli M., Cremonini F. et al. Bacillus clausii therapy to reduce side-effects of anti-Helicobacter pylori treatment: randomized, double-blind, placebo controlled trial // Aliment. Pharmacol. Ther. 2004. V. 20, № 6. P. 1181–1188.
-
O’Connor A., Gisbert J., O’Morain C. Treatment of Helicobacter pylori infection // Helicobacter. 2009. V. 14, Suppl. 1. P. 46–51.
-
Park S. K., Park D. I., Choi J. S. et al. The effect of probiotics on Helicobacter pylori eradication // Hepatogastroenterology. 2007. V. 54, № 6. P. 2032–2036.
-
Vaira D., Zullo A., Vakil N. et al. Sequential therapy versus standard triple-drug therapy for Helicobacter pylori eradication: a randomized trial // Ann. Intern. Med. 2007. V. 146, № 3. P. 556–563.
-
Van der Poorten D., Katelaris P. H. The effectiveness of rifabutin triple therapy for patients with difficull-to-eradicate Helicobacter pylori in clinical practice // Aliment. Pharmacol. Ther. 2007. V. 26, № 7. P. 1537–1542.
-
Zou J., Dong J., Yu X. Meta-analysis: Lactobacillus containing quadruple therapy versus standard triple first-line therapy for Helicobacter pylori eradication // Helicobacter. 2009. V. 14, № 5. P. 97–107.
-
Zullo A., Pema F., Hassan C. et al. Primary antibiotic resistance in Helicobacter pylori strains isolated in northern and central Italy // Aliment. Pharmacol. Ther. 2007. V. 25, № 6. P. 1429–1434.
В. В. Цуканов*, О. С. Амельчугова*, П. Л. Щербаков**, доктор медицинских наук, профессор
*НИИ медицинских проблем Севера Сибирского отделения РАМН, Красноярск **ЦНИИ гастроэнтерологии, Москва
Контактная информация об авторах для переписки: [email protected]
Первичная резистентность к антибиотикам (%) в разных странах
Эрадикация хеликобактер пилори — схемы лечения
В последние годы выяснена роль инфекции Helicobacter pylori (Hp) в патогенезе язвенной болезни (ЯБ). Hp может усиливать факторы агрессии и ослабевать факторы защиты слизистой.
Современные подходы к диагностике и лечению инфекции Нр обсуждались на XXIV заседании Международной рабочей группы по Helicobacter pylori и родственным бактериям при хронических воспалительных процессах пищеварительного тракта и раке желудка, которое состоялось в г. Дублине 11-13 cентября 2011 г. Итоговый документ опубликован в журнале Gut (2012), а Положения этого документа являются основным руководством по проблеме Нр в странах Европейского Союза.Итоговый документ Маастрихтской конференции предлагает планировать лечение инфекции Нр, предусматривая возможность его неудачи. Поэтому предлагается рассматривать его как единый блок, включающий не только эрадикационную терапию первой линии, но и (в случае сохранения Нр) — второй и третьей линии.
Схемы лечения Helicobacter pylori первой линии
Схемы лечения первой линии рекомендуются в зависимости от наличия в популяции резистентных штаммов к кларитромицину. Следует отказаться от тройной терапии с ингибиторами протонной помпы (ИПП) и кларитромицином при уровне резистентности к кларитромицину в регионе более 15-20%.
В регионах с низким уровнем резистентности к кларитромицину схемы с кларитромицином рекомендуются в качестве первой линии терапии. Альтернативой служит назначение квадротерапии с препаратом висмута: ИПП (Омез, Омепразол, Париет) + соль висмута + метронидазол+ тетрациклин. Увеличение продолжительности тройной терапии с ИПП и кларитромицином с 7 до 10-14 дней повышает уровень успешной эрадикации на 5%. Оптимальная длительность лечения — 10 дней.
У пациентов с аллергией на пенициллин, в регионах с низкой резистентностью к кларитромицину в качестве терапии первой линии может быть назначена тройная терапия (ИПП + кларитромицин + метронидазол).Эффективность схем тройной терапии (ИПП + кларитромицин + метронидазол) и (ИПП + кларитромицин + амоксициллин) эквивалентна при отсутствии резистентности к метронидазолу.
В качестве терапии первой линии может быть применена «последовательная» схема: ИПП + амоксициллин — 5 дней, затем ИПП+ кларитромицин + метронидазол или тинидазол — 5 дней.
Назначение высокой (увеличение в 2 раза) дозы ИПП (дважды в день) повышает эффективность тройной терапии.Максимальный эффект был замечен в исследованиях, когда использовались ИПП второго поколения: эзомепразол (Нексиум) и рабепразол (Рабепразол).
Некоторые про- и пребиотики демонстрируют обнадеживающие результаты в качестве дополнительной терапии, способной уменьшить побочные эффекты.
Схемы лечения Helicobacter pylori второй линии
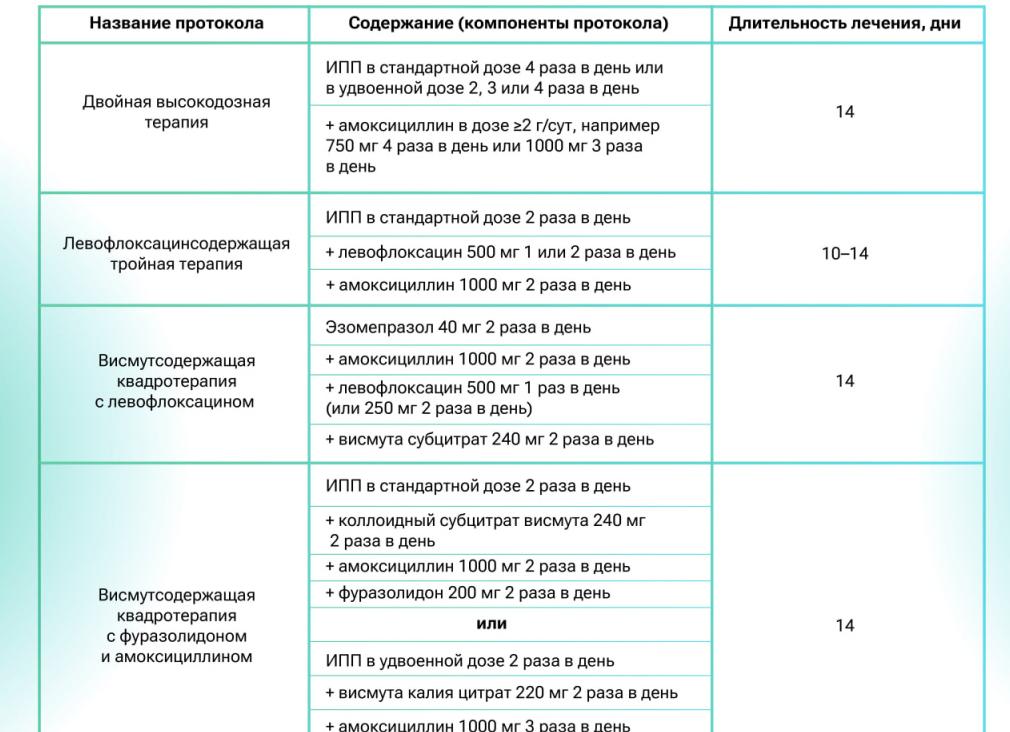
В качестве терапии второй линии при отсутствии эффективности схемы с ИПП и кларитромицином рекомендуется назначение квадротерапии с препаратом висмута или тройной терапии с левофлоксацином (ИПП + амоксициллин + левофлоксацин). Однако следует учитывать растущий уровень резистентности к левофлоксацину.
В регионах с высоким уровнем резистентности к кларитромицину в качестве терапии первой линии рекомендуется квадротерапия с препаратом висмута. Если эту схему невозможно осуществить, рекомендуется «последовательная» терапия или квадротерапия без препарата висмута (ИПП + кларитромицин + амоксициллин + метронидазол или тинидазол). В качестве терапии второй линии при отсутствии эффективности квадротерепии с препаратом висмута рекомендуется назначение тройной терапии с левофлоксацином.
Дозы лекарственных препаратов, используемые в схемах эрадикации
Амоксициллин — по 1000 мг 2 раза в день; Де-нол (препарат висмута) — 120 мг 4 раза в день; Кларитромицин — по 500 мг 2 раза в день; Левофлоксацин — 500 мг 2 раза в день; Метронидазол — 400/500 мг 2 раза в день (3 раза в день в квадротерапии с препаратом висмута); Тетрациклин — 500 мг 4 раза в день; Тинидазол — 500 мг 2 раза в день.
Терапия третьей линии
После неэффективной терапии второй линии лечение должно основываться на тестах чувствительности к антибиотикам, где это возможно.
Контроль проведения терапии: для определения эффективности эрадикации интервал после эрадикационной терапии должен составлять не менее 4-х недель; частота рецидивов спустя 6 месяцев или год после эрадикации в основном связана с реинфекцией.
При неосложненной язве двенадцатиперстной кишки продолжение лечения ИПП не рекомендуется.
При язве желудка и осложненной язве двенадцатиперстной кишки рекомендуется продолжение лечения ИПП.
Эрадикационная терапия при кровотечениях из язв должна начинаться с момента возможности питания через рот.
Эрадикационная терапия
Трехкомпонентная терапия с висмута трикалия дицитратом
1. Висмута трикалия дицитрат внутрь
8 мг/кг 2 раза в сутки
+ Амоксициллин внутрь
или кларитромицин внутрь
+ метронидозол внутрь или
нифурател внутрь или
фуразолидон
2. Висмута трикалия дицитрат
+ кларитромицин внутрь
Трехкомпонентная терапия с ИПП
1. ИПП
+ кларитромицин
+ метронидазол или
нифурател или
2. ИПП
+амоксициллин
+кларитромицин
Четырехкомпонентная терапия
Висмута трикалия дицитрат
+ амоксициллин или
кларитромицин 7-14 дней
+ нифурател или
+ ИПП
В связи с выраженною резистентностью к НР-инфекцией рекомендуется назначение следующих схем:
1. Омепразол + Де-нол + Флемоксин-солютаб 10 дн.
2. Эзомепразол + Де-нол + антибиотик (Амоксициллин 10 дн.)
3. Эзомепразол + Де-нол + антибиотик (5 дн. Амоксициллин + 5 дн. Вильпрафен (джозамицин))
Домперидон внутрь за 15-20 минут до еды и перед сном 0,25 мг/кг 3-4 раза в сутки, 10-14 дней
Метоклопромид внутрь 0,1 мг/кг 3-4 раза в сутки, 10-14 дней
Омепрозол внутрь 20 мг 2 раза в сутки или 40 мг 1 раз в сутки (вечером) 7-14 суток или
Рабепрозол внутрь 20 мг 2 раза в сутки 7-14 дней или эзомепрозол внутрь 20 мг 2 раза в сутки 7-14 дней
Нифуратель 15 мг\ кг 2рвсут
ФЕРМЕНТЫ
Хронические воспалительные заболевания органов пищеварения или даже временные дисфункции работы пищеварительного тракта всегда сопровождаются нарушением фукционирования органов, обеспечивающих нормальное переваривание пищи. Переваривание пищи представляет собой процесс превращения сложных структур продуктов питания в более простой вид, котором они могут абсорбироваться в кишечнике. В осуществлении этого процесса принимают участие прежде всего пищеварительные железы, в секрете которых содержатся ферменты (таб. № 1), представленные в таб.
Нарушение процессов пищеварения (мальдигестия) и всасывания (мальабсорбция) являются наиболее распространенными синдромами в практике врача-педиатра и гастроэнтеролога. Их развитие может быть обусловлено недостаточной продукцией пищеварительных ферментов или снижением их активности.
Поэтому основным направлением в лечении больных с синдромами мальдигестии и мальабсорбции является заместительная терапия ферментами.
У детей с заболеваниями органов пищеварения широко используются витаминные препараты, антацидные и антисекреторные лекарственные средства, репаранты и цитопротекторы, желчегонные и гепатопротекторы, а также другие медикаменты. Эти лекарственные средства с успехом применяются на всех этапах лечения: в поликлинике, в стационаре, в санаторно-курортных условиях. Что касается ферментных препаратов, то практически во всех руководствах и справочниках они рекомендуются при заболеваниях поджелудочной железы. В литературе приводится мало данных об особенностях действия ферментных препаратов у детей в возрастном аспекте. По сравнению с другими препаратами, существенным образом изменившими терапевтические подходы, например в лечении ЯБ, арсенал ферментных и, особенно, антиферментных средств за последние 2-3 десятилетие увеличился незначительно.
Тем не менее, интерес к этой группе лекарственных средств в последнее время вырос. Новые технологии способствовали созданию ферментных препаратов, оказавшихся более эффективными в лечении больных с гастропатологией. Убедительным примером является использование у детей и взрослых с муковисцидозом капсулированных ферментных препаратов и микротаблеток, которые позволили изменить взгляд на течение и прогноз заболевания.
Если в общей медицинской практике, включая хирургию, гинекологию, дерматологию, отоларингологию и др., ферментные препараты давно занимают одно из 1-ых мест, то в гастроэнтерологии их перечень невелик. Нет единой классификации ферментных лекарственных средств, что затрудняет выбор нужного препарата.
Как любое другое лекарственное средство, ферментные препараты должны отвечать определенным требованиям:
-
нетоксичность;
-
хорошая переносимость;
-
отсутствие существенных побочных реакций;
-
оптимум действия в интервале рН 5-7;
-
устойчивость к действию соляной кислоты, пепсинов и др. протеаз;
-
содержание достаточного количества активных п/в-ых ферментов;
-
иметь длительный срок хранения.
В зависимости от своего состава ферментные препараты можно разделить на несколько групп:
1. экстракты СОЖ, основным действующим веществом которых является пепсин (абомин, ацидинпепсин, пепсидил, пепсин)
2. панкреатические энзимы, представленные амилазой, липазой и трипсином (панкреатин, панцитрат, мезим-форте, трифермент, пангрол, пролипаза, панкурмен, нео-нампур, креон)
3. ферменты, содержащие панкреатин, компоненты желчи, гемицеллюлозу (дигестал, кадистал, рестал, котазим-форте, мензим, панстал, рустал, энзистал).
4. комбинированные ферменты
а) комбицин – панкреатин
+ экстракт рисового грибка
б) панзинорм-форте:
липаза, амилаза трипсин, эммотрипсин, холевая к-та, гидрохлориды ам/к
в) панкреофлэт – панкреатин
+ диметикон