 [Белковый состав плазмы]
[Белковый состав плазмы]
Нарушение белкового состава плазмы крови
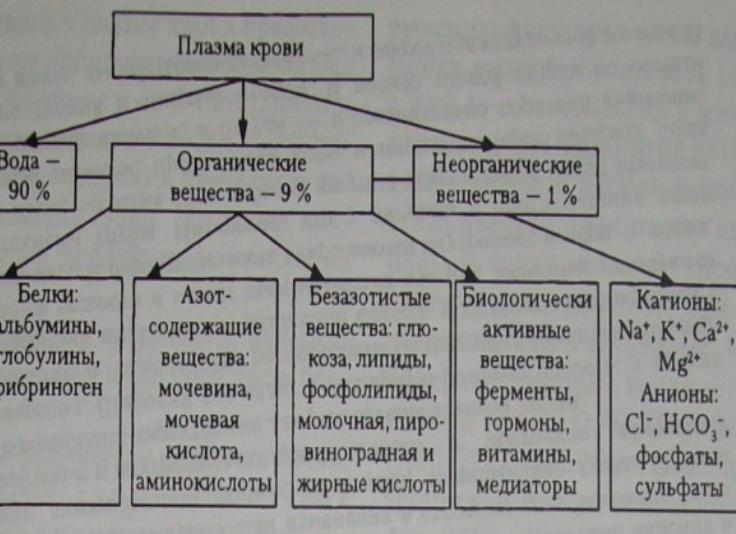
В плазме крови человека присутствуют более 200 белков, имеющих различную концентрацию. Количественно наиболее представлен альбумин. Содержание отдельных белков изменяется при многих физиологических и патологических состояниях.
Большинство белков плазмы представлено гликопротеинами обычно с содержанием углеводов от 10 до 25%, исключение составляет альбумин, который не гликозилирован.
С клинической точки зрения удобно разделять белки по их функции, поэтому специфический индивидуальный белок может быть отнесен более чем к одной группе.
Функции белков крови:
1. Транспортная.
2. Поддержания онкотического давления.
3. Защитная.
4. Буферная.
5. Формирования реологических свойств крови.
6. Повреждающая (криоглобулины и др.).
Концентрация белка в плазме зависит от скорости синтеза, скорости удаления и объема распределения. Альбумины, α-глобулины и часть β-глобулинов синтезируются в печени, γ-глобулины и часть β-глобулинов — в клетках лимфоидной ткани. Концентрация белка в плазме может быстро меняться — через 30 мин в положении стоя после длительного лежания она может увеличиться на 10–20%, после венопункции может измениться в течение нескольких минут. В обоих случаях это связано с перераспределением жидкости между внутрисосудистым пространством и интерстицием.
На концентрацию белков в плазме влияют следующие факторы:
• возраст (у недоношенных детей содержание белка в крови составляет 36–60 г/л, у новорожденных — 46–70 г/л, у детей 2–12 лет — 50-75 г/л, у взрослых — 64–83 г/л);
• пол (мужские и женские половые гормоны влияют на концентрацию α-фетопротеина, ферритина, IgM и многих других белков);
• фенотипы, связанные с расовыми различиями;
• наследственный дефицит отдельных белков;
• окружающая среда (у жителей тропиков уровень иммуноглобулинов выше, чем у живущих в зоне с холодным климатом);
• физическая нагрузка (активная физ. работа повышает концентрацию белка в крови до 10%);
• сон;
• питание;
• беременность (влияет в первую очередь на концентрацию транспортных белков);
• прием лекарственных препаратов (оральные контрацептивы, тестостерон, фенотиазины, эстрогены).
Факторы, обусловливающие изменение концентрации белка в организме:
• потеря белка через поврежденный орган (при нефротическом синдроме, клубочковой и канальцевой протеинурии, патологии кишечника);
• нарушение синтеза белка (при заболеваниях печени, почек);
• изменение объема циркулирующей крови в результате гипер-, гипогидратации или перераспределения между водными пространствами организма;
• усиление катаболизма белка (при воспалении, опухолевых заболеваниях);
• изменение скорости утилизации белка (при воспалении, патологии почек).
Только существенные изменения уровня альбумина и иммуноглобулинов влияют на концентрацию общего белка в сыворотке. Концентрация общего белка в плазме быстро снижается при увеличении проницаемости капилляров, так как белок способен быстро диффундировать в интерстициальное пространство. Это может иметь место у больных с сепсисом или генерализованным воспалением.
Патология белкового состава сыворотки крови связана с нарушением водного обмена и обмена белков плазмы крови. Она выражается в различных изменениях белкового состава:
1. Гипопротеинемии
2. Гиперпротеинемии.
3. Дефектопротеинемии.
В сыворотке крови в патологических условиях могут появляться белки, в норме не встречающиеся. К ним относятся: парапротеины, пироглобулины, криоглобулины.
Паропротеины — патологические моноклональные иммуноглобулины, отличающиеся от нормальных иммуноглобулинов по физико-химическим свойствам, антигенному строению, активности и ряду других признаков.
Появление парапротеинов в крови наблюдается при парапротеинемических гемобластозах. Парапротеинемические гемобластозы — опухоли системы В-лимфоцитов, дифференцирующихся до стадии секреции моноклонального иммуноглобулина. К нозологическим формам парапротеинемических гемобластозов относят: солитарную плазмоцитому, множественную миелому, макроглобулинемию Вальденстрема, болезни тяжелых цепей, острый плазмобластный лейкоз, лимфомы с парапротеинемией.
Пироглобулины — глобулины, подвергающиеся коагуляции при нагревании до 56 С. Обнаруживаются при саркоидозе, сифилисе, СКВ.
Криоглобулины — глобулины, которые осаждаются при охлаждении и вновь растворяются при нагревании до 37 С. Выявляются при циррозах печени, аутоиммунных заболеваниях, идиопатической криоглобулинемии.
Рис. 2. — Типовые нарушения содержания белков в плазме крови (по П.Ф. Литвицкому, 2002)
Гиперпротеинемии — увеличение общей концентрации белков в плазме крови:
• Гиперсинтетический (истинный, протеосинтетический): результат гиперпродукции белка (например, Ig), парапротеинов (например, при B-лимфоцитарных лейкозах, плазмоцитомах, миеломной болезни);
• Гемоконцентрационный (ложный): развивается в результате гемоконцентрации без усиления протеосинтеза (например, при ожоговой болезни, диарее, повторной рвоте, длительном усиленном потоотделении).
Гипопротеинемии — уменьшение общей концентрации белков в плазме крови:
• Гипосинтетическая (истинная) гипопротеинемия может быть двух видов.
а) первичной (наследственной или врождённой — гипопротеинемия при болезни Брутона).
б) вторичной (приобретённой, симптоматической — при печёночной недостаточности, белковом голодании, почечной недостаточности, гипоаминоацидемии различного генеза, ожоговой болезни).
• Гемодилюционная (ложная): обусловлена гиперволемией (при гиперальдостеронизме или почечной недостаточности).
Парапротеинемии наблюдают при:
• множественной миеломе: опухолевые плазмоциты продуцируют аномальные лёгкие или тяжёлые цепи молекулы Ig;
• лимфомах (лимфоцитарных или плазмоцитарных): синтезируются аномальные IgM, обладающие повышенной агрегируемостью.
12.6.5. Нарушение белкового состава плазмы крови
Большинство белков плазмы (табл. 12-9) представлено гликопротеинами обычно с содержанием углеводов от 10 до 25%, исключение составляет альбумин, который не гликозилирован.
Таблица 12-9. Белки плазмы крови
|
Функциональные группы белков |
Пример |
|
Транспортные белки |
Трансферрин, тироксинсвязывающий белок |
|
Белки острой фазы |
С-реактивный белок, фибриноген |
|
Комплемент |
С3, С4 |
Окончание табл. 12-9
|
Факторы свертывания |
Протромбин, фактор VIII, фибриноген |
|
Ферменты |
Амилаза, ренин, холинэстераза |
|
Ингибиторы протеиназ |
α,-антитрипсин, антитромбин III |
|
Гормоны |
Инсулин, глюкагон, вазопрессин |
|
Иммуноглобулины |
IgG, IgM, |
|
Белки, поддерживающие онкотическое давление |
Все белки, особенно альбумин |
|
Белки, поддерживающие буферную емкость плазмы |
Все белки |
Физиологические функции белков плазмы состоят в поддержании коллоидно-осмотического давления, буферной емкости плазмы, в осуществлении транспорта и депонировании молекул липидов, продуктов метаболизма, гормонов, лекарственных веществ и микроэлементов. Белки плазмы: ферменты, иммуноглобулины, компоненты комплемента и С-реактивный белок. Равновесие между белками — прокоагулянтами и ингибиторами свертывания обеспечивает жидкое состояние крови в норме и быстрое свертывание при повреждении. При непосредственном участии белков плазмы протекают все физиологические и патофизиологические реакции в организме.
Концентрация белка в плазме зависит от скорости синтеза, скорости удаления и объема распределения. Альбумины, α-глобулины и часть β-глобулинов синтезируются в печени, γ-глобулины и часть β-глобулинов — в клетках лимфоидной ткани. Концентрация белка в плазме может быстро меняться — через 30 мин в положении стоя после длительного лежания она может увеличиться на 10-20%, после венопункции может измениться в течение нескольких минут. В обоих случаях это связано с перераспределением жидкости между внутрисосудистым пространством и интерстицием.
• возраст (у недоношенных детей содержание белка в крови составляет 36-60 г/л, у новорожденных — 46-70 г/л, у детей 2-12 лет — 50-75 г/л, у взрослых — 64-83 г/л);
• физическая нагрузка (активная физическая работа повышает концентрацию белка в крови до 10%);
К патологическим факторам, обусловливающим изменение концентрации белка в организме, относятся:
Только существенные изменения уровня альбумина и иммуноглобулинов влияют на концентрацию общего белка в сыворотке. Концентрация общего белка в плазме быстро снижается при увеличении проницаемости капилляров, так как белок способен быстро диффундировать в интерстициальное пространство. Это может иметь место у больных с сепсисом или генерализованным воспалением. Причины увеличения и снижения концентрации общего белка в сыворотке представлены в табл. 12-10.
Гипопротеинемия — уменьшение концентрации белков в крови. Существуют различия между абсолютной гипопротеинемией, например после увеличения выделением почками альбумина при их патологии или в результате нарушения синтеза при хроническом циррозе печени, и относительной гипопротеинемией, например в результате избыточной инфузионной терапии или значительно уменьшенном количестве мочи (олигурия, анурия).
Таблица 12-10. Клинико-диагностическое значение изменения концентрации общего белка крови
|
Повышение концентрации выше 85 г/л |
Снижение концентрации ниже 60 г/л |
|
Дегидратация: недостаточное питье; избыточные потери воды при потоотделении, профузных поносах, болезни Аддисона, диабетическом кетоацидозе Увеличение содержания одного или нескольких специфических белков: острые и хронические инфекции; аутоиммунные болезни; парапротеинемические гемобластозы: миеломная болезнь; болезнь Вальденстрема; болезнь тяжелых цепей; лимфогранулематоз; саркоидоз; активный хронический гепатит; цирроз печени без выраженной печеночно-клеточной недостаточности |
Пониженный синтез белка: недостаток белка в пище, голодание; мальабсорбция, энтериты, панкреатиты; болезни печени (цирроз, атрофия и др.); длительный прием кортикостероидов Увеличенные потери белка: гломерулонефрит и другая патология почек; сахарный диабет; асцит, экссудаты и транссудаты; ожоги; кровотечения Повышенный распад белка: тиреотоксикоз; длительная физическая нагрузка; продолжительная лихорадка; травмы; опухоли Гипергидратация |
Как правило, основной причиной гипопротеинемии является гипоальбуминемия. Недостаточный синтез альбумина в печени может быть связан с уменьшенным поступлением аминокислот или с повреждением гепатоцитов. Нарушение всасывания в кишечнике (синдром мальабсорбции) может быть результатом бактериальной или паразитарной (лямблиоз) инфекции, муковисцидоза, колита, дисахаридазной недостаточности, энтеропатии с потерей белков или демпинг-синдрома. Поражение гепатоцитов может иметь место при циррозе, токсикозе, атрофии, метастазировании или первичном раке печени.
Потеря белка возникает при:
• нефротическом синдроме, гломерулонефрите (80%), диабете, системной красной волчанке и других аутоиммунных заболеваниях, амилоидозе, тромбозе почечных вен;
• энтеропатиях в результате заболеваний желудка или кишечника, колита, полипов;
• поражениях кожи (ожоги, дерматоз);
• образовании экссудатов и транссудатов (перитонит, плеврит, асцит);
• коагулопатиях;
• усиленном катаболизме белков (сепсис, лихорадки, множественные поражения, злокачественные опухоли).
Гиперпротеинемия — повышение концентрации общего белка в крови. Выделяют две основные причины повышения концентрации общего белка в сыворотке крови: уменьшение объема плазмы при дегидратации и повышение содержания в плазме одного или нескольких специфических белков. В связи с этим проводятся различия между абсолютной гиперпротеинемией, например повышение концентрации иммуноглобулинов (парапротеинемия), и относительной гиперпротеинемией при дегидратации. Гиперпротеинемия не может быть результатом усиленного синтеза альбумина, поэтому гиперальбуминемия указывает на дегидратацию.
Выраженное поликлональное увеличение концентрации иммуноглобулинов наблюдается при хроническом бактериальном воспалении, обострении вирусных инфекций (в частности, ВИЧинфекции), хронических заболеваниях печени (хронический и подострый гепатит), аутоиммунных болезнях (ревматоидный артрит, дерматомиозит), саркоидозе. Заподозрить гиперпротеинемию можно при изменении скорости оседания эритроцитов (СОЭ).
Диспротеинемия означает, что имеются количественные и качественные изменения концентрации нормальных белков плазмы, например при остром воспалении, циррозе печени, болезнях почек, парапротеинемии, опухолях. Диспротеинемия может быть обусловлена увеличением или уменьшением концентрации отдельных групп белков или продукцией новых белков, которые до этого не выявлялись. Диспротеинемия определяется путем электрофореза.
Гипоальбуминемия. Возможные причины ее представлены в табл. 12-11.
Известно более 20 генетических вариантов альбумина, что никак не связано со склонностью к заболеваниям. Этот эффект обозначается как бисальбуминемия. Наследственное отсутствие альбумина — анальбуминемия — асимптоматична, может проявляться лишь определенной склонностью к отекам. В клинической практике гипоальбуминемия чаще всего является следствием по-
Таблица 12-11. Клинико-диагностическое значение изменения содержания альбумина в плазме крови
|
Функция |
Концентрация |
||
|
норма повышенная сниженная |
|||
|
Связывание и транспорт катионов (Fe2+, Cu2+, Zn2+, Ca2+), малых и больших анионов, билирубина, жирных кислот, витаминов В12, С, лекарств, гормонов щитовидной железы. Нормализация коллоидноосмотического давления. Резерв белка (аминокислот) |
37-53 г/л |
Острое обезвоживание Прием анаболических стероидов |
Пониженный синтез: цирроз печени, недоедание, синдром мальабсорбции, анальбуминемия Повышенный катаболизм: травма, инфекция, сепсис, лихорадка, опухоли, гипоксия, синдром Кушинга, гипертиреоз, гиперкортицизм Аномальные потери: шок, кровотечение, энтероколиты, нефротический синдром Патологическое распределение: после операционного вмешательства, при ожогах, токсикозе, асците, плеврите |
тери альбумина при нефротическом синдроме, гастроэнтерите, активации катаболизма. При ожоговой болезни гипоальбуминемия развивается вследствие потери жидкости, изменения сосудистой проницаемости, угнетения синтеза. Выраженная гипоальбуминемия наблюдается при портальном циррозе и жировой дистрофии печени, амилоидозе, кахексии, тяжелых инфекциях, панкреатите, коллагенозах.
Гиперальбуминемия может быть либо артефактом (в частности, при взятии венозной крови в момент стаза), либо результатом чрезмерного внутривенного введения альбумина при инфузиях, либо связана с дегидратацией. При некоторых патологических состояниях отмечается повышенный синтез альбумина, однако это, как правило, не приводит к гиперальбуминемии.
Гипогаммаглобулинемия может быть физиологической и встречается у новорожденных (рис. 12-41). Контакт новорожденных с антигенами стимулирует В-лимфоциты, которые начинают активно продуцировать IgM. После трансформации в плазматические
Рис. 12-41. Изменение концентрации иммуноглобулинов в сыворотке крови у новорожденных
клетки начинается синтез и секреция IgG и IgA, при этом одновременно снижается содержание материнских IgG, поэтому у детей уровень IgG минимален в возрасте 3 месяцев. Наиболее подвержены инфекциям две группы детей: недоношенные, поскольку материнских IgG у них меньше, чем у доношенных, и дети, у которых происходит временная задержка синтеза IgG. В этом случае требуется вмешательство, направленное на активацию синтеза IgG. Патологическая гипогаммаглобулинемия как у детей, так и у взрослых может быть и врожденной, и приобретенной. В обоих случаях это сопровождается иммунодефицитом (см. главу 7).
Гипергаммаглобулинемия возможна при повышенном синтезе антител. Нарастает содержание иммуноглобулинов всех классов, но преобладают IgG. Концентрация иммуноглобулинов увеличивается при всех бактериальных и паразитарных заболеваниях, сепсисе, рожистом воспалении, инфекционном мононуклеозе, краснухе, бруцеллезе и др. Повышение уровня IgG имеет место при аутоиммунных заболеваниях; IgA — при инфекционных по-
ражениях кожи, желудка, дыхательных путей, почек; IgM — при первичной вирусной инфекции и паразитарных инфекциях с накоплением паразита в крови (малярия).
Парапротеинемия — появление в крови нехарактерных патологических белков.
Парапротеины (моноклональные иммуноглобулины) — это иммуноглобулины или их фрагменты, вырабатываемые плазматическими клетками. Парапротеины часто не способны выполнять функцию антител, обычно они структурно однородны, т.е. молекула состоит из тяжелых или легких цепей одного типа, иногда они состоят только из отдельных легких цепей (каппа или лямбда) или только из тяжелых цепей (фрагментов иммуноглобулинов). Класс и тип не меняются в течение болезни. Так как все молекулы идентичны, то парапротеины определяются при электрофорезе белков по наличию узкого пика (М-градиента). Часто при электрофорезе выявляется более чем одна полоса парапротеинов, что обусловлено присутствием фрагментов IgG или IgM, полимеризацией иммуноглобулинов или образованием комплексов иммуноглобулинов с другими белками плазмы.
Парапротеины (обычно IgG или IgM) встречаются наиболее часто при множественной миеломе, заболеваниях иммунной системы, как макроглобулинемия Вальденстрема, острый плазмобластный лейкоз, болезни тяжелых цепей, лимфомы с парапротеинемией и др.
Криоглобулины — патологические белки плазмы (10-80 мг/мл), обладающие свойством превращения в желеобразное состояние при температуре ниже 37 °С. Большинство криоглобулинов — это комплексы поликлональных иммуноглобулинов, в состав которых примерно наполовину входят моноклональные иммуноглобулины. Обычно это IgM. Криоглобулины могут появиться при макроглобулинемии Вальденстрема, миеломе, хроническом лимфолейкозе, инфекционных заболеваниях (мононуклеоз, сифилис, туберкулез, лепра), вирусных, аутоиммунных и паразитарных заболеваниях, циррозе печени, коллагенозах, при опухолевой трансформации клеток. С криоглобулинами связаны синдромы холодовой непереносимости, повышение вязкости крови, образование иммунных комплексов с факторами I, II, V, VII свертывания крови, что может сопровождаться кровоточивостью, активацией системы комплемента, вызывать поражение почек и гемолиз эритроцитов. Количество криоглобулинов определяют по отношению объема преципитированного глобулина к общему объему сыворотки.
Белки крови, их основные ф-ции. Нарушения белкового состава плазмы крови, виды. Причины, значение.
Таблица 12-9.Белки плазмы крови
| Функциональные группы белков | Пример |
| Транспортные белки | Трансферрин, тироксинсвязывающий белок |
| Белки острой фазы | С-реактивный белок, фибриноген |
| Комплемент | С3, С4 |
| Факторы свертывания | Протромбин, фактор VIII, фибриноген |
| Ферменты | Амилаза, ренин, холинэстераза |
| Ингибиторы протеиназ | α,-антитрипсин, антитромбин III |
| Гормоны | Инсулин, глюкагон, вазопрессин |
| Иммуноглобулины | IgG, IgM, |
| Белки, поддерживающие онкотическое давление | Все белки, особенно альбумин |
| Белки, поддерживающие буферную емкость плазмы | Все белки |
1. Альбумин — важнейший транспортный белок. Он транспортирует свободные жирные кислоты, неконъюгированный билирубин, Са2+, Сu2+, триптофан, тироксин и трийодтиронин. Многие лекарства (аспирин, дикумарол, сульфаниламиды) связываются в крови с альбумином. Этот факт необходимо учитывать при лечении заболеваний, сопровождающихся гипоальбуминемией, так как в этих случаях повышается концентрация свободного лекарства в крови. Кроме того, следует помнить, что некоторые лекарства могут конкурировать за центры связывания в молекуле альбумина с билирубином и между собой.
Транстиретин (преальбумин) называют тирок-синсвязывающим преальбумином. Это белок острой фазы. Транстиретин относят к фракции альбуминов, он имеет тетрамерную молекулу. Он способен присоединять в одном центре связывания ретинолсвязывающий белок, а в другом — до двух молекул тироксина и трийодтиронина.
2. Глобулины. Увеличение содержания альфа-глобулинов наблюдается при воспалительных процессах, стрессовых воздействиях на организм (травмы, ожоги, инфаркт миокарда и др.). Это белки, так называемой острой фазы. Степень увеличения альфа-глобулинов отражает интенсивность процесса. Преимущественное увеличение альфа-2-глобулинов отмечается при острых гнойных заболеваниях, вовлечении в патологический процесс соединительной ткани (ревматизм, системная красная волчанка и др.). Повышение содержания альфа-глобулинов возможно также при некоторых хронических заболеваниях, злокачественных новообразованиях, особенно при их метастазировании. Уменьшение альфа-глобулинов отмечается при угнетении их синтеза в печени, гипотиреозе — пониженной функции щитовидной железы.Бета-глобулины. В этой фракции присутствуют липопротеиды, поэтому количество бета-глобулинов увеличивается при гиперлипопротеидемиях. Это наблюдается при атеросклерозе, сахарном диабете, гипотиреозе, нефротическом синдроме. Повышение содержания гамма-глобулинов (гипергаммаглобулинемия) наблюдается при усилении иммунных процессов. Оно обусловлено повышенной продукцией иммуноглобулинов классов G, A, M, D, Е и наблюдается при острых и хронических вирусных, бактериальных, паразитарных инфекциях, заболеваниях соединительной ткани (коллагенозах), злокачественных заболеваниях крови, некоторых опухолях.
3. Фибриноген -бесцветный белок, растворенный в плазме крови. При активации системы свёртывания крови подвергается ферментативному расщеплению ферментом тромбином, образующийся фибрин-мономер под действием активного XIII фактора свёртывания крови полимеризуется и выпадает в осадок в виде белых нитей фибрина-полимера. При взятии биоматериала для анализа фибриногена используется антикоагулянт Цитрат натрия (3,8 %). Фибриноген — белок, вырабатываемый в печени и превращающийся в нерастворимый фибрин — основу сгустка при свертывании крови. Фибрин впоследствии образует тромб, завершая процесс свертывания крови. Фибриноген является ценным показателем гемостаза (коагулограмма). Анализ фибриногена — необходимый этап предоперационного обследования, пренатальной диагностики, проводится при воспалительных, сердечно-сосудистых заболеваниях. Содержание фибриногена в крови повышается при возникновении острых воспалительных заболеваний и отмирания тканей. Фибриноген влияет и на скорость оседания эритроцитов (СОЭ).
Функции белков плазмы крови:
1. Питательная функция. В организме человека содержится около 3 л плазмы, в которой растворено примерно 200 г белка. Это вполне достаточный запас питательных веществ . Обычно клетки захватывают не столько белки, сколько аминокислоты , однако некоторые клетки могут захватывать белки плазмы и расщеплять их при помощи собственных внутриклеточных ферментов. Высвобождающиеся при этом аминокислоты поступают в кровь, где сразу же могут использоваться другими клетками для синтеза новых белков.
2. Транспортная функция: Многие небольшие молекулы при переносе их от кишечника или депо к месту потребления связываются со специфическими белками плазмы. Все белки плазмы связывают катионы крови и переводят их в недифффундирующую форму. Так, около 2/3 кальция плазмы неспецифически связано с белками. Связанный кальций находится в равновесии со свободно растворенным в плазме ионизированным физиологически активным кальцием.
3. Роль белков в создании коллоидно-осмотического давления. Вследствие низкой молекулярной концентрации белков вклад их в общее осмотическое давление плазмы крови невелик, но создаваемое ими коллоидно- осмотическое (онкотическое) давление играет важную роль в регулировании распределения воды между плазмой и межклеточной жидкостью . Стенки капилляров свободно пропускают небольшие молекулы, поэтому концентрации этих молекул и создаваемое ими осмотическое давление примерно одинаковы в плазме и в межклеточной жидкости. Крупные молекулы белков плазмы лишь с большим трудом проходят через стенки капилляров (так, период полувыведения меченного альбумина из кровотока составляет примерно 14 часов). Кроме того, белки захватываются клетками и переносятся лимфой . Поэтому между плазмой и межклеточной жидкостью создается градиент концентрации белков, обусловливающий разницу в коллоидно-осмотическом давлении, составляющую примерно 22 мм рт.ст. (3 кПа). Любые изменения осмотически эффективной концентрации белков плазмы приводят к нарушениям обмена веществами и распределения воды между кровью и межклеточной жидкостью.
4. Буфферная функция. Так как белки плазмы могут взаимодействовать как с кислотами, так и с основаниями с образованием солей, они участвуют в поддержании постоянства рН.
5. Роль белков в предупреждении кровопотери. Свертывание крови , препятствующее кровотечению, частично обусловлено наличием в плазме фибриногена . Процесс свертывания включает целую цепь реакций, в которых в качестве ферментов участвует ряд белков плазмы, и заканчивается превращением растворенного в плазме фибриногена в сеть из фибрина , образующую сгусток.
Различают следующие виды синтеза белка в зависимости от его назначения:
• регенерационный,связанный с процессами физиологической и репаративной регенерации;
• синтез роста,сопровождающийся увеличением массы и размеров тела;
• стабилизирующий,связанный с возмещением структурных белков, утраченных в процессе диссимиляции, способствующий поддержанию структурной целостности организма;
• функциональный,связанный со специфической деятельностью различных органов (синтез гемоглобина, белков плазмы крови, антител, гормонов и ферментов).
Причинами нарушения синтеза белка являются:
• отсутствие достаточного количества аминокислот;
• дефицит энергии в клетках;
• расстройства нейроэндокринной регуляции;
• нарушение процессов транскрипции или трансляции информации о структуре того или иного белка, закодированной в геноме клетки.
Наиболее частой причиной нарушения синтеза белка является недостаток аминокислот в организмевследствие:
1) расстройств пищеварения и всасывания;
2) пониженного содержания белка в пище;
3) питания неполноценными белками, в которых отсутствуют или имеются в незначительном количестве незаменимые аминокислоты, не синтезирующиеся в организме
Гипопротеинемия — уменьшение концентрации белков в крови. Существуют различия между абсолютной гипопротеинемией, например, после увеличения выделением почками альбумина при их патологии или в результате нарушения синтеза при хроническом циррозе печени, и относительной гипопротеинемией, например, в результате избыточной инфузионной терапии или значительно уменьшенном количестве мочи (олигурия, анурия)
ак правило, основной причиной гипопротеинемии является гипоальбуминемия. Недостаточный синтез альбумина в печени может быть связан с уменьшенным поступлением аминокислот или с повреждением гепатоцитов. Нарушение всасывания в кишечнике (синдром мальабсорбции) может быть результатом бактериальной или паразитарной (лямблиоз) инфекции, муковисцидоза, колита, дисахаридазной недостаточности, энтеропатии с потерей белков или демпинг-синдрома. Поражение гепатоцитов может иметь место при циррозе, токсикозе, атрофии, метастазировании или первичном раке печени.
Гиперпротеинемия- повышение концентрации общего белка в крови. Выделяют две основные причины повышения концентрации общего белка в сыворотке крови: уменьшение объема плазмы при дегидратации и повышение содержания в плазме одного или нескольких специфических белков. В связи с этим проводятся различия между абсолютной гиперпротеинемией, например повышение концентрации иммуноглобулинов (парапротеинемия), и относительной гиперпротеинемией при дегидратации. Гиперпротеинемия не может быть результатом усиленного синтеза альбумина, поэтому гиперальбуминемия указывает на дегидратацию.
Диспротеинемияозначает, что имеются количественные и качественные изменения концентрации нормальных белков плазмы, например при остром воспалении, циррозе печени, болезнях почек, парапротеинемии, опухолях. Диспротеинемия может быть обусловлена увеличением или уменьшением концентрации отдельных групп белков или продукцией новых белков, которые до этого не выявлялись. Диспротеинемия определяется путем электрофореза.
Гиперальбуминемияможет быть либо артефактом (в частности, при взятии венозной крови в момент стаза), либо результатом чрезмерного внутривенного введения альбумина при инфузиях, либо связана с дегидратацией. При некоторых патологических состояниях отмечается повышенный синтез альбумина, однако это, как правило, не приводит к гиперальбуминемии.
Гипогаммаглобулинемияможет быть физиологическойи встречается у новорожденных. Контакт новорожденных с антигенами стимулирует В-лимфоциты, которые начинают активно продуцировать IgM. После трансформации в плазматические
клетки начинается синтез и секреция IgG и IgA, при этом одновременно снижается содержание материнских IgG, поэтому у детей уровень IgG минимален в возрасте 3 месяцев. Наиболее подвержены инфекциям две группы детей: недоношенные, поскольку материнских IgG у них меньше, чем у доношенных, и дети, у которых происходит временная задержка синтеза IgG. В этом случае требуется вмешательство, направленное на активацию синтеза IgG. Патологическая гипогаммаглобулинемиякак у детей, так и у взрослых может быть и врожденной, и приобретенной. В обоих случаях это сопровождается иммунодефицитом (см. главу 7).
Гипергаммаглобулинемиявозможна при повышенном синтезе антител. Нарастает содержание иммуноглобулинов всех классов, но преобладают IgG. Концентрация иммуноглобулинов увеличивается при всех бактериальных и паразитарных заболеваниях, сепсисе, рожистом воспалении, инфекционном мононуклеозе, краснухе, бруцеллезе и др. Повышение уровня IgG имеет место при аутоиммунных заболеваниях; IgA — при инфекционных поражениях кожи, желудка, дыхательных путей, почек; IgM — при первичной вирусной инфекции и паразитарных инфекциях с накоплением паразита в крови (малярия).
Парапротеинемия- появление в крови нехарактерных патологических белков.
Парапротеины (моноклональные иммуноглобулины)- это иммуноглобулины или их фрагменты, вырабатываемые плазматическими клетками. Парапротеины часто не способны выполнять функцию антител, обычно они структурно однородны, т.е. молекула состоит из тяжелых или легких цепей одного типа, иногда они состоят только из отдельных легких цепей (каппа или лямбда) или только из тяжелых цепей (фрагментов иммуноглобулинов). Класс и тип не меняются в течение болезни. Так как все молекулы идентичны, то парапротеины определяются при электрофорезе белков по наличию узкого пика (М-градиента). Часто при электрофорезе выявляется более чем одна полоса парапротеинов, что обусловлено присутствием фрагментов IgG или IgM, полимеризацией иммуноглобулинов или образованием комплексов иммуноглобулинов с другими белками плазмы.
Криоглобулины- патологические белки плазмы (10-80 мг/мл), обладающие свойством превращения в желеобразное состояние при температуре ниже 37 °С. Большинство криоглобулинов — это комплексы поликлональных иммуноглобулинов, в состав которых примерно наполовину входят моноклональные иммуноглобулины. Обычно это IgM. Криоглобулины могут появиться при макроглобулинемии Вальденстрема, миеломе, хроническом лимфолейкозе, инфекционных заболеваниях (мононуклеоз, сифилис, туберкулез, лепра), вирусных, аутоиммунных и паразитарных заболеваниях, циррозе печени, коллагенозах, при опухолевой трансформации клеток. С криоглобулинами связаны синдромы холодовой непереносимости, повышение вязкости крови, образование иммунных комплексов с факторами I, II, V, VII свертывания крови, что может сопровождаться кровоточивостью, активацией системы комплемента, вызывать поражение почек и гемолиз эритроцитов. Количество криоглобулинов определяют по отношению объема преципитированного глобулина к общему объему сыворотки.
25. Нарушения белкового обмена (синтеза и распада белка, обмена аминокислот, мочевинообразования)
Дефицит заменимых аминокислот в пище реже приводит к понижению синтеза белка, так как они могут образовываться в организме из кетокислот, являющихся продуктами метаболизма углеводов, жиров и белков. Недостаток кетокислот возникает при сахарном диабете, нарушении процессов дезаминирования и трансаминирования аминокислот (гиповитаминоз В6).
Недостаток источников энергии имеет место при гипоксии, действии разобщающих факторов, сахарном диабете, гиповитаминозе В1, дефиците никотиновой кислоты и др. Синтез белка — энергозависимый процесс. Энергия макроэргов АТФ и ГТФ необходима для активации аминокислот и образования пептидных связей (21,9 кал на каждую пептидную связь).
Расстройства нейроэндокринной регуляции синтеза и расщепления белка.Нервная система оказывает на белковый обмен прямое и косвенное действие. При выпадении нервных влияний возникает расстройство трофики клетки1. Нарушения нервной трофики являются важным звеном патогенеза любого заболевания. Денервация тканей вызывает: прекращение их стимуляции вследствие нарушения выделения нейромедиаторов; нарушение секреции или действия комедиаторов, обеспечивающих регуляцию рецепторных, мембранных и метаболических процессов; нарушение выделения и действия трофогенов2. Подтверждением прямого трофического
1 Комплекс процессов, обеспечивающих жизнедеятельность клетки и поддержание генетически заложенных свойств. Нервные волокна регулируют в иннервируемых тканях не только кровообращение, но также метаболические, энергетические и пластические процессы в соответствии с текущими потребностями организма.
Действие гормонов может быть анаболическим (усиливающим синтез белка) и катаболическим (повышающим распад белка в тканях).
Синтез белка увеличивается под действием:
• инсулина (обеспечивает активный транспорт в клетки многих аминокислот — особенно валина, лейцина, изолейцина; повышает скорость транскрипции ДНК в ядре; стимулирует сборку рибосом и трансляцию; тормозит использование аминокислот в глюконеогенезе, усиливает митотическую активность инсулинзависимых тканей, повышая синтез ДНК и РНК);
• соматотропного гормона (СТГ; ростовой эффект опосредуют соматомедины, вырабатываемые под его влиянием в печени). Другое название соматомединов — инсулиноподобные ростовые факторы — появилось в связи с их способностью снижать уровень глюкозы в крови. Основной из них — соматомедин С, который во всех клетках тела повышает скорость синтеза белка. Так стимулируется образование хрящевой и мышечной ткани. В хондроцитах имеются рецепторы и к самому гормону роста, что доказывает его прямое влияние на хрящевую и костную ткань;
• тиреоидных гормонов в физиологических дозах: трийодтиронин, связываясь с рецепторами в ядре клетки, действует на геном и вызывает усиление транскрипции и трансляции. Вследствие этого стимулируется синтез белка во всех клетках тела. Кроме того, тиреоидные гормоны стимулируют действие
СТГ;
• половых гормонов, оказывающих СТГ-зависимый анаболический эффект на синтез белка; андрогены стимулируют образование белков в мужских половых органах, мышцах, скелете, коже и ее производных, в меньшей степени — в почках и мозгу; действие эстрогенов направлено в основном на молочные железы и женские половые органы. Следует отметить, что анаболический эффект половых гормонов не касается синтеза белка в печени.
Распад белка повышается под влиянием:
• тиреоидных гормонов при повышенной их продукции (гипертиреоз);
• глюкагона (уменьшает поглощение аминокислот и повышает распад белков в мышцах; в печени активирует протеолиз, а также стимулирует глюконеогенез и кетогенез из аминокислот; тормозит анаболический эффект СТГ);
• катехоламинов (способствуют распаду мышечных белков с мобилизацией аминокислот и использованием их печенью);
• глюкокортикоидов (усиливают синтез белков и нуклеиновых кислот в печени и повышают распад белков в мышцах, коже, костях, лимфоидной и жировой ткани с высвобождением аминокислот и вовлечением их в глюконеогенез. Кроме того, они угнетают транспорт аминокислот в мышечные клетки, снижая синтез белка).
Анаболическое действие гормонов осуществляется в основном путем активации определенных генов и усилением образования различных видов РНК (информационная, транспортная, рибосомальная), что ускоряет синтез белков; механизм катаболического действия гормонов связан с повышением активности тканевых протеиназ.
Снижение синтеза гормонов анаболического действия, таких как СТГ и тиреоидные гормоны, в детском возрасте ведет к задержке роста.
Инактивацию тех или иных факторов, участвующих в биосинтезе белка, могут вызвать некоторые лекарственные препараты (например, антибиотики) и микробные токсины. Известно, что дифтерийный токсин тормозит присоединение аминокислот к синтезируемой полипептидной цепи; этот эффект устраняется анатоксином.
Последствия нарушения общего синтеза белка:
Длительное и значительное понижение синтеза белка приводит к развитию дистрофических и атрофических нарушений в различных органах и тканях вследствие недостаточного обновления структурных белков. Замедляются процессы регенерации. В детском возрасте тормозятся рост, физическое и умственное развитие. Снижается синтез различных ферментов и гормонов (СТГ, антидиуретический и тиреоидный гормоны, инсулин и др.), что приводит к эндокринопатиям, нарушению других видов обмена (углеводного, водно-солевого, основного). Понижается содержание белков в сыворотке крови в связи со снижением их синтеза в гепатоцитах. Вследствие этого в крови уменьшается онкотическое давление, что способствует развитию отеков. Уменьшается продукция антител и других защитных белков и, как следствие, снижается иммунологическая реактивность организма. В наиболее выраженной степени эти расстройства возникают в результате длительного нарушения усвоения белков пищи при различных хронических заболеваниях органов пищеварения, а также при длительном белковом голодании, особенно если оно сочетается с дефицитом жиров и углеводов. В последнем случае повышается использование белка в качестве источника энергии.
Причины и механизм нарушения синтеза отдельных белков. В большинстве случаев эти нарушения имеют наследственную природу. В основе их лежит отсутствие в клетках информационной РНК (иРНК), специфической матрицы для синтеза какого-либо определенного белка, или нарушение ее структуры вследствие изменения структуры гена, на котором она синтезируется. Генетические нарушения, например замена или потеря одного нуклеотида в структурном гене, приводят к синтезу измененного белка, нередко лишенного биологической активности. К образованию аномальных белков могут привести отклонения от нормы в структуре иРНК, мутации транспортной РНК (тРНК), вследствие чего к ней присоединяется несоответствующая аминокислота, которая и будет включаться в полипептидную цепь при ее сборке (например, при образовании гемоглобина). Процесс трансляции является сложным, совершающимся при участии ряда ферментов, и нарушение функции какого-либо из них может привести к тому, что та или другая иРНК не передаст закодированную в ней информацию. Нарушение синтеза отдельных белков-ферментов или структурных белков лежит в основе различных наследственных болезней (гемоглобинозы, альбинизм, фенилкетонурия, галактоземия, гемофилия и многие другие — см. раздел 5.1). Нарушение какой-либо ферментативной функции чаще всего связано не с отсутствием соответствующего белка — фермента, а с образованием патологически измененного неактивного продукта.
Нарушение обмена аминокислот
Аминокислоты поступают в кровь и ткани из пищеварительного тракта; кроме того, они образуются при деструкции тканевых белков под действием внутриклеточных катепсинов (протеиназ). Основная часть аминокислот используется в организме в качестве строительных блоков при синтезе белков. Кроме того, аминокислоты используются для синтеза пуриновых и пиримидиновых оснований, гормонов, гема, различных биологически активных пептидов (интерлейкины, факторы роста и т.д.), меланина, глюкозы, жирных кислот и ряда других веществ.
Катаболизм большинства аминокислот начинается с отщепления от них аминогруппы, что происходит в 2-х типах реакций: трансаминирования и дезаминирования.
Трансаминирование — перенос аминогруппы аминокислоты на α-кетокислоту, в результате образуются новая кетокислота и новая аминокислота.
Нарушение процесса трансаминирования в целом организме происходит при гиповитаминозе В6, при недостатке α-кетокислот (голодание, сахарный диабет). Нарушение трансаминирования в отдельных органах, например в печени, происходит при некрозе клеток, что сопровождается выходом трансаминаз в кровь. Такое же явление имеет место при инфаркте миокарда. В поврежденных клетках может быть нарушен синтез белковой части трансаминаз.
Дезаминирование — реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота, которая может использоваться в реакциях трансаминирования, и выделяется молекула аммиака. Процесс окислительного дезаминирования снижается в связи с ослаблением трансаминирования, при гипоксии, гиповитаминозах В2, РР, С, белковом голодании.
Нарушение процессов трансаминирования и окислительного дезаминирования аминокислот ограничивает их использование для синтеза глюкозы, жирных кислот, заменимых аминокислот, а также их окисление с освобождением энергии. При этом повышается содержание свободных аминокислот в сыворотке крови и в моче (гипераминоацидемия и гипераминоацидурия), снижается синтез мочевины. Такие нарушения особенно выражены при обширных повреждениях гепатоцитов (вирусные и токсические гепатиты и др.), так как в этих клетках метаболизм аминокислот происходит наиболее интенсивно.
Одним из путей метаболизма аминокислот является их декарбоксилирование, которое состоит в отщеплении от аминокислоты α-карбоксильной группы. В результате образуются СО2 и биогенные амины: гистамин — из гистидина, серотонин — из 5-окситриптофана, тирамин — из тирозина, γ-аминомасляная кислота (ГАМК) — из глутаминовой, дофамин — из диоксифенилаланина и некоторые другие.
Эти процессы необратимы и катализируются декарбоксилазами, коферментом которых является пиридоксальфосфат (витамин В6); при его дефиците образование биогенных аминов снижается. В частности, уменьшается образование ГАМК, которая является основным тормозным нейромедиатором, как следствие этого наблюдается частое развитие судорог. Биогенные амины обладают высокой физиологической активностью. Наряду с ГАМК, серотонин и дофамин являются также нейромедиаторами в ЦНС, их повышенное или пониженное содержание в ткани мозга играет роль в патогенезе некоторых форм нейропатологии (нервной депрессии, паркинсонизма, шизофрении). Повышенное образование в организме серотонина (при опухоли, развивающейся из энтерохромафинных клеток кишечника) сопровождается спазмом мускулатуры бронхов и кишечника, диареей, усилением агрегации тромбоцитов; кроме того, серотонин является мощным вазоконстриктором. Хорошо известна роль гистамина в появлении болевых ощущений, развитии воспаления и аллергических реакций.
Устранение избытка биогенных аминов происходит при участии аминооксидаз, которые катализируют превращение их в альдегиды после отщепления аминогруппы в виде Nh4. Серотонин превращается в оксииндолилуксусную кислоту, которая выделяется с мочой.
Нарушение белкового состава плазмы крови
| Функциональные группы белков | Пример |
| Транспортные белки | Трансферрин, тироксинсвязывающий белок |
| Белки острой фазы | С-реактивный белок, фибриноген |
| Комплемент | С3, С4 |
| Факторы свертывания | Протромбин, фактор VIII, фибриноген |
| Ферменты | Амилаза, ренин, холинэстераза |
| Ингибиторы протеиназ | α,-антитрипсин, антитромбин III |
| Гормоны | Инсулин, глюкагон, вазопрессин |
| Иммуноглобулины | IgG, IgM, |
| Белки, поддерживающие онкотическое давление | Все белки, особенно альбумин |
| Белки, поддерживающие буферную емкость плазмы | Все белки |
Физиологические функции белков плазмысостоят в поддержании коллоидно-осмотического давления, буферной емкости плазмы, в осуществлении транспорта и депонировании молекул липидов, продуктов метаболизма, гормонов, лекарственных веществ и микроэлементов. Белки плазмы: ферменты, иммуноглобулины, компоненты комплемента и С-реактивный белок. Равновесие между белками — прокоагулянтами и ингибиторами свертывания обеспечивает жидкое состояние крови в норме и быстрое свертывание при повреждении. При непосредственном участии белков плазмы протекают все физиологические и патофизиологические реакции в организме.
Гипопротеинемия -уменьшение концентрации белков в крови. Существуют различия между абсолютной гипопротеинемией, например после увеличения выделением почками альбумина при их патологии или в результате нарушения синтеза при хроническом циррозе печени, и относительной гипопротеинемией, например в результате избыточной инфузионной терапии или значительно уменьшенном количестве мочи (олигурия, анурия).
Таблица 12-10.Клинико-диагностическое значение изменения концентрации общего белка крови
| Повышение концентрации выше 85 г/л | Снижение концентрации ниже 60 г/л |
| Дегидратация: недостаточное питье; избыточные потери воды при потоотделении, профузных поносах, болезни Аддисона, диабетическом кетоацидозе Увеличение содержания одного или нескольких специфических белков: острые и хронические инфекции; аутоиммунные болезни; парапротеинемические гемобластозы: миеломная болезнь; болезнь Вальденстрема; болезнь тяжелых цепей; лимфогранулематоз; саркоидоз; активный хронический гепатит; цирроз печени без выраженной печеночно-клеточной недостаточности | Пониженный синтез белка: недостаток белка в пище, голодание; мальабсорбция, энтериты, панкреатиты; болезни печени (цирроз, атрофия и др.); длительный прием кортикостероидов Увеличенные потери белка: гломерулонефрит и другая патология почек; сахарный диабет; асцит, экссудаты и транссудаты; ожоги; кровотечения Повышенный распад белка: тиреотоксикоз; длительная физическая нагрузка; продолжительная лихорадка; травмы; опухоли Гипергидратация |
Гипоальбуминемия.Возможные причины ее представлены в табл. 12-11.
Известно более 20 генетических вариантов альбумина, что никак не связано со склонностью к заболеваниям. Этот эффект обозначается как бисальбуминемия.Наследственное отсутствие альбумина — анальбуминемия- асимптоматична, может проявляться лишь определенной склонностью к отекам. В клинической практике гипоальбуминемия чаще всего является следствием по-
Таблица 12-11.Клинико-диагностическое значение изменения содержания альбумина в плазме крови
| Функция | Концентрация | ||
| норма повышенная сниженная | |||
| Связывание и транспорт катионов (Fe2+, Cu2+, Zn2+, Ca2+), малых и больших анионов, билирубина, жирных кислот, витаминов В12, С, лекарств, гормонов щитовидной железы. Нормализация коллоидноосмотического давления. Резерв белка (аминокислот) | 37-53 г/л | Острое обезвоживание Прием анаболических стероидов | Пониженный синтез:цирроз печени, недоедание, синдром мальабсорбции, анальбуминемия Повышенный катаболизм:травма, инфекция, сепсис, лихорадка, опухоли, гипоксия, синдром Кушинга, гипертиреоз, гиперкортицизм Аномальные потери:шок, кровотечение, энтероколиты, нефротический синдром Патологическое распределение:после операционного вмешательства, при ожогах, токсикозе, асците, плеврите |
Гипогаммаглобулинемияможет быть физиологическойи встречается у новорожденных (рис. 12-41). Контакт новорожденных с антигенами стимулирует В-лимфоциты, которые начинают активно продуцировать IgM. После трансформации в плазматические
Рис. 12-41.Изменение концентрации иммуноглобулинов в сыворотке крови у новорожденных
Гипергаммаглобулинемиявозможна при повышенном синтезе антител. Нарастает содержание иммуноглобулинов всех классов, но преобладают IgG. Концентрация иммуноглобулинов увеличивается при всех бактериальных и паразитарных заболеваниях, сепсисе, рожистом воспалении, инфекционном мононуклеозе, краснухе, бруцеллезе и др. Повышение уровня IgG имеет место при аутоиммунных заболеваниях; IgA — при инфекционных по-
Дата добавления: 2016-07-11; просмотров: 3325; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ