 [Асинергия мжп сердца что это]
[Асинергия мжп сердца что это]
Асинергия мжп сердца
Такие «перебои» непосредственно не могут перейти в «мерцалку» — разный механизм. При этому у одного человека может быть и мерцательная аритмия и экстрасистолия, но между ними патогенетической связи нет.
Оглавление:
Предсердные экстрасистолы иногда переходят в мерцательную аритмию, желудочковые — не переходят. А болеть они не могут. Экстрасистолы безопасны. Это самая частая и самая безопасная форма аритмии, она встречается у 80% всех здоровых людей, не дает осложнений, не уменьшает продолжительность жизни, не требует никаких ограничений в образе жизни и не нуждается в лечении. С ними можно жить долго и счастливо. К ним просто надо привыкнуть. Так, как вы привыкли к своему росту, форме носа и ушей, цвету глаз. Но если они все-таки причиняют беспокойство, то дело не в них, а в их неправильном восприятии и надо обращаться к психотерапевту.
Источник: https://www.consmed.ru/kardiolog/view/993288/
Все про дефект межжелудочковой перегородки у новорожденных, детей и взрослых
Из этой статьи вы узнаете о пороке развития сердца в виде дефекта межжелудочковой перегородки. Что это за нарушение развития, когда возникает и как себя проявляет. Особенности диагностики, лечения заболевания. Как долго живут с таким пороком.
Дефект межжелудочковой перегородки (ДМЖП) – это нарушение целостности стенки между левым и правым желудочками сердца, возникшее в период развития эмбриона на сроке беременности 4–17 недель.
Такая патология в 20 % случаев сочетается с другими пороками развития мышцы сердца (Фалло, полное открытие предсердно-желудочкового канала, транспозиция основных сердечных сосудов).
При дефекте перегородки образуется сообщение двух из четырех камер сердечной мышцы и происходит «сбрасывание» крови из левых отделов в правые (лево-правый шунт) за счет более высокого давления в этой половине сердца.
Симптомы значимого изолированного дефекта начинают себя проявлять на 6–8 неделе жизни ребенка, когда повышенное давление в системе сосудов легких (физиологично для этого срока жизни) нормализуется и возникает заброс артериальной крови в венозную.
Такая аномалия кровотока постепенно приводит к следующим патологическим процессам:
- расширению полостей левого предсердия и желудочка со значительным утолщением стенки последнего;
- повышению давления в системе кровотока легких с развитием в них гипертензии;
- прогрессивному нарастанию недостаточности работы сердца.
Окно между желудочками – это патология, которая не возникает в процессе жизни человека, такой дефект может развиться только в процессе беременности, поэтому его относят к врожденным порокам сердца.
У взрослых (люди старше 18 лет) такой порок может сохраняться в течение всей жизни при условии малых размеров сообщения между желудочками и (или) эффективности проведенного лечения. Никакой разницы в клинических проявлениях болезни между детьми и взрослыми, за исключением этапов нормального развития, нет.
Опасность порока зависит от размеров дефекта в перегородке:
- малые и средние практически никогда не сопровождаются нарушением работы сердца и легких;
- большие могут стать причиной смерти ребенка от 0 до 18 лет, но чаще фатальные осложнения развиваются в грудном возрасте (дети первого года жизни), если вовремя не провести лечение.
Данная патология хорошо поддается корректировке: часть пороков закрывается самопроизвольно, другие протекают без клинических проявлений болезни. Большие дефекты успешно устраняют хирургическим путем после подготовительного этапа лекарственной терапии.
Серьезные осложнения, которые могут стать причиной смерти, обычно развиваются при сочетанных формах нарушения строения сердца (описаны выше).
Диагностикой, наблюдением и лечением пациентов с ДМЖП занимаются педиатры, детские кардиологи и сосудистые хирурги.
Как часто встречается порок
Нарушения строения стенки между желудочками занимают второе место по частоте возникновения среди всех сердечных пороков. Дефект регистрируют у 2–6 детей на 1000 рожденных живыми. Среди младенцев, рожденных до срока (недоношенных), – у 4,5–7 %.
Если техническое оснащение детской поликлиники позволяет проводить ультразвуковое исследование всем грудничкам, то нарушение целостности перегородки регистрируют у 50 новорожденных на каждую 1000. Большая часть таких дефектов незначительного размера, поэтому другими методами диагностики они не выявляются и никак не влияют на развитие ребенка.
Порок межжелудочковой перегородки – самое частое проявление при нарушении количества генов у ребенка (хромосомные болезни): синдромы Дауна, Эдвартса, Патау и пр. Но более чем в 95 % дефект не сочетается с нарушениями строения хромосом.
Дефект целостности стенки между желудочками сердца в 56 % случаев выявляют у девочек и в 44 % – у мальчиков.
Почему возникает
Нарушение формирования перегородки может происходить по нескольким причинам.
Сахарный диабет с плохо скорректированным уровнем сахара
Фенилкетонурия – наследственная патология обмена аминокислот в организме
Инфекции – краснуха, ветрянка, сифилис и пр.
В случае рождения близнецов
Тератогены – препараты, которые вызывают нарушение развития плода
Классификация
В зависимости от локализации окна различают несколько видов порока:
Симптомы
Дефект межжелудочковой перегородки у новорожденного (ребенок первых 28 дней жизни) проявляет себя только в случае обширного окна или сочетания с другими пороками, если этого нет, клинические симптомы значимого дефекта возникают только после 6–8 недель. Тяжесть зависит от объема сброса крови из левых камер сердца в правые.
Малый дефект
- Клинических проявлений нет.
- Питание ребенка, прибавка в весе и развитие без отклонений от нормы.
Умеренный дефект
Клинические проявления у недоношенных младенцев возникают значительно раньше. Любые инфекции дыхательной системы (нос, горло, трахея, легкие) ускоряют появление симптомов сердечной проблемы в связи с повышением давления венозной крови в легких и снижением их растяжимости:
- умеренное учащение дыхания (тахипноэ) – более 40 в минуту у грудничков;
- участие в дыхании вспомогательной мускулатуры (плечевого пояса);
- потливость;
- слабость при кормлении, вынуждающая делать перерывы на отдых;
- низкая ежемесячная прибавка в весе на фоне нормального роста.
Большой дефект
Те же симптомы, что и при умеренном дефекте, но в более выраженной форме, кроме того:
- посинение лица и шеи (центральный цианоз) на фоне физической нагрузки;
- постоянное синюшное окрашивание кожи – признак сочетанного порока.
По мере повышения давления в системе легочного кровотока присоединяются проявления гипертензии в малом круге кровообращения:
- Затрудненное дыхание при любой нагрузке.
- Боли в грудной клетке.
- Предобморочные и обморочные состояния.
- Присаживание на корточки облегчает состояние.
Диагностика
Выявить дефект межжелудочковой перегородки у детей, основываясь только на клинических проявлениях, нельзя, учитывая, что жалобы не носят специфического характера.
Физикальные данные: внешний осмотр, пальпация и выслушивание
Усиленный верхушечный толчок
Расщепление второго тона
Грубый систолический шум слева от грудины
Грубый систолический шум в нижней трети грудины слева
Есть ощутимое дрожание грудной клетки при сокращении миокарда
Умеренное усиление второго тона
Короткий систолический шум или его полное отсутствие
Выраженный акцент второго тона, ощутимый даже при пальпации
Выслушивается патологический третий тон
Часто есть хрипы в легких и увеличение печени
Электрокардиография (ЭКГ)
При прогрессировании сердечной недостаточности – утолщение правого желудочка
Утолщение правого предсердия
Отклонение электрической оси сердца влево
При выраженной легочной гипертензии утолщения левых отделов сердца нет
Рентгенография грудной клетки
Усиление легочного рисунка в центральных отделах
Расширение легочной артерии и левого предсердия
Увеличение правого желудочка
При сочетании с легочной гипертензией сосудистый рисунок ослаблен
Эхокардиография (ЭхоКГ) или ультрасонография (УЗИ) сердца
Позволяет выявить наличие, локализацию и размер ДМЖП. Исследование дает четкие признаки нарушения работы миокарда на основании:
- примерного уровня давления в камерах мышцы сердца и легочной артерии;
- разницы давления между желудочками;
- размеров полостей желудочков и предсердий;
- толщины их стенок;
- объема крови, который выбрасывает сердце при сокращении.
Размеры дефекта оценивают по отношению к основанию аорты:
Катетеризация сердца
Используется только в сложных диагностических случаях, позволяет определить:
- вид порока развития;
- размер окна между желудочками;
- точно оценить давление во всех полостях сердечной мышцы и центральных сосудах;
- степень сброса крови;
- расширение сердечных камер и их функциональный уровень.
Компьютерная и магнитная томография
- Это высокочувствительные методы исследования с большой диагностической ценностью.
- Позволяют полностью исключить необходимость проведения инвазивных способов диагностики.
- По результатам можно построить трехмерную реконструкцию сердца и кровеносных сосудов для выбора оптимальной хирургической тактики.
- Высокая цена и специфичность исследования не позволяют проводить их на потоке – диагностика такого уровня проводится только в специализированных сосудистых центрах.
Осложнения порока
- Легочная гипертензия (синдром Эйзенменгера) – самое тяжелое из осложнений. Изменения в сосудах легких невозможно вылечить. Они приводят к обратному сбросу крови из правых отделов в левые, что быстро проявляется симптомами сердечной недостаточности и приводит к гибели пациентов.
- Вторичная недостаточность клапана аорты – возникает обычно у детей старше двух лет и встречается в 5 % случаев.
- Значительное сужение выходной части правого желудочка есть у 7 % пациентов.
- Инфекционно-воспалительные изменения внутренней выстилки сердца (эндокардит) – редко возникает ранее двухлетнего возраста ребенка. Изменения захватывают оба желудочка, чаще располагаясь в области дефекта или на створках трикуспидального клапана.
- Закупорка (эмболия) крупных артерий бактериальными тромбами на фоне воспалительного процесса – очень частое осложнение эндокардита при дефекте стенки между желудочками.
Лечение
Малый ДМЖП не требует лечения. Дети развиваются в соответствии с нормами и живут полноценной жизнью.
Показано проведение антибактериальной профилактики попадания в кровь возбудителей, которые могут вызвать эндокардит, при лечении зубов или инфекционных заболеваниях ротовой полости и дыхательной системы.
Такой порок не оказывает влияния на качество жизни, даже если не закроется самостоятельно. Взрослые пациенты должны знать о своей патологии и предупреждать о заболевании медицинский персонал при любом лечении других заболеваний.
Дети с умеренными и большими пороками наблюдаются кардиологами в течение всей жизни. Им проводят лечение, которое компенсирует проявления заболевания или, в случае операции, может избавить от патологии. Есть умеренные ограничения по подвижности и риск воспаления внутренней выстилки сердца, но продолжительность жизни, как и у людей без порока.
Лекарственное лечение
Показания: умеренный и большой дефект в перегородке между желудочками.
- мочегонные препараты для снижения нагрузки на мышцу сердца (Фуросемид, Спиронолактон);
- ингибиторы АПФ, которые помогают миокарду в условиях повышенной нагрузки, расширяют сосуды в легких и почках, снижают давление (Каптоприл);
- сердечные гликозиды, улучающие сократимость миокарда и проведение возбуждения по нервным волокнам (Дигоксин).
Препараты при дефекте межжелудочковой перегородки
Хирургическое лечение
- Отсутствие эффекта от лекарственной коррекции в виде прогрессирования недостаточности функции сердца с нарушением развития ребенка.
- Частые инфекционно-воспалительные процессы дыхательных путей, особенно бронхов и легких.
- Большие размеры дефекта перегородки с повышением давления в системе кровотока легких, даже без снижения работы сердца.
- Наличие бактериальных отложений (вегетаций) на внутренних элементах камер сердца.
- Первые признаки нарушения работы аортального клапана (неполное смыкание створок по данным ультразвукового обследования).
- Размер мышечного дефекта более 2 см при расположении его в области верхушки сердца.
- Эндоваскулярные операции (малоинвазивные, не требующие большого оперативного доступа) – фиксация специальной заплатки или окклюдера в области дефекта.
Невозможно использовать при больших размерах окна между желудочками, так как нет места для фиксации. Используют при мышечном типе порока.
При умеренном размере дефекта проводят соединение двух лоскутов со стороны каждого желудочка, фиксируя их к ткани перегородки.
Большой дефект закрывают одной крупной заплаткой из медицинского материала.
Риск смертельного исхода при проведении оперативного лечения в первые два месяца жизни составляет 10–20 %, а после 6 месяцев – 1–2 %. Поэтому любые необходимые оперативные коррекции сердечных пороков стараются проводить во второй половине первого года жизни.
После проведения операции, особенно эндоваскулярной, возможно повторное открытие дефекта. При повторных операциях риск смертельных осложнений возрастает до 5 %.
Прогноз
Изолированные ДМЖП хорошо поддаются коррекции, при условии своевременной диагностики, наблюдения и проведения необходимого лечения.
- При мышечном варианте порока, если дефект малого или умеренного размера, в течение первых двух лет самопроизвольно закрываются 80 % патологических сообщений, еще 10 % могут закрыться в более позднем возрасте. Крупные дефекты перегородки не закрываются, но уменьшаются в размере, позволяя провести операцию с меньшим риском осложнений.
- Перимембранозные дефекты самостоятельно закрываются у 35–40 % пациентов, при этом у части из них в зоне бывшего окна формируется аневризма перегородки.
- Инфундибулярный тип нарушения целостности перегородки между желудочками сам закрыться не может. Все дефекты умеренного и большого диаметра требуют хирургической коррекции в течение второй половины первого года жизни ребенка.
- Дети с малыми размерами дефекта не требуют никакой терапии, а только наблюдение в динамике.
Всем пациентам с таким пороком сердца показана антибактериальная профилактика при стоматологических процедурах, в связи с риском развития воспаления внутренней выстилки сердца.
Ограничение по уровню физических нагрузок показано при любом типе дефекта умеренного и большого диаметра до его самопроизвольного заращения или хирургического закрытия. После операции дети наблюдаются кардиологом и при отсутствии рецидива в течение одного года допускаются к любым видам нагрузок.
Общая летальность при нарушении строения стенки между желудочками, включая послеоперационную, составляет около 10 %.
Лечение сердца и сосудов © 2016 | Карта сайта | Контакты | Политика по персональным данным | Пользовательское соглашение | При цитировании документа ссылка на сайт с указанием источника обязательна.
Источник: https://okardio.com/bolezni-serdca/defekt-mezhzheludochkovoj-peregorodki-619.html
Нарушения сократимости миокарда
Нарушения сократимости миокарда могут наблюдаться не только при ишемической болезни сердца, но также при кардиомиопатиях, расстройствах проводимости и некоторых пороках сердца с перегрузкой правого желудочка давлением и объемом.
В разделах, посвященных этим патологическим состояниям, приведены определенные дифференциально-диагностические критерии. Тем не менее при ишемической болезни сердца необходимо использовать не только ультразвуковые, но и все современные методы исследования.
Эхокардиография, дающая одномерное изображение выбранного сегмента сердца, позволяет говорить только о наличии или отсутствии дискинезии миокарда в лоцируемой области.
Для более полного изучения этого феномена необходимо применение методов, дающих двухмерное изображение сердца. Так, в частности, при помощи В-сканирования можно получить изображение левых отделов сердца, сходное с вентрикулографическим в левой передней косой проекции.
В этих случаях визуализируются аорта, межжелудочковая перегородка, часть передней стенки левого желудочка, верхушка сердца и задняя стенка левого желудочка.
Получив сканограммы левого желудочка в систолу и диастолу, накладывают их одну на другую так, чтобы совместились центры просвета аорты на уровне створок ее клапана. В норме контур систолы всегда находится внутри контура диастолы.
При ишемической болезни сердца с выраженной гипокинезией контур систолы в месте поражения очень близко подойдет к контуру диастолы: при наличии акинезии стенки левого желудочка в систолу и диастолу будут иметь на каком-то участке общий контур.
Дискинезия левого желудочка (т. е. его аневризма) характеризуется систолическим выбуханием в области повреждения за контур диастолы.
Таким образом, при помощи ультразвукового В-сканирования можно диагностировать практически все выделенные W. Gorlin (1969) виды диссинергии миокарда: гипокинезию (снижение систолической амплитуды движения пораженного участка), акинезию (полное отсутствие движения того или иного участка стенки левого желудочка), дискинезию (парадоксальное выбухание определенного участка миокарда в систолу) и крайне выраженную дискинезию (аневризма левого желудочка с деформацией не только систолического, но и диастолического контура).
Наше мнение о высокой диагностической значимости этого метода исследования при ишемической болезни сердца подтверждают данные L. Teichholz (1974).
При совмещении систолических и диастолических сканограмм автором получен высокий процент совпадения участков асинергии, выявленных методом ультразвукового сканирования и вентрикулографии, выполненной в левой передней косой проекции.
Характерно, что асинергия межжелудочковой перегородки лучше визуализируется при ультразвуковом сканировании. Аналогичные данные опубликовали Y. Ioshikawa с соавт. (1975), подчеркнувшие значительные трудности выявления зон умеренной гипокинезии.
«Ультразвуковая диагностика в кардиологии», Н.М.Мухарлямов
Эта информация для ознакомления, за лечением обратитесь к врачу.
Источник: https://www.serdechno.ru/ultrasound/sense/673.html
Дефект межжелудочковой перегородки сердца: что это такое, причины, лечение, симптомы, признаки
Самая частая локализация дефекта межжелудочковой перегородки — перепончатая часть перегородки (мембранозный дефект) — 80%.
Что такое дефект межжелудочковой перегородки сердца
Врождённый дефект межжелудочковой перегородки (ДМЖП) — результат неполного образования перегородки между желудочками. У эмбриона МЖП состоит из мембранозной и мышечной части. Большинство врождённых дефектов «перимембранозные», т.е. они находятся в месте соединения мембранозной и мышечной части.
Причины дефекта межжелудочковой перегородки сердца
ДМЖП — самые часто встречающиеся ВПС: 1 на 500 детей, родившихся живыми. Дефект может быть изолированным или представлять собой часть сложного ВПС. Приобретённый ДМЖП может произойти при её разрыве, осложнившем острый ИМ, или при травме.
Продолжительность жизни больного определяется состоянием гемодинамики, которая зависит от площади дефекта и состояния легочных артерий. Локализация дефекта оказывает меньшее влияние на прогноз. У больного, дожившего до взрослого возраста и не подвергшегося хирургическому лечению, исходно дефект небольшой. Неоперированный больной со значимым дефектом, как правило, умирает в детском возрасте. МЖП может закрыться спонтанно. Примерно 50% всех дефектов имеет малые размеры, а три четвертых из них закрываются спонтанно. Даже большие по площади дефекты с возрастом уменьшаются. Спонтанно закрываются, как правило, дефекты в трабекулярной части МЖП и очень редко в мембранозной части. Спонтанное закрытие дефектов происходит в первые 5 лет жизни ребенка в 90% всех случаев. В литературе описаны единичные случаи спонтанного закрытия дефекта у взрослого. Таким образом, врач, наблюдающий подростка или взрослого больного с дефектом межжелудочковой перегородки, имеет дело с практически стабильной площадью дефекта. При отсутствии существенных изменений площади дефекта решающая роль в прогнозе заболевания принадлежит легочному сосудистому сопротивлению, степень которого зависит от перегрузки объемом крови, возникающей при сбросе крови слева направо.
Симптомы и признаки дефекта межжелудочковой перегородки
Кровоток из ЛЖ с высоким давлением в ПЖ низким давлением во время систолы продуцирует пансистолический шум, иррадиирующий по всей прекордиальной области. Маленький дефект часто продуцирует громкий шум (maladie de Roger) при отсутствии других нарушений гемодинамики. И наоборот, большой дефект может давать мягкий шум, особенно при увеличении давления в ПЖ.
Врождённый ДМЖП проявляется как СН в младенчестве или как шум с минимальными нарушениями гемодинамики у старших детей и взрослых и редко — как синдром Эйзенменгера. У некоторых детей шум становится тише или исчезает после спонтанного закрытия дефекта.
Сердечная недостаточность осложняет большой дефект обычно в период 4-6 нед жизни, но отсутствует в раннем постнатальном периоде. Помимо шума, имеется выраженная парастерналь-ная пульсация, тахипноэ и втяжение нижних рёбер на вдохе. При рентгенологическом исследовании грудной клетки видно полнокровие лёгких, на ЭКГ — синдром гипертрофии ЛЖ и ПЖ.
Обычно наблюдают в срок от 24 ч (наибольший риск) до 10 сут после ОИМ и встречают в 2-4% случаев. Клинически наблюдается резкое ухудшение состояния пациента, появление грубого пансистолического шума (с эпицентром в области левого края грудины, внизу), нарушение тканевой перфузии и отек легких. Отсутствие шума у пациента с низким сердечным выбросом не исключает дефекта межжелудочковой перегородки.
В клинической практике принято оценивать:
- отношение легочного кровотока к общему кровотоку;
- среднее давление в легочной артерии;
- отношение легочного сосудистого сопротивления к общему сосудистому сопротивлению.
В 1994 г. в рамках клинического исследования «Первая естественная история изучения врожденных пороков сердца» (First Natural History Study of Congenital Heart Defects) создана классификация дефекта межжелудочковой перегородки с учетом величин, характеризующих связь легочного кровотока и легочного сосудистого сопротивления с системным кровотоком и системным сосудистым сопротивлением. В классификации учтен уровень давления в легочной артерии. В соответствии с классификацией все дефекты межжелудочковой перегородки разделены на 4 группы:
- группа 1 — дефект межжелудочковой перегородки с незначительным сбросом крови; отношение легочного кровотока к системному < 1,5, а среднее давление в легочной артерии 1,2, среднее давление в легочной артерии повышено (>20 мм рт.ст.); легочное сосудистое сопротивление еще значимо не выросло: отношение легочного сосудистого сопротивления к системному 1/3 общего сосудистого сопротивления, не останавливает прогрессирование легочной гипертензии.
- Турбулентное движение крови в дефекте МЖП способствует возникновению ИЭ. В связи с этим его профилактика обязательна для больных ДМЖП.
- Все больные с дефектом межжелудочковой перегородки имеют высокий риск внезапной смерти. В постоперационном периоде он достигает 2%. В связи с этим холтер-мониторирование обязательно как в до-, так и послеоперационном периоде. Вопрос о выборе и эффективности антиаритмических препаратов у больных с ДМЖП остается нерешенным.
- В связи с отсутствием исследования оценки эффективности медикаментозного лечения больных с дефектом межжелудочковой перегородки до операции, эту тактику необходимо вырабатывать совместно с хирургом. Можно предположить, что традиционные препараты для лечения ХСН эффективны и для лечения больных с ДМЖП.
- У больных с ДМЖП необходимо достижение целевого АД. Высокое АД приводит к росту сброса слева направо.
- Если у больного с ДМЖП появляется мерцательная аритмия, тактика лечения должна быть направлена на контроль частоты, а не ритма. Контроль состояния свертывающей системы крови у пациентов с дефектом межжелудочковой перегородки и мерцательной аритмией — важная составляющая лечения. MHO необходимо поддерживать на уровне 2-2,5.
- При присоединении ИБС следует обсуждать вопрос об одномоментном вмешательстве на коронарной артерии и коррекции дефекта МЖП.
- В послеоперационном периоде при отсутствии роста легочной гипертензии тактика ведения пациента направлена на предотвращение ремоделирования камер сердца, при росте легочной гипертензии — на ее коррекцию.
Мероприятия по стабилизации состояния больного направлены на то, чтобы выиграть время для окончательного восстановления целостности стенки миокарда. Лечение гипотензии и отека легких производят по описанным повсеместно принципам. Ниже представлены наиболее важные положения:
- Для проведения адекватной гемодинамической поддержки необходим инвазивный мониторинг (катетеризация артерии и легочной артерии). Потребность в инфузионной терапии или диуретиках определяет состояние ПЖ и давление заклинивания легочных капилляров (ДЗЛК). Сердечный выброс, среднее АД и сосудистое сопротивление определяют потребность в вазодилататорах.
- Если систолическое АД >110, с целью уменьшения сосудистого сопротивления и выраженности шунтирования назначают вазодилататоры, обычно начинают с натрия нитропруссида Нитраты расширяют вены, что приводит к усилению шунтирования, в связи с чем их назначения следует избегать. Вазодилататоры не назначают при нарушении функций почек.
- У пациентов с тяжелой гипотензией показано назначение препаратов с инотропными свойствами (вначале добутамина, но в зависимости от гемодинамического эффекта может потребоваться введение эпинефрина). Повышение АД уменьшает выраженность шунтирования.
- В большинстве случаев показана быстрая установка внутриаортапьного баллона для проведения баллонной контрпульсации.
- Как можно раньше следует связаться с хирургом с целью решения вопроса о хирургическом лечении. Операционная летальность продолжает оставаться высокой (20-70%), особенно на фоне интраоперационного шока, задненижнего ОИМ и инфаркта правого желудочка. Сейчас следуют рекомендациям о проведении сопряженного с высоким риском коронарного шунтирования и пластики или протезировании митрального клапана.
- При постепенной отмене лекарственной терапии и механических методов лечения с целью достижения некоторого заживления в области инфаркта проведение хирургического вмешательства может быть отсрочено на 2-4 нед.
- Идеально проведение катетеризации перед операцией с целью выявления сосуда, который будет подвергнут шунтированию.
- Закрытие дефекта перегородки с помощью катетера или напоминающего зонд устройства обеспечивает стабилизацию состояния пациента до тех пор, пока не станет возможным проведение окончательного лечения.
Прогноз при дефекте межжелудочковой перегородки
За исключением синдрома Эйзенменгера, долгосрочный прогноз весьма благоприятней при врождённых ДМЖП. Многие больные с синдромом Эйзенменгера умирают во II или III декаде жизни, незначительная часть пациентов доживает до V декады без трансплантации.
Перепечатка материалов с сайта строго запрещена!
Информация на сайте предоставлена для образовательных целей и не предназначена в качестве медицинской консультации и лечения.
Источник: https://www.sweli.ru/zdorove/meditsina/kardiologiya/defekt-mezhzheludochkovoy-peregorodki-serdtsa-prichiny-lechenie-simptomy-priznaki.html
Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки – врожденная внутрисердечная аномалия, характеризующаяся наличием сообщения между правым и левым желудочками. Дефект межжелудочковой перегородки проявляется одышкой, отставанием в физическом развитии, быстрой утомляемостью, учащенным сердцебиением, наличием «сердечного горба». Инструментальная диагностика дефекта межжелудочковой перегородки включает проведение ЭКГ, ЭхоКГ, рентгенографии органов грудной клетки, вентрикулографии, аортографии, катетеризации камер сердца, МРТ. При дефектах межжелудочковой перегородки проводят радикальные (закрытие дефекта) и паллиативные (сужение легочной артерии) вмешательства.
Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки (ДМЖП) – отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки – наиболее часто встречающийся врожденный порок сердца (9–25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Дефект межжелудочковой перегородки может быть единственной внутрисердечной аномалией (изолированный ДМЖП) или входить в структуру сложных пороков (тетрады Фалло, общего артериального ствола, транспозиции магистральных сосудов, атрезии трехстворчатого клапана и др.). В ряде случаев межжелудочковая перегородка может отсутствовать полностью — такое состояние характеризуется как единственный желудочек сердца.
Причины дефекта межжелудочковой перегородки
Чаще всего дефект межжелудочковой перегородки является следствием нарушения эмбрионального развития и формируется у плода при нарушениях закладки органов. Поэтому дефекту межжелудочковой перегородки часто сопутствуют другие сердечные пороки: открытый артериальный проток (20%), дефект межпредсердной перегородки (20%), коарктация аорты (12%), стеноз устья аорты (5%), аортальная недостаточность (2,5—4,5%), недостаточность митрального клапана (2%), реже — аномальный дренаж легочных вен, стеноз легочной артерии и др.
В 25-50% случаев дефект межжелудочковой перегородки сочетается с пороками развития внесердечной локализации — болезнью Дауна, аномалиями развития почек, расщелиной твердого неба и заячьей губой.
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
Межжелудочковая перегородка образует внутренние стенки обоих желудочков и составляет примерно 1/3 площади каждого из них. Межжелудочковая перегородка представлена мембранозным и мышечным компонентами. В свою очередь, мышечный отдел состоит из 3-х частей — приточной, трабекулярной и отточной (инфундибулярной).
Межжелудочковая перегородка, наряду с другими стенками желудочков, принимает участие в сокращении и расслаблении сердца. У плода она полностью формируется к 4-5-ой неделе эмбрионального развития. Если этого по каким-либо причинам не происходит, в межжелудочковой перегородке остается дефект. Нарушения гемодинамики при дефекте межжелудочковой перегородки обусловлены сообщением левого желудочка с высоким давлением и правого желудочка с низким давлением (в норме в период систолы давление в левом желудочке враз выше, чем в правом).
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова–Роже), средний – равен примерно 1/2 диаметра аортального отверстия, большой – равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
- перимембранозные дефекты межжелудочковой перегородки — 75% (приточные, трабекулярные, инфундибулярные) расположены в верхней части перегородки под аортальным клапаном, могут закрываться самопроизвольно;
- мышечные дефекты межжелудочковой перегородки – 10% (приточные, трабекулярные) — расположены в мышечном отделе перегородки, на значительном удалении от клапанной и проводящей систем;
- надгребневые дефекты межжелудочковой перегородки — 5% — расположены выше наджелудочкового гребня (мышечного пучка, отделяющего полость правого желудочка от его выносящего тракта), самопроизвольно не закрываются.
Симптомы дефекта межжелудочковой перегородки
Клинические проявления больших и малых изолированных дефектов межжелудочковой перегородки различны. Малые дефекты межжелудочковой перегородки (болезнь Толочинова—Роже) имеют диаметр менее 1 см и встречаются в 25-40% от числа всех ДМЖП. Проявляются нерезко выраженной утомляемостью и одышкой при нагрузке. Физическое развитие детей, как правило, не нарушено. Иногда у них определяется слабо выраженное куполообразное выпячивание грудной клетки в области сердца — «сердечный горб». Характерным клиническим признаком малых дефектов межжелудочковой перегородки служит аускультативно выявляемое наличие грубого систолического шума над областью сердца, который фиксируется уже на первой неделе жизни.
Большие дефекты межжелудочковой перегородки, имеющие размеры более 1/2 диаметра устья аорты или более 1 см, проявляются симптоматически уже в первые 3 месяца жизни новорожденных, приводя в 25-30% случаев к развитию критического состояния. При больших дефектах межжелудочковой перегородки отмечается гипотрофия, одышка при физической нагрузке или в покое, повышенная утомляемость. Характерны затруднения при кормлении: прерывистое сосание, частые отрывы от груди, одышка и бледность, потливость, пероральный цианоз. В анамнезе у большинства детей с дефектом межжелудочковой перегородки — частые респираторные инфекции, затяжные и рецидивирующие бронхиты и пневмонии.
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких выслушиваются застойные хрипы.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.
Дефект межжелудочковой перегородки — лечение в Москве
Cправочник болезней
Болезни сердца и сосудов
Последние новости
- © 2018 «Красота и медицина»
предназначена только для ознакомления
и не заменяет квалифицированную медицинскую помощь.
Источник: https://www.krasotaimedicina.ru/diseases/zabolevanija_cardiology/ventricular-septal-defect
Ишемическая болезнь сердца и связанная с ней патология левого желудочка — serdce.com.ua
Ишемия миокарда вызывает локальные нарушения сократимости ЛЖ, нарушения глобальной диастолической и систолической функции ЛЖ. При хронической ишемической болезни сердца наибольшее прогностическое значение имеют два фактора: выраженность поражения коронарных артерий и глобальная систолическая функция левого желудочка. При трансторакальном эхокардиографическом исследовании можно судить о коронарной анатомии, как правило, только косвенным образом: лишь у небольшого числа пациентов визуализируются проксимальные участки коронарных артерий (рис. 2.7, 5.8). С недавнего времени для визуализации коронарных артерий и изучения коронарного кровотока начали применять чреспищеводное исследование [252, 254] (рис. 17.5, 17.6, 17.7). Однако этот метод пока не получил широкого практического применения для изучения коронарной анатомии. О методах оценки глобальной сократимости ЛЖ говорилось выше. Эхокардиографическое исследование, проведенное в покое, строго говоря, — не метод диагностики ишемической болезни сердца. О применении эхокардиографии в сочетании с нагрузочными пробами речь пойдет ниже, в главе «Стресс-эхокардиография».
Рисунок 5.8. Аневризматическое расширение ствола левой коронарной артерии: парастернальная короткая ось на уровне аортального клапана. Ao — корень аорты, LCA — ствол левой коронарной артерии, PA — легочная артерия, RVOT — выносящий тракт правого желудочка.
Несмотря на упомянутые ограничения, эхокардиографическое исследование в покое, дает ценную информацию при ишемической болезни сердца. Боль в грудной клетке может быть сердечного или несердечного происхождения. Распознавание ишемии миокарда в качестве причины боли в грудной клетке имеет принципиальное значение для дальнейшего ведения пациентов как при амбулаторном исследовании, так и при поступлении их в блок интенсивной терапии. Отсутствие нарушений локальной сократимости ЛЖ во время болей в грудной клетке практически исключает ишемию или инфаркт миокарда в качестве причины болей (при хорошей визуализации сердца).
Локальную сократимость ЛЖ оценивают при двумерном эхокардиографическом исследовании, проводимом из различных позиций: чаще всего это парастернальные позиции длинной оси ЛЖ и короткой оси на уровне митрального клапана и апикальные позиции двух- и четырехкамерного сердца (рис. 4.2). Для визуализации задне-базальных отделов ЛЖ применяется также апикальная позиция четырехкамерного сердца с отклонением плоскости сканирования книзу (рис. 2.12). При оценке локальной сократимости ЛЖ необходимо визуализировать как можно лучше эндокард в исследуемой области. Для принятия решения о том, нарушена локальная сократимость ЛЖ или не нарушена, следует учитывать как движение миокарда исследуемой области, так и степень его утолщения. Кроме того, следует сравнивать локальную сократимость различных сегментов ЛЖ, исследовать эхо-структуру ткани миокарда в исследуемой области. Нельзя полагаться только на оценку движения миокарда: нарушения внутрижелудочковой проводимости, синдром предвозбуждения желудочков, электростимуляция правого желудочка сопровождаются асинхронным сокращением различных сегментов ЛЖ, поэтому эти состояния затрудняют оценку локальной сократимости ЛЖ. Затрудняет ее и парадоксальное движение межжелудочковой перегородки, наблюдаемое, например, при объемной перегрузке правого желудочка. Нарушения локальной сократимости ЛЖ описывают в следующих терминах: гипокинезия, акинезия, дискинезия. Гипокинезия означает снижение амплитуды движения и утолщения миокарда исследуемой области, акинезия — отсутствие движения и утолщения, дискинезия — движение исследуемого участка ЛЖ в направлении, противоположном нормальному. Термин «асинергия» означает неодновременное сокращение различных сегментов; асинергию ЛЖ нельзя отождествлять с нарушениями его локальной сократимости. Для описания выявленных нарушений локальной сократимости ЛЖ и количественного их выражения прибегают к делению миокарда на сегментов. Американская кардиологическая ассоциация рекомендует деление миокарда ЛЖ на 16 сегментов (рис. 15.2). Чтобы рассчитать индекс нарушения локальной сократимости, сократимость каждого сегмента оценивают в баллах: нормальная сократимость — 1 балл, гипокинезия — 2, акинезии — 3, дискинезии — 4. Сегменты, недостаточно четко визуализированные, не учитывают. Сумму баллов затем делят на общее число исследованных сегментов.
Причиной нарушений локальной сократимости ЛЖ при ишемической болезни сердца может быть: острый инфаркт миокарда, постинфарктный кардиосклероз, преходящая ишемия миокарда, постоянно действующая ишемия жизнеспособного миокарда («гибернирующий миокард»). На нарушениях локальной сократимости ЛЖ неишемической природы мы здесь не будем останавливаться. Скажем только, что кардиомиопатии неишемического генеза часто сопровождаются неравномерным поражением различных участков миокарда ЛЖ, так что судить с уверенностью об ишемической природе кардиомиопатии только на основании обнаружения зон гипо- и акинезии не следует.
Сократимость некоторых сегментов ЛЖ страдает чаще других. Нарушения локальной сократимости в бассейнах правой и левой коронарных артерий обнаруживаются при эхокардиографическом исследовании с примерно одинаковой частотой. Окклюзия правой коронарной артерии, как правило, приводит к нарушениям локальной сократимости в области задне-диафрагмальной стенки ЛЖ. Нарушения локальной сократимости передне-перегородочно-верхушечной локализации типичны для инфаркта (ишемии) в бассейне левой коронарной артерии.
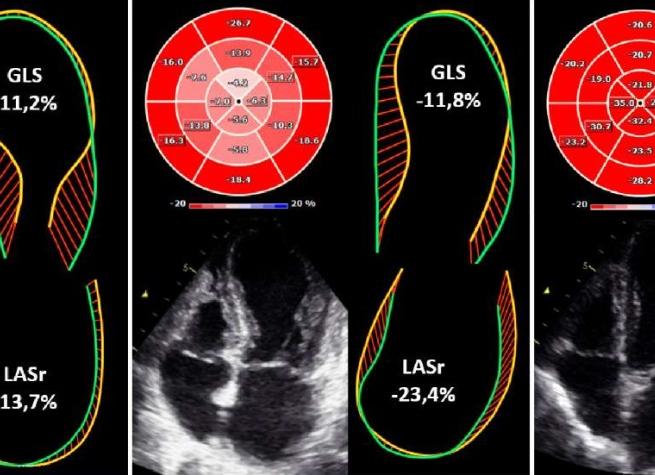
Клинические проявления асинергии и методы ее диагностики
Вконтакте
Одноклассники
Человеческий мозг представляет собой сложноорганизованную структуру, состоящую из разных отделов, связанных между собой анатомически и функционально и отвечающих за выполнение определенных видов деятельности в организме человека.
Одной из важнейших составных частей мозга, в частности его заднего отдела, является мозжечок. Он является ответственным за координацию движений, регулирует тонус мышц, без него невозможно обеспечить нормальное равновесие тела человека в пространстве. Кроме того, доказано участие мозжечка в психических функциях. Вот почему патология в этом отделе головного мозга привлекает внимание не только неврологов, но и психиатров.
Что происходит при поражении мозжечка?
В силу разных причин (опухоль, травма, абсцесс, кровоизлияние, наследственные дегенеративные заболевания, демиелинизирующие болезни, алкогольная дегенерация) мозжечок перестает нормально функционировать, что проявляется различными симптомами двигательных расстройств.
Важнейшими из них являются атония (или гипотония), атаксия и её проявление асинергия. Последняя выражается в неспособности человека симметрично совершать сложные движения, выполнять действия, требующие одновременного участия разных отделов тела, то есть каждое движение будет выполняться как последовательность отдельных простых реакций, а не целое сочетание.
Выделяют статическую атаксию (невозможность удержаться в равновесии в вертикальном положении тела) и динамическую (дискоординационные нарушения при ходьбе, шаткая походка с широко поставленными ногами). Все три вышеперечисленных симптома появляются при повреждении любого отдела в мозжечке, а вот степень выраженности их зависит от места расположения патологического очага и его размеров.
Кроме этого, характерными проявлениями мозжечковых расстройств считаются:
- появление тремора и нистагма;
- гиперметрия (несоответствие движений с расстоянием до определенной точки, например, больной человек промахивается дальше носа при пальценосовой пробе);
- нарушения речи;
- адиадохокинез (невозможность правильного чередования при противоположных действиях).
Клинические проявления асинергии
Эта патология была описана французским ученым Бабинским, согласно его представлениям существуют:
- лобная асинергия (при патологии соответствующих долей мозга) — нарушения при ходьбе проявляются тем, что ноги отстают от туловища, которое постепенно отклоняется назад, и человек падает на спину вследствие смещения центра тяжести тела;
- мозжечковая 1 типа — человек испытывает затруднения при попытке встать из горизонтального положения без помощи рук (при скрещенных на груди руках), из-за отсутствия симметричного сокращения мышц ягодиц таз и ноги не прижимаются к опоре, а поднимаются при вставании кверху. Описаны случаи одностороннего нарушения — гемиасинергия.
- мозжечковая асинергия 2 типа — патология червя мозжечка — больной при запрокидывании головы назад и попытке прогнуться, падает, теряя равновесие, на спину, так как не происходит симметричного сокращения мышц и сгибания ног в коленных и разгибания в тазобедренных суставах.
Следует отметить, что бурно нарастающая клиника атаксии и асинергии характерна для острых ситуаций (кровоизлияние в мозг, инфаркт в мозжечке), быстро развивается симптомокомплекс при опухоли, абсцессе мозга, алкоголизме.
Эпизодические проявления нарушения координации могут отмечаться при поступлении в организм некоторых лекарств (противосудорожные) или при наследственной патологии. Медленно прогрессирует атаксия и асинергия при идиопатических поражениях и дегенеративных формах болезней, рассеянном склерозе.
Что такое пробы на асинергию?
Их проводят специалисты при подозрении на патологию мозжечка следующим образом:
- из исходной позиции «лежа на спине» больного просят скрестить руки на груди и подняться, при этом здоровый человек легко садится, а при мозжечковых расстройствах у человека поднимаются кверху ноги или одна нога при гемипоражении, но сам он не может сесть без помощи;
- из положения «стоя» человеку предлагают опереться на ладони врача, стоящего впереди, при быстром убирании рук, больной падает вперед (симптом, описанный Ожеховским). Если человек здоров, то он слегка отклонится назад или будет стоять ровно на месте;
- больной не в состоянии самостоятельно подняться со стула из-за того, что ноги не симметрично сгибаются в коленных суставах;
- в вертикальном положении человек не может прогнуться назад и запрокинуть голову, а падает на спину;
- при передвижении тело отстает от ног, и постепенно происходит падение больного на спину.
Следует отметить, что все вышеописанное относится к проявлениям асинергии, обусловленной наличием органических поражений мозга, но существует еще и асинергия функционального характера, например, диссоциативные нарушения моторики у больных шизофренией или другими психиатрическими заболеваниями.
Лечебные мероприятия при асинергии сводятся к выяснению причины данного состояния и симптоматической терапии. Необходимо проводить адекватное лечение основного заболевания.
Наследственные и идиопатические формы не лечатся, на первый план выступают вопросы социальной адаптации пациентов, лечебных упражнений. Прогноз обычно малоблагоприятный.
(Пока нет голосов)
Асинергия межжелудочковой перегородки
Из этой статьи вы узнаете о пороке развития сердца в виде дефекта межжелудочковой перегородки. Что это за нарушение развития, когда возникает и как себя проявляет.
Оглавление:
Особенности диагностики, лечения заболевания. Как долго живут с таким пороком.
- расширению полостей левого предсердия и желудочка со значительным утолщением стенки последнего;
- повышению давления в системе кровотока легких с развитием в них гипертензии;
- прогрессивному нарастанию недостаточности работы сердца.
- малые и средние практически никогда не сопровождаются нарушением работы сердца и легких;
- большие могут стать причиной смерти ребенка от 0 до 18 лет, но чаще фатальные осложнения развиваются в грудном возрасте (дети первого года жизни), если вовремя не провести лечение.
Диагностикой, наблюдением и лечением пациентов с ДМЖП занимаются педиатры, детские кардиологи и сосудистые хирурги.
Как часто встречается порок
Почему возникает
Классификация
Симптомы
Малый дефект
- Клинических проявлений нет.
- Питание ребенка, прибавка в весе и развитие без отклонений от нормы.
Умеренный дефект
- умеренное учащение дыхания (тахипноэ) – более 40 в минуту у грудничков;
- участие в дыхании вспомогательной мускулатуры (плечевого пояса);
- потливость;
- слабость при кормлении, вынуждающая делать перерывы на отдых;
- низкая ежемесячная прибавка в весе на фоне нормального роста.
Большой дефект
- посинение лица и шеи (центральный цианоз) на фоне физической нагрузки;
- постоянное синюшное окрашивание кожи – признак сочетанного порока.
- Затрудненное дыхание при любой нагрузке.
- Боли в грудной клетке.
- Предобморочные и обморочные состояния.
- Присаживание на корточки облегчает состояние.
Диагностика
Физикальные данные: внешний осмотр, пальпация и выслушивание
Электрокардиография (ЭКГ)
Рентгенография грудной клетки
Эхокардиография (ЭхоКГ) или ультрасонография (УЗИ) сердца
- примерного уровня давления в камерах мышцы сердца и легочной артерии;
- разницы давления между желудочками;
- размеров полостей желудочков и предсердий;
- толщины их стенок;
- объема крови, который выбрасывает сердце при сокращении.
Катетеризация сердца
- вид порока развития;
- размер окна между желудочками;
- точно оценить давление во всех полостях сердечной мышцы и центральных сосудах;
- степень сброса крови;
- расширение сердечных камер и их функциональный уровень.
Компьютерная и магнитная томография
- Это высокочувствительные методы исследования с большой диагностической ценностью.
- Позволяют полностью исключить необходимость проведения инвазивных способов диагностики.
- По результатам можно построить трехмерную реконструкцию сердца и кровеносных сосудов для выбора оптимальной хирургической тактики.
- Высокая цена и специфичность исследования не позволяют проводить их на потоке – диагностика такого уровня проводится только в специализированных сосудистых центрах.
Осложнения порока
- Легочная гипертензия (синдром Эйзенменгера) – самое тяжелое из осложнений. Изменения в сосудах легких невозможно вылечить. Они приводят к обратному сбросу крови из правых отделов в левые, что быстро проявляется симптомами сердечной недостаточности и приводит к гибели пациентов.
- Вторичная недостаточность клапана аорты – возникает обычно у детей старше двух лет и встречается в 5 % случаев.
- Значительное сужение выходной части правого желудочка есть у 7 % пациентов.
- Инфекционно-воспалительные изменения внутренней выстилки сердца (эндокардит) – редко возникает ранее двухлетнего возраста ребенка. Изменения захватывают оба желудочка, чаще располагаясь в области дефекта или на створках трикуспидального клапана.
- Закупорка (эмболия) крупных артерий бактериальными тромбами на фоне воспалительного процесса – очень частое осложнение эндокардита при дефекте стенки между желудочками.
Лечение
Такой порок не оказывает влияния на качество жизни, даже если не закроется самостоятельно. Взрослые пациенты должны знать о своей патологии и предупреждать о заболевании медицинский персонал при любом лечении других заболеваний.
Лекарственное лечение
- мочегонные препараты для снижения нагрузки на мышцу сердца (Фуросемид, Спиронолактон);
- ингибиторы АПФ, которые помогают миокарду в условиях повышенной нагрузки, расширяют сосуды в легких и почках, снижают давление (Каптоприл);
- сердечные гликозиды, улучающие сократимость миокарда и проведение возбуждения по нервным волокнам (Дигоксин).
Хирургическое лечение
- Отсутствие эффекта от лекарственной коррекции в виде прогрессирования недостаточности функции сердца с нарушением развития ребенка.
- Частые инфекционно-воспалительные процессы дыхательных путей, особенно бронхов и легких.
- Большие размеры дефекта перегородки с повышением давления в системе кровотока легких, даже без снижения работы сердца.
- Наличие бактериальных отложений (вегетаций) на внутренних элементах камер сердца.
- Первые признаки нарушения работы аортального клапана (неполное смыкание створок по данным ультразвукового обследования).
- Размер мышечного дефекта более 2 см при расположении его в области верхушки сердца.
- Эндоваскулярные операции (малоинвазивные, не требующие большого оперативного доступа) – фиксация специальной заплатки или окклюдера в области дефекта.
Прогноз
- При мышечном варианте порока, если дефект малого или умеренного размера, в течение первых двух лет самопроизвольно закрываются 80 % патологических сообщений, еще 10 % могут закрыться в более позднем возрасте. Крупные дефекты перегородки не закрываются, но уменьшаются в размере, позволяя провести операцию с меньшим риском осложнений.
- Перимембранозные дефекты самостоятельно закрываются у 35–40 % пациентов, при этом у части из них в зоне бывшего окна формируется аневризма перегородки.
- Инфундибулярный тип нарушения целостности перегородки между желудочками сам закрыться не может. Все дефекты умеренного и большого диаметра требуют хирургической коррекции в течение второй половины первого года жизни ребенка.
- Дети с малыми размерами дефекта не требуют никакой терапии, а только наблюдение в динамике.
АСИНЕРГИЯ МЖП
Дефект межжелудочковой перегородки сердца: что это такое, причины, лечение, симптомы, признаки
Что такое дефект межжелудочковой перегородки сердца
Причины дефекта межжелудочковой перегородки сердца
ДМЖП — самые часто встречающиеся ВПС: 1 на 500 детей, родившихся живыми. Дефект может быть изолированным или представлять собой часть сложного ВПС. Приобретённый ДМЖП может произойти при её разрыве, осложнившем острый ИМ, или при травме.Продолжительность жизни больного определяется состоянием гемодинамики, которая зависит от площади дефекта и состояния легочных артерий. Локализация дефекта оказывает меньшее влияние на прогноз. У больного, дожившего до взрослого возраста и не подвергшегося хирургическому лечению, исходно дефект небольшой. Неоперированный больной со значимым дефектом, как правило, умирает в детском возрасте. МЖП может закрыться спонтанно. Примерно 50% всех дефектов имеет малые размеры, а три четвертых из них закрываются спонтанно. Даже большие по площади дефекты с возрастом уменьшаются. Спонтанно закрываются, как правило, дефекты в трабекулярной части МЖП и очень редко в мембранозной части. Спонтанное закрытие дефектов происходит в первые 5 лет жизни ребенка в 90% всех случаев. В литературе описаны единичные случаи спонтанного закрытия дефекта у взрослого. Таким образом, врач, наблюдающий подростка или взрослого больного с дефектом межжелудочковой перегородки, имеет дело с практически стабильной площадью дефекта. При отсутствии существенных изменений площади дефекта решающая роль в прогнозе заболевания принадлежит легочному сосудистому сопротивлению, степень которого зависит от перегрузки объемом крови, возникающей при сбросе крови слева направо.
Симптомы и признаки дефекта межжелудочковой перегородки
- отношение легочного кровотока к общему кровотоку;
- среднее давление в легочной артерии;
- отношение легочного сосудистого сопротивления к общему сосудистому сопротивлению.
- группа 1 — дефект межжелудочковой перегородки с незначительным сбросом крови; отношение легочного кровотока к системному < 1,5, а среднее давление в легочной артерии 1,2, среднее давление в легочной артерии повышено (>20 мм рт.ст.); легочное сосудистое сопротивление еще значимо не выросло: отношение легочного сосудистого сопротивления к системному 1/3 общего сосудистого сопротивления, не останавливает прогрессирование легочной гипертензии.
- Турбулентное движение крови в дефекте МЖП способствует возникновению ИЭ. В связи с этим его профилактика обязательна для больных ДМЖП.
- Все больные с дефектом межжелудочковой перегородки имеют высокий риск внезапной смерти. В постоперационном периоде он достигает 2%. В связи с этим холтер-мониторирование обязательно как в до-, так и послеоперационном периоде. Вопрос о выборе и эффективности антиаритмических препаратов у больных с ДМЖП остается нерешенным.
- В связи с отсутствием исследования оценки эффективности медикаментозного лечения больных с дефектом межжелудочковой перегородки до операции, эту тактику необходимо вырабатывать совместно с хирургом. Можно предположить, что традиционные препараты для лечения ХСН эффективны и для лечения больных с ДМЖП.
- У больных с ДМЖП необходимо достижение целевого АД. Высокое АД приводит к росту сброса слева направо.
- Если у больного с ДМЖП появляется мерцательная аритмия, тактика лечения должна быть направлена на контроль частоты, а не ритма. Контроль состояния свертывающей системы крови у пациентов с дефектом межжелудочковой перегородки и мерцательной аритмией — важная составляющая лечения. MHO необходимо поддерживать на уровне 2-2,5.
- При присоединении ИБС следует обсуждать вопрос об одномоментном вмешательстве на коронарной артерии и коррекции дефекта МЖП.
- В послеоперационном периоде при отсутствии роста легочной гипертензии тактика ведения пациента направлена на предотвращение ремоделирования камер сердца, при росте легочной гипертензии — на ее коррекцию.
- Для проведения адекватной гемодинамической поддержки необходим инвазивный мониторинг (катетеризация артерии и легочной артерии). Потребность в инфузионной терапии или диуретиках определяет состояние ПЖ и давление заклинивания легочных капилляров (ДЗЛК). Сердечный выброс, среднее АД и сосудистое сопротивление определяют потребность в вазодилататорах.
- Если систолическое АД >110, с целью уменьшения сосудистого сопротивления и выраженности шунтирования назначают вазодилататоры, обычно начинают с натрия нитропруссида Нитраты расширяют вены, что приводит к усилению шунтирования, в связи с чем их назначения следует избегать. Вазодилататоры не назначают при нарушении функций почек.
- У пациентов с тяжелой гипотензией показано назначение препаратов с инотропными свойствами (вначале добутамина, но в зависимости от гемодинамического эффекта может потребоваться введение эпинефрина). Повышение АД уменьшает выраженность шунтирования.
- В большинстве случаев показана быстрая установка внутриаортапьного баллона для проведения баллонной контрпульсации.
- Как можно раньше следует связаться с хирургом с целью решения вопроса о хирургическом лечении. Операционная летальность продолжает оставаться высокой (20-70%), особенно на фоне интраоперационного шока, задненижнего ОИМ и инфаркта правого желудочка. Сейчас следуют рекомендациям о проведении сопряженного с высоким риском коронарного шунтирования и пластики или протезировании митрального клапана.
- При постепенной отмене лекарственной терапии и механических методов лечения с целью достижения некоторого заживления в области инфаркта проведение хирургического вмешательства может быть отсрочено на 2-4 нед.
- Идеально проведение катетеризации перед операцией с целью выявления сосуда, который будет подвергнут шунтированию.
- Закрытие дефекта перегородки с помощью катетера или напоминающего зонд устройства обеспечивает стабилизацию состояния пациента до тех пор, пока не станет возможным проведение окончательного лечения.
Прогноз при дефекте межжелудочковой перегородки
/ Клиническая эхокардиография. Шиллер Н. / Глава 05 левый желудочек
Фундаментальное исследование диастолического наполнения ЛЖ при различных заболеваниях миокарда методом допплер-эхокардиографии провели Appleton с соавторами в 1988 году [3]. У 70 пациентов с заболеваниями миокарда и 30 здоровых людей производилось допплеровское исследование трансмитрального кровотока одновременно с катетеризацией полостей сердца до и после рентгеноконтрастной вентрикулографии. Было обнаружено, что у большинства больных трансмитральный кровоток отличался от нормального. Авторы выделили два типа нарушенного трансмитрального кровотока: 1) характеризующийся преобладанием кровотока во время предсердной систолы, 2) «псевдонормальный», или «рестриктивный». Первый тип соответствует начальному нарушению диастолического наполнения ЛЖ. Этот тип нарушения трансмитрального кровотока характеризуется удлинением периода изоволюметрического расслабления ЛЖ, снижением скорости и объема раннего диастолического кровотока, увеличением кровотока во время предсердной систолы (рис. 5.5B). Другими словами, происходит перераспределение трансмитрального кровотока: большая часть крови поступает в ЛЖ во время систолы предсердия. Заметим, что хотя преобладание кровотока во время предсердной систолы и свидетельствует о нарушении податливости [compliance] ЛЖ, конечно-диастолическое давление в ЛЖ при этом остается на нормальном уровне.
При дальнейшем прогрессировании заболевания происходит «псевдонормализация» диастолического наполнения ЛЖ. Переход к «псевдонормальному» (или «рестриктивному») типу диастолического наполнения ЛЖ ассоциируется с повышением давления в левом предсердии: при этом возрастает градиент давления между левыми отделами сердца в начале диастолы. Это приводит к увеличению скорости кровенаполнения в раннюю фазу диастолы (рис. 5.5C). От нормального трансмитрального кровотока «рестриктивный» отличается укороченным временем изоволюметрического расслабления, быстрым падением скорости раннего диастолического наполнения, почти полным отсутствием кровотока во время предсердной систолы. Такой тип трансмитрального кровотока ассоциируется с высоким конечно-диастолическим давлением в ЛЖ [4].
Представление о диастолическом наполнении ЛЖ можно получить с помощью цветного допплеровского сканирования. Этот метод позволяет одновременно исследовать направление кровотока в ЛЖ, в левом предсердии и легочных венах. На рис. 17.2 представлен кровоток, который регистрируется у пациентов, имеющих нормальный или повышенный сердечный выброс. Красный цвет в легочных венах, левом предсердии и желудочке говорит о том, что кровоток в них одновременно происходит в одном направлении — в сторону верхушки ЛЖ. При низком сердечном выбросе диастолический кровоток в легочных венах, левом предсердии и желудочке выглядит иначе: он осуществляется как бы короткими толчками из одного отдела в другой.
Варианты диастолического наполнения ЛЖ не являются чем-то застывшим, свойственным данному больному или виду поражения миокарда. Диастолическое наполнение ЛЖ может изменяться по мере прогрессирования заболевания или под влиянием лечения.
Ишемическая болезнь сердца и связанная с ней патология левого желудочка
Локальную сократимость ЛЖ оценивают при двумерном эхокардиографическом исследовании, проводимом из различных позиций: чаще всего это парастернальные позиции длинной оси ЛЖ и короткой оси на уровне митрального клапана и апикальные позиции двух- и четырехкамерного сердца (рис. 4.2). Для визуализации задне-базальных отделов ЛЖ применяется также апикальная позиция четырехкамерного сердца с отклонением плоскости сканирования книзу (рис. 2.12). При оценке локальной сократимости ЛЖ необходимо визуализировать как можно лучше эндокард в исследуемой области. Для принятия решения о том, нарушена локальная сократимость ЛЖ или не нарушена, следует учитывать как движение миокарда исследуемой области, так и степень его утолщения. Кроме того, следует сравнивать локальную сократимость различных сегментов ЛЖ, исследовать эхо-структуру ткани миокарда в исследуемой области. Нельзя полагаться только на оценку движения миокарда: нарушения внутрижелудочковой проводимости, синдром предвозбуждения желудочков, электростимуляция правого желудочка сопровождаются асинхронным сокращением различных сегментов ЛЖ, поэтому эти состояния затрудняют оценку локальной сократимости ЛЖ. Затрудняет ее и парадоксальное движение межжелудочковой перегородки, наблюдаемое, например, при объемной перегрузке правого желудочка. Нарушения локальной сократимости ЛЖ описывают в следующих терминах: гипокинезия, акинезия, дискинезия. Гипокинезия означает снижение амплитуды движения и утолщения миокарда исследуемой области, акинезия — отсутствие движения и утолщения, дискинезия — движение исследуемого участка ЛЖ в направлении, противоположном нормальному. Термин «асинергия» означает неодновременное сокращение различных сегментов; асинергию ЛЖ нельзя отождествлять с нарушениями его локальной сократимости.
Для описания выявленных нарушений локальной сократимости ЛЖ и количественного их выражения прибегают к делению миокарда на сегментов. Американская кардиологическая ассоциация рекомендует деление миокарда ЛЖ на 16 сегментов (рис. 15.2). Чтобы рассчитать индекс нарушения локальной сократимости, сократимость каждого сегмента оценивают в баллах: нормальная сократимость — 1 балл, гипокинезия — 2, акинезии — 3, дискинезии — 4. Сегменты, недостаточно четко визуализированные, не учитывают. Сумму баллов затем делят на общее число исследованных сегментов.
Инфаркт миокарда и его осложнения
Инфаркт миокарда вызывает нарушения локальной сократимости ЛЖ разной степени выраженности: от гипокинезии отдельных сегментов до истинной аневризмы ЛЖ. Структура ткани в области с нарушенной сократимостью может указать на давность инфаркта. Нередко на границе с нормальными сегментами видна резкая демаркационная линия: ее появление объясняют локальным изменением формы ЛЖ в области с нарушенной сократимостью. Граница между акинетичным и нормальным миокардом иногда хорошо визуализируется. Наличие диастолической деформации ЛЖ с резко выраженной демаркационной линией свидетельствует об образовании аневризмы. На рис. 5.9, 5.10 представлены эхокардиографические проявления инфаркта миокарда передне-перегородочно-верхушечной локализации с образованием аневризмы ЛЖ; на рис. 5.11 — передне-перегородочный инфаркт миокарда, на рис. 5.12 — задний инфаркт миокарда.
Рисунок 5.9. Акинезия левого желудочка передне-перегородочно-верхушечной локализации. Сегменты левого желудочка с нарушенной сократимостью отмечены стрелками. LAX — позиция парастернальной длинной оси левого желудочка, SAX — позиция парастернальной короткой оси левого желудочка на уровне папиллярных мышц, 4-ch — апикальная позиция четырехкамерного сердца, 2-ch — апикальная позиция двухкамерного сердца, LV — левый желудочек, RV — правый желудочек, Ao — восходящий отдел аорты, LA — левое предсердие.
Рисунок 5.10. Аневризма левого желудочка перегородочно-верхушечной локализации (стрелки): апикальная позиция четырехкамерного сердца, диастола (А) и систола (В). Истончение миокарда и диастолическая деформация — признаки истинной аневризмы. LV — левый желудочек, RV — правый желудочек, LA — левое предсердие, RA — правое предсердие.
Рисунок 5.11. Дискинезия левого желудочка передне-перегородочной локализации: апикальная позиция четырехкамерного сердца, диастола (А) и систола (В). Сегменты левого желудочка с нарушенной сократимостью отмечены стрелками. LV — левый желудочек, RV — правый желудочек, LA — левое предсердие, RA — правое предсердие.
Рисунок 5.12. Аневризма левого желудочка задне-базальной локализации (стрелка): апикальная позиция двухкамерного сердца. Деформация левого желудочка и истончение миокарда в области аневризмы. LV — левый желудочек, LA — левое предсердие.
Эхокардиография может использоваться для диагностики и определения прогноза при остром инфаркте миокарда. Нормальная локальная сократимость ЛЖ у пациента с болями в грудной клетке помогает исключить острый инфаркт миокарда. Разработаны схемы количественной характеристики нарушений локальной сократимости ЛЖ. Показано, что индекс нарушения локальной сократимости ЛЖ при остром инфаркте служит независимым прогностическим признаком.
С помощью эхокардиографического исследования, проведенного непосредственно у постели больного, можно быстро распознать многие осложнения инфаркта миокарда. Об истинных аневризмах ЛЖ мы уже говорили. Псевдоаневризмы внешне похожи на истинные аневризмы, но причиной их появления служит разрыв миокарда. Аневризматический мешок псевдоаневризмы при внешнем разрыве состоит из перикарда и остатков разорвавшейся стенки. Только небольшие псевдоаневризмы совместимы с жизнью, поэтому у диагностированных с помощью эхокардиографии псевдоаневризм тонкий перешеек; это позволяет их отличить от истинных аневризм, у которых перешеек так же широк как и верхушка. Часто именно эхокардиография позволяет обнаружить псевдоаневризмы [22, 26]. Без хирургического лечения прогноз при псевдоаневризме ЛЖ крайне неблагоприятный.
Массивный разрыв стенки ЛЖ обычно не совместим с жизнью. При небольших разрывах стенки ЛЖ можно обнаружить эхо-негативное пространство между листками перикарда и признаки тампонады сердца. В подавляющем большинстве случаев появление жидкости в полости перикарда при инфаркте миокарда связано, к счастью, не с разрывом миокарда, а с эпистенокардитическим перикардитом или постинфарктным перикардитом (синдромом Дресслера).
Разрыв межжелудочковой перегородки приводит к сбросу крови слева направо на уровне желудочков (рис. 5.13), разрыв или дисфункция папиллярной мышцы приводят к появлению молотящей [flail] створки митрального клапана и тяжелой митральной недостаточности (рис. 5.14). У пациентов с молотящей створкой митрального клапана обнаруживается эксцентрическая струя регургитации, распространяющаяся циркулярно по периферии левого предсердия от пораженной створки [113]. При поражении передней створки митрального клапана струя направлена в сторону заднелатеральной стенки предсердия, при поражении задней створки — к межпредсердной перегородке (рис. 17.3).
Рисунок 5.13. Разрыв межжелудочковой перегородки (осложнение инфаркта миокарда задней локализации): интраоперационное чреспищеводное эхокардиографическое исследование. А — перед операцией, В — после операции ушивания дефекта межжелудочковой перегородки. Дефект межжелудочковой перегородки отмечен стрелкой. LV — левый желудочек, RV — правый желудочек, t — тромб, patch — заплата.
Рисунок 5.14. Молотящая задняя створка митрального клапана — результат дисфункции папиллярных мышц (осложнение инфаркта миокарда левого желудочка задней локализации). Задняя створка митрального клапана в систолу провисает в полость левого предсердия. Несмыкание створок митрального клапана приводит к тяжелой митральной недостаточности. При цветном допплеровском сканировании струи митральной регургитации выявляется, что она направлена в сторону межпредсердной перегородки и циркулярно распространяется по всему предсердию. LV — левый желудочек, RV — правый желудочек, LA — левое предсердие, Ao — восходящий отдел аорты.
При дефекте межжелудочковой перегородки контрастное исследование может выявить появление пузырьков воздуха в левых отделах сердца, с помощью допплеровского исследования можно рассчитать градиент давления между левым и правым желудочками, объем шунтируемой крови.
О тромбозе ЛЖ речь пойдет ниже, в разделе «Патологические образования в полости ЛЖ».
Существует три типа кардиомиопатий, каждый из которых имеет характерные эхокардиографические признаки: это дилатационная, гипертрофическая и рестриктивная кардиомиопатии.
Диагностировать дилатационную кардиомиопатию на ранних стадиях ее развития удается редко. Однако, тяжелые формы дилатационной кардиомиопатии имеют яркие эхокардиографические признаки. К этим признакам относятся: сферическая форма ЛЖ, дилатация ЛЖ при нормальной или уменьшенной толщиной его стенок, систолическое движение всех сегментов внутрь ЛЖ. Практически всегда увеличено левое предсердие, нередко расширены все камеры сердца. Увеличение правых отделов сердца может быть как вторичным (из-за легочной гипертензии), так и первичным (из-за вовлечения миокарда правого желудочка в патологический процесс). Объем ЛЖ часто превышает 250 мл, а левого предсердия — 125 мл. Фракция выброса нередко оказывается ниже 20%, но чаще всего она составляет от 20% до 30%. Сердечный выброс может быть нормальным или почти нормальным. Это обусловлено тем, что, во-первых, дилатационная кардиомиопатия часто сопровождается синусовой тахикардией, и во-вторых, большой конечно-диастолический объем может обеспечивать почти нормальный ударный объем, несмотря на низкую фракцию выброса. На рис. 5.15 представлены некоторые характерные признаки дилатационной кардиомиопатии.
Рисунок 5.15. Эхокардиографические находки при дилатационной кардиомиопатии. Парастернальная длинная ось левого желудочка (А), апикальная позиция четырехкамерного сердца (В), М-модальное исследование на уровне митрального клапана (С). Левый желудочек принимает сферическую форму. Мерой «сферичности» служит отношение размеров левого желудочка по длинной и короткой осям (В): при дилатационной кардиомиопатии это отношение приближается к единице. Расстояние от Е-пика движения передней створки митрального клапана до межжелудочковой перегородки в норме не превышает 5 мм, при дилатационной кардиомиопатии оно значительно больше. LV — левый желудочек, RV — правый желудочек, LA — левое предсердие, RA — правое предсердие, IVS — межжелудочковая перегородка.
Если кардиомиопатия диагностирована, нет необходимости в частом повторении эхокардиографического исследования, за исключением тех случаев, когда это делается для мониторинга давления в легочной артерии и параметров глобальной сократимости ЛЖ, его объемов и массы.
При допплеровском исследовании обнаруживается снижение скорости и ускорения кровотока в восходящем отделе аорты и уменьшение интеграла линейной скорости кровотока в выносящем тракте ЛЖ и легочной артерии.
Диагностировать дилатационную кардиомиопатию, особенно сопровождающуюся тяжелой сердечной недостаточностью, не составляет большого труда. Как ни парадоксально, эхокардиография предоставляет очень мало возможностей судить о генезе кардиомиопатии. В Лаборатории эхокардиографии UCSF предпринимались попытки выработать критерии дифференциальной диагностики ишемической и идиопатической дилатационной кардиомиопатии с использованием эхокардиографии и магнитно-резонансной томографии. С этой целью определяли толщину стенок, их структуру, локальную сократимость и форму ЛЖ. У пациентов с ишемической кардиомиопатией были более выражены нарушения локальной сократимости, неоднородность эхо-структуры, наличие сегментов с нормальной сократимостью, однако эти изменения были обнаружены и у значительного числа пациентов молодого возраста, не имеющих ангиографических признаков ишемической болезни сердца. Это позволяет утверждать, что эхокардиография не может быть надежным методом выявления причин дилатационной кардиомиопатии.
Все более широкое распространение сейчас получает еще один диагностический метод с применением эхокардиографии: эндокардиальная биопсия миокарда под эхокардиографическим контролем. С накоплением опыта эта изящная комбинация инвазивного метода с неинвазивным может стать стандартным методом диагностики кардиомиопатий.
В Южной Америке распространена болезнь Чагаса [Chagas]; эта болезнь сопровождается кардиомиопатией, которая может иметь сегментарный характер [1]. Причина болезни Чагаса — попадание в организм человека Trypanosoma cruzi (при укусе насекомыми-переносчиками) с массивной инвазией миокарда. Кардиомиопатия, развивающаяся при этой болезни, клинически сходна с другими далеко зашедшими поражениями миокарда. При эхокардиографии выявляется характерное сегментарное поражение миокарда, в типичном случае — аневризма верхушки ЛЖ при интактной межжелудочковой перегородке, чего почти никогда не бывает при ишемической болезни сердца. В редких случаях отмечаются аневризмы базальных отделов задней стенки ЛЖ.
Гипертрофическая кардиомиопатия — это увеличение толщины стенок ЛЖ и его массы неизвестной этиологии; иными словами — это гипертрофия ЛЖ в отсутствие аортального стеноза или артериальной гипертонии. Гипертрофия ЛЖ может быть симметричной или асимметрической. Обычно при асимметрической гипертрофической кардиомиопатии максимально гипертрофированы базальные отделы межжелудочковой перегородки. Причины неравномерного распределения гипертрофии неизвестны, как неизвестен и сам ее генез. Удивительно то, что, хотя гипертрофическая кардиомиопатия определенно является наследственным заболеванием, локализация гипертрофии ЛЖ у членов семьи может быть разной.
Эхокардиография — надежный метод диагностики гипертрофической кардиомиопатии. В клинике этого заболевания три ведущих синдрома определяют тяжесть поражения и прогноз: это обструкция выносящего тракта ЛЖ, диастолическая дисфункция ЛЖ и желудочковые нарушения сердечного ритма. Эхокардиография, в особенности допплеровское исследование, позволяет достоверно оценить выраженность первых двух синдромов.
Классическая эхокардиографическая картина при гипертрофической кардиомиопатии такова: максимальная гипертрофия в области базальных отделов межжелудочковой перегородки, разной степени выраженности вовлеченность в процесс остальных стенок ЛЖ; передне-систолическое движение створок митрального клапана, средне-систолическое прикрытие аортального клапана, динамический градиент давления в выносящем тракте ЛЖ, нарушение диастолического наполнения ЛЖ, митральная регургитация (рис. 5.16, 5.17, 5.18, 5.19, 5.21). Кальциноз митрального кольца наблюдается при гипертрофической кардиомиопатии более чем в половине случаев [28].
Рисунок 5.16. Гипертрофическая кардиомиопатия: асимметрическая гипертрофия левого желудочка, передне-систолическое движение митрального клапана. Парастернальная длинная ось левого желудочка. Локализация гипертрофии типична для гипертрофической кардиомиопатии: это — межжелудочковая перегородка, толщина которой в диастолу достигает 20 мм. В передне-систолическое движение вовлечена в основном задняя створка митрального клапана (пунктирная стрелка). LV — левый желудочек, RV — правый желудочек, LA — левое предсердие, Ao — восходящий отдел аорты.
Рисунки 5.17, 5.18. Гипертрофическая кардиомиопатия. Передне-систолическое движение митрального клапана, в котором участвуют обе створки клапана. Апикальная позиция четырехкамерного сердца. Рис. 5.17 — диастола, рис. 5.18 — систола. LV — левый желудочек, LA — левое предсердие, RV — правый желудочек, RA — правое предсердие.
Рисунок 5.19. Гипертрофическая кардиомиопатия: субкостальный доступ, длинная ось сердца, диастола. Толщина межжелудочковой перегородки достигает 35 мм в максимально гипертрофированном участке. LV — левый желудочек, RV — правый желудочек, LA — левое предсердие, RA — правое предсердие.
Передне-систолическое движение митрального клапана (рис. 5.17), в которое могут быть вовлечены одна или обе створки, не служит патогномоничным признаком гипертрофической кардиомиопатии (рис. 5.20). Передне-систолическое движение митрального клапана может быть связано с удлинением хорд, иногда оно наблюдается при пролапсе митрального клапана, бывает и у здоровых людей. Однако длительный систолический контакт митрального клапана с межжелудочковой перегородкой (более 1/3 систолы) всегда сопряжен с высокоскоростным кровотоком в выносящем тракте ЛЖ: при гипертрофической кардиомиопатии, гипертоническом сердце, иногда — при аортальном стенозе. При выраженном передне-систолическом движении митрального клапана нередко обнаруживается утолщение эндокарда межжелудочковой перегородки в месте контакта с ней митрального клапана.
Рисунок 5.20. Передне-систолическое движение митрального клапана у пациентки, перенесшей реконструктивную операцию на митральном клапане (по поводу разрыва хорд). Передне-систолическое движение митрального клапана появилось после операции и привело к динамической обструкции выносящего тракта левого желудочка. Апикальная позиция четырехкамерного сердца: слева — диастола, справа — систола. LV — левый желудочек, LA — левое предсердие.
Причинно-следственная связь передне-систолического движения митрального клапана и динамической обструкции ЛЖ до конца не ясна. Считается, что высокоскоростная струя крови в выносящем тракте ЛЖ притягивает створки митрального клапана (эффект Вентури). Передне-систолическое движение митрального клапана уменьшает просвет выносящего тракта ЛЖ и вызывает его динамическую обструкцию. Контакт митрального клапана с межжелудочковой перегородкой появляется в среднем на 30 мс раньше, чем максимальный внутрижелудочковый градиент давления.
Сложнее поставить правильный диагноз атипичной, апикальной гипертрофии ЛЖ, поскольку миокард верхушки ЛЖ наименее доступен для изучения. Затрудняет диагностику гипертрофической кардиомиопатии также отсутствие обструкции выносящего тракта ЛЖ; в этих случаях необходимы специальные пробы, провоцирующие ее появление; эти пробы помогают не только выявить обструкцию, но и определить ее тяжесть. К методам провоцирующим или усугубляющим обструкцию выносящего тракта ЛЖ относятся: проба Вальсальвы, ингаляция амилнитрита (рис. 5.21, пробы с физической нагрузкой. Их следует проводить одновременно с регистрацией кровотока в выносящем тракте ЛЖ в постоянно-волновом допплеровском режиме.
Рисунок 5.21. Гипертрофическая кардиомиопатия: исследование кровотока в выносящем тракте левого желудочка в постоянно-волновом допплеровском режиме у двух пациентов. А — обструкция выносящего тракта левого желудочка в покое: внутрижелудочковый градиент давления достигает 100 мм рт. ст. В — в покое обструкция отстутствует, после ингаляции амилнитрита внутрижелудочковый градиент давления — 36 мм рт. ст. Независимо от степени динамической обструкции форма допплеровского спектра потока имеет несимметричный характер, скорость кровотока достигает пика ближе к концу систолы. PG — градиент давления.