Проанализируйте распределение биогенных микроэлементов
5.5. Закономерности распределения биогенных элементов по 5-, р-, д-, Яблокам периодической системы элементов д. И. Менделеева
Основой для изучения свойств элементов и, в частности, их биологической роли является периодический закон Д. И. Менделеева. Физико-химические свойства, а следовательно, их физио-
логическая и патологическая роль, определяются положением . этих элементов в периодической системе Д. И. Менделеева.
Как правило, с увеличением заряда ядра атомов увеличивается токсичность элементов данной группы и уменьшается их содержание в организме. Уменьшение содержания, очевидно, связано с тем, что многие элементы длинных периодов из-за больших атомных и ионных радиусов, высокого заряда ядра, сложности электронных конфигураций, малой растворимости соединений плохо усваиваются живыми организмами. В организме в значительных количествах содержатся легкие элементы 5- и р-блоков.
К макроэлементам относятся 5-элементы первого (водород), третьего (натрий, магний) и четвертого (калий, кальций) периодов, а также р-элементы второго (углерод, азот, кислород) и третьего (фосфор, сера, хлор) периодов. Все они жизненно необходимы. Большинство остальных 5- и р-элементов первых трех периодов (1л, В, А1, Р) физиологически активны. 5- и р-Элемен-ты больших периодов (п^4) редко выступают в качестве незаменимых. Исключение составляют 5-элементы — калий, кальций, р-элемент — иод. К физиологически активным относят некоторые 5- и р-элементы четвертого и пятого периодов — стронций, мышьяк, селен, бром.
Среди ^-элементов жизненно необходимы в основном элементы четвертого периода: марганец, железо, цинк, медь, кобальт. В последнее время установлено, что несомненна физиологическая роль и некоторых других ^-элементов этого периода: титана, хрома, ванадия.
^-Элементы пятого и шестого периодов, за исключением молибдена, не проявляют выраженной положительной физиологической активности. Молибден же входит в состав ряда окислительно-восстановительных ферментов (например, ксантиноксидЗ-зы, альдегидоксидазы) и играет большую роль в протекании биохимических процессов.
Некоторые /-элементы (лантаноиды и актиноиды) в ничтожных количествах содержатся в организме человека, наличие многих из них пока не установлено. Как правило, они высокотоксичны, образуют устойчивые соединения с комплексонами, полифосфатами, р-дикетонами, полифенолами, оксикислотами и другими полидентатными лигандами. Поэтому попадание их в организм может изменить течение многих биохимических реакций
Сходство и различие биологического действия связано с электронным строением атомов и ионов. Близкие значения атомных и ионных радиусов, энергии ионизации, координационных чисел, склонность к образованию связей с одними и теми же элементами в молекулах биолигандов обусловливает эффекты замещения элементов в биологических системах. Такое замещение ионов может происходить как с усилением (синергизм), так и с угнетением активности (антагонизм) замещаемого элемента.
Например, 5-элементы 1А-группы склонны образовывать связи
с атомом кислорода, все они находятся в растворе в виде гид-ратированного иона Э+(Н2О)*. Сходство лития с натрием обусловливает их взаимозамещаемость, причем, как правило, они являются синергистами. Рубидий и цезий по физико-химическим характеристикам сходны с калием, поэтому в организме они могут замещать друг друга.
5-Элементы ПА-группы входят в состав биомолекул, связываясь через атом кислорода с анионами А полифосфатов, фос-
-А
фатов, карбонатов, карбоновых кислот: М
Упражнение 1. Проанализируйте распределение биогенных макроэлементов по периодам и группам Периодической системы Д. И. Менделеева. Напомним, что к ним относят С, Н, О, N, Са, S, Р, К, Mg, Fe. из ГДЗ по химии за 11 класс Габриелян.
- 6. Определите валентность и степень окисления атомов в веществах с формулами N2, NF3, Nh4, Н2O2, OF2, O2F2.6. Определите валентность и степень окисления атомов в вещества...
- 7. Определите валентные возможности атомов серы и хлора в основном и возбужденном состояниях....
- 1. Проанализируйте распределение биогенных макроэлементов по периодам и группам Периодической системы Д. И. Менделеева. Напомним, что к ним относят С, Н, О, N, Са, S, Р, ...
- 2. Почему элементы главных подгрупп второго и третьего периода называют химическими аналогами? В чем проявляется эта аналогия?Элементы главных подгрупп второго и третьего...
- 3. Почему водород, в отличие от всех других элементов, записывают в Периодической таблице Д.И. Менделеева дважды? Докажите правомочность двойственного положения водорода ...
- 4. Почему так похожи свойства лантана и лантоноидов, актиния и актиноидов?Свойства лантана и лантаноидов, актиния и актиноидов схожи, т.к. свойства элементов в основном о...
- 5. Какие формы соединений будут одинаковыми у элементов главных и побочных подгрупп?У элементов главных и побочных подгрупп одинаковые формы соединений будут иметь высшие...
- 6. Почему общие формулы летучих водородных соединений в Периодической системе пишут только под элементами главных подгрупп, а формулы высших оксидов — под элементами обеи...
- 7. Какова общая формула высшего гидроксида, соответствующего элементам VII группы? Каков его характер?HXO4 — общая формула высшего гидроксида для элементов VII группы, гд...
- 1. Часто встречается выражение: «Молекулы благородных газов одноатомны». Насколько оно соответствует истине?Приведенное выражение соответствует истине, т.к. при нормальны...
Биогенные элементы, микроэлементы и растворенные газы
Один интересный способ представить четыре группы ионов — это «наложить» их на периодическую таблицу (рисунок 7.2). При этом некоторые элементы попадут в несколько групп. Можно видеть также, какие элементы жизненно важны для роста растений, а какие обладают сходным с ними распределением, но таковыми не считаются. Наиболее интересен углерод: это макроэлемент, встречающийся главным образом в виде бикарбонат-ионов (CO32-, HCO3-), он входит в состав растворенного газа (в виде С02), он же принимает участие в образовании органических молекул, а потому его можно отнести к биогенным элементам.
Биогенные элементы
К основным биогенным элементам относится азот (в виде нитрат-иона NO3-, фосфор (в виде фосфат-иона РО34-) и кремний (в виде кремнекислоты Si(OH)4). Они играют важную роль в жизни растений, и поэтому их распределение существенно отличается от распределений основных компонентов (макроэлементов). Концентрации биогенных элементов почти всегда малы в поверхностном слое, где они потребляются растениями, и возрастают с глубиной, так как в глубоких слоях происходит разложение органического материала. В главе Два океанологических рейса мы проанализируем вертикальные профили питательных, или биогенных, веществ, полученные по данным гидрологической станции в северо-восточной части Тихого океана.
Микроэлементы
На рисунке 7.2 представлены элементы, содержание которых в морской воде незначительно: измеренные концентрации их не превышают 1 млн-1. Вертикальное распределение некоторых из этих элементов сходно с вертикальным распределением биогенных элементов. Значение их двояко.
1. Биологи обнаружили, что многие морские организмы усваивают ионы некоторых микроэлементов, изменяя их концентрации. Например, отношение концентраций железа и калия в клетке растения гораздо больше, чем в окружающей его морской воде. Так же ведет себя большинство переходных элементов, таких как железо, магний, цинк, медь и кобальт (рисунок 7.2). Эти металлы играют важную роль в формировании активных центров в молекулах ферментов, обеспечивая их специфические функции; атомы таких металлов обычно находят вблизи тех участков молекулы фермента, где происходит химическое взаимодействие между ферментом и субстратом.
Мы могли бы классифицировать эти микроэлементы и как биогенные элементы. Первые эксперименты по производству морской воды для аквариумов, при которых в чистую воду добавляли в нужных концентрациях основные соли, окончились неудачей. Собственно это и послужило толчком к поискам в морской воде ингредиентов, не учтенных в первоначальных опытах.
2. Из микроэлементов могут состоять частицы, находящиеся в воде во взвешенном состоянии. Так, во всех океанах в очень малых количествах присутствуют мельчайшие частички терригенной пыли, которая поставляется промышленными выбросами, а также такими природными явлениями, как извержения вулканов.
Растворенные газы
Газы, растворенные в морской воде, — это инертные газы (рисунок 7.2), а также основные составляющие атмосферного воздуха — азот и кислород. Углерод, как и в атмосфере, присутствует в виде углекислого газа. Элементарный азот, в общем, не относят к биогенным элементам, поскольку фитопланктон открытого океана обычно потребляет азот в форме иона NO3-. Важным исключением из этого правила служат сообщества кораллов, где основную растительную продукцию дают сине-зелёные водоросли, потребляющие азот в виде растворенного газа N2. Изотоп радона 222Rn иногда используют в качестве трассера при изучении движения жидкости вблизи морского дна; этот газ входит в состав выделений из мантии в областях спрединга океанического дна.
Классификация биогенных элементов по их содержанию в организме (макро-, олиго-, микробиогенные элементы) и по функциональной роли (органогены, элементы электролитного фона, микроэлементы).
⇐ ПредыдущаяСтр 5 из 9Следующая ⇒I Классификация БЭ по содержанию:
1)Макробиогенные элементы (>1%)
к ним относятся O(62,4%), C(21%), H( 9,7%), N(3,1%), P(0,95%), Ca(1,5%)
Первые пять элементов- неметаллы, находятся в I-III периодах.
2)Олигобиогенные элементы(10-2%-1%)
Na, K, Mg, Fe, S, Cl- располагаются в III-IV периодах.
Содержание этих элементов составляет: 0,08; 0,23; 0,027; 0,01; 0,16; 0,08
3)Микробиогенные(10-2%)
находятся в IV-V периодах (16 из 21)
Выводы: -процентное содержание хим.элементов обратно пропорционально их порядковым номерам;
-основу организма составляют элементы первых трех периодов.
II Классификация БЭ по функциональной роли:
1)Органогены
С, Н, О, N, P, S составляют основу живых систем (Б,Ж,У,НК)
Суммарное содержание- 97,4%
Все ,кроме S, принадлежат к макробиогенным эл-там.
2)Элементы электролитного фона
Na+, K+, Mg+, Ca+, Cl- являются основными катионами физ.жидкостей.
Na,K,Mg,Cl относятся к олигоэлементам.
3)Микроэлементы в их число входят остальные БЭ (22), к ним относится 21 микроэлемент (по содержанию) +Fe. Функция- активаторов и катализаторов.
Биологические ф-ции связаны с процессами комплексообразования. Входя в состав ферментов, гормонов, витаминов, МЭ участвуют в процессах роста и размножения, обмене в-в, в тканевом дыхании, обезвреживании токсических в-в. МЭ способствуют поддержанию кислотно-основного, окислительно-восстановительного, метало-лигандного равновесия.
МЭ неравномерно распределены между тканями и органами, большая часть содержится в печени (депо для МЭ)
Примеры повышенного содержания МЭ в организме:
I- в щитовидной железе,
F- в эмали зубов,
Zn-в поджелудочной железе,
Mo-в почках,
Ba-в сетчатке.
44. Эссенциальные микроэлементы (Fe, Co, Cr, Mn, Zn, Cu, Mo): содержание в организме, биологическая роль.
Железо (Fe)
В организме содержится 5-5,5 г, большая его часть 70-80% находится в гемоглобине.
Ежедневная доза- 1,2 мг. Ежедневное потребление 10-20 (5-10) мг
Из пищи поступает в организм только 10-20% железа.
Недостаток Fe вызывает железодефицитную анемию. Соединения железа выполняют каталитическую, транспортную, буферную функцию.
Цинк (Zn)
В организме содержится 2,3 г.
Суточная потребность 13 мг.
Биологическая роль Zn обусловлена постоянным зарядом его иона. Известно более 40 металлоферментов , активирующих гидролиз белка, пептидов. Zn влияет на основные процессы кроветворения, размножения, роста и развития организма.
Медь (Cu)
В организме содержится 100 мг.
Суточная норма- 2-3 мг
Главная функция- ферментативная. Известно около 25 медьсодержащих ферментов. Участие меди в ОВР основано на легкости превращения: Cu2+ +e=Cu+ Cu участвует в кроветворении
Марганец (Mn)
В организме содержится 12 мг.
Суточная потребность 5-7 мг.
Присутствует в виде ионов M2+ или в комплексе с белками, амк.
Функция- регуляция активности различных ферментов. Активируя АТФ, марганец участвует в процессах аккумуляции и переноса энергии. Мn стабилизирует структуру нуклеиновых кислот.
Молибден (Мо)
В организме содержится 9 мг.
С пищей потреб. 0,2-0,3 мг/сут.
Входит в состав ферментов, которые катализируют окислительно- восстановительные процессы. Входе этих реакций, его степень окисления с +6 уменьшается до +5,+4, происходит восстановление. При избыточном поступлении молибдена происходит активация синтеза ксантиноксидазы.
Хром (Cr)
Содержание в организме 6-6,6 мг
Суточная потребность- 0,15мг.
Преимущественно концентрируется в костях, содержится в эритроцитах.
Cr участвует в обмене НК, входит в состав ферментных систем. Иона Cr3+ участвуют в стабилизации НК.
Кобальт (Со)
В организме содержится 1,2 мг.
Ежедневное потребление- 0,3 мг.
5-10% входит в состав витамина В12, Со единственный из металлов, входящий в структуру витамина. Участвует в ОВР организма, поскольку возможен процесс: Со3+ +е= Со2+
Со влияет на минеральный, липидный обмен, участвует в кроветворении. Недостаток Со вызывает злокачественную анемию.
Часть II. Теория. Биоорганическая химия
Номенклатура органиеских соединений.Понятие о структурной изомерии органических соединений . Строение атома углерода , типы гибридизации и виды ковалентной связи в орг соединениях. Связь пространственного строения орг. соединений с их биолог активностью
Названия углеводородов и алкильных групп:
| Метан | СН4 | Метил | СН3- |
| Этан | С2Н6 | Этил | С2Н5- |
| Пропан | СН3СН2СН3 | Пропил Изопропил | СН3СН2СН2- СН3СНСН3 |
| Бутан | СН3СН2СН2СН3 | Бутил Изобутил Втор. бутил Трет. бутил | 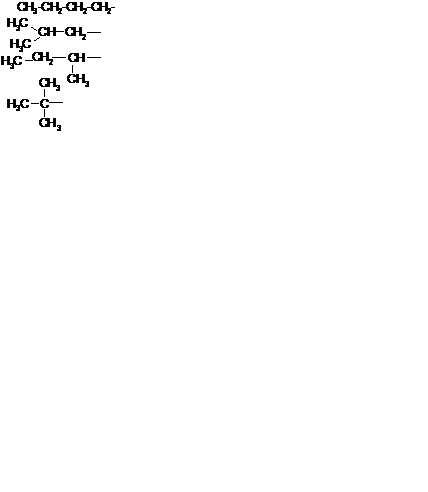 |
по номенклатуреIUPAC
( заместительная номенклатура)
Для составления названия органического соединения по номенклатуре IUPAC необходимо выполнить следующие операции:
1. Определите функциональную (характеристическую) группу, если она имеется, суффикс которой используют при составлении названия. При составлении названия используется суффикс только одной функциональной группы, называемой главной ( исключение: суффиксы двойной или тройной связи). Все заместители, в том числе и другие младшие функциональные группы, указываются префиксами.
Некоторые характеристические группы, расположенные
в порядке уменьшения старшинства
| КЛАСС | Формула | ПРЕФИКСЫ | СУФФИКСЫ |
| Карб.к-ты Альдегиды Кетоны Спирты Фенолы Амины | -СООН -(С)ООН -СНО -(С)НО -(С)=О -ОН -ОН -Nh3 | -карбокси - -формил -оксо -оксо -гидрокси -гидрокси -амино | -карб. кислота -овая кислота -карбальдегид -аль -он -ол -ол -амин |
2. Определите родовой гидрид:
а) для ациклических соединений родовым гидридом является самая длинная неразветвленная цепь, включающую главную функциональную группу а также двойные и (или) тройные связи. Родовой гидрид образуется прибавлением атомов водорода вместо заместителей или гетероатомов, присоединеннных к длинной цепи, чтобы получился насыщенный углеводород.
б) для циклических соединений родовым гидридом является насыщенный циклоалкан, например циклогексан или полностью ненасыщенный углеводород ( гетероциклическое соединение), например бензол, пиридин и т.д.
3. Назовите родовой гидрид вместе с суффиксом главной группы.
4. Пронумеруйте самую длинную цепь таким образом, чтобы атом углерода главной функциональной группы получил наименьший номер.
5. Назовите заместители вместе с цифрами(локантами), указывающими атомы углерода, при которых заместители находятся и присоедините их к названию родового гидрида. Локанты двойной и (или) тройной связи и локант главной функциональной группы расположите перед соответствующими суффиксами.
1-ый пример
Н3С - СН2 - ОН НО - СН2 - СН2 - ОН
Главная группа: -ОН -ол
Родовой гидрид: Н3С - СН3 этан
Название: этанолэтандиол-1,2
2-ой пример:

3-ий пример:


Пространственные изомеры: Энантиомеры

Строение атома углерода
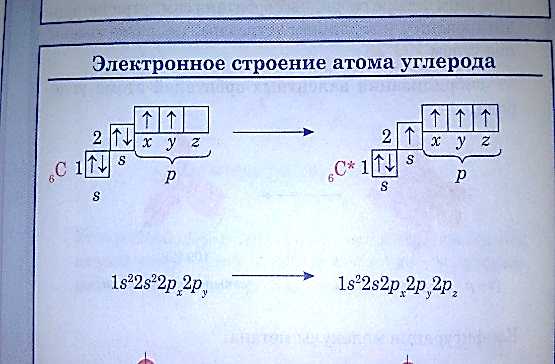
Типы гибридизации
В зависимости от числа вступивших в гибридизациб орбиталей том углерода может находиться в 3 видах гибрид-ии
1.первое валентное состояние sp3 гибр- при комбинации 1 s и 3 p орбиталей,
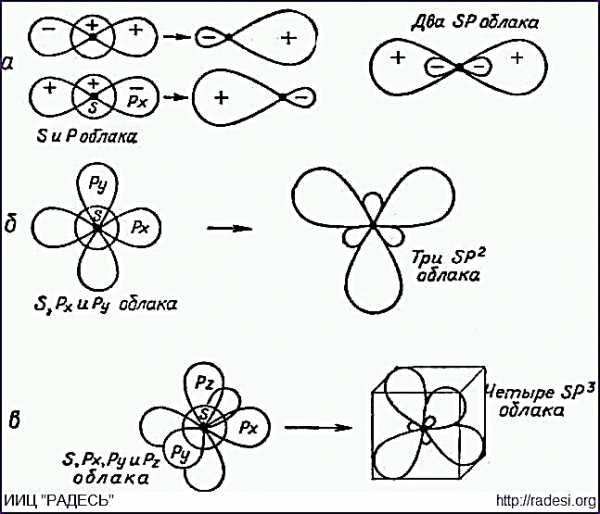
2. Sp2- 1s и 2p
3. Sp -1s и 1p
Ковалентная связь-хим связь, образованная за счете обобщения электронов связываемых атомов-осн тип связи в орг в-вах
Неполярная КС-связь, образованная между атомами с одинаковой электроотрицательностью, при которой связующее электронное облако равномерно распределено в обасти пространства между ядрами данных атомов
Полярная КС- связь, образованная между атомами с разной электроотрицательностью, при которой связующее электронное облако смещено в сторону более электроотрицательного атома
КС бывают 2х типов: сигма и пи связи
Сигма связь-связь,образованная при осевом перекрывании атомной орбиталей с расположением максимума перекрывания на прямой ,соединяющей ядра связываемых атомов
Пи связь-образована при бороков перекрывании p-АО
46-Реакция электрофильного присоединения: гетеролитическая реакция с участием π-связи между sp2-гибридизованными атомами углерода (галогенирование, гидрогалогенирование, гидратация).
АЕ- реакция электрофильного присоединения.
Ненасыщенные углеводороды – алкены, циклоалкены, алкадиены и алкины проявляют способность к реакциям присоединения, так как содержат двойные или тройные связи. За счёт π-электронов в молекулах таких соединений имеется довольно обширная область отрицательного заряда. Поэтому они представляют собой нуклеофилы и, следовательно, склонны подвергаться атаке электрофильной частицей (электрофильмым реагентом).
⇐ Предыдущая123456789Следующая ⇒Рекомендуемые страницы:
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе