Общая бактериальная масса норма у мужчин
61-93-230. Андрофлор (соскоб из уретры)
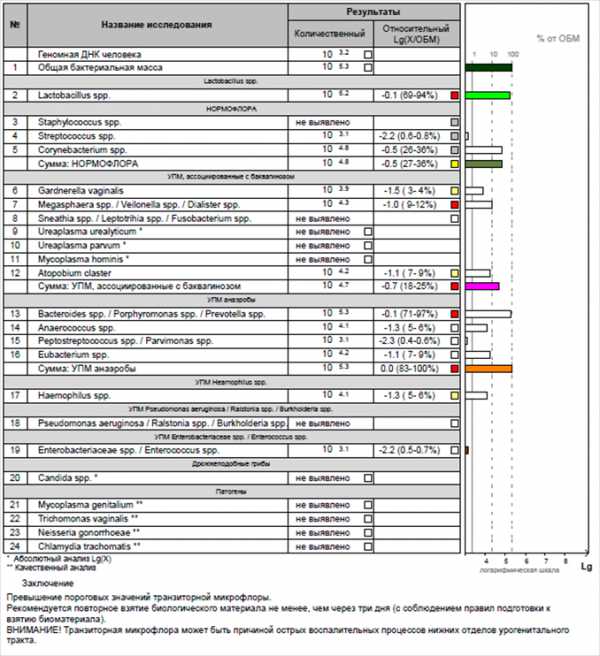
За интерпретацией результатов исследования необходимо обратиться к врачу. Индивидуальный бланк ответа и первичная трактовка результата проводится в лаборатории автоматически. Результаты исследований выдаются в табличной форме и в виде гистограммы.
Геномная ДНК человека (ГДЧ) оценивается в абсолютных значениях, служит для подтверждения наличия в пробирке человеческого биоматериала. Минимальное пороговое значение 10/3.
Общая бактериальная масса (ОБМ) – бактериальная обсемененность биотопа – абсолютный показатель количества бактерий, с которым сравнивают все определяемые бактерий/группы бактерий, минимальное пороговое значение – 10/4.
В случае, если в образце биоматериала одновременно ОБМ и ГДЧ ниже пороговых значений, анализ микрофлоры не проводится. В этом случае рекомендуется повторить взятие биоматериала.
Транзиторная микрофлора: Lactobacillus spp. Относительный показатель, служит маркером наличия в половых путях транзиторной микрофлоры, попадающей в половые пути от половой партнерши. При диагностике острых заболеваний нижних отделов МПС может служить косвенным маркером того, что причиной заболевания является транзиторная микрофлора. Пороговое значение – 10% от ОБМ. При повышении порогового значения Lactobacillus spp. Количественно-качественная оценка микрофлоры не проводится и заключение не выдается. В этом случае требуется повторное взятие биоматериала при условии отсутствия незащищенных половых контактов в течение трех дней.
Нормофлора: Staphylococcus spp., Streptococcus spp., Corynebacterium spp. Сумма количества микроорганизмов нормофлоры – относительный показатель, снижение которого трактуется как дисбиоз. Низкая общая бактериальная масса (ОБМ 10/3) трактуется\ как НОРМОЦЕНОЗ. Если нормофлора составляет большую часть ОБМ, а относительное количество УПМ ниже пороговых значений, структура микробиома оценивается как НОРМОЦЕНОЗ.
Условно-патогенные микроорганизмы (УМП). Показатель оценивается в относительных значениях. Относительное количество УМП и/или группы УМП выше пороговых значений свидетельствует об их участии в развитии дисбиоза.
Дрожжеподобные грибы: Candida spp. Показатель оценивается в абсолютных значениях, клинически значимое пороговое значение – 10/4.
Патогены: Mycoplasma genitalium, Trichomonas vaginalis, Neisseria gonorrhoeae, Chlamydia trachomatis. Качественный показатель, оценивается наличие или отсутствие микроорганизма.
Образец бланка с результатами:
Правила взятия:
Для исключения ложноотрицательных результатов исследования предусмотрен контроль взятия материала (количество эпителиальных клеток), так как количественный результат микрофлоры рассчитывается на содержание клеток эпителия пациента в образце). Поэтому результат лабораторного исследования полностью зависит от врача уролога, проводящего забор материала. Интерпретации подлежат только результаты со значением контроля взятия материала (КВМ) более 10^4. При КВМ менее 10^4 необходимо повторное взятие материала врачом-клиницистом.
1. Непосредственно перед взятием материала наружное отверстие уретры обработать тампоном, смоченным стерильным физиологическим раствором.
2. При наличии гнойных выделений соскоб рекомендуется брать через 15-20 мин после мочеиспускания.
3. При отсутствии выделений необходимо провести массаж уретры с помощью зонда для взятия материала. Ввести зонд на глубину 3-4 см, собрать материал осторожными вращательными движениями.
4. Погрузить зонд в пробирку с 0,5-1,0 мл физиологического раствора, несколько раз вращать и, отжав остатки раствора о стенки, удалить из пробирки. Пробирку плотно закрыть и промаркировать. Оставлять наконечник зонда в пробирке не рекомендуется!
Фемофлор
Дисбаланс микробиоты урогенитального тракта женщин, обусловленный условно- патогенными микроорганизмами представляет собой симптомокомплекс, характеризующийся изменением качественного и/или количественного состава нормобиоты, метаболическими и иммунными нарушениями, в ряде случаев клиническими проявлениями.
Соответственно, частным проявлением выраженного дисбаланса биоты является бактериальный вагиноз.
Этиологическая структура урогенитальных инфекций, обусловленных условно-патогенной биотой, представлена ассоциацией нескольких микроорганизмов.
В свою очередь, стертая, малосимптомная субъективная и/или объективная клиническая симптоматика, отсутствие специфических патогномоничных симптомов практически в большинстве случаев приводит к поздней обращаемости женщин в лечебные учреждения, уже на стадии развития осложнений и нарушения репродуктивной функции.
Поздняя обращаемость, на стадии развития осложнений со стороны репродуктивной функции позволяет рассматривать данную проблему как актуальную, имеющую медико-социальное значение.
Квалифицированное комплексное лабораторное обследование, полное выявление этиологической структуры заболевания позволяет своевременно устанавливать топический клинический диагноз, выявлять осложненные формы течения заболевания, и, соответственно, проводить направленную адекватную этиотропную терапию, в соответствие с принципом «необходимости и достаточности».
В настоящее время для оценки состояния микробиоты используют традиционные методы клинической и лабораторной диагностики:
- Данные клинического осмотра (жалобы, результаты клинического субъективного и объективного осмотра);
- Результаты бимануального исследования;
- Лабораторная диагностика:
а) микроскопическое исследование: -исследование нативного препарата в темном поле; -микроскопия препаратов, окрашенных по Граму:
б) культуральное исследование:
- посевы на среду Эндо, кровяной агар для идентификации аэробных микроорганизмов;
- посевы на селективные питательные среды для выращивания анаэробных микроорганизмов;
в) полимеразная цепная реакция (ПЦР).
- Полимеразная цепная реакция (качественная) - не позволяет определить этиологическое значение тех или иных условно-патогенных микроорганизмов без определения их количественной характеристики;
- Полимеразная цепная реакция в реальном времени с количественной характеристикой тех или иных условно-патогенных микроорганизмов. Однако предлагаемые в настоящее время тест-системы позволяют идентифицировать и оценивать количественную характеристику микроорганизмов, без учета биоты изучаемого эпитопа в целом.
Некорректно поставленный топический и/или этиологический диагноз неизбежно приводит к полипрагмазии или к неадекватной терапии (недостаточные суточные и/или курсовые дозы лекарственных препаратов), в результате чего увеличивается риск рецидивов, приводящих к хронизации инфекционно-воспалительного процесса.
В этой связи, в качестве скринингового метода диагностики состава биоты урогенитального тракта женщин сотрудниками курса «Лабораторной диагностики и лабораторной микологии» при кафедре дерматовенерологии и клинической микологии ГОУ ДПО РМАПО и коллегами НПФ «ДНК-Технология» (Москва) сделана попытка создания эффективного способа клинко - лабораторной диагностики дисбаланса биоты, позволяющего расширить диагностические возможности выявлениядисбиотических нарушений на ранней стадии, до развития осложнений. В основу способа положена впервые предлагаемая авторами комплексная количественная оценка биоты методом ПЦР в реальном времени (РВ) с проведением сравнительного анализа конкретных представителей нормо - и условно-патогенной биоты с общим количеством микроорганизмов с целью выявления дисбаланса биоты, степени его выраженности и определения этиологической роли конкретных микроорганизмов в его развитии при условии контроля качества получения клинического образца для исследования.Способ позволяет в короткие сроки объективно:
- Оценить качественный и количественный состав биоты;
- Дифференцировать состояния физиологического равновесия и дисбаланса;
- Оптимизировать и индивидуализировать лекарственную терапию;
- Проводить мониторинг эффективности терапии;
- Определять критерии излеченности и прогноз заболевания;
- Осуществлять контроль качества получения биопробы.
С помощью данного метода определяются следующие показатели:
- контроль взятия материала;
- общая бактериальная масса;
- количество нормобиоты (Lactobacterium spp,);
- количество условно-патогенной биоты - факультативные аэробы (Enterobacteraceae, Streptococcus spp и Staphylococcus spp), анаэробы (Qardnerella vaginalis /Prevotella bivia/ Porphyromonas spp; Atopobium vaginae; Eubacterium spp; Sneathia spp/Leptotrihia spp/Fusobacterium spp; Megasphera spp/Veilonella spp/Dialister spp; Lachnobacterium spp/Clostridium spp; Mobiluncus spp/Corynebacterium spp; Peptostreptococcus spp); Mycoplasma hominis, Ureaplasma urealiticum; Candida albicans.
Показания и противопоказания к применению метода Показания:
- Наличие инфекционно-воспалительного процесса урогенитального тракта у женщин репродуктивного возраста вне беременности, вызванного изменением количественного и качественного состава условно-патогенной биоты;
- Профилактическое обследование женщин на урогенитальные инфекции, ассоциированные с условно-патогенной биотой.
Этиологическая диагностика осуществляется с помощью лабораторных методов исследования. Этиологический диагноз устанавливается на основании результатов лабораторных исследований и определяет направленный выбор лекарственных препаратов с учетом выявленных этиологически значимых микроорганизмов.
Как известно, эффективность лабораторного исследования определяется качеством получения взятия клинического образца. С целью выявления различных микроорганизмов, используют различные лабораторные методологии, для каждой из которых определены требования к подготовке пациента к исследованию, лабораторный инструментарий и техника получения биоматериала.
При отсутствии выраженных симптомов воспаления обследование женщин целесообразно проводить в период овуляции, при условии отсутствия приема антибактериальных препаратов per os в течение двух месяцев, предшествующего исследованию и per vaginae в течение трех недель, а также незащищенных половых контактов в течение предшествующих пяти дней. Накануне и в день обследования пациентке не рекомендуется выполнять спринцевание влагалища.
Материалом для лабораторных исследований (микроскопия, бакпосев) должно служить отделяемое четырех локализаций - уретры, влагалища, цервикального канала шейки матки, ампулы прямой кишки. Свободно стекающее отделяемое удаляется сухим ватным тампоном. Биоматериал из уретры получают на полном мочевом пузыре после массажа уретры через переднюю стенку поступательными движениями от лона к себе с помощью стерильной ложки Фолькмана, введенной на глубину 1,5-2 см от наружного отверстия по передней стенке уретры. Материалом для лабораторного исследования из влагалища (микроскопия, бакпосев) служит отделяемое заднебоковых сводов влагалища. Взятие материала осуществляется ложкой Фолькмана или желобоватым зондом.
Из канала шейки матки с помощью стерильного акушерского или гинекологического пинцета, введенного в эндоцервикальный канал на глубину 1,5 см, берется отделяемое крипт цервикального канала.
Из ампулы прямой кишки материал получают ложкой Фолькмана, вводя ее на глубину 3-4 см и производя циркулярный соскоб слизистой оболочки и ее складок.
Возможности светооптической микроскопии позволяют идентифицировать «морфотипы» следующих микроорганизмов: Lactobacillus spp., Gardnerella vaginalis, Bacteroides spp., Mobiluncus spp., Fusobacterium spp., Leptotrihia spp., Veillonella spp., Candida spp., грамположительные кокки, колиформные палочки.
Некоторые виды этиологически значимых возбудителей невозможно выявить при световой микроскопии, например, такие как Atopobium vaginae. Mycoplasma hominis, Chlamydia trachomatis и т.д. Существенными недостатками данного метода являются также субъективизм и зависимость результата исследования от профессиональной квалификации врача клинической лабораторной диагностики.
Культуральная диагностика до настоящего времени является «золотым стандартом» лабораторной диагностики любого патологического процесса поскольку позволяет выполнить количественную характеристику, идентифицировать микроорганизм до вида и определить чувствительность выделенного штамма к лекарственным препаратам.
Однако и этот метод не лишен ряда недостатков. Условно-патогенная биота, являющаяся причиной ряда патологических процессов в организме, главным образом, состоит из анаэробных микроорганизмов, для культивирования которых требуются высококачественные селективные питательные среды и создание анаэробных условий. В связи с этим результат лабораторного исследования в значительной степени зависит от оснащенности бактериологической лаборатории необходимым лабораторным оборудованием и реагентами, а также от профессиональной квалификации исследователя. Недостатком метода являются также длительные сроки культивирования (в среднем 7 дней) и необходимость сохранения жизнеспособности микроорганизмов до момента поступления биоматериала в лабораторию. Кроме того, ряд этиологически значимых микроорганизмов относятся ктруднокультивируемым, что не позволяет основывать верификацию диагноза на результатах культурального исследования и свидетельствует о необходимости разработки и внедрения в практическое здравоохранение новых скриннинговых диагностических подходов для их своевременного выявления.
В то же время, стертая, малосимптомная субъективная и/или объективная клиническая симптоматика заболеваний, вызванных условно-патогенной биотой, отсутствие патогномоничных специфических симптомов в большинстве случаев приводящая к поздней обращаемости женщин в лечебные учреждения, уже на стадии развития осложнений, поставило задачу разработки количественного, культивационно-независимого метода оценки условно-патогенной биоты.
Таким методом, получившим в последние годы широкое распространение, является метод ПЦР в режиме «реального времени» (РВ), который позволяет не только идентифицировать микроорганизмы до вида, в том числе и трудно культивируемые, но и определить их количественное содержание.
Материалом для исследования методом ПЦР в режиме РВ служит соскоб эпителиальных клеток (уретра, заднебоковой свод влагалища, цервикальный канал шейки матки). Для получения объективного результата необходимо, чтобы исследуемый материал содержал возможно большее количество эпителиальных клеток и минимальное количество слизи и примеси крови. Нарушение техники взятия биоматериала приводит к недостоверному результату и необходимости повторного взятия соскоба.
Клинический материал берут одноразовыми стерильными инструментами типа «Cytobrush». Полученный клинический образец помещают в пробирку типа «Эппендорф», содержащую транспортную среду.
При необходимости исследования материала из нескольких биотопов, процедуру повторяют, каждый раз забирая материал новым зондом в новую пробирку.
Условия хранения и доставки материала для ПЦР исследования
Полученный биологический материал должен быть промаркирован. В сопроводительном направлении необходимо указать: пол, фамилию, имя, отчество, возраст пациента, предполагаемый диагноз или показания к обследованию, день менструального цикла, дату взятия пробы, наименование учреждения, направляющего материал. В том случае, если пациент принимал лекарственный (ые) препарат (ы) per 05 в течение 2-х месяцев или per vaginae в течение 3-х недель, предшествующих исследованию, рекомендуется указать название лекарственного препарата и суточную и курсовую дозу.
Материал доставляется в лабораторию лицами, получившими специальный инструктаж, с учетом правил транспортировки.
Если время транспортировки биологического материала с момента взятия до момента его доставки в лабораторию от 2 часов до суток, то пробирку с биоматериалом необходимо хранить и доставлять в лабораторию при температуре бытового холодильника (+ 4°С), не замораживая. В случае невозможности доставки образца в лабораторию в течение суток, допускается однократное замораживание и хранение образца биоматериала при -20°С до 1 месяца.
В урогенитальном тракте женщин репродуктивного возраста как аэробные, так и анаэробные условно-патогенные микроорганизмы могут быть причиной патологических процессов. В таблице 2 представлены систематика и описание свойств микроорганизмов, которые можно диагностировать набором «Фемофлор».
Набор реагентов «Фемофлор», производства «ДНК-Технология» предусматривает возможность анализа ряда показателей (таблица 1):
Таблица 1
| ПОКАЗАТЕЛИ | Фемофлор 4 | Фемофлор 8 | Фемофлор16 |
| Контроль взятия материала | V | V | |
| Общая бактериальная масса | V | V | V |
| НОРМОФЛОРА | |||
| Lactobacillus spp. | V | V | V |
| АЭРОБНЫЕ МИКРООРГАНИЗМЫ (факультативные анаэробы) | |||
| Enterobacteriaceae | V | V | |
| Streptococcus spp. | V | V | |
| Staphylococcus spp. | V | ||
| АНАЭРОБНЫЕ МИКРООРГАНИЗМЫ (строгие анаэробы) | |||
| Gardnerella vaginalis/Prevotella bivia/ Porphyromonas spp. | V | V | |
| Eubacterium spp. | V | V | |
| Sneathia spp./Leptotrihia spp./ Fusobacterium spp. | V | ||
| Megasphaera spp./Veilonella spp./Dialister spp. | V | ||
| Lachnobacterium spp./ Clostridium spp. | V | ||
| Mobiluncus spp./Corynebacterium spp. | V | ||
| Peptostreptococcus spp. | V | ||
| Atopobium vaginae | V | ||
| МИКОПЛАЗМЫ | |||
| Mycoplasma hominis | V | V | |
| Urea plasma (urealyticum + parvum) | V | ||
| |ГРИБЫ | |||
| Candida spp. | V | V |
МИКРООРГАНИЗМЫ, диагностируемые набором «Фемофлор»
| Микроорганизм | Систематика, представители | Морфология, тинкториальные и метаболические свойства | Значение группы микроорганизмов в биоценозе |
| Lactobacillus spp. | Класс Bacilli Порядок Lactobacillales Семейство Lactobacillaceae |
Тест "Андрофлор"
Болезни мочеполовой системы являются ведущей причиной нарушения репродуктивной функции у мужчин, что имеет огромное социально-экономическое значение, особенно в современных условиях снижения рождаемости. Наиболее частой причиной болезней мочеполовой системы у мужчин является инфекционно-воспалительный процесс, длительность и интенсивность которого определяет степень нарушений репродуктивной функции. Хроническое воспаление оказывает продолжительное токсическое действие на сперматогенный эпителий, нарушает гематотестикулярный барьер, реологические свойства и химический состав семенной жидкости, а также может приводить к развитию аутоиммунных реакций, например, к образованию антиспермальных антител.
В процессе развития воспалительной реакции возрастает количество активированных клеток иммунной системы, что сопровождается повышенным образованием свободных радикалов кислорода и увеличением секреции лимфокинов и монокинов, результатом чего является вторичное воспаление в тканях репродуктивного тракта.
Согласно Международной классификации болезней 10-го пересмотра (МКБ-10), в перечень заболеваний мочеполовой системы у мужчин, причиной которых может быть инфекционно-воспалительный процесс, входят:
N34.1 Неспецифический уретрит
N34.2 Другие уретриты
N34.3 Уретральный синдром неуточненный
N40 Гиперплазия предстательной железы
N41.0 Острый простатит
N41.1 Хронический простатит
N45 Орхит и эпидидимит
N48.1 Баланопостит
N48.6 Баланит
N49.0 Воспалительные болезни семенного пузырька
N49.1 Воспалительные болезни семенного канатика, влагалищной оболочки и семявыносящего протока
По данным литературы этиологическими факторами развития инфекционно-воспалительного процесса урогенитального тракта у мужчин являются облигатные патогены и вирусы: Neisseria gonorrhoeae, Chlamydia trachomatis, Trichomonas vaginalis, Mycoplasma genitalium, Herpes Simplex Virus типов 1 и 2. Однако в последние годы отмечается существенное увеличение роли условно-патогенных микроорганизмов: генитальных микоплазм (Ureaplasma urealyticum, Ureaplasma parvum, Mycoplasma hominis), бактерий рода Haemophilus, дрожжеподобных грибов рода Candida и др. (табл. 1). Появление молекулярно-биологических технологий позволило установить существенно более широкий круг возбудителей, в том числе облигатно анаэробных, также имеющих значение в патологии. Однако большинство из них являются некультивируемыми или трудно культивируемыми in vitro, поэтому они не могут быть выявлены при стандартных микроскопических или бактериологических исследованиях.
Таблица 1. Микроорганизмы – возбудители заболеваний мочеполовой системы у мужчин (по данным литературы)
| Заболевание | Возможные возбудители заболевания | Источник информации |
| Баланит, баланопостит | Neisseria gonorrhoeae Chlamydia trachomatis Mycoplasma genitalium Trichomonas vaginalis | 8, 17 |
| Bacteroides/Prevotella Аnaerococcus Peptostreptococcus Clostridium | 9,17 | |
| Gardnerella vaginalis | 17 | |
| Candida | 8,17 | |
| Staphylococcus Streptococcus | 30 | |
| Уретрит | Neisseria gonorrhoeae | 23 |
| Chlamydia trachomatis | 11 | |
| Mycoplasma genitalium | 11 | |
| Trichomonas vaginalis | 7 | |
| Ureaplasma urealyticum | 14, 34, 44 | |
| Ureaplasma parvum | 7 | |
| Haemophilus | 25 | |
| Candida spp. | 29, 35 | |
| Leptotrichia/Sneathia Megasphaera, Clostridium BVAB-2, BVAB-3 | 31 | |
| Staphylococcus Streptococcus | 26 | |
| Corynebacterium | 19 | |
| Простатит | Chlamydia trachomatis | 38, 44 |
| Ureaplasma urealyticum | 38 | |
| Mycoplasma hominis | 38 | |
| E.сoli Enterococcus faecalis | 33,44 | |
| Pseudomonas aeruginosa | 44 | |
| Bacteroides/Prevotella/ Porphyromonas | 5, 10,40 | |
| Burkholderia pseudomallei | 4, 16 | |
| Staphylococcus Streptococcus | 33 | |
| Corynebacterium | 41 | |
| Орхит, эпидидимит | Neisseria gonorrhoeae | 42 |
| Chlamydia trachomatis | 42, 43 | |
| Enterobacteriaceae | 42, 43 | |
| Pseudomonas aeruginosa | 43 |
Значительную роль в нарушении репродуктивного здоровья мужчин играет воспаление предстательной железы. Простатит – самый частый урологический диагноз у мужчин моложе 50 лет и третий по частоте у мужчин старше 50 лет, при этом приблизительно у 10 % мужчин заболевание диагностируется уже на стадии хронического течения [4, 25, 40].
Острый бактериальный простатит (ОБП) чаще всего является результатом восходящей инфекции мочевого тракта или процедур, затрагивающих мочевой тракт, например уретральной катетеризации или трансректальной биопсии простаты. Бактериальный простатит протекает в острой форме с яркими клиническими проявлениями только в 5 % случаев, что требует обязательной лабораторной диагностики при подозрении на заболевание простаты.
Наиболее часто при ОБП определяются бактерии группы Enterobacteriaceae (87 %), другие грамотрицательные бактерии, такие как Pseudomonas aeruginosa, Enterococcus и др., встречаются приблизительно в 10 % случаев. В развитии хронической формы заболевания большое значение имеют анаэробные бактерии, в том числе Bacteroides/ Prevotella/ Porphyromonas, ассоциированные с развитием бактериального вагиноза у женщин, а также Burkholderia.
При хроническом течении заболевания более 70 % случаев также имеют инфекционную этиологию, при этом наиболее распространенными микроорганизмами являются: C. trachomatis (>30 %), T. vaginalis (11 %) и U. urealyticum (5 %) [4, 25, 40].
Секреты мужских половых желез (эякулят, секрет простаты, моча после массажа простаты) в случае возникновения простатита часто содержат обильные полимикробные сообщества, включающие как оппортунистические патогены, так и бактерии-комменсалы. Последние играют двойственную роль в мужском урогенитальном тракте, так как при возникновении определенных условий способны вызывать уретриты и простатиты. Отсутствие патогномоничной симптоматики инфекционно-воспалительных процессов у мужчин, а также преобладание стертого или бессимптомного клинического течения обусловливает необходимость введения в практику информативной диагностической технологии, которая позволяет быстро и достоверно выявить фактор воспалительного процесса и выбрать эффективную, этиологически обоснованную лекарственную терапию.
Методы лабораторной диагностики инфекционно-воспалительных заболеваний урогенитального тракта у мужчин
В настоящее время перечень лабораторных исследований, рекомендованный стандартами оказания медицинской помощи при заболеваниях мочеполовой системы у мужчин, включает преимущественно бактериологический и микробиологический методы. В то же время в международной и российской лабораторной практике культуральный и микроскопический методы рассматриваются как имеющие ряд существенных ограничений, которые затрудняют получение объективного результата обследования. Стоит заметить, что такие облигатные патогенны, как Chlamydia trachomatis, Mycoplasma genitalium, а также вирус простого герпеса не могут быть выявлены при стандартном микроскопическом и культуральном исследовании.
Микроскопический (бактериоскопический) метод – самый быстрый и дешевый, его использование связано с минимальными требованиями к организации лаборатории. Однако использование микроскопии для диагностики инфекционных заболеваний имеет ряд ограничений:
- низкая чувствительность метода;
- субъективность оценки результатов;
- невозможность выявления большинства этиологически значимых микроорганизмов;
- невозможность количественной оценки.
Так, при диагностике трихомониаза микроскопический метод имеет самую низкую чувствительность: в среднем 30 % (для женщин – 50–60 %, для мужчин – 10–12 %), тогда как метод ПЦР достоверно определяет возбудителя в 90–96 % случаев (Sexually Transmitted Diseases Treatment Guidelines, CDC, 2010). Национальный центр по предупреждению заболеваний (CDC, USA) с 2006 г. не рекомендует применение микроскопиии для диагностики трихомониаза у мужчин, указывает на большую информативность культурального исследования выделений, мочи и спермы. Особенно затруднительна диагностика в случае низкокопийных препаратов или биоматериала, содержащего значительное количество клеток эпителия и лейкоцитов.
При сравнении чувствительности микроскопических методов исследования и ПЦР показано, что частота обнаружения N. gonorrhoeae при микроскопии у мужчин – 80–95 %, у женщин – 30–50 %, C. trachomatis – 10–12 %; использование метода ПЦР дает возможность определять указанные микроорганизмы с чувствительностью более 95 % [6, 28, 36, 39, 46]. Кроме того, при микроскопии мазков можно идентифицировать микроорганизмы, присутствующие в биоматериале в количестве выше 105 КОЕ/мл, тогда как многие факультативно-анаэробные и аэробные бактерии могут проявлять патогенный эффект при сравнительно небольшом количестве (до 104 КОЕ/мл), которое не выявляется при микроскопии. Данные обстоятельства существенно снижают диагностическую ценность микроскопического исследования.
В то же время микроскопия является на сегодня единственным методом, позволяющим оценить интенсивность воспалительной реакции путем подсчета лейкоцитов.
Культуральный (бактериологический) метод позволяет выявить и установить видовую принадлежность микроорганизмов по их культуральным, биохимическим, антигенным свойствам и определить чувствительность к антимикробным препаратам. Кроме того при бактериологическом исследовании некоторых видов биоматериала возможно количественная оценка. Бактериологическое исследование эффективно для выявления аэробных и факультативно-анаэробных микроорганизмов. Сложности возникают при попытке выделить облигатно анаэробные бактерии, в то время как эта группа микробов имеет большое значение в патологии урогенитального тракта как у женщин, так и мужчин. Невозможно при бактериологическом исследовании выявить вирусные агенты, простейшие, некультивируемые бактерии.
Особую проблему представляет организация преаналитического этапа при бактериологическом исследовании. Доставка исследуемого биоматериала в лабораторию должна осуществляться с течение короткого промежутка времени (2-6 часов) с соблюдением температурной цепи. Охлаждение материала при транспортировке приводит к гибели патогенных бактерий. Использование коммерческих транспортных сред также не всегда позволяет доставить все микроорганизмы до лаборатории в живом состоянии и может приводить к искажению результатов исследования.
Метод ПЦР с детекцией результатов в режиме реального времени (ПЦР-РВ) позволяет выявлять ДНК/РНК микроорганизмов вне зависимости от их культуральных и морфологических особенностей; охарактеризовать структуру микробиоты соответствующего биотопа для оценки патогенетической роли каждой группы микроорганизмов у данного пациента. Комбинация высокой чувствительности и специфичности, скорость (1-1,5 часа) получения результата, возможность количественного анализа и диагностики некультивируемых микроорганизмов делают технологию ПЦР-РВ максимально удобной и клинически значимой в исследовании инфекционных заболеваний.
Качественный анализ с помощью ПЦР-РВ предназначен для выявления облигатных патогенов (C.trachomatis, M.genitalium, T.vaginalis, N. gonorrhoeae) и вирусов (ЦМВ, ВПГ 1 и 2 типа), так как количественное определение данных агентов не имеет смысла. При отсутствии облигатных патогенов необходимо количественное определение условно-патогенной микрофлоры.
Количественный анализ микроорганизмов с помощью ПЦР-РВ в настоящее время используется для изучения нормальной, патогенной и условно-патогенной микрофлоры в разных биотопах человека: периодонте [20], респираторном тракте [47], образцах из желудочно-кишечного тракта [18] и вагинального микробиома у женщин [27]. Подобный подход реализован в Наборе реагентов для исследования биоценоза урогенитального тракта у женщин методом ПЦР-РВ (тест «Фемофлор®»).
В настоящее время актуальным направлением в исследовании биоценозов является сравнение микробного состава урогенитального тракта половых партнеров с целью разработки эффективного алгоритма лабораторного обследования пар и подбора терапии в случае выявления у одного/обоих партнеров заболеваний репродуктивной системы инфекционной этиологии либо нарушений репродуктивной функции. Так при обследовании половых партнеров пациенток с бактериальным вагинозом морфотипы ассоциированных с бактериальным вагинозом микроорганизмов выявлялись у 25 % мужчин, при этом клинические проявления (баланопостит) наблюдались у 3 % пациентов. Кроме того, условно-патогенные микроорганизмы – потенциальные возбудители воспалительных заболеваний урогенитального тракта могут попадать в уретру при анальных и орогенитальных контактах, что создает опасность заражения обоих половых партнеров.
В настоящее время в арсенале лабораторий появился новый тест для количественной оценки микробиоценоза урогенитального тракта у мужчин методом ПЦР-РВ «Андрофлор®». Новая технология позволяет решить несколько задач, стоящих перед клиницистам:
- идентификация облигатно патогенных возбудителей инфекций, передающихся половым путем (ИППП);
- анализ условно-патогенных микроорганизмов, которые могут присутствовать в мочеполовом тракте мужчин или вызывать инфекционно-воспалительные заболевания мочеполовой системы;
- определение этиологии инфекционного процесса;
- возможность прогнозирования объема назначаемой терапии;
- возможность проведения динамических наблюдений;
- контроль качества взятия биоматериала (количественная оценка геномной ДНК человека).
Одно исследование микробиоценоза урогенитального тракта мужчин с помощью теста «Андрофлор®» позволяет полностью заменить комплекс методов ПЦР-РВ, предлагаемых в стандартах медицинской помощи, которые утверждены Минздравом России в 2012 г., а также расширить его за счет дополнительной диагностики облигатных анаэробов.
В состав Набора реагентов для исследования микробиоценоза урогенитального тракта мужчин методом ПЦР в режиме реального времени «Андрофлор®» входят 24 показателя.
| № | Показатель | Значение |
| 1 | Геномная ДНК человека (ГДЧ) | контроль адекватности взятия материала |
| 2 | Общая бактериальная масса (ОБМ) | общая обсемененность биотопа |
| 3 | Lactobacillus spp. | транзиторная микрофлора, указывающая на возможную контаминацию вагинальной микрофлорой партнерши |
| 4 | Staphylococcus spp. | Представители нормальной микрофлоры урогенитального тракта мужчин |
| 5 | Streptococcus spp. | |
| 6 | Corynebacterium spp. | |
| Условно-патогенные микроорганизмы | ||
| 7 | Gardnerella vaginalis | Облигатно анаэробные и факультативно анаэробные микроорганизмы, ассоциированные с развитием бактериального вагиноза у женщин |
| 8 | Atopobium cluster | |
| 9 | Megasphaera spp./Veilonella spp./Dialister spp. | |
| 10 | Sneathia spp./Leptotrihia spp. /Fusobacterium spp. | |
| 11 | Ureaplasma urealyticum | |
| 12 | Ureaplasma parvum | |
| 13 | Mycoplasma hominis | |
| 14 | Bacteroides spp./Porphyromonas spp./Prevotella spp. | Анаэробные микроорганизмы |
| 15 | Anaerococcus spp. | |
| 16 | Peptostreptococcus spp./Parvimonas spp./Eubacterium spp. | |
| 17 | Heamophilus spp. | Факультативно анаэробные микроорганизмы |
| 18 | Pseudomonas aeruginosa/Ralstonia spp./Burkholderia spp. | |
| 19 | Enterobacteriaceae/Enterococcus spp. | |
| 20 | Candida spp. | Дрожжеподобные грибы |
| Облигатно патогенные микроорганизмы | ||
| 21 | Mycoplasma genitalium | |
| 22 | Trichomonas vaginalis | |
| 23 | Neisseria gonorrhoeae | |
| 24 | Chlamydia trachomatis |
Подготовка к получению биоматериала для теста «Андрофлор®»
Для исключения искажений результатов определения состава микрофлоры урогенитального тракта мужчин из-за присутствия транзиторной микрофлоры в течение трех дней перед взятием биоматериала рекомендуется половое воздержание или защищенный половой контакт. При несоблюдении этого требования будут выявлены микроорганизмы, типичные для влагалища партнерши (лактобациллы) в превышающих пороговые значения количествах.
Рекомендуемые варианты биоматериала для исследования в тесте «Андрофлор®»
Для этиологической диагностики уретрита, баланопостита, мониторинга терапии данных заболеваний рекомендованными видами биологического материала являются:
- соскоб из уретры,
- соскоб с крайней плоти головки полового члена,
- моча (первая порция утренней мочи используется только для идентификации патогенов).
Для этиологической диагностики простатита, мужского бесплодия, мониторинга терапии данных заболеваний рекомендованными видами биологического материала являются:
- секрет (сок) простаты*,
- остаточная моча после массажа простаты,
- эякулят,
- биопсийный материал из ткани простаты. *
*При подозрении на острый простатит выполнять массаж простаты категорически запрещено!
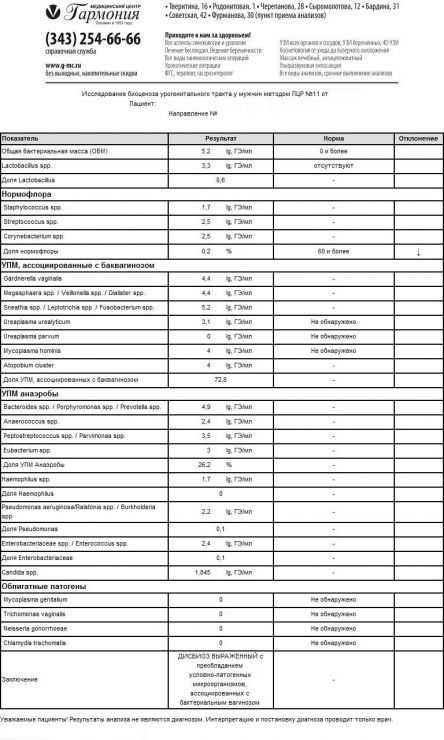
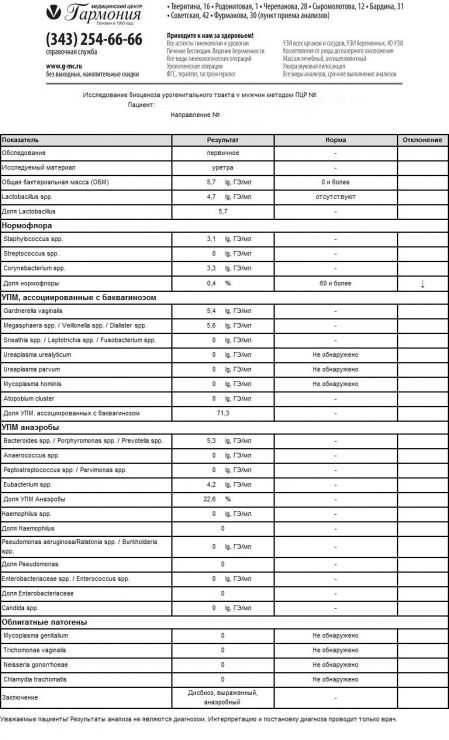
Интерпретация результатов теста «Андрофлор®»
Лабораторная оценка результатов теста «Андрофлор®» проводится в несколько этапов.
- Оценка адекватности полученного материала. Критерием достаточности полученного биоматериала является наличие геномной ДНК человека (ГДЧ). Отсутствие в представленном материале ГДЧ свидетельствует об отсутствии клеток эпителия репродуктивного тракта, поверхность которых колонизирована микроорганизмами.
- Оценка общей обсемененности биотопа – ОБМ (общей бактериальной массы). При отсутствии воспалительного процесса урогенитального тракта у мужчины не превышает 104 ГЭ/мл.
- Наличие облигатных патогенов - C.trachomatis, M.genitalium, T.vaginalis, N. gonorrhoeae. В норме они отсутствуют. При выявлении любого из них пациенту должно быть назначено этиотропная терапия с обязательным контролем излеченности.
- Доля транзиторной микрофлоры – лактобацилл, представителей нормофлоры влагалища. В норме доля лактобацилл не превышает 10% от всех выделенных микроорганизмов (ОБМ). В случае превышение порогового показателя необходимо убедиться, что последний незащищенный половой контакт у пациента не менее, чем за 3 суток до взятия материала. Следует иметь в виду, что в ряде случаев транзиторная микрофлоры может быть причиной воспалительных заболеваний нижних отделов урогенитального тракта у мужчин.
- Доля нормальной микрофлоры – группа непатогенных стафилококков, стрептококков и коринебактерий. В норме на долю этой группы микроорганизмов приходится более 60% всей бактериальной массы. Снижение доли нормофлоры свидетельствует о наличии дисбиоза.
- Критерии дисбиоза. Состояние микробиоценоза урогенитального тракта расценивают как умеренный дисбиоз при доле нормофлоры в пределах 30-60%, как выраженный дисбиоз при доле нормофлоры менее 30% от всех выделенных микроорганизмов.
- В зависимости от доминирующей группы микроорганизмов делают заключение об этиологии дисбиоза.
Варианты лабораторных заключений, получаемых с использованием теста «Андрофлор®»
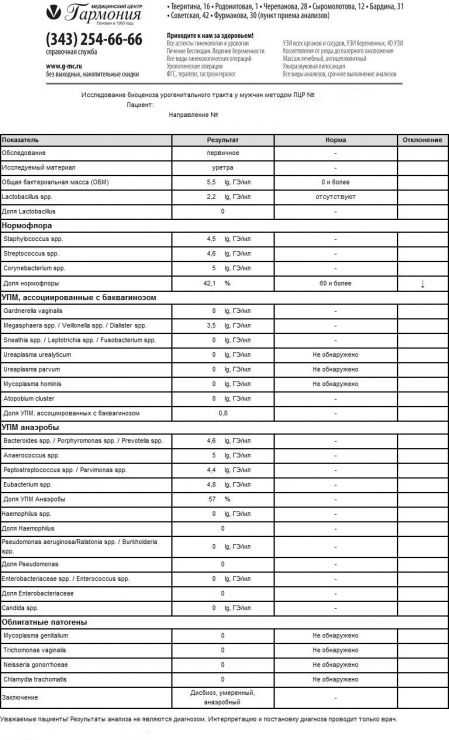
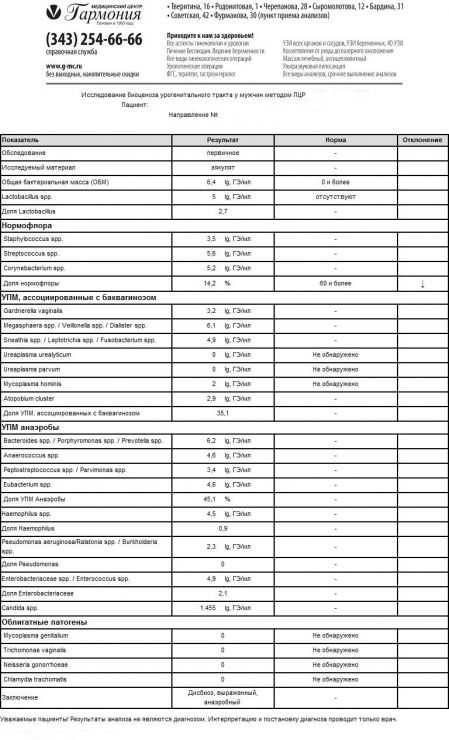
- Лабораторные исследования
- Исследование биоценоза урогенитального тракта методом ПЦР в реальном времени
- Наименование услугСтоимость в рубляхАндрофлор Биоценоз урогенитального тракта у мужчин (24 показателя: общая бактериальная масса, лактобактерии, Streptococcus Spp., Staphylococcus Spp., Enterobacteriaceae Spp. Enterococcus Spp., Haemophilus Spp.,Prevotella Spp., Gardnerella Vaginalis, Eubacterium Spp., Megasphaera Spp., Mobiluncus Spp., Clostridium Spp., Peptostreptococcus Spp., Atopobium Vaginae, M.genitalium, M.hominis., U.urealyticum, U.parvum,, Candida Spp., C.trachomatis, N.gonorrhoeae, Tr.vaginalis)
- Рекомендации по виду исследуемого материала, технике забора, срокам обследования после лечения дает врач на консультации.
- Исследование биоценоза урогенитального тракта методом ПЦР в реальном времени
Бактериальный вагиноз
Бактериальный вагиноз (БВ) – инфекционный невоспалительный синдром, характеризующийся значительным снижением количества (или отсутствием) нормальной лактофлоры влагалища и ее заменой на полимикробные ассоциации строгих анаэробов. БВ – самая распространенная инфекция нижнего отдела мочеполовой системы у женщин детородного возраста. По данным различных авторов 25-30% женщин страдают этим заболеванием. Бактериальный вагиноз, по последним данным, является одной из причин раннего прерывания беременности, преждевременных родов, хориоамнионита, послеродового эндометрита, послеоперационных осложнений после гинекологических операций, воспалительных заболеваний малого таза у женщин. При бактериальном вагинозе увеличивается риск инфицирования половыми инфекциями, включая ВИЧ. Согласно последним рекомендациям ВОЗ 2005 г. бактериальный вагиноз относится к эндогенным инфекциям репродуктивного тракта человека (RTI).
Диагноз Диагноз бактериального вагиноза ставится либо при определении клинико-лабораторных критериев Амселя, либо при определении баллов Нугента, либо при обнаружении так называемых высокоспецифичных маркеров (Atopobium vaginae, Clostridium spp.) бактериального вагиноза. В настоящее время, традиционным методом этиологической диагностики любого инфекционного процесса является культуральный метод. Однако этот способ имеет ряд серьезных недостатков:
- Длительные сроки культивирования микроорганизмов (в среднем 5 дней).
- Анаэробные микроорганизмы (наиболее часто встречаемые при БВ) трудно культивируются, либо не поддаются культивированию вообще.
- При доставке материала в лабораторию с использованием транспортных сред продолжается размножение микроорганизмов с изменением их количественного соотношения.
- В случае использования сухого тампона для взятия биоматериала, срок транспортировки образца в лабораторию ограничен часами (т.к. необходимо сохранить жизнеспособность).
- Культуральный метод не дает точной количественной оценки и используется только для ориентировочной оценки соотношения микроорганизмов между собой.
Объективные и субъективные ограничения методов лабораторной диагностики, применяемых сегодня в мировой медицинской практике, приводят к большому количеству диагностических ошибок: при манифестированном БВ – более чем в 60%, при кандидозном вульвовагините – до 77%; при микст-инфекции – до 87% (Schwiertz A. et al. 2006). С другой стороны, невысокая чувствительность критериев Амселя и наличие бессимптомных форм бактериального вагиноза заставило искать другие методы и критерии подтверждения диагноза. Достижения молекулярной биологии предоставили новые возможности в изучении микробного состава различных биотопов человека, обеспечивающие принципиально новый подход к исследованию условно-патогенной флоры, основанный на комплексной оценке основных групп микроорганизмов, формирующих урогенитальный биоценоз. Новый метод исследования микробиоценоза влагалища методом ПЦР – уникальное исследование, позволяющее наиболее полно и точно охарактеризовать качественный и количественный состав биоценоза влагалища. Достоинством нового метода является возможность исследовать нормофлору, наличие, степень и характер дисбаланса условно-патогенной инормальной флоры.
В ходе исследования выполняется количественная оценка общей бактериальной массы, урогенитальной нормофлоры (лактобациллы) и комплекса аэробных и анаэробных микроорганизмов, микоплазм, грибов рода Candida, участвующих в развитии дисбиотических процессов в урогенитальном биоценозе.
Показания к применению метода
- Наличие субъективных и/или объективных симптомов, связанных с урогенитальным трактом, у женщин репродуктивного возраста вне беременности
- Планирование беременности
- Репродуктивные потер
- Подготовка к экстракорпоральному оплодотворению
- Планируемое оперативное вмешательство в области малого таза
Данная технология предусматривает возможность анализа ряда показателей Контроль взятия биоматериала Общая бактериальная масса
Нормобиота
Аэробные микроорганизмы (факультативные анаэробы)
- Enterobacterium spp.
- Streptococcus spp.
- Staphylococcus spp.
Анаэробные микроорганизмы (строгие анаэробы)
- Gardnerella vaginalis/Prevotella bivia
- Porphyromonas spp.
- Eubacterium spp.
- Sneathia spp./Leptotrihia spp.
- Fusobacterium spp.
- Megasphaera spp.
- Veilonella spp./Dialister spp.
- Lachnobacterium spp./Clostridium spp.
- Mobiluncus spp./Corynebacterium spp.
- Peptostreptococcus spp.
- Atopobium vaginae
Микоплазмы
- Mycoplasma (hominis +genitalium)
- Ureaplasma (urealyticum + parvum)
Грибы
Интерпретация полученных результатов НОРМОЦЕНОЗ Общая бактериальная масса (ОБМ) – показатель, по которому можно судить об общем количестве бактерий, присутствующих в исследуемой биопробе. Основным представителем нормобиоты урогенитального тракта у здоровых женщин репродуктивного возраста являются представители рода Lactobacillus (LB). LB оцениваются как в абсолютных, так и относительных показателях. В норме LB являются главной составляющей ОБМ, поэтому абсолютный показатель уровня лактобацилл практически не отличается от абсолютного показателя общей бактериальной массы и соответствует 106–108 для вагинальных соскобов, для уретры и цервикального канала – на порядок меньше – 105 – 107. Снижение относительного показателя LB служит одним из критериев дисбаланса урогенитальной биоты. Умеренное снижение относительного показателя LB соответствует интервалу значений от -0,3 до -1,0 (70%-10% от ОБМ). Значительное снижение относительного показателя ЛБ соответствует значениям ниже, чем -1,0 (меньше 10% от ОБМ). Снижение ОБМ ниже указанных пороговых значений, соответственно, свидетельствует о недостаточном заселении исследуемого биотопа бактериями, возможно вследствие антибиотикотерапии, гипоэстрогении различного генеза и др.
Аэробные и анаэробные условно-патогенные микроорганизмы Абсолютный показатель 104, относительные показатели различных условно-патогенной микрофлоры варьируют от -3 до -1 (0,1%-10%).
Mycoplasma hominis и Ureaplasma (urealyticum + parvum) В норме отсутствуют или абсолютный показатель > 104 .
Грибы рода Candida spp. В норме отсутствуют или абсолютный показатель > 103.
ДИСБАЛАНС II (выраженный) Общая бактериальная масса Абсолютный показатель варьирует в широких пределах, он может быть как меньше 105, так и соответствовать норме (106-108) в зависимости от этиологии и патогенеза урогенитального заболевания. Как правило, во влагалище ОБМ на 1 порядок выше, чем в уретре или цервикальном канале.
Нормобиота (Lactobacillus spp) Абсолютный показатель может варьировать от полного отсутствия лактобацилл до значений 105-6 (как правило во влагалище количество лактобацилл на 1 порядок выше, чем в уретре и цервикальном канале); относительный показатель – меньше -1 (0-10%).
Аэробные и анаэробные условно-патогенные микроорганизмы В большинстве случаев абсолютный показатель больше >105, относительные показатели различных представителей условно-патогенной микрофлоры могут варьировать от -3 до 0 (0,01%-100%), однако относительные показатели хотя бы её части находятся в пределах от -1 до 0 (10%-100%).
Mycoplasma hominis и Ureaplasma (urealyticum + parvum) Могут отсутствовать или абсолютный показатель >104 .
Грибы рода Candida spp. Отсутствуют или абсолютный показатель > 103 .
Классификация дисбалансов в зависимости от этиологической структуры
Анаэробный Дисбаланс, вызванный преимущественно анаэробными микроорганизмами: Gardnerella vaginalis /Prevotella bivia/Porphyromonas spp; Atopobium vaginae; Eubacterium spp; Sneathia spp /Leptotrihia spp/Fusobacterium spp; Megasphera spp/Veilonella spp/Dialister spp; Lachnobacterium spp/Clostridium spp; Mobiluncus spp/Corynebacterium spp; Peptostreptococcus spp.
Аэробный Дисбаланс, вызванный преимущественно аэробными микроорганизмами: Enterobacteraceae, Streptococcus spp и Staphylococcus spp.
Смешанный Дисбаланс, вызванный сочетанием аэробной и анаэробной бактериальной биоты, возможно в сочетании с дрожжевыми грибами рода Candida.
В методе предусмотрена возможность контроля качества взятия материала. Данный показатель служит для оценки правильности взятия материала врачом-клиницистом и позволяет отличать случаи биоценозов со сниженной бактериальной массой, от случаев некорректного взятия материала. Это исключает также получение ложноотрицательных результатов исследования. Программное обеспечение позволяет автоматически анализировать полученные данные и выдавать заключение в удобном для интерпретации виде. Метод предназначен как для повседневной лабораторной диагностики, так и в качестве чувствительного и высокоспецифичного инструмента для научных исследований.
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе