Медицина и Здоровье на портале EUROLAB | Медицинский справочник болезней и их лечение, консультации врача, клиники
Регистрация Вход в личный кабинет
Антитела (иммуноглобулины, ИГ, Ig) — это растворимые гликопротеины, присутствующие в сыворотке крови, тканевой жидкости или на клеточной мембране, которые распознают и связывают антигены. Иммуноглобулины синтезируются В-лимфоцитами (плазматическими клетками) в ответ на чужеродные вещества определенной структуры — антигены. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов.
Антитела выполняют две функции: антиген-связывающую функцию и эффекторную (например запуск классической схемы активации комплемента и связывание с клетками), являются важнейшим фактором специфического гуморального иммунитета, состоят из двух лёгких цепей и двух тяжелых цепей. У млекопитающих выделяют пять классов иммуноглобулинов — IgG, IgA, IgM, IgD, IgE, различающиеся между собой по строению и аминокислотному составу тяжелых цепей. Иммуноглобулины экспрессируются в виде мембраносвязанных рецепторов на поверхности В-клеток и в виде растворимых молекул, присутствующих в сыворотке и тканевой жидкости.
Строение антител
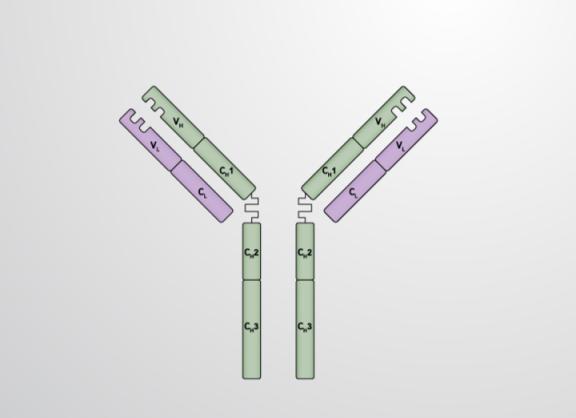
Антитела являются относительно крупными (~150 кДа — IgG) гликопротеидами, имеющими сложное строение. Состоят из двух идентичных тяжелых цепей (H-цепи, в свою очередь состоящие из VH, Ch2, шарнира, Ch3 and Ch4 доменов) и из двух идентичных лёгких цепей (L-цепей, состоящих из VL и CL доменов). К тяжелым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding — антиген-связывающий фрагмент) и один Fc (англ. fragment crystallizable — фрагмент, способный к кристаллизации). В зависимости от класса и исполняемых функций антитела могут существовать как в мономерной форме (IgG, IgD, IgE, сывороточный IgA) так и в олигомерной форме (димер-секреторный IgA, пентамер — IgM). Всего различают пять типов тяжелых цепей (α-, γ-, δ-, ε-и μ- цепи) и два типа легких цепей (κ-цепь и λ-цепь).
Виды антител:
- IgG является основным иммуноглобулином сыворотки здорового человека (составляет 70-75 % всей фракции иммуноглобулинов), наиболее активен во вторичном иммунном ответе и антитоксическом иммунитете. Благодаря малым размерам (коэффициент седиментации 7S, молекулярная масса 146 кДа) является единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер и тем самым обеспечивая иммунитет плода и новорожденного.
- IgM представляют собой пентамер основной четырехцепочечной единицы, содержащей две μ- цепи. Появляются при первичном иммунном ответе на неизвестный антиген, составляют до 10 % фракции иммуноглобулинов. Являются наиболее крупными иммуноглобулинами (970 кДа).
- IgA сывороточный IgA составляет 15-20 % всей фракции иммуноглобулинов, при этом 80 % молекул IgA представлено в мономерной форме у человека. Секреторный IgA представлен в димерной форме в комплексе секреторным компонентом, содержится в серозно-слизистых секретах (например, в слюне, молозиве, молоке, отделяемом слизистой оболочки мочеполовой и респираторной системы).
- IgD составляет менее одного процента фракции иммуноглобулинов плазмы, содержится в основном на мембране некоторых В-лимфоцитов. Функции до конца не выяснены, предположительно является антигенным рецептором для В-лимфоцитов, еще не представлявшихся антигену.
- IgE связан с мембранами базофилов и тучных клеток, в свободном виде в плазме почти отсутствует. Связан с аллергическими реакциями.
Функции антител
Иммуноглобулины всех изотипов бифункциональны. Это означает, что иммуноглобулин любого типа — распознает и связывает антиген, а затем — усиливает киллинг и/или удаление иммунных комплексов, сформированных в результате активации эффекторных механизмов. Одна область молекулы антител (Fab) определяет ее антигенную специфичность, а другая (Fc) осуществляет эффекторные функции: связывание с рецепторами, которые экспрессированы на клетках организма (например, фагоцитах); связывание с первым компонентом (C1q) системы комплемента для инициации классического пути каскада комплемента.
Как вырабатываются антитела
Выработка антител в ответ на поступление в организм антигенов зависит от того, впервые или повторно организм сталкивается с данным антигеном. При первичной встрече антитела появляются не сразу, а через несколько дней, при этом сначала образуются IgМ- антитела, а затем начинают преобладать IgG-антитела. Своего пика количество антител в крови достигает приблизительно за неделю, затем их количество медленно снижается. При повторном поступлении антигена в организм выработка антител происходит быстрее и в большем объеме, при этом образуются сразу IgG- антитела. Иммунная система способна запоминать свои встречи с некоторыми антигенами очень надолго, этим объясняется, например, пожизненный иммунитет к натуральной оспе или к детским инфекциям.
Реакция антиген-антитело
В результате реакции антиген-антитело в геле образуются линии преципитации, по которым можно судить о числе реагирующих компонентов, иммунологическом родстве антигенов и их электрофоретической подвижности. Антитела могут быть обнаружены в макроскопической реакции агглютинации с помощью частиц, нагруженных антигеном. Разработаны многочисленные варианты иммунологического анализа, основанные на взаимодействии меченых антигенов и антител. В качестве меток используют радиоактивные изотопы и ферменты.
Как антитела нейтрализуют токсины?
Молекула антитела, присоединившись вблизи активного центра токсина, может стереохимически блокировать его взаимодействие с субстратом, особенно с макромолекулярным. В комплексе с антителами токсин теряет способность к диффузии в тканях и может стать объектом фагоцитоза, особенно если размер комплекса увеличивается в результате связывания с нормальными аутоантителами.
Защитное действие сывороточных антител
Антитела нейтрализуют вирусы разными способами – например, стереохимически ингибируя связывание вируса с клеточным рецептором и предотвращая тем самым его проникновение в клетку и последующую репликацию. Иллюстрация этого механизма – протективный эффект, которым обладают антитела, специфичные к гемагглютинину вируса гриппа. Антитела к гемагглютинину вируса кори тоже препятствуют его проникновению в клетку, но межклеточное распространение вируса блокируется антителами к белку слияния цитоплазматических мембран соседних клеток.
Антитела могут непосредственно разрушать вирусные частицы, активируя комплемент по классическому пути или вызывая агрегацию вирусов с последующим фагоцитозом и внутриклеточной гибелью. Эффективными могут быть даже относительно низкие концентрации антител в крови: например, можно защитить реципиентов от заражения полиомиелитом, вводя противовирусные антитела, или предотвратить заболевание корью детей, контактировавших с больными, вводя профилактически нормальный гамма-глобулин человека.
Материнские антитела
В первые несколько месяцев жизни, когда собственная лимфоидная система ребенка еще недостаточно развита, защиту от инфекций обеспечивают материнские антитела, проникающие через плаценту или поступающие с молозивом и всасывающиеся в кишечнике. Основной класс иммуноглобулинов молока – это секреторный иммуноглобулин А. Он не всасывается в кишечнике, а остается здесь, защищая слизистую оболочку. Поразительно, что эти антитела направлены к бактериальным и вирусным антигенам, часто попадающим в кишечник. Кроме того, полагают, что клетки, продуцирующие иммуноглобулин А к таким антигенам, мигрируют в ткань молочной железы, откуда продуцируемые ими антитела попадают молоко.
Оценка иммунного статуса
Иммунограмма
Антитела — это… Что такое Антитела?
Антитела (иммуноглобулины, ИГ, Ig) — это особый класс гликопротеинов, присутствующих на поверхности В-клеток в виде мембраносвязанных рецепторов и в сыворотке крови и тканевой жидкости в виде растворимых молекул. Они являются важнейшим фактором специфического гуморального иммунитета. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов. Антитела выполняют две функции: антиген-связывающую и эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками, которыми становятся В-лимфоциты в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом — характерным фрагментом поверхности или линейной аминокислотной цепи антигена.
Антитела состоят из двух лёгких цепей и двух тяжелых цепей. У млекопитающих выделяют пять классов антител (иммуноглобулинов) — IgG, IgA, IgM, IgD, IgE, различающихся между собой по строению и аминокислотному составу тяжёлых цепей и по выполняемым эффекторным функциям.
История изучения
Самое первое антитело было обнаружено Берингом и Китазато в 1890 году, однако в это время о природе обнаруженного столбнячного антитоксина, кроме его специфичности и его присутствия в сыворотке иммунного животного, ничего определенного сказать было нельзя. Только с 1937 года — исследований Тизелиуса и Кабата, начинается изучение молекулярной природы антител. Авторы использовали метод электрофореза белков и продемонстрировали увеличение гамма-глобулиновой фракции сыворотки крови иммунизированных животных. Адсорбция сыворотки антигеном, который был взят для иммунизации, снижала количество белка в данной фракции до уровня интактных животных.
Строение антител
Общий план строения иммуноглобулинов: 1) Fab; 2) Fc; 3) тяжелая цепь; 4) легкая цепь; 5) антиген-связывающийся участок; 6) шарнирный участок
Антитела являются относительно крупными (~150 кДа — IgG) гликопротеинами, имеющими сложное строение. Состоят из двух идентичных тяжелых цепей (H-цепи, в свою очередь состоящие из VH, Ch2, шарнира, Ch3 и Ch4 доменов) и из двух идентичных лёгких цепей (L-цепей, состоящих из VL и CL доменов). К тяжелым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding — антиген-связывающий фрагмент) и один Fc (англ. fragment crystallizable — фрагмент, способный к кристаллизации). В зависимости от класса и исполняемых функций антитела могут существовать как в мономерной форме (IgG, IgD, IgE, сывороточный IgA) так и в олигомерной форме (димер-секреторный IgA, пентамер — IgM). Всего различают пять типов тяжелых цепей (α-, γ-, δ-, ε-и μ- цепи) и два типа легких цепей (κ-цепь и λ-цепь).
Классификация по тяжелым цепям
Различают пять классов (изотипов) иммуноглобулинов, различающихся:
- величиной
- зарядом
- последовательностью аминокислот
- содержанием углеводов
Класс IgG классифицируют на четыре подкласса (IgG1, IgG2, IgG3, IgG4), класс IgA — на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех индивидов. Каждый изотип определяется последовательностью аминокислот константной области тяжелой цепи.
Функции антител
Иммуноглобулины всех изотипов бифункциональны. Это означает, что иммуноглобулин любого типа
- распознает и связывает антиген, а затем
- усиливает киллинг и/или удаление иммунных комплексов, сформированных в результате активации эффекторных механизмов.
Одна область молекулы антител (Fab) определяет ее антигенную специфичность, а другая (Fc) осуществляет эффекторные функции: связывание с рецепторами, которые экспрессированы на клетках организма (например, фагоцитах); связывание с первым компонентом (C1q) системы комплемента для инициации классического пути каскада комплемента.
- IgG является основным иммуноглобулином сыворотки здорового человека (составляет 70-75 % всей фракции иммуноглобулинов), наиболее активен во вторичном иммунном ответе и антитоксическом иммунитете. Благодаря малым размерам (коэффициент седиментации 7S, молекулярная масса 146 кДа) является единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер и тем самым обеспечивающей иммунитет плода и новорожденного. В составе IgG 2-3 % углеводов; два антигенсвязывающих Fab-фрагмента и один FC-фрагмент. Fab-фрагмент (50-52 кДа) состоит из целой L-цепи и N-концевой половины H-цепи, соединённых между собой дисульфидной связью, тогда как FC-фрагмент (48 кДа) образован C-концевыми половинами H-цепей. Всего в молекуле IgG 12 доменов (участки, сформированные из β-структуры и α-спиралей полипептидных цепей Ig в виде неупорядоченных образований, связанных между собой дисульфидными мостиками аминокислотных остатков внутри каждой цепи): по 4 на тяжёлых и по 2 на лёгких цепях.
- IgM представляют собой пентамер основной четырехцепочечной единицы, содержащей две μ-цепи. При этом каждый пентамер содержит одну копию полипептида с J-цепью (20 кДа), который синтезируется антителообразующей клеткой и ковалентно связывается между двумя соседними FC-фрагментами иммуноглобулина. Появляются при первичном иммунном ответе B-лимфоцитами на неизвестный антиген, составляют до 10 % фракции иммуноглобулинов. Являются наиболее крупными иммуноглобулинами (970 кДа). Содержат 10-12 % углеводов. Образование IgM происходит ещё в пре-B-лимфоцитах, в которых первично синтезируются из μ-цепи; синтез лёгких цепей в пре-B-клетках обеспечивает их связывание с μ-цепями, в результате образуются функционально активные IgM, которые встраиваются в поверхностные структуры плазматической мембраны, выполняя роль антиген распознающего рецептора; с этого момента клетки пре-B-лимфоцитов становятся зрелыми и способны участвовать в иммунном ответе.
- IgA сывороточный IgA составляет 15-20 % всей фракции иммуноглобулинов, при этом 80 % молекул IgA представлено в мономерной форме у человека. Секреторный IgA представлен в димерной форме в комплексе секреторным компонентом, содержится в серозно-слизистых секретах (например в слюне, слезах, молозиве, молоке, отделяемом слизистой оболочки мочеполовой и респираторной системы). Содержит 10-12 % углеводов, молекулярная масса 500 кДа.
- IgD составляет менее одного процента фракции иммуноглобулинов плазмы, содержится в основном на мембране некоторых В-лимфоцитов. Функции до конца не выяснены, предположительно является антигенным рецептором с высоким содержанием связанных с белком углеводов для В-лимфоцитов, еще не представлявшихся антигену. Молекулярная масса 175 кДа.
- IgE в свободном виде в плазме почти отсутствует. Способен осуществлять защитную функцию в организме от действия паразитарных инфекций, обуславливает многие аллергические реакции. Механизм действия IgE проявляется через связывание с высоким сродством (10−10М) с поверхностными структурами базофилов и тучных клеток, с последующим присоединением к ним антигена, вызывая дегрануляцию и выброс в кровь высоко активных аминов (гистамина и серотонина — медиаторов воспаления). 200 кДа.
Классификация по антигенам
- антиинфекционные или антипаразитарные антитела, вызывающие непосредственную гибель или нарушение жизнедеятельности возбудителя инфекции либо паразита
- антитоксические антитела, не вызывающие гибели самого возбудителя или паразита, но обезвреживающие вырабатываемые им токсины.
- так называемые «антитела-свидетели заболевания», наличие которых в организме сигнализирует о знакомстве иммунной системы с данным возбудителем в прошлом или о текущем инфицировании этим возбудителем, но которые не играют существенной роли в борьбе организма с возбудителем (не обезвреживают ни самого возбудителя, ни его токсины, а связываются со второстепенными белками возбудителя).
- аутоагрессивные антитела, или аутологичные антитела, аутоантитела — антитела, вызывающие разрушение или повреждение нормальных, здоровых тканей самого организма хозяина и запускающие механизм развития аутоиммунных заболеваний.
- аллореактивные антитела, или гомологичные антитела, аллоантитела — антитела против антигенов тканей или клеток других организмов того же биологического вида. Аллоантитела играют важную роль в процессах отторжения аллотрансплантантов, например, при пересадке почки, печени, костного мозга, и в реакциях на переливание несовместимой крови.
- гетерологичные антитела, или изоантитела — антитела против антигенов тканей или клеток организмов других биологических видов. Изоантитела являются причиной невозможности осуществления ксенотрансплантации даже между эволюционно близкими видами (например, невозможна пересадка печени шимпанзе человеку) или видами, имеющими близкие иммунологические и антигенные характеристики (невозможна пересадка органов свиньи человеку).
- антиидиотипические антитела — антитела против антител, вырабатываемых самим же организмом. Причём это антитела не «вообще» против молекулы данного антитела, а именно против рабочего, «распознающего» участка антитела, так называемого идиотипа. Антиидиотипические антитела играют важную роль в связывании и обезвреживании избытка антител, в иммунной регуляции выработки антител. Кроме того, антиидиотипическое «антитело против антитела» зеркально повторяет пространственную конфигурацию исходного антигена, против которого было выработано исходное антитело. И тем самым антиидиотипическое антитело служит для организма фактором иммунологической памяти, аналогом исходного антигена, который остаётся в организме и после уничтожения исходных антигенов. В свою очередь, против антиидиотипических антител могут вырабатываться анти-антиидиотипические антитела и т. д.
Специфичность антител
Клонально-селекционная теория имеет в виду то, что каждый лимфоцит синтезирует антитела только одной определенной специфичности. И эти антитела располагаются на поверхности этого лимфоцита в качестве рецепторов.
Как показывают опыты, все поверхностные иммуноглобулины клетки имеют одинаковый идиотип: когда растворимый антиген, похожий на полимеризованный флагеллин, связывается со специфической клеткой, то все иммуноглобулины клеточной поверхности связываются с данным антигеном и они имеют одинаковую специфичность то есть одинаковый идиотип.
Антиген связывается с рецепторами, затем избирательно активирует клетку с образованием большого количества антител. И так как клетка синтезирует антитела только одной специфичности, то эта специфичность должна совпадать со специфичностью начального поверхностного рецептора.
Специфичность взаимодействия антител с антигенами не абсолютна, они могут в разной степени перекрестно реагировать с другими антигенами. Антисыворотка, полученная к одному антигену, может реагировать с родственным антигеном, несущим одну или несколько одинаковых или похожих детерминант . Поэтому каждое антитело может реагировать не только с антигеном, который вызвал его образование, но и с другими, иногда совершенно неродственными молекулами. Специфичность антител определяется аминокислотной последовательностью их вариабельных областей.
Клонально-селекционная теория:
- Антитела и лимфоциты с нужной специфичностью уже существуют в организме до первого контакта с антигеном.
- Лимфоциты, которые участвуют в иммунном ответе, имеют антигенспецифические рецепторы на поверхности своей мембраны. У B-лимфоцитов рецепторы- молекулы той же специфичности, что и антитела, которые лимфоциты впоследствии продуцируют и секретируют.
- Любой лимфоцит несет на своей поверхности рецепторы только одной специфичности.
- Лимфоциты, имеющие антиген, проходят стадию пролиферации и формируют большой клон плазматических клеток . Плазматические клетки синтезируют антитела только той специфичности, на которую был запрограммирован лимфоцит-предшественник. Сигналами к пролиферации служат цитокины, которые выделяются другими клетками. Лимфоциты могут сами выделять цитокины.
Вариабельность антител
Антитела являются чрезвычайно вариабельными (в организме одного человека может существовать до 108 вариантов антител). Все разнообразие антител проистекает из вариабельности как тяжёлых цепей, так и лёгких цепей. У антител, вырабатываемых тем или иным организмом в ответ на те или иные антигены, выделяют:
- Изотипическая вариабельность — проявляется в наличии классов антител (изотипов), различающихся по строению тяжёлых цепей и олигомерностью, вырабатываемых всеми организмами данного вида;
- Аллотипическая вариабельность — проявляется на индивидуальном уровне в пределах данного вида в виде вариабельности аллелей иммуноглобулинов — является генетически детерминированным отличием данного организма от другого;
- Идиотипическая вариабельность — проявляется в различии аминокислотного состава антиген-связывающего участка. Это касается вариабельных и гипервариабельных доменов тяжёлой и лёгкой цепей, непосредственно контактирующих с антигеном.
Контроль пролиферации
Наиболее эффективный контролирующий механизм заключается в том, что продукт реакции одновременно служит ее ингибитором. Этот тип отрицательной обратной связи имеет место при образовании антител. Действие антител нельзя объяснить просто нейтрализацией антигена, потому что целые молекулы IgG подавляют синтез антител намного эффективнее, чем F(ab’)2 -фрагменты. Предполагают, что блокада продуктивной фазы T-зависимого B-клеточного ответа возникает в результате образования перекрестных связей между антигеном, IgG и Fc — рецепторами на поверхности B-клеток. Инъекция IgM, усиливает иммунный ответ. Так как антитела именно этого изотипа появляются первыми после введения антигена, то на ранней стадии иммунного ответа им приписывается усиливающая роль.
Рекомендуемая литература
- А. Ройт, Дж. Брюсстофф, Д. Мейл. Иммунология- М.: Мир, 2000 — ISBN 5-03-003362-9
- Иммунология в 3 томах / Под. ред. У. Пола.- М.:Мир, 1988
- В. Г. Галактионов. Иммунология- М.: Изд. МГУ, 1998 — ISBN 5-211-03717-0
См. также
Антитела — это защитные силы организма
Специфические глобулины, образованные организмом под действием антигена, носят название антител. К их особым свойствам относят способность соединения с антигеном, вызвавшим их образование, а также обеспечение защиты организма от воздействия инфекционных возбудителей. Антитела — это нейтрализаторы инфекционных агентов, понижающие восприимчивость последних к воздействию комплемента или фагоцитов.
Различают две категории антител:
- Преципитирующие, или полные. Их взаимодействие с антигеном дает видимый иммунологический процесс, такой как реакции преципитации или агглютинации.
- Неприципитирующие, или неполные. Это категория блокирующих антител. Они не дают видимой реакции в момент соединения с антигеном.
Антитела имеют различный характер воздействия на микроорганизмы: антитоксический, антимикробный и антиклеточный. Существуют антитела, которые нейтрализуют вирусы и обездвиживают спирохеты.
Дифференцируют антитела на те, что склеивают эритроциты (гемагглютинины), растворяют эритроциты (гемолизины) и умерщвляют клетки животных (цитотоксины).
Против собственного белка при разрушениях органов и тканей выступают аутоантитела. Они вырабатываются путем освобождения антигена при изменениях химической структуры организма.
В сыворотке крови можно обнаружить циркулирующие антитела. Это анализ на антитела, проводимый на основании иммунологических реакций, таких как связывание комплемента, преципитации или агглютинации. Он показывает как внутриклеточные, так и связанные с поверхностью клетки, формы.
Иммунитет. Функции антител
В сыворотке крови практически здорового человека содержатся естественные антитела. Это тела, обеспечивающие иммунитет. Их образование, по мнению иммунологов, происходит по трем основным механизмам:
- Генетическая обусловленность без антигенного раздражителя.
- Реакция организма на незначительные атаки инфекций, неспособных вызвать заболевание.
- Ответ организма человека на групповое воздействие микроорганизмов или антигена пищи.
Химическое строение антител
Антитела тесно связаны с фракцией Y-глобулина сывороточного белка. При его отсутствии возникает заболевание агаммаглобулинемия, при котором антитела не вырабатываются организмом. Иммуноглобулины делятся на пять, различных по химической структуре и биологическим функциям, классов: G, A, M, D, E.
Иммуноглобулины класса G, или антитела igG, играют самую важную роль в формировании иммунитета при проявлении различных форм и видов заболеваний.
Накопление антител igG в организме происходит постепенно. В самом начале болезни их количество невелико. Но по мере развития клинической картины, количество антител начинает стремительно расти, обеспечивая защитную функцию организма.
Структура иммуноглобулинов
Структура иммуноглобулина класса G представляет собой молекулу мономера из 4-х полипептидных белковых связей. Это две пары, каждая из которых состоит из одной тяжелой и одной легкой цепи. На окончаниях цепей каждая пара имеет участок, так называемый «активный центр». Центр отвечает за связь с антигеном, вызывающим образование антител. Антитела igG на своих окончаниях имеют по два «активных центра». Следовательно, они являются двухвалентными и способны связывать по две молекулы антигена. Антитела — это нейтрализующий фактор инфекционных проявлений.
Под электронным микроскопом молекула igG имеет форму вытянутого эллипса с тупыми концами. Конфигурация в пространстве активной части антитела напоминает небольшую полость, соответствующую антигенному детерминанту, как замочная скважина соответствует ключу.
открытая библиотека учебной информации
Природа и виды антител.
Антитела — ϶ᴛᴏ молекулы гликопротеидов, которые по своей электрофоретической подвижности относятся к γ- глобулинам и по международной классификации именуются иммуноглобулинами. Οʜᴎ составляют 1/3 всœех белков сыворотки крови (около 16 г/л).
Иммуноглобулины и антитела – синонимы. При этом слово «антитело» чаще используется тогда, когда речь идет об иммуноглобулинœе определœенной специфичности.
Продуцентами иммуноглобулинов являются плазматические клетки.
Все Ат данной специфичности являются продуктами одного клона клеток – антителопродуцентов. Продукты одного клона бывают названы моноклональными антителами. При этом поскольку каждый природный антигенный субстрат представляет собой комплекс антигенов, иммунный ответ на него реализуется несколькими клонами клеток и образованные антитела являются поликлональными. Антитела, которые продуцируются в организме после иммунизации или в результате инфекционного процесса, называются иммунными. Антитела, появление которых не связано с иммунизацией или инфекцией называются нормальнами.
Истинные нормальные антитела – результат неспецифической активации антиген-реактивных клеток цитокинами или другими стимуляторами, формируемыми в ходе иммунного ответа на другие Аᴦ. Нормальные антитела способствуют индукции первичного ответа͵ участвуя в представлении антигена антиген-реактивных клеткам, и усиливают фагоцитоз, направляя действие фагоцитов на микробные и другие клетки, к которым присоединились антитела (опсонизация).
Первичная функция Ат состоит взаимодействии их активных центров комплементарными (гомологичными, соответствующими) им детерминантами Аᴦ.
Вторичная функция Ат состоит в способности их:
а) связывать Аг с целью его нейтрализации и элиминации из организма, т. е. принимать участие в формировании защиты от Аг;
б) участвовать в распознавании «чужого» Аг;
в) обеспечивать кооперацию иммунокомпетентных клеток (макрофагов, Т- и В -лимфоцитов);
г) участвовать в различных формах иммунного ответа (фагоцитозе, киллерной функции, ГНТ, ГЗТ, иммунологической толерантности, иммунологической памяти).
Белки Ig по химическому составу относятся к гликопротеидам, т. к. состоят из протеина и сахаров; построены из 18 аминокислот. Молекулярная масса Ig находится в пределах от 150 – 900 кД. Молекулы Ig имеют цилиндрическую форму, видны в электронном микроскопе. До 80% Ig имеют константу седиментации 7S; устойчивы к слабым кислотам, щелочам, нагревания до 60оС.
Выделить Ig из сыворотки крови можно физическими и химическими методами (электрофорез, изоэлектрическое осаждение спиртом и кислотами, высаливание, аффинная хроматография и др.). Эти методы используют в производстве при приготовлении иммунобиологических препаратов.
Р. Портер и Д. Эдельман установили строение молекулы Ig. По их данным, молекулы Ig всœех 5 классов состоят из полипептидных цепей: двух одинаковых тяжелых цепей Н (от англ. heavy – тяжелый) и двух одинаковых легких цепей – L(от англ. light – легкий), соединœенных между собой дисульфидными мостиками (– С – S – S).
Соответственно каждому классу Ig, т. е. М, G, A, E, D различают 5 типов тяжелых цепей: M (мю), γ (гамма), α (альфа), E (эпсилон) и δ (дельта), имеющих молекулярную массу в пределах от 50 – 70 кД (содержат 420 – 700 аминокислотных остатков) и различающихся по антигенности.
Легкие цепи всœех 5классов являются общими и бывают двух типов:
ϰ (каппа) и λ (лямбда); имеют молекулярную массу 23кД (214 — 219 аминокислотных остатков). Как в Н-, так и L — цепях имеется вариабельная – V (от англ. various – разный) область, в которой последовательность аминокислот непостоянна и константаная – С (от англ. constant – постоянный) область с постоянным набором аминокислот.
При воздействии протеолитических ферментов Ig расщепляется на три фрагмента: два некристаллизующихся, содержащих детерминантные группы к Аг и названных Fad – фрагментами I и II (фрагменты, связывающие Аг) и один кристаллизующийся Fc – фрагмент.Fad и Fc соединœены между собой гибкими участками Н -цепи, благодаря чему молекулы Ig имеют гибкую структуру.
Как Н- цепи, так и L — цепи имеют отдельные, линœейно связанные компактные участки, названные доменами; в Н-цепи их по 4, а в L — цепи – по 2.
Активные центры, или детерминанты, которые формируются в Y – областях, занимают примерно 2% поверхности молекулы. В каждой молекуле имеются две детерминанты, относящиеся к гипервариабельным участкам Н- и L -цепей, т. е. каждая молекула Ig может связать две молекулы антигена. По этой причине Ат являются двухвалентными.
В ответ на введение любого Аг могут вырабатываться антитела всœех пяти классов. Обычно вначале вырабатываются IgM, затем IgG, остальные – IgA, IgE, IgD, – несколько позже.
Ig разных классов отличаются друг от друга биологическими свойствами.
IgG – составляют около 80% сывороточных Ig (в среднем 12г/л), с молекулярной массой 160 000 Д и скоростью седиментации 7. они образуются на высоте первичного иммунного ответа и при повторном введении Аг (вторичный ответ). Οʜᴎ обладают достаточно высокой авидностью, т. е. высокой скоростью связывания с Аг, особенно бактериальной природы (принимают участие в реакциях бактериолиза). IgG являются единственным классом антител, проникающих через плаценту в организм плода.Через неĸᴏᴛᴏᴩᴏᴇ время после рождения ребенка содержание IgG в сыворотке крови падает и достигает минимальной концентрации к 3 – 4 месяцам, после чего начинает возрастать за счет накопления собственных IgG, достигая нормы к 7 – летнему возрасту. Около 48% IgG содержится в тканевой жидкости, в которую он диффундирует из крови. IgG подвергют катаболическому распаду (период полураспада = 21 сут.), который происходит в печени, макрофагах, воспалительном очаге под действием протеиназ.
Известно 4 подкласса IgG (IgG1, IgG2, IgG3, IgG4), различающиеся по структуре тяжелой цепи. Οʜᴎ обладают разной способностью взаимодействовать с комплементом и проходить через плаценту. IgG термостабильны.
IgM – первыми начинают синтезироваться в организме плода и первыми появляются в сыворотке крови после иммунизации людей большинством Аᴦ. Οʜᴎ составляют около 13% сывороточных Ig при средней концентрации 1г/л. По молекулярной массе они значительно превосходят всœе другие классы Ig – 900 000 Д. Это связано с тем, что IgM являются пентамерами, т. е. состоят из 5 субъединиц. IgM не проходят через плаценту и обладают наиболее высокой авидностью. Οʜᴎ термостабильны. Период полураспада 5 суток.
IgA – встречаются в сыворотке крови и в секретах на поверхности слизистых оболочек. В сыворотке крови присутствуют мономеры IgA с константой седиментации 7, в концентрации 2,5 г/л. Данный уровень достигается к 10 годам жизни ребенка. Молекулярная масса 170 000 – 350 000 дальтон, термостабилен. Период полураспада 6 суток. Сывороточный IgA синтезируется в плазмоцитах селœезенки, лимфоузлов и слизистых оболочек. Οʜᴎ не принимают участие в обычных СР, но нейтрализуют Аᴦ.
Секреторные IgA отличаются от сывороточных наличием секреторного компонента͵ который синтезируется клетками секреторного эпителия и может функционировать в качестве их рецептора, а к IgA присоединяется при прохождении последнего через эпителиальные клетки. Секреторные IgA играют существенную роль в местном иммунитете, поскольку препятствуют адгезии микроорганизмов на эпителиальных клетках слизистых оболочек рта͵ кишечника, респираторных и мочевыводящих путей. Οʜᴎ стимулируют местную фагоцитарную защиту. Секреторные IgA препятствуют адсорбции и репродукции вирусов в эпителиальных клетках слизистой оболочки, к примеру при аденовирусной инфекции, полиомиелите, кори. Около 40% общего IgA содержится в крови.
IgD – до 75% IgD содержится в крови, достигая концентрации 0,03 г/л.
Он имеет молекулярную массу 180 000 Д и скорость седиментации 7. Термолабилен. Период полураспада 3 суток. IgD не проходят через плаценту и не связывает комплемент. До сих пор не ясно, какие функции выполняет IgD. Полагают, что он является одним из рецепторов В- лимфоцитов.
IgE – в норме содержатся в крови в концентрации 0,00025 г/л. Молекулярная масса 190 000 Д, скорость седиментации 8 суток, период полураспада 2 суток термолабильны, не проходят через плаценту. IgE синтезируются плазматическими клетками в бронхиальных и перитониальных лимфатических узлах, в слизистой оболочке желудочно- кишечного тракта со скоростью 0,02 мг/кг массы в сутки. IgE называют также реагинами, поскольку они принимают участие в анафилактических реакциях, обладают выраженной цитофильностью.