 [Фибриноген крови превращается в фибрин во время]
[Фибриноген крови превращается в фибрин во время]
Фибриноген и фибрин
Нормальные показатели анализа на фибриноген и фибрин приведены в таблице 43.
Фибриноген
Фибриноген — фактор свертывания крови — вырабатывается паренхиматозными клетками печени и под действием тромбина превращается в фибрин (нерастворимый белок), основной субстрат тромба.
Повышенный показатель
Повышенное значение фибриногена наблюдается при:
• воспалительных и некротических процессах;
• лихорадке;
• инфекционных заболеваниях;
• ожогах;
• травмах;
• хирургических вмешательствах;
• диффузных болезнях соединительной ткани;
• нефрите;
• уремическом синдроме;
Физиологическое повышение значения фибриногена наблюдается при беременности и во время менструации.
• инфаркте миокарда;
• лучевой болезни;
• пароксизмальной ночной гемоглобинурии;
• злокачественных опухолях.
Пониженный показатель
Пониженное значение фибриногена наблюдается при:
• циррозе печени;
• отравлении гепатотропными ядами;
• врожденном дефиците фибриногена;
• ДВС-синдроме;
• состояниях после кровотечения;
• шоковых состояниях;
• кахексии;
• цинге;
• тяжелом токсикозе беременных;
• укусе змей;
• эмболии околоплодными водами;
• действии фенобарбитала, урокиназы и стрептокиназы.
Фибринолитическая активность плазмы
Фибринолитическая активность освобожденной от ингибиторов плазмы — это время, которое необходимо для полного растворения сгустка.
Время устанавливается по лизису эуглобулиновой фракции.
Удлинение времени фибринолитической активности наблюдается при:
• тромбозе;
• геморрагическом васкулите;
• апластических процессах кроветворения.
Сокращение времени фибринолитической активности наблюдается при:
• хирургических операциях на легких, матке, простате, мозге;
• осложнениях после родов;
• шоковых и стрессовых состояниях;
• ацидозе;
• гипоксии;
• сильных физических нагрузках.
Фибриназа
Это фермент, который принимает участие в образовании фибринового сгустка.
Повышение показателя фибриназы (снижение активности) наблюдается при:
• гепатите;
• болезни Лаки — Лорана;
• раке с метастазированием в печень;
• сепсисе;
• миелолейкозе;
• тяжелых операциях.
Пониженный показатель Понижение показателя фибриназы (повышение активности) наблюдается при большом объеме плазмотрансфузий.
Ретракция кровяного сгустка
Это самопроизвольное отделение сыворотки крови от ее сгустка при отстаивании.
Повышенный показатель ретракции кровяного сгустка наблюдается при:
• анемии;
• гиперфибриногемии.
Пониженный показатель ретракции кровяного сгустка наблюдается при:
• эритремии;
• увеличении гематокрита;
• тромбоцитопении;
болезни Верльгофа;
• геморрагической алейкии Франка.
Продукты деградации фибриногена
Наличие продуктов деградации фибриногена наблюдается при:
• легочной эмболии;
• лейкозе;
• злокачественных опухолях;
Для исследования ретракции кровяного сгустка берут венозную кровь, а для определения продуктов деградации фибриногена — свежую сыворотку с добавлением ингибиторов фибринолиза.
• почечной недостаточности;
• болезнях печени;
• состояниях после хирургического вмешательства;
• лечении фибринолитическими препаратами.
Следующая глава
med.wikireading.ru
Большая Энциклопедия Нефти и Газа
Cтраница 1
Превращение фибриногена в фибрин происходит под влиянием тромбина и в отсутствие кальция. Роль ионов кальция или комплексов кальция [61] в первой фазе свертывания еще не вполне ясна. [1]
Ферментативный характер процесса превращения фибриногена в фибрин в настоящее время не вызывает сомнения, однако сущность изменений, которые претерпевает при этом молекула фибриногена, остается до сих пор невыясненной. Есть основания полагать, что переход фибриногена в фибрин, подобно процессу денатурации нативного белка, заключается в развертывании пептидных цепей молекул фибриногена. Вполне возможно, однако, что гепарин влияет на первую фазу процесса свертывания, играя роль антипротромбина. [2]
Свертывание крови обусловлено превращением фибриногена в необратимый гель — фибрин. Этот широко изученный процесс еще не известен во всех подробностях. Превращение фибриногена в фибрин катализируется ферментом — тромбином. [3]
В III фазе происходит превращение фибриногена в фибрин. Этот процесс протекает в 3 этапа. На 1 — м этапе под влиянием тромбина из фибриногена образуется золеобразный фибрингмономер. На 3 — м этапе при участии фактора XIII и фибриназы тканей, тромбоцитов и эритроцитов образуется окончательный или нерастворимый фибрин I. Фибриназа образует прочные пептидные связи между соседними молекулами фибрин-полимера, что цементирует фибрин, увеличивает его механическую прочность и устойчивость к фибринолизу. Образование фибрина завершает образование кровяного тромба. [4]
Другим примером ограниченного протеолиза является превращение фибриногена в фибрин, индуцируемое тромбином. При этом процессе в небелковой фракции обнаруживается около 2 % общего азота фибриногена. Два из этих пептидов содержат N-концевую глутаминовую кислоту, которая, возможно, соответствует остаткам, теряемым фибриногеном при его превращении. [5]
Тромбин участвует в конечной стадии образования кровяного сгустка путем активации превращения фибриногена в фибрин. [6]
При отсутствии витамина К нарушается образование протромбина, необходимого для образования тромбина, способствующего превращению фибриногена в фибрин. [7]
Из цельной крови без защитных добавок при стоянии через несколько минут выделяются хлопья в результате превращения растворимого глобулярного фибриногена в нерастворимый нитевидный белок-фибрин, нити которого образуют ячеистую структуру сгустков. Это превращение происходит под влиянием протромбина и ионов кальция. Центрифугирование свернувшейся крови приводит к отделению смеси фибрина и красных кровяных тел. Надосадочная жидкость представляет собой кровяную сыворотку, которая отличается от плазмы тем, что не содержит фибриногена. Витамин К является антигеморрагическим агентом, так как он снижает концентрацию протромбина. Цитрат и гепарин предупреждают свертывание крови, связывая ионы кальция. [8]
Четкообразная форма волокон фибрина дает основание предполагать, что они образуются путем продольной ассоциации глобулярных частичек и что процесс полимеризации, ведущий к превращению фибриногена в фибрин, заключается в соединении молекул фибриногена конец с концом. Вероятно, структурной единицей сгустка фибрина является ячейка из 10 — 14 молекул фибриногена, соединенных между собой своими концами по продольной оси. В первоначальном рыхлом сгустке фибрина имеется, вероятно, лишь небольшое число боковых поперечных связей. [9]
Таким образом, свертывание крови включает эффективно регулируемую серию превращений неактивных зимогенов в активные ферменты, что в итоге приводит к образованию тромбина и превращению фибриногена в фибрин. [11]
Наиболее важной в биологическом отношении особенностью фибриногена является его способность превращаться при определенных условиях в не растворимый в воде фибрин-белок, имеющий фибриллярное строение. Таким образом, превращение фибриногена в фибрин сопровождается свертыванием крови с образованием сгустка ( или геля), в котором под микроскопом можно рассмотреть сетчатую структуру, состоящую из нитей фибрина; в ячейках этой сетчатой структуры удерживается большое количество жидкости и форменных элементов крови. Через некоторое время образовавшийся сгусток крови подвергается синерезису — фибриновый гель сжимается, из него выдавливается значительное количество сыворотки крови и остается более плотный сгусток, состоящий в основном из тромбоцитов и фибрина. Превращение фибриногена в фибрин происходит при повреждении кровеносных сосудов под влиянием особого белкового вещества, обладающего ферментативной протеолитической активностью, названного Шмидтом фибрин-ферментом, или тромбином. [12]
N лишает последние групповой специфичности. N-ацетилней-раминовая к-та участвует в процессе превращения фибриногена в фибрин. Предполагается также, что наличие больших количеств сиалопротеидов в слизи дыхательного и желудочно-кишечного трактов является защитным фактором в борьбе организма с проникающим инфицирующим агентом. [13]
При авитаминозе К в организме снижается уровень белка протромбина и других факторов, участвующих в процессе свертывания крови. Полагают, что витамин К является активной группой фермента, принимающего участие в синтезе протромбина, способствующего превращению фибриногена в фибрин. [14]
Таким образом, присутствие ионов кальция необходимо и здесь так же, как и при свертывании молока, однако, механизм их действия в этих двух случаях совершенно различен. При свертывании крови ионы кальция участвуют в предварительной реакции образо — — вания активной формы фермента ( тромбина) и, следовательно, без них ферментативная реакция превращения фибриногена в фибрин невозможна. [15]
Страницы: 1 2
www.ngpedia.ru
Фибрин: как образуется, место и функции в организме, норма и отклонения
Содержание:
Фибрин – белок твердый, нерастворимый, состоящий из волокнистых, довольно длинных, нитей. Фибрин — непостоянный в плазме протеин, поэтому просто так он в крови не циркулирует. Своим образованием фибрин обязан неординарной ситуации, активирующей систему гемостаза, как, например, повреждение сосудистой стенки в результате ранения либо, например, воспалительной реакции на участке образования атеросклеротической бляшки. А в кровеносном русле присутствует его предшественник – растворимый фибриноген (первый фактор свертывания крови – FI), который, как и многие другие белки, синтезируется в печеночной паренхиме и в ответ на повреждение кровеносного сосуда под ферментативным воздействием тромбина на ране превращается в фибрин.
Когда необходимость в фибрине отпадает, фибринолитическая система занимается растворением сгустка (фибринолиз). Специалисты полагают, что в крови в постоянном режиме идет процесс превращения какого-то очень небольшого количества фибриногена в фибрин, но эту задачу так же постоянно решает фибринолиз.
Норма на сам фибрин в клинической лабораторной диагностике не существует. Поскольку в норме это вещество в крови не определяется, анализ, изучающий данный показатель, не производят. О количестве и качестве фибрина судят по уровню фибриногена в крови, исследуя также другие факторы свертывающей системы в составе коагулограммы.
Как идет образование фибрина
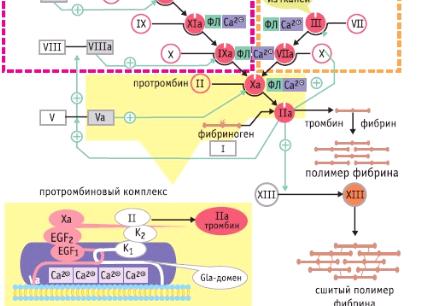
Синтезируемый в печени с участием витамина К растворимый белок фибриноген при кровотечении вступает во взаимодействием с пептидазой, называемой тромбином, которая способствует частичному гидролизу молекул фибриногена, трансформируя в присутствии ионов кальция (Са2+) данный белок в фибрин. В целом, образование фибрина из фибриногена проходит в три этапа:
- Димер фибриногена под действием тромбина подвергается ферментативному расщеплению, отделяя в результате этого процесса по 2 пептида (фибринопептиды А и Б) – идет формирование фибрин-мономера, который строится из двух абсолютно одинаковых субъединиц, соединенных между собой дисульфидными мостиками и состоящих из трех полипептидных цепей (альфа — α, бета — β, гамма – γ);
- Агрегация фибрин-мономера (появление нитей фибрина или фибрин-агрегата – нестабилизированного фибрина), протекающая на второй стадии процесса образования данного вещества, состоит в том, что он (фибрин-мономер) без внешнего воздействия (кроме участия ионов кальция) самостоятельно начинает формировать сверток, результатом этой реакции (полимеризация) становится растворимый фибрин-полимер «S»;
- Воздействие фибринстабилизирующего фактора (FXIIIа), которого приводят в активное состояние ионы кальция и тромбин, завершает реакцию образования нерастворимого фибрина («J»), он «сшивает» между собой отдельные нити фибрина, то есть, окончательно стабилизирует и формирует тромб.
Таким образом, нити фибрина – объединенные молекулы этого вещества. Они, опутывая своей сетью (фибриновая сеть) клетки крови, устремляющиеся в зону аварии (в первую очередь, тромбоциты) или просто циркулирующие в кровеносном русле, дают «фундамент» для строительства губчатой массы, которая становится основой сгустка, закрывающего кровеносный сосуд при его повреждении. Губчатая масса сжимается, твердеет, формируя сам сгусток. Для того, чтобы образованный тромб тут же не разрушился, на данном этапе в процесс вступает фактор, который стабилизирует «пробку» на ране сосуда.
Видео: нити фибрина под микроскопом
Как и где можно увидеть «готовый» фибрин?
Фибрин можно видеть на ране, которая первоначально была гнойной, дренировалась и стала заживать вторичным натяжением. Через некоторое время в процессе выздоровления по краям раны образуется налет белого цвета – это и есть фибрин, который защищает место поражения и формирует будущую ткань. Однако на ране, в которой только-только остановилось кровотечение, фибрин хоть и присутствует, но невооруженным глазом вряд ли будет обнаружен.
Фибрин можно заметить в язве, образованной на коже или слизистых оболочках (например, в язве 12-перстной кишки при эндоскопическом исследовании), причем наличие этого вещества на дне язвы указывает на то, что она уже начала подготовку к заживлению (2 стадия – стадия затихания воспалительного процесса).
Наличие фибрина в мазке из урогенитального тракта (как мужчин, так и женщин), просматриваемом под микроскопом, может указывать на то, что в данном месте идет воспалительный процесс. Однако это — косвенный признак. А для того, чтобы установить (или заподозрить?) диагноз, необходимо полное описание биоценоза, присутствующего в мазке, то есть фибрин в подобных случаях не представляется самостоятельным объектом исследования и для диагностики мало значит.
Еще нити фибрина можно наблюдать в крови, взятой без консервирующего раствора. Сворачиваясь, кровь образует сгусток, выделяя сыворотку. В плазме (кровь, взятая с консервантом) фибриноген сохраняется, чем она и отличается от сыворотки, поэтому плазма не теряет способность к образованию нитей фибрина, что достигается добавлением к данной биологической среде хлорида кальция. Эти методы используются для приготовления гемагглютинирующих сывороток, определяющих группы крови человека.
Функции фибрина
Функции фибрина немногочисленны, однако важность их очевидна:
- При повреждении ткани, сопровождающемся кровотечением, фибриноген сразу же спешит перейти в фибрин – тут же, на ране. Являясь основой сгустка, фибрин способствует остановке кровотечения и тем самым предотвращает потерю драгоценной для организма жидкости;
- Недавно замечено, что фибрин помогает регенерации нервной ткани при ее повреждении, что открывает новые возможности для терапии такого тяжелого патологического процесса, как рассеянный склероз (данное вещество восстанавливает волокна миелина);
- Фибрин оказывает противовоспалительное действие. Находясь в очаге воспаления, он окутывает вредоносные вещества, заключает их в сгусток, чем препятствует дальнейшему продвижению токсинов на здоровые ткани.
А так как образование фибрина идет от фибриногена – первого фактора свертывания крови (FI), который для формирования сгустков в процессе коагуляции из золя превращается в гель (фибрин), то многие функции фибрина будут зависеть от содержания FI в плазме и нарушаться по причине неполноценности (наследственные дис-, гипо-, афибриногенемии), недостатка или избыточного количества его предшественника при поражениях органа его производящего (печень). При снижении концентрации фибриногена появляется угроза опасной для жизни кровопотери. Повышенный уровень предшественника фибрина предрасполагает к образованию ненужных тромбов, их отрыву и миграции по кровеносному руслу, что также нередко приводит к смертельному исходу.
Фибрин и воспаление
Основная функция фибрина – образование свертка и остановка кровотечения, безусловно, не вызывает сомнений в своей значимости, однако роль этого вещества в протекании и завершении воспалительного процесса также немаловажна, но не столь широко известна людям немедицинских профессий, поэтому хотелось бы несколько остановиться на теме: «Фибрин и воспаление».
Образование фибрина идет сразу после контакта фибриногена с тканевой тромбокиназой, высвободившейся из поврежденной (на ране) или разрушенной (в язве) ткани. Эта местная реакция, при которой токсины захватываются фибрином и заключаются в сверток, является адаптивной и называется «реакцией фиксации». Она очень важна для организма, поскольку на самых ранних этапах, еще до того, как белые клетки крови – лейкоциты, «почувствуют», что их ждет место аварии, фибрин создаст заслон вокруг очага, чем будет противодействовать распространению инфекции по всему организму. То есть, следует признать, что немедленно отложенный фибрин по праву может претендовать на весьма важную и нужную защитную роль. А негативные изменения, которые, так или иначе, будут присутствовать на маленьком участке, попробуют взять на себя проблему, защищая от зла другие, более важные органы (внутренние).
Какие же это изменения и как их можно распознать? Довольно легко, ведь каждый из нас неоднократно наблюдал у себя самого, как недавняя, даже небольшая царапина краснеет, опухает, доставляет неприятные ощущения. Это нерастворимый фибрин, образовавшийся в первые минуты аварии, создает значительные трудности для местного кровообращения, а иной раз и вовсе останавливает его. Естественно, место повреждения отекает и болит. Для того, чтобы читателю был понятен весь происходящий на ране или в язве биохимический процесс, попробуем описать его последовательно:
- В момент перехода фибриногена в фибрин (1 стадия образования фибрина), присутствующие в воспалительном очаге ферменты, которые способны подвергать триптическому гидролизу белки, имеющие дисульфидные мостики (фибрин-мономер, как известно, их имеет), уже начинают свою деятельность, выступая в роли ингибиторов воспалительного процесса;
- На 2 стадии (образование фибрин-полимера) триптические ферменты стараются всячески затормозить полимеризацию фибрина. Эти протеазы, расщепляя фибрин и прочие макромолекулы протеинов на более мелкие органические соединения (аминокислоты, пептиды), переводят вязкий густой экссудат, образовавшийся на ране, в более жидкое состояние, кроме этого, они тормозят образование новых крупных, плохо поддающихся растворению молекул;
- Протеолитические ферменты – протеазы (например, плазмин) на этапе репарации запускают механизм разрушения фибриновых сгустков и, таким образом, восстанавливают ткань.
Кстати, благодаря многочисленным и всесторонним исследованиям, было установлено, что введение протеолитических ферментов до того, пока в силу вступит воспалительная реакция на ране, дает возможность препятствовать ее развитию, это значит, что, по сути, получение человеком протеаз извне после различных травмирующих ситуаций является профилактикой воспаления.
По завершению воспалительного процесса на его месте нередко формируются рубцы – это фибрин, образованный на данном участке и сохранившийся в течение длительного времени, дал основу для размножения клеток соединительной ткани.
Содержание фибрина в очаге не должно отклоняться от нормы
Количество фибрина, в котором может нуждаться организм в тот или иной момент своей жизни, зависит от факторов свертывания (протромбин, тромбин, тканевая тромбокиназа и др.), и противосвертывания (протеолитические ферменты, например, плазмин). Обычно образование фибрина идет в количествах, обеспечивающих восстановительный период, но не мешают процессу заживления.
Недостаток фибрина в зоне поражения ничего хорошего организму не сулит:
- Площадь очага воспаления расширяется, поскольку нет надежной фибриновой изоляции;
- Заживление медленное («вторичным натяжением»);
- Образование некрасивых рубцов;
- Возможны кровотечения, если образование фибрина связано с нарушением в свертывающей системе крови.
Между тем, бывают и такие случаи, когда накопление фибрина превосходит потребности, а фибринолиз запаздывает, что также может повлечь развитие других патологических процессов:
- Воспалительная реакция начинается и идет более остро, сопровождаясь резкой болью, быстрым распространением отека, полным прекращением кровотока в зоне поражения;
- Закупоренные микротромбами кровеносные сосуды сдавливаются;
- Нарушается фагоцитоз, массово гибнут клетки;
- Заживление задерживается.
Такое состояние поврежденной ткани в условиях замедленной работы фибринолитической системы может обернуться обширным некрозом с образованием язв, а затем келоидных рубцов, нарушающих функциональные способности ткани. Опасным итогом подобных событий является ишемия и тромбоз. Кроме этого, излишнее образование фибрина на стенке артериального сосуда может стать причиной формирования бляшек.
Перейти в раздел:
- Заболевания крови, анализы, лимфатическая система
Шаг 1: оплатите консультацию с помощью формы → Шаг 2: после оплаты задайте свой вопрос в форму ниже ↓ Шаг 3: Вы можете дополнительно отблагодарить специалиста еще одним платежом на произвольную сумму ↑
sosudinfo.ru
ПОИСК
Кровяная плазма, полученная по описанной выше методике, представляет собой жидкость, слегка окрашенную каротиноидамн, и содержит следующие белки альбумины (растворимы в 5%-ном солевом растворе), липопротеины, фибриноген и протромбин. Из цельной крови без защитных добавок при стоянии через несколько минут выделяются хлопья в результате превращения растворимого глобулярного фибриногена в н< растворимый нитевидный белок—фибрин, нити которого образуют ячеистую структуру сгустков. Это превращение происходит под влиянием протромбина и ионов кальция. Центрифугирование свернувшейся крови приводит к отделению смеси фибрина и красных кровяных тел. Надосадочная жидкость представляет собой кровяную сыворотку, которая отличается от плазмы тем, что не содержит фибриногена. Витамин К является антигеморрагическим агентом, так как он снижает концентрацию протромбина. Цитрат и гепарин предупреждают свертыванис крови, связывая ионы кальция. [c.670] Главное звено в свертывании крови — превращение растворимого белка фибриногена (фактор 1) под действием тромбина в фиб-рин-мономер, а затем путем полимеризации последнего — в нерастворимый фибрин-полимер. Фибриноген — высокомолекулярный белок, состоящий из грех пар неидентичных субъединиц — аА, рВ и Yi т. е. его структура (aA,fiB,v)2. Совокупность физико-хими-ческих данных позволила С. Халлу и X. Слэйтеру предложить модель пространственной организации фибриногена (рис. 134). [c.234]
После отщепления пептидов, получивших название фибрин-пептиды , фибриноген превращается в хорошо растворимый в плазме крови фибрин-мономер, который затем быстро полимеризуется в нерастворимый фибрин-полимер. Превращение фибрин-мономера в фибрин-полимер протекает с участием фибринстабилизирующего фактора—фактора ХП1 в присутствии ионов Са . [c.605]
Кровь млекопитающих и человека, выпущенная из сосудов, при 37 С свертывается в течение 3—5 мин. При этом фибриноген свертывается с образованием фибрина. Превращение фибриногена в фибрин — ферментативный процесс, катализируемый специальным ферментом — тромбином. Тромбин сам по себе в крови отсутствует. Он образуется из своего неактивного профермента — протромбина. [c.520]
Из изложенного видно, что свертывание крови является сложным ферментативным процессом, в котором, наряду с фибриногеном, участвуют проферменты, превращающиеся в ферменты (протромбин-тромбин, тромбопластин, специфические глобулины и иные факторы). Наличие многих факторов, участвующих в превращении фибриногена в фибрин, указывает на сложность процесса свертывания крови. Благодаря регуляторным механизмам кровь свободно течет по сосудам и не подвергается свертыванию. Ранение кровеносных сосудов приводит к сдвигам в системах, прямо или косвенно участвующих в свертывании крови. В результате этого образуется тромб, препятствующий утечке крови из сосудов. [c.522]
Все протеолитические ферменты — фактор ХИа, фактор Х1а, фактор 1Ха, фактор Vila, фактор Ха и тромбин — ингибируются ДФФ, который для этого реагирует с определенным остатком серина в их молекулах. Аминокислотные последовательности вокруг этого остатка серина и других фрагментов, участвующих в образовании активного центра, почти одинаковы у факторов 1Ха, Ха, ХПа, тромбина и панкреатических эндопептидаз. N-концевые последовательности, освобождающиеся при активации зимогенов, также гомологичны с таковыми панкреатических протеиназ (табл. 3.3). Эти данные, а также сопоставление полных аминокислотных последовательностей тромбина [39], фактора X [40] и фактора IX [41] свидетельствуют о том, что факторы свертывания крови (синтезируемые в печени) и панкреатические протеиназы произошли от общего белка-пред-щественника и функционируют по одинаковому каталитическому механизму. Можно полагать, что структурные перестройки, происходящие при активации зимогенов после разрыва связи, также сходны между собой. При превращении фактора X в Ха, катализируемом фактором 1Ха или фактором УПа, происходит расщепление такой же связи Arg-Ile, как и у других зимогенов [42]. Превращение фактора IX в 1Ха, осуществляемое фактором Х1а, начинается с расщепления связи Arg-Ala, однако это еще не приводит к активации она наступает лишь при последующем расщеплении связи Arg-Ile. При переходе протромбина в тромбин вначале расщепляется связь Arg-Thr (без активации), а затем связь Arg-Ile, это приводит к активации. Для того чтобы превратить фибриноген в фибрин, тромбин расщепляет четыре связи Arg-Gly, а для превращения фактора XIII в Xllla —одну связь Arg-Gly. [c.52]
Освобождение молекулы фибриногена от отрицательно заряженных фибринопептидов А и В и образование мономера фибрина. Превращение фибриногена (фактор 1) в фибрин (фактор 1а) катализирует фермент тромбин (фактор 11а). Тромбин является сериновой протеазой и разрывает 4 пептидные связи аргинил—глицил в фибриногене, [c.318]
Фибрины. В кровяном русле постоянно циркулирует растворимый белок — фибриноген. Если повредить артерии или вены, начинается цепь реакций, приводящая к превращению этого растворимого белка в нерастворимый фибрин. Фибрин образуется в крови при возникновении тромбов. [c.331]
Тромбин. Превращение фибриногена в фибрин под действием тромбина является примером ограниченного протеолиза, затрагивающего только две или три связи примерно из 3000 связей фибрина и приводящего к образованию двух полипептидов, которые были охарактеризованы [18, 30]. Оба полипептида содержат аргинин. Поскольку тромбин гидролизует синтетические субстраты, например метиловый эфир то-луолсульфонил-/-аргинина [285], был сделан вывод, что в фибриногене происходит расщепление аргинильных связей. Однако лизин в одном из. пептидов может участвовать в образовании разрываемой связи, так как субстратами тромбина являются как этиловый эфир лизина, так и лизилаланиноаая связь в цепи Б окисленного инсулина [95]. Протеолитического действия тромбина на овальбумин и миозин кролика не было обнаружено [18]. [c.213]
Превращение фибриногена в фибрин. Фибриноген — это гликопротеин, который синтезируется в печени и содержится в плазме крови в концентрации 8,02—12,9 мкмоль/л (0,3 г/л). Молекула фибриногена состоит из 6 полипептидных цепей, которые связаны друг с другом дисульфидными связями. [c.317]
При свертывании крови растворимый глобулиноподобный белок плазмы крови — фибриноген (изоэлектрическая точка при pH 5,4) превращается в нерастворимый белок — фибрин (изоэлектрическая точка при pH 6,6). В норме в плазме крови около 0,3% фибриногена. Его превращение в фибрин, по-видимому, сходно с реакциями гидролитического расщепления и происходит при участии фермента тромбина. В плазме крови, циркулирующей в сосудах, находится неактивная форма тромбина — протромбин (тромбоген, претромбин не применяется). Для образования активного тромбина необходимо взаимодействие, по крайней мере, трех компонентов 1) неактивного протромбина (тромбогена), 2) тромбокиназы, находящейся [c.218]
К глобулинам относится и фибриноген, молекулы которого состоят из трех шаровидных частиц, соединенных пептидными нитями. При свертывании крови в результате сложного процесса фибриноген превращается в фибрин, состоящий из длинных нитей. Свертываясь, эти нити образуют сгусток, останавливающий кровотечение. В превращении фибриногена в фибрин принимает участие другой белок, являющийся ферментом и носящий название тромбина. Тромбин в свою очередь получается из глобулино-Бого белка протромбина, причем для протекания этого процесса требуется присутствие ионов кальция. [c.63]
Образование студня наблюдается, как известно, при свертывании крови, однако этот процесс не связан с денатурацией. При свертывании крови растворимый белок фибриноген превращается в нерастворимый фибрин. Этот процесс превращения связан с действием тромбин-фермента. Молекулы фибриногена сами по себе к образованию студня не способны. Тромбин-фермент расщепляет специфически несколько пептидных связей у фибриногена и оголяет у него некоторые реактивные центры. Взаимодействуя при встрече этими реактивными центрами, молекулы видоизмененного фибриногена, как показали В. А. Белицер и Е. Л. Ходорова (1950—1952 гг.), образуют сетку фибрина. В образовавшемся сплошном студне быстро наст шает синерезис. [c.301]
Ферментативный характер процесса превращения фибриногена в фибрин в настоящее время не вызывает сомнения, однако сущность изменений, которые претерпевает при этом молекула фибриногена, остается до сих пор невыясненной. Есть основания полагать, что переход фибриногена в фибрин, подобно процессу денатурации нативного белка, заключается в развертывании пептидных цепей молекул фибриногена. При этом развертывании обнажаются положительные и отрицательные группы молекул фибриногена, которые, взаимодействуя между собой, образуют сеть из фибриновых молекул отдельные цепи этой сети связаны солевыми мостиками [70], В пользу этого взгляда говорит торможение образования сгустка фибрина всеми теми веществами, которые обладают способностью соединяться с положительно или отрицательно заряженными группами белковой молекулы к такого рода веществам следует отнести гепарин и формальдегид, реагирующие с аминогруппами [70], а также основные краски, обладающие способностью присоединяться к кислотным группам фибриногена [71]. Вполне возможно, однако, что гепарин влияет на первую фазу процесса свертывания, играя роль антипротромбина. Если превращение фибриногена в фибрин действительно представляет собой процесс денатурации, то тромбин следует отнести к денатуразам [72], т, е. к ферментам, катализирующим разрыв слабых связей между отдельными пептидными цепями. В пользу той же гипотезы свидетельствует и то, что при действии тромбина на фибриноген в последнем [c.183]
С помощью ряда опытов была выяснена роль углеводов в превращении фибриноген — фибрин. Цара и Багди [175] показали, что в процессе превращения фибриногена в фибрин происходит частичная потеря гексоз. Так, если бычий фибриноген содержал 1,6% гексоз, то образовавшийся из него фибрин — 1,3% гексоз. Те же величины были получены для кроличьего фибриногена и фибрина. Чандрасекар и др. [176] нашли, что бычий фибриноген при свертывании терял около 18% (эквивалентно 1,2 остатка) сиаловой кислоты. Однако отщепляющаяся при свертывании фибриногена сиаловая кислота выделяется в связанной форме, так как ее можно определить методом с использованием тиобарбитуровой кислоты только после кислотного гидролиза. Кроме того было найдено, что при обработке фибриногена нейраминидазой отщепляется вся сиаловая кислота, и после этого свертывание фибриногена происходит значительно быстрее. Лаки и ]Иестер [177] окисляли бычий фибриноген разбавленным перйодатом при pH 7,0 и нашли, что окисление фибриногена сопровождалось параллельной потерей свертываемости. Через 2 час после начала окисления от фибриногена отщеплялось 30% гексоз и 43% сиаловой кислоты при этом свертываемость уменьшалась на 50%. Условия проведения опыта исключали окисление аминокислот. Было установлено, что тромбин не действует на окисленный фибриноген и не катализирует отщепление от фибриногена каких-либо пептидов. [c.254]
Кровь, вытекающая из раны, соприкасается с воздухом и смещивается с вешествами, вьще-ляющимися из поврежденных клеток и разрушенных тромбоцитов. К числу таких веществ относятся в частности 1) тромбопластин — липопротеин, который высвобождается из по-врежденньгх тканей 2) факторы свертывания VII и X, представляющие собой ферменты плазмы 3) ионы кальция. Все вместе эти вещества катализируют превращение растворенного в плазме белка протромбина в тромбин, представляющий собой активную протеазу, т. е. фермент, расщепляющий белки. Тромбин гидролизует фибриноген (другой растворенный в плазме белок) с образованием фибрина. Фибрин нерастворим и имеет волокнистую структуру. Волокна фибри- [c.171]
Многие полипептиды и белки синтезируются в виде цепей, имеющих большее число аминокислотных остатков, чем конечные функционально-активные структуры, присутствующие в клетке или секретируемые в кровь и другие жидкости организма. Так называемый процессинг этого предшественника с образованием более короткого белка осуществляется с участием ряда протеолитических ферментов. Здесь будет приведено лишь несколько примеров таких превращений, более подробная информация представлена в последующих главах. Один из примеров зимогенов (неактивных предшественников протеолитических ферментов) —трипсиноген, который при гидролизе одной пептидной связи превращается в активный фермент — трипсин (гл. 8). Фибриноген представляет собой растворимый белок плазмы крови, превращающийся в результате протеолиза в нерастворимый фибрин кровяных сгустков, предохраняющих организм от больших потерь крови при поражении кровеносных сосудов (гл. 29). Проинсулин, состоящий из одной полипептидной цепи с внутримолекулярными дисульфидными мостиками, в результате протеолиза дает активный инсулин, состоящий из двух пептидных цепей и образующийся за счет выщеплепия внутреннего пептидного сегмента из полипептидной цепи предшественника (гл. 46). Наконец, состоящий из трех цепей нерастворимый фибриллярный белок, коллаген, образуется в результате протеолитического расщепления предшественников, имеющих более длинные аминокислотные последовательности (с дополнительными пептидными сегментами в Nh3- и СООН-концевых частях), чем цепи коллагена (гл. 38). Эти примеры иллюстрируют также возможные пути участия протеаз в контроле биологических процессов. [c.200]
Тромбопластин (тромбокиназа) имеет, вероятно, энзиматичб скую природу. Принимает участие в превращении протромбина в тромбин в крови. Тромбин в свою очередь действует как энзим, превращая фибриноген циркулирующей крови в нерастворимый фибрин кровяного сгустка. Препараты, содержащие тромбопластин, получают из экстрактов мозга. Эти экстракты применяются местно (смачивание или орошения) для приостановления кровотечения, особенно при кровоточащих поверхностях, а также в зубной практике, после экстракции. [c.336]
Другим примером ограниченного протеолиза является превращение фибриногена в фибрин, индуцируемое тромбином. При этом процессе в небелковой фракции обнаруживается около 2% общего азота фибриногена. В течение некоторого времени считали, что этот азот принадлежит гомогенному пептиду, названному фибринопептидом [475]. Однако сейчас кажется более вероятным, что при этом образуются четыре пептида [476], отщепление которых может оставить на молекуле фибрина четыре шрама (четыре N-концевых глициновых остатка, которых нет в фибриногене). Два из этих пептидов содержат N-концевую глутаминовую кислоту, которая, возможно, соответствует остаткам, теряемым фибриногеном при его превращении. [c.185]
Фибриноген образуется в печени. Содержание его в плазме крови человека составляет около 0,35%. При забо,деваниях печени содержание фибриногена в крови понижается (гипофибриногенемия). Фибриноген осаждается из плазмы на холоду при добавлении к ней до полунасыщения хлористого натрия или же до четверти насыщения сернокислого амлюния и некоторыми иными солями. Осаждается он также из плазмы при —3°—0° С 10-процентным раствором этилового спирта. Молекулярный вес фибриногена человека равен около 330 ООО. Фибриноген, как улНекоторые другие ферменты (протеолитические), как папаин и ферменты змеиного яда, также вызывают превращение фибриногена в фибрин. [c.520]
III. Превращение фибриногена в фибрин Фибриноген > Фибринпептид-f Фибрин [c.523]
На рис. 7.2 представлены результаты изучения литического действия комплексов иммобилизованного гепарина на неста-билизированный фибрин [60]. Из этого рисунка видно, что и по характеру литического действия иммобилизованный гепарин мало отличается от гепарина в растворе наиболее активными реакции лизиса являются комплексы иммобилизованного гепарина с фибриногеном и тромбином. Замедление скорости лизиса по мере протекания реакции позволило авторам работы [58] предложить наиболее вероятный механизм этого явления, который заключается в связывании комплексами иммобилизованного гепарина растворимого фибрин-мономера (равновесная концентрация этого вещества составляет 6,3-10 моль/л) с по- следующим превращением связанного фибрин-мономера в неспособные вступать в дальнейшую полимеризацию с образованием фибрина соединения. При этом в результате обратимости перехода фибрин-мономера в нестабилизированный фибрин рав- [c.260]
chem21.info