 [Эхограмма почки с патологией эхонегативного характера]
[Эхограмма почки с патологией эхонегативного характера]
Диагностика заболеваний почек (УЗИ
Абсцесс почки может возникнуть самостоятельно и тогда в своем инволютивном процессе проходит три фазы: фазу острого воспаления, гнойного расплавления и хронического течения или вследствие гнойного расплавления инфильтрата при остром пиелонефрите – слияния нескольких гнойничков, абсцедирования карбункула и гематомы. Могут встречаться единичные и множественные.
В острой фазе это округлое, более низкой эхогенности, чем окружающая паренхима, очаговое образование разных размеров. Зона паренхимы в этой фазе не претерпевает структурных изменений.
В зависимости от локализации абсцесс может несколько выбухать над контуром почки или сдавливать лоханку. При небольших абсцессах почка сохраняет нормальную величину, при больших и множественных почка увеличена, капсула утолщена и вокруг нее лоцируется низкоэхогенная зона инфильтрации паранефральной клетчатки (признак вторичного паранефрита).
В фазе гнойного расплавления происходит образование полости с нечеткими прерывистыми контурами, содержимое которой низкоэхогенно, с точечными или линейными эхогенными включениями.
В хронической фазе вокруг абсцесса формируется толстая неравномерно эхогенная капсула, содержимое сочетает плавающие сигналы низкой и высокой эхогенности, иногда наблюдаются два разной эхогенности уровня (плотный и жидкий слои гноя). В редких случаях полость абсцесса сморщивается и кальцифицируется.
Хронический пиелонефрит
При хроническом пиелонефрите почка может иметь обычные размеры или быть несколько уменьшенной вследствие нефросклероза. Зона паренхимы сужена, содержит разной величины эхосигналы от мелких и крупных рубцов и кальцификатов. Лоханка расширена, стенки неравномерно расширены, ригидны, не реагируют на водную нагрузку. В ряде случаев в толще паренхиме или на поверхности почки лоцируются мелкие, до 2 см, жидкостные образования, так называемые вторичные кисты, которые иногда трудно отличить от губчатой и поликистозной почки.
Пионефроз
Пионефроз – это конечная стадия специфического или неспецифического гнойно-деструктивного воспалительного процесса, чаще является исходом хронического вторичного пиелонефрита, мочекаменной болезни, аномалий или других обструктивных процессов мочевых путей.
Почка лоцируется как мешковидное образование с неровными выпуклыми контурами, неравномерной эхогенности, обусловленной характером гнойного содержимого. Гнойное расплавление почки может быть тотальное, и тогда трудно дифференцировать его от гидропионефроза, или в виде отдельных полостей, заполненных гноем, распадом и мочой, которые трудно дифференцировать от парапельвикальных кист небольших размеров, от кист или заблокированных чашечек, каверн в фазе деструкции и др. Зона паренхимы сужена, оттеснена к периферии в виде утолщенной полоски повышенной эхогенности. Стенка коханки неравномерно утолщена, содержимое низкой эхогенности, но со множеством эхогенных сигналов разной интенсивности.
Гломерулонефрит
При гломерулонефрите всегда присутствует двухстороннее диффузное поражение обеих почек, может протекать остро и хронически. Эхографическая диагностика очень затруднена, так как отсутствуют какие-либо четкие критерии, позволяющие дифференцировать его, в первую очередь, от нефрита другой этиологии и пиелонефрита. Однако следует отметить, что при обследовании больных с клинически и лабораторно установленным диагнозом острый гломерулонефрит, классический вариант, было отмечено, что зона паренхимы расширена больше, равномерно, диффузно отечна и почти всегда низко- или анэхогенна, по-видимому, это связано со значительным поражением капиллярной системы почек.
При пиелонефрите отечность зоны паренхимы отличается неравномерным распределением сигналов разной акустической плотности (мелкозернистость), что объясняется наличием большого количества мелких абсцессов, и, кроме того, всегда вовлекаются в процесс лоханки и чашечки, а у детей – и пирамиды. Возможно вовлечение в процесс околопочечной клетчатки.
Эхографически также трудно дифференцировать нефросклероз при хроническом пиелонефрите от нефросклероза при терминальной стадии гломерулонефрита.
Первостепенное значение в дифференциальной диагностике пиелонефрита и гломерулонефрита, как в острой, так и в хронической стадии, принадлежит клинической картине, которая значительно ярче при последнем заболевании.
Специфические воспаления
Специфические заболевания почек возникают вследствие их вторичного инфицирования основными заболеваниями, среди которых анаэробная инфекция, септицемия, хронический сепсис, бактериальный эндокардит, сахарный диабет, ряд инфекционных заболеваний, таких, как геморрагическая лихорадка, малярия, холера, скарлатина, актиномикоз, сифилис, туберкулез и др.
При анаэробной инфекции в паренхиме увеличенной почки и в околопочечной клетчатке лоцируются пузырьки газа в виде высокоэхогенных, сильно светящихся, разных размеров округлых образований и очаги некроза низкой эхогенности.
При септических состояниях вначале почка увеличена в размере за счет расширения зоны паренхимы, которая имеет низкую эхогенность. В дальнейшем на фоне низкой эхогенности паренхимы лоцируются очаги некроза от мелких до крупних (слабо- или анэхогенные образования).
При вышеперечисленных инфекционных болезнях почки всегда страдают, и эхографическая картина характерна для нефрита, то есть почка может быть увеличенной, зона паренхимы несколько расширяется, низкоэхогенна.
Особо надо отметить актиномикоз, при котором почки поражаются в виде мелких очагов нагноения, из которых могут формироваться крупные абсцессы.
Очень выражено перифокальное воспаление, которое может привести к склерозированию и деформации органа. В процесс всегда вовлекается околопочечная клетчатка. Эхокартина мало отличается от банального абсцесса. Единственное отличие – при актиномикозе процесс протекает очень вяло.
Для туберкулеза чаще характерно одностороннее поражение почек в виде цилиарных туберкулом – мелких низкоэхогенных очагов (фокальный некротизирующий гломерулонефрит), в большинстве случаев процесс заканчивается заживлением и образованием петрификатов, с чем в большинстве случаев и встречается эхографист. Но часть очагов (гранулем) может распасться, и, проникая в мозговое вещество, они развертывают процесс язвенно-некротического поражения, каверны лоцируются как овальное, очерченное, разных размеров, вначале низко- или анэхогенное округлое образование. В процессе инволютивного развития внутренние структуры полости становятся эхогенными и таковой становится вся каверна. При прогрессировании процесса некротизации полость расширяется и заполняется слабо- или анэхогенным содержимым (гной), то есть развивается пионефроз, которыйэхографически не отличается от такового при неспецифическом воспалении.
После лечения туберкулеза почка уменьшена в размере, деформирована, капсула высокоэхогенна, зона паренхимы неравномерно сужена, разной степени эхогенности, лоцируется множество мелких и крупных кальцификатов, стенки лоханки неравномерно утолщены, ригидны. Лоханка и чашечки могут быть расширены, последние из-за их блока. Редко туберкулезный процесс заканчивается вторичным амилоидозом. При этом почка лоцируется как размытое эхогенное образование, при котором теряется специфичность строения почки, то есть не удается выделить зону паренхимы и чашечно-лоханочной системы.
Читайте также: Эхографическое исследование мышц человека
Эхинококкоз почек
Эхинококковое поражение почек встречается довольно редко и чаще сочетается с эхинококковым поражением других органов. Эхографическая картина мало отличается от таковой в других паренхиматозных органах.
Как правило, поражается одна почка, в редких случаях – обе. Кисты и альвеолярная опухоль могут располагаться поверхностно и внутри органа.
Чаще встречается гидативная форма однокамерного эхинококка в виде округлого жидкостного (анэхогенного) образования с нежной капсулой, ничем не отличается от простой кисты, и лишь после его гибели стенка эхинококковой кисты несколько утолщается, а на фоне жидкости лоцируются во взвешенном состоянии эхосигналы. Если после гибели эхинококка прошло много времени, то стенка значительно утолщается, кальцифицируется, сморщивается и оставляет акустический эффект ослабления дальнего контура, а внутреннее содержимое кисты становится разной эхогенности, вплоть до высокой.
Многокамерный гидативный эхинококк встречается крайне редко, и его следует дифференцировать от мультнкнстозной и поликистозной почки (особенно если почка представляет из себя несколько больших кист).
Альвеолярный эхинококк встречается крайне редко. На эхограмме это чаще всего высокоэхогенное опухолевидное образование, вначале овальной, с нечеткими контурами формы. Но потом он инфильтрирует ткань в виде псевдоподий, принимает неправильную форму, поэтому бывает очень трудно дифференцировать его от солидной опухоли, если в других органах не найдено эхинококковое поражение.
В центре эхинококковой кисты иногда обнаруживается зона низкой эхогенности – зона распада. После гибели эхинококка вся эхинококковая опухоль имбибируется кальцием и кальцифицируется. Эхографическая диагностика обеих форм затруднена, так как, к сожалению, не существует качественных критериев дифференциальной диагностики однокамерных эхинококковых кист от простих и гидронефроза III и терминальной стадий, а также опухолей от альвеолярного эхинококка. Единственное отличие заключается в том, что простые кисты и гидронефроз по сравнению с гидативной кистой редко претерпевают инволютивные морфологические изменения, а значит редко меняют эхографическую картину.
Альвеолярный эхинококк по сравнению со злокачественной опухолью медленнее инфильтрирует близлежащие ткани. В диагностике помогают специфические иммунологические пробы, которые в 90% случаев положительны лишь при живом эхинококке.
Мочекаменная болезнь
Одной из наиболее часто встречаемых патологий почек, которая поражает все возрасты, является мочекаменная болезнь. Ее распространение во многом зависит от географического региона, характера питания, обмена веществ, качества питьевой воды и наследственного фактора.
В частности, в Молдове, где вода содержит большое количество солей кальция, частота обнаружения скоплений солей мочевой кислоты, мелких и больших камней, по нашим данным, составляет 95-97%. Примерно одинаково поражаются оба пола. По сравнению с мужчинами у женщин чаще обнаруживаются большие камни, притом в правой почке. Это связано с длительным застоем мочи в почках при беременности. Однако, несмотря на столь высокую распространенность, мочекаменное поражение клинически проявляется лишь у 1/3 пациентов в виде почечной колики и пиелонефрита.
Эхография в реальном масштабе времени является бесценным диагностическим методом выявления мочекаменного поражения почек (почти 100% точность).
По многим параметрам превосходит рентгенологические методы исследования.
Основным преимуществом является возможность эхолокации скоплений солей мочевой кислоты по ходу почечных сосочков в виде островков повышенной эхогенности или диффузного накопления точечных сигналов высокой эхогенности, мелких, 1-2 мм, и больших камней, независимо от формы и химического состава.
Для улучшения их визуализации следует применять водную нагрузку (4 стакана воды за 1-1.5 часа до исследования), которая способствует увеличению гидрофильности паренхимы почки, водной нагрузки на чашечки и лоханки.
На эхограмме камни почек лоцируются в виде высокоэхогенных, четко контурированных образований, некоторые из них (высокоплотные) оставляют акустическую тень. По характеру отражения эхосигналов можно определить степень их плотности.
У детей, начиная с новорожденных (возможно и во внутриутробном периоде, с 26 недель), но чаще с 3-5-летнего возраста, выявляются скопление солей мочевой кислоты в виде островков повышенной эхогенности и мелкие камни в виде точечных эхосигналов, которые могут располагаться как в паренхиме, так в чашечках и лоханках. Такую эхографическую картину мы описывали как мочекислый диатез. Доказательством правильности нашего заключения служили клинические проявления в виде болей в брюшной полости, почечной колики, частых болезненных мочеиспусканий и ночного недержания мочи, а также отхождение камней и большого количества песка после приема урикозурических средств, спазмолитиков, водной нагрузки и положительные результаты при проведении курсов санаторно-курортного лечения.
Эходиагностика больших камней не представляет трудности, так как в большинстве случаев они располагаются в чашечках и лоханках, на фоне жидкости хорошо контурируются как эхопозитивные образования, которые в большинстве случаев оставляют акустическую тень.
Единственным недостатком эхографии является то, что не всегда можно определить является большой камень цельным или состоит из нескольких склеенных камней и точное место его расположения. В настоящее время этот пробел восполнен применением эхографии интраоперационно.
Камни мочеточников
В связи со спецификой анатомического строения эхографическая диагностика камней мочеточников значительно затруднена. Она возможна лишь на значительно расширенных отрезках мочеточников, в частности в верхней и нижней трети, примерно на расстоянии 5-6 см от лоханки или от устья мочевого пузыря.
Исследование осуществляется со стороны спины, передней брюшной стенки, через правый или левый бок при полном мочевом пузыре на высоте вдоха. Лучшие результаты по выявлению камней получены при исследовании мочеточников через брюшную стенку, на боку и у худых пациентов. В методике обнаружения камней в мочеточнике присутствуют прямые и косвенные признаки.
Прямые признаки
Четкая визуализация камня на каком-либо отрезке мочеточника и его расширение выше места расположения камня, а при его полном блоке – расширение лоханочно-мочеточникового сегмента, лоханки и чашечек. Следует отметить, что камни мочеточников – это небольшие эхопозитивные, четко контурированные образования, очень редко оставляющие акустическую тень, так как чаще всего они состоят из склеенных песчинок уратов и фосфатов. Акустическую тень оставляют лишь оксалаты больше 8-10 мм, и то не всегда.
Читайте также: Ультразвуковое исследование паращитовидных желез
Косвенные признаки
Расширение лохано-мочеточникового сегмента, лоханки, чашечек и отсутствие их реакции на водную нагрузку, то есть степень гидронефроза и гидрокаликоза, при повторном осмотре после мочеиспускания не меняется (полная обструкция мочеточника). Зона паренхимы расширяется и становится гидрофильной (низкой эхогенности) – признаки застойного пиелонефрита. Место обструкции не удается выявить. Это состояние в основном встречается при значительном метеоризме и у тучных больных.
Первостепенное значение в диагностике камней мочеточников и установлении точного места нахождения камня принадлежит рентгенографии. Эхография как очень быстрый метод исследования должна применяться на начальном этапе клинического проявления с целью селекции больных для проведения урографии.
Опухоли почек
Опухоли почек раньше встречались редко, но в последнее время стали встречаться чаще и в наших наблюдениях составили 5.6% от всех новообразований. Оба пола страдают примерно одинаково, чаще лица в возрасте 35-55 лет, очень редко в пожилом и старческом возрасте. Обычно опухоли поражают одну почку и очень редко обе. В наших 23-летних наблюдениях двухстороннее поражение было выявлено у 5 пациентов, притом у двух из них в одной почке была первичная злокачественная опухоль, а во второй – метастатическая злокачественная опухоль.
Опухоли почек делятся на доброкачественные и злокачественные, поражающие паренхиму и лоханки почки.
Диагностика и дифференциация опухолей значительно затруднены и длительное время осуществлялись лишь клинико-рентгенологическими методами, имеющими ряд недостатков и ограничений. С внедрением эхографии появилась надежда на значительное улучшение диагностики опухолей почек, однако из-за отсутствия специфических эхографических признаков опухолей остался нерешенным вопрос ранней и дифференциальной диагностики нозологических форм опухолей, но она может быть осуществлена при помощи направленной пункционной биопсии под контролем эхографии, что невозможно сделать рентгенологически.
Опухоли почечной паренхимы
Из доброкачественных опухолей паренхимы чаще встречаются липома, аденома, фиброма, ангиома и гемангиома, лейомиома, лимфангиома и дермоиды.
К сожалению, как уже было отмечено, нозологически практически невозможно их дифференцировать.
На эхограмме это небольших размеров образования округлой или овальной формы с четкими контурами, слабоэхогенные или анэхогенные. Иногда их эхоструктура плохо или почти не дифференцируется от структуры паренхимы. Легче диагностируются хорошо васкуляризированные и кистозного строения опухоли.
При динамическом наблюдении редко выходят за пределы зоны паренхимы.
Из злокачественных опухолей паренхимы на первом месте находится рак, его эхографическая выявляемость, по нашим данным, составляет 97,8%. К сожалению, на начальных стадиях рак протекает без клинических проявлений, и больные в основном попадают на обследование в запущенных случаях, корда опухоль имеет уже большие округлые размеры с нечеткими прерывистыми контурами, что приводит к деформации почки, если рост направлен в сторону фиброзной капсулы.
Эхоструктура опухоли гетерогенна – может содержать жидкость, эхогенные тяжи, очаги некроза разных размеров, которые, сливаясь, могут образовывать большие кисты, кальцификаты. Если рост направлен в сторону чашечно-лоханочной системы, то опухоль частично или полностью заполняет ее. Почка принимает округлую форму и теряется дифференциация на зоны.
Опухоль Вильмса (нефробластома)
Встречается у детей, в очень редких случаях – у взрослых. Поражает паренхиму почек. Чаще всего выявляется случайно, так как клинически проявляется лиш при больших размерах.
На эхограмме это овальное образование больших размеров с нечеткими контурами со сложной гетерогенной эхоструктурой. В процессе прогрессирования вследствие множественных кровоизлияний и некрозов наступает ее кистозное перерождение, и на эхограмме лоцируется как слабо- или анэхогенное образование со множественными эхогенными перегородками, эхокартина схожа с картиной поликистоза. Единственным дифференциальным отличием может служить то, что поликистоз почек всегда является двухсторонним поражением.
Опухоли почечной лоханки и мочеточников
Из доброкачественных опухолей чаще встречаются папиллома и ангиома.
Когда опухоль имеет небольшие размеры (до 2 см), то на фоне застоя мочи в расширенной лоханке вследствие применения водной нагрузки папиллома лоцируется как округлое довольно хорошо контурированное слабоэхогенное образование, связанное со стенкой лоханки тонкой ножкой; ангиома имеет такую же округлую форму, хорошо контурирована и может быть эхогенна, и тогда ее трудно отличить от липомы, низко- или анэхогенна (когда опухоль богата сосудами), и в этих случаях ее очень трудно дифференцировать от парапельвикальных кист и чашечек.
Из всех форм злокачественных опухолей , поражающих лоханку, чаще встречается и представляет эхографический интерес папиллярный рак. Опухоль небольших размеров лоцируется как округлое слабоэхогенное образование с нечеткими прерывистыми контурами, связанное со стенкой лоханки тонкой ножкой, правда, ножку редко удается выделить четко; в сравнении с папилломой дает быстрый рост, края изъязвляются и в моче появляется гематурия. Достигая больших размеров, рак прорастает всю чашечно-лоханочную систему и, инфильтрируя паренхиму, значительно деформирует почку, которая лоцируется как гетерогенный конгломерат с овально-выпуклыми прерывистыми краями.
Эхографическая диагностика доброкачественных и злокачественных опухолей мочеточников значительно затруднена, так как прямые признаки опухолей когут быть выявлены лишь в верхней и нижней трети.
В основном присутствуют косвенные признаки обструкции мочеточника, такие, как расширение лохано-мочеточникового сегмента, лоханки и чашечек, не реагирующих на водную нагрузку. Следует отметить, что такие же признаки присутствуют при других механических обструкциях. Окончательный диагноз за рентгенографией.
Метастазы
Злокачественные опухоли метастазируют гематогенным и лимфогенным путем, в связи с чем метастазы встречаются у более 60% больных. В первую очередь, поражаются легкие, кости, печень и головной мозг. Доступным для эхографии является лишь метастазирование печени и самих почек, которые поражаются лишь в запущенных случаях.
Эхографическая картина метастазов печени и почек ничем не отличается от таковой при злокачественных поражениях других органов.
Несмотря на отсутствие четких эхографических критериев для дифференциальной диагностики доброкачественных и злокачественных опухолей, в большинстве случаев эхография позволяет провести ее. Являясь быстрым высокоинформативным методом, эхография должна широко применяться как скрининг-метод при исследовании населения с целью раннего выявления опухолевидных образований в почках.
Читайте также: Ультразвуковое исследование органов малого таза у женщин
Вазоренальная патология
Как уже было отмечено, эхография в реальном масштабе времени в сочетании с Доплером может оказать определенную помощь в диагностике врожденной и приобретенной патологии артериальной и венозной систем почек. Чаще всего это одностороннее поражение. В связи с этим следует выделить прямые и косвенные эхографические признаки вазоренальной патологии.
Врожденные – аномалия развития аорты, почечной артерии (сужение, аневризма).
Приобретенные – сдавление из-вне или прорастание почечной артерии опухолью, артериосклероз и другие причины.
При аномалии развития брюшная аорта на продольной эхограмме видна как эхонегативный извилистый тяж с суженными и расширенными участками на уровне отхождения почечной артерии.
Аневризма почечной артерии – это округлое анэхогенное пульсирующее образование, которое в большинстве случаев располагается в синусе, хотя может встречаться и в паренхиме, с неравномерно утолщенными стенками, имбибированными кальцием, в просвете могут встречаться тромбы (эхогенные образования).
Приобретенные признаки, приводящие к снижению кровотока по почечной артерии: инфаркт почки (частичный или тотальный), доброкачественные и злокачественные опухоли, расположенные в воротах почки, приводящие к сдавлению сосудистой ножки.
Инфаркт почки, частичный и тотальный, проходит две инволютивные фазы острую и хроническую.
При частичном остром инфаркте почка неравномерно увеличена, низкой эхогенности, на фоне которой в паренхиме лоцируется зона повышенной эхогенности (инфаркт).
При тотальном остром инфаркте (полная закупорка почечной артерии) почка нормальных размеров, более эхогенна, чем здоровая почка.
При частичном хроническом инфаркте почка уменьшается в размере и склерозируется только инфарктированная ее часть, эхогенность которой намного выше ее здоровой части.
При тотальном хроническом инфаркте почка значительно уменьшается, склерозируется. Контуры становятся неровными, стертыми, а структура высокоэхогенна, разделение почки на зоны стирается.
При сдавлении сосудистой ножки опухолью почка постепенно уменьшается в размере, а эхогенность структуры повышается.
Основные косвенные признаки: уменьшение одной почки в размере по сравнению со второй, сужение зоны паренхимы, стертость границ разделения почки на зоны, эхогенность плохо васкуляризированной почки выше, чем здоровой. В большинстве случаев присутствуют высокие цифры АД с небольшой разницей между систолическим и диастолическим давлением. Следует отметить, что чаще всего эхографист встречается именно с косвенными признаками.
Венозные повреждения
Одним из наиболее частых местных признаков повреждения венозной сети почки являются варикоцеле – кистозные расширения вен семенного канатика.
Причинами могут быть сдавление или прорастание опухоли и тромбоз левой почечной вены или нижней полой вены и др. При этих же ситуациях встречается и варикоцеле почечных вен, которые лоцируются в виде мелких округлых расширений по ходу стенок лоханки, их трудно дифференцировать от множества мелких кист. При остром тромбозе почечной вены почка увеличивается в размере, зона паренхимы расширена, эхогенность структуры низкая. При хроническом тромбозе почка уменьшается в размере, эхогенность становится высокой.
Острая почечная недостаточность
Острая почечная недостаточность наступает вследствие нарушения секреторной и экскреторной функций обеих или единственной почки. Причины могут бать преренальные-кровотечение, травма, операция; ренальны е- различные отравления специфическими нефротоксическими веществами; постренальные – при нарушении проходимости обоих или единственного мочеточника (окклюзия конкрементами или сдавление мочеточников опухолью); аренальные – вследствие травматическогоразмозжения обеих или единственной почки, случайное удаление или по жизненным показаниям (последнее встречается очень редко).
Независимо от причины, эхографическая картина острой почечной недостаточности примерно одинакова. Почки (или почка) увеличены, зона паренхимы расширена, структура низкоэхогенна, пирамиды увеличены, а их эхогенность ниже, чем структуры паренхимы.
Хроническая почечная недостаточность
Основные причины хронической почечной недостаточности: аномалии развития почек и мочеточников, двусторонний стеноз почечных артерий, нефросклероз, нефриты разной этиологии, гломерулонефрит, коллагеновые заболевания и др.
Эхографическая картина соответствует тому или иному заболеванию, приводящему к хронической недостаточности, большинство из которых описаны в соответствующих разделах. Обычно почки уменьшаются в размере, капсула высокоэхогенна с извилистыми контурами (признаки нефросклероза), зона паренхимы сужена, эхогенная, плохо или почти не дифференцируется от зоны чашечно-лоханочной системы.
Почка при длительном гемодиализе
При длительном хроническом гемодиализе почки постепенно уменьшаются в размере, контуры эхогенные, но нечеткие, теряется четкость границ между значительно суженной зоной паренхимы и чашечно-лоханочной системой. Пирамиды кистозно изменены, почти анэхогенны, с толстыми эхогенными стенками, кроме того, могут присутствовать кисты различных размеров (кистозное перерождение).
При терминальной стадии почки могут не дифференцироваться.
Пересаженная почка
Для исследования пересаженной почки применяются зонды в 3.5-5 МГц с использованием Доплера для изучения кровотока по сосудистому пучку. Пересаженная почка по сравнению с непересаженной несколько уменьшена в размере, однако при благоприятном исходе быстро увеличивается. Контуры стертые, размытые. Капсула дифференцируется с трудом.
При остром отторжении почка быстро неравномерно уменьшается в размере.
Зона паренхимы высокоэхогенна, пирамиды расширены – эхонегативна. Лоханка также расширена (зияет), с эхогенными удвоенными контурами.
При хроническом отторжении почка постепенно уменьшается в размере, контуры стираются. Паренхима высокоэхогенна, содержит кальцификаты, не дифференцируется от чашечно-лоханочной системы.
Таким образом, на современном этапе развития диагностической техники не существует более быстрого и эффективного визуального метода, чем эхографический, который иногда за считанные минуты, независимо от состояния больного, может дать клиницисту оптимальную диагностическую информацию о состоянии нормы и патологии почек, может применяться у постели больного неоднократно в течение суток без вреда для здоровья. Это единственный визуальный метод, который может быть использован как скрининг-метод при обследовании населения с целью выявления отклонения от нормы и селекции для проведения специальных методов исследования с целью уточнения некоторых патологических аспектов, особенно сосудистой патологии, где эхография малоинформативна.
Эхография в руках хорошего специалиста с развитым клиническим мышлением и при применении в нужный момент пункционной биопсии позволяет ответить на большинство вопросов по поводу любых поражений почек (кроме патологии сосудов, которая является уделом рентгенологии). Но, к сожалению, уровень подготовки некоторых эхографистов и чисто рентгенологическое мышление некоторых урологов порой дискредитируют этот бесценный метод исследования, что не идет на пользу больному.
Узи диагностика кист почек
Подробности Категория: Ультразвук в нефрологии
Узи диагностика кист почек
Простая киста почки (солитарная, истинная, серозная, кортикальная) — одиночное кистозное образование, имеющее круглую или овальную форму, врожденного или приобретенного характера [1]. Солитарная киста встречается у 3% больных, страдающих урологическими заболеваниями [1, 2]. Чаще локализуется в нижнем полюсе левой почки [1,2]. Врожденная киста развивается из зародышевых канальцев, утративших связь с мочевыми путями. Приобретенная киста возникает в результате ретенционных процессов, развившихся вследствие пиелонефрита, мочекаменной болезни, туберкулеза, опухоли, инфаркта почки.
Солитарные кисты могут длительное время оставаться бессимптомными. Артериальная гипертензия возникает в 20% случаев вследствие сдавления сосудов и ишемии паренхимы [ 1 ]. В 1-10% случаев, по различным данным, происходит озло-качествление кисты [3]. Показанием к чрескожной пункции солитарной кисты является увеличение ее более 5 см в диаметре, болевой синдром, артериальная гипертензия, сдавление верхних мочевых путей, нагноение, кровоизлияние в кисту. При выраженном болевом синдроме пунктируют кисты диаметром более 3 см. При кистах менее 6 см диаметром можно ограничиться пункцией кисты и ее склерозированием, что дает достаточно высокий положительный эффект. При пункционном склерози-ровании 96° спиртом кист большего размера результаты ухудшаются [4]. Если размер кисты более 6 см в диаметре, производят пункцию, дренирование кисты и склерозирование с длительной экспозицией спирта. Для склеротерапии помимо спирта возможно использование других склерозантов, в том числе 2%-го этоксисклерола (полидоканола) [5].
Множественные кисты почек (наличие в одной почке нескольких кист различной локализации) могут быть врожденного и приобретенного характера, встречаются реже, в 9,8% случаев кист почек [1, 2]. Множественные кисты чаще всего располагаются в корковом слое паренхимы. Также как и солитарные кисты, они длительное время не имеют клинических проявлений. Кисты диаметром до 20 мм не приводят к значительной компрессии паренхимы и нарушению уродинамики [2]. В отли-чие от поликистоза почек при множественных кистах почечная ткань практически полностью сохраняется.
Окололоханочная (парапельвикальная) киста представляет собой кистозное образование, локализующееся у почечного синуса, не сообщающееся с лоханкой, может состоять из множества кист. Образование парапельвикальных кист связано с атрезией и расширением лимфатических сосудов почечного синуса. Может стать причиной острой боли, развития гидрокаликоза в случае локализации близко к шейкам почечных чашек, при увеличении сдавливает лоханку, являясь причиной вторичной пиелоэктазии, и вызывает нарушение уродинамики. В результате сдавления сосудов почечного синуса приводит к развитию артериальной гипертензии.
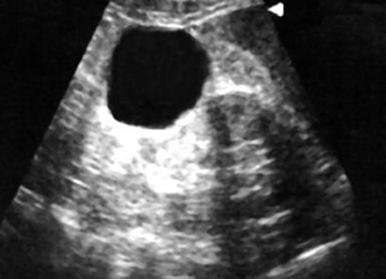
Ультрасонография занимает первое место в диагностическом алгоритме кист почек и является ведущим методом диспансерного наблюдения за больными. Достоверность ультразвукового исследования в выявлении простых кист почек составляет 98-100% [3, 6]. На ультрасонограммах киста почки выглядит как округлое анэхоген-ное образование с хорошо очерченными краями. В кисте отмечается эффект усиле- I ния дальней стенки (рис. 8.1). Киста может иметь неоднородную структуру за счет наличия в ней плотных участков в связи с кровоизлияниями или наличием кальцина-тов. При функциональном тесте с применением диуретиков на предмет дифференцирования с гидронефрозом, что наиболее актуально для парапельвикальных кист, кистозные образования в отличие от полостной системы почки не увеличиваются в размерах (см. гл. 6). При ЦДК простые кисты не имеют самостоятельной васкуляри-зации (рис. 8.1). В перегородках доброкачественных многокамерных кист нет цветовых сигналов. Часто в связи со сдавлением паренхимы почки кровоток вблизи кист ослаблен. По мере увеличения размеров кисты нарастают явления нарушения почечного кровотока. При озлокачествлении кисты или опухоли с преобладанием кистозного компонента вокруг образования и в его перегородках определяется разветвленная, как бы полыхающая, сосудистая сеть. Скоростные характеристики кровотока увеличиваются, резистивные — уменьшаются, исчезает градиент IR между мелкими и крупными сосудами [7].
Рис- 8.1 — Простая киста правой почки. ЦДК, эффект усиления дальней стенки кисты, от
сутствие самостоятельной васкуляризации. j
Ультрасонография является незаменимым вспомогательным методом для осуществления чрескожной пункционной аспирации кисты и ее склерозирования. Устройство для чрескожной пункции простой кисты почки под контролем ультразвукового направителя было применено В. Goldberg и Н. Pollack в 1973 году [8]. С помощью ультразвукового исследования выясняют положение кисты, ее размеры, толщину паренхимы, степень расширения ЧЛС. По изображению предполагаемого направления движения иглы определяют доступность кисты для пункции и предварительно измеряют глубину безопасного вкола. Пункцию проводят с помощью адап-тера, фиксированного на пункционном датчике. Место нахождения иглы постоянно контролируют по изображению на экране.
Поданным Н.С. Игнашина [9] улучшение нарушенных функциональных показателей почки, выявленных у 82,6% из 106 больных с простыми кистами почек, после пункционного лечения наблюдалось в 32,3% случаев, стабилизация артериального давления наблюдалась в 58,5% случаев из 39,1% больных с сопутствующей артериальной гипертензией. У части больных с кистами почек и артериальной гипертензи-ей методом допплеровской ультрасонографии было выявлено одностороннее снижение объемного кровотока в почке на стороне поражения. У всех больных с нормализовавшимся артериальным давлением объемный кровоток после пункционного лечения увеличился.
Приводим клинические примеры исследования больных с кистами почек с использованием допплерографии.
Больная С, 68 лет. Левая почка не изменена. Правая почка — дыхательная подвижность сохранена, контуры ровные, четкие, размеры 10,1×4,2×3,8 см. Почечная паренхима диффузно неоднородна. ЧЛС не расширена. В проекции средней части правой почки визуализируется эхонегативное однородное образование округлой формы с четкими контурами размерами 4,3×5,4 см. Допплерометрия левой почечной артерии: Vps 1,47 м/с, Ved 0,55 м/с, AT 0,92 с, IR0,63, PI 1,00, S/D 2,70, правой почечной артерии: Vps 1,37 м/с, Ved 0,43 м/с, AT 0,75 с, 1R 0,69, PI 1,25, S/D 3,2, междолевой артерии вблизи эхонегативного образования: Vps 0,50 м/с, Ved 0,10 м/с, IR 0,80, PI 1,74, S/D 5,0. Резистентность сосудов правой почечной артерии выше, чем левой. Повышение резистентности междолевой артерии вблизи кисты. Заключение: Простая киста правой почки. Допплерометрические показатели почечных артерий в пределах возрастной нормы. Локальное нарушение кровотока в бассейне правой почечной артерии в результате сдавления внутриорганных сосудов кистой. Рекомендована пункционная аспирация кисты.
Больной К., 63 лет. Левая почка не изменена. Правая почка подвижна при дыхании, контуры ровные, размеры 10,5×5,5×5,1 см. Размеры почечного синуса 6,0×3,9×2,1 см. Структурный индекс 0,75, увеличен. Толщина паренхимы в средней части почки 17 мм. В области почечного синуса однородное эхонегативное образование округлой формы с четкими контурами размерами 3,2×3,0 см. Допплерометрия почечных артерий: справа — Vps 1,53 м/с, Ved 0,52 м/с, IR 0,64, PI 1,54, S/D 2,94, слева -Vps 0,98 м/с, Ved 0,31 м/с, IR 0,63, PI 1,41, S/D 3,20. Через 8 минут после внутривенного введения 2 мл 1% раствора лазикса, справа — Vps 1,19 м/с, Ved 0,37 м/с, IR 0,68, PI 1,50, S/D 3,25, через 20 минут, справа — Vps 1,30 м/с, Ved 0,57 м/с, IR 0,57, PI 1,30, S/D 3,07. После введения лазикса указанное образование не изменилось в размерах, ЧЛС не визуализируется. Заключение: Парапельви-кальная киста правой почки. Нарушений почечного кровотока и оттока мочи нет. Рекомендовано динамическое наблюдение.
Больной Д., 53 года. Левая почка не изменена. Правая почка подвижна при дыхании, контуры ровные, размеры 11,5×5,9×5,2 см. В области почечного синуса однородное эхонегативное образование правильной округлой формы с четко очерченными контурами и тонкой ровной гиперэхогенной стенкой размерами 3,5×4,4 см (см. рис. 6.12), не сливающееся в единую структуру с визуализирующимися расширенными эхонегативными чашками. Допплерометрия почечных артерий: справа ~ Vps 0,98 м/с, Ved 0,27 м/с, IR 0,72, РТ 1,58, S/D 3,62, слева — Vps 1,07 м/с, Ved 0,49 м/с, IR0,61, PI 1,09, S/D 2,19. В правой почечной артерии снижение диасто-лического кровотока, повышение резистентности. При ЦДК МПВ частота выбросов мочи из правого мочеточника 0,8 в мин, несколько снижена, из левого 0,9 в мин, в норме. Vmax МПВ справа 0,20 м/с, Vmean 0,14 м/с, снижена. Заключение: Пара-пельвикальная киста правой почки. Вторичный гидронефроз справа II стадии. Нарушение кровотока в правой почечной артерии. Нарушение уродинамики верхних мочевых путей справа. Рекомендовано плановое оперативное лечение -удаление па-рапельвикальной кисты.
Рис, 6.12. Парапельвикальная киста правой почки, сдавливающая почечную лоханку, Гидронефроз II стадии, Киста правильной округлой формы с четко очерченными конту¬рами, заполнена анэхогенным содержимым (обозначена маркерами).
Литература
1. Руководство по урологии/ Под ред. НА. Лопагкина. -Т. 2. — М.: Медицина, 1998. -768 с.
2. Лопаткин НА., Мазо Е.Б. Простая киста почки. -М.: Медицина, 1982. — 128 с.
3. Ковальков А.Б. Морфогенез, дифференциальная диагностика и выбор метода лечения простых кист почек: Автореф. дисс. … канд. мед. наук. -Киев, 1992. -23 с.
4. Капитанчук Ю.А. Пункционное дренирование кист почек различных размеров под ультразвуковым контролем. -Перший украшський конгрес фах1вщв з ультразвуковоТ д1агностики. Тези. -Киш: Наукова думка, 1999. — С. 148.
5. Reuter H.J., Ottinger H. La obliteracion de quistes renales у de rinones poliquistosis // Arch. esp. Urol. — 1987. -V. 40, N 5. -P. 314-318.
6. KollfP., ZucklerH., Otto P. Sonographie, Zystenpunktion und Renogystographie in der Differentialdiagnostik raumfordern der Proxesse der Niere. -Helv. Chir. Acta. — 1977. -Bd. 44, N 3. -S. 251-254.
7. Дуган I.В. Комплексы ультразвуков! дослщження в дшгностищ i диференщальнш Д1агностиц1 ЗЛОЯК1СНИХ пухлин нирок: Автореф. дис. … канд. мед наук. — Ки’1в, 1999.-20с.
8. Goldberg В., Pollack H. Ultrasonically guided renal cystaspiration. -J. Urology. — 1973.-V. 109, N1.- P. 5-7.
9. Игнашин Н.С. Ультрасонография в диагностике и лечении урологических заболеваний. -М.: Видар, 1997. -112 с.
Е.А. Квятковский, ТА. Квятковская — Ультрасонография идопплерография в диагностике заболеваний почек. -Днепропетровск: Новая идеология, 2005
УЗИ почек с эхоконтрастированием как возможная альтернатива КТ
Еще совсем недавно ультразвуковой метод исследования был единственным, в котором не рассматривалось применение контрастных препаратов. Ультразвуковая цветовая допплерография считалась уникальной неинвазивной методикой исследования сосудов. С внедрением в практику ультразвуковых исследований контрастных агентов стало возможным изучать сосудистый рисунок, оценивать его характер, прослеживать фазы накопления и выведения контрастных препаратов, изучать гемодинамику. По сути, появилась определенная альтернатива контрастной компьютерной рентгеновской томографии.
А.В. Зубарев, С.В.Сальникова, А.А. Федорова, А.В. Ганина, С.О. Чуркина, А.П. Норкина
Кремлевская медицина клинический вестник №3/2017
Введение.
В качестве контрастного вещества при эхоконтрастировании почек используются микропузырьковые взвеси, которые получают при внутривенном введении в кровь пациента специальных газообразующих препаратов. Размеры микропузырьков не превышают размеры эритроцита и полностью безвредны для пациента. К тому же они не вызывают аллергических реакций в организме, у них отсутствует нефротоксичность, свойственная рентгеноконтрастным препаратам. Микропузырьки взаимодействуют с ультразвуковым сигналом и начинают резонировать и лопаться, обеспечивая контрастирование различных по морфологическому строению сосудов и органов. [1] Сегодня эхоконтрастные препараты активно внедряются в повседневную практику и все шире используются врачами ультразвуковой диагностики, обеспечивая возможность проведения контрастного усиления по аналогии методикам контрастного усиления при КТ и МРТ. [2, 3, 4, 5, 6] В то же время, возможности эхоконтрастирования в диагностике заболеваний почек пока мало знакомы нашим клиницистам. Вероятно, поэтому своих пациентов они чаще направляют на конкурирующие высокоинформативные и затратные методы визуализации, например, КТ или МРТ, позволяющие провести комплексную оценку морфологии и функции почек. Однако, важно напомнить, что КТ исследование почек отягощено лучевой нагрузкой и нефротоксичностью йодного рентгеноконтрастного препарата [ 7 ].
Мы предприняли попытку на собственном клиническом материале показать возможности эхоконтрастирования в диагностике различных патологических состояний почек.
Материалы и методы:
За период с мая 2016 года по апрель 2017 года мы провели эхоконтрастирование почек у 27 пациентов. Критерием отбора пациентов для проведения эхоконтрастирования было наличие изменений в структуре и функции почек, визуализируемых при стандартном УЗИ почек. Перед введением эхоконтрастного препарата у каждого пациента получали информированное согласие по утвержденному протоколу. Возраст обследованных пациентов составлял от 31 до 64 лет, в среднем — 47 лет. У 13 пациентов подозревались кистозные образования почек, у 7- пиелонефрит, и еще у 7 – объемные солидные образования неясного, предположительно, злокачественного генеза. Результаты компьютерной и магнитно-резонансной томографии были доступны у 23 пациентов; 15 пациентам проводилось последующее патоморфологическое исследование после выполненных оперативных вмешательств.
Во время обычного ультразвукового исследования почек с применением методик серой шкалы и УЗ-ангиографии мы оценивали наличие патологических изменений в структуре и функции почек. После этого выявляли зону интереса. Стараясь не смещать датчик от области интереса, активировали на ультразвуковом сканере формат двойного экрана. В режиме двух экранов на ультразвуковом аппарате контрастное изображение почки отображалось параллельно и одновременно с соответствующим изображением почки в B-режиме.
При наличии в почке объемного образования эхоконтрастирование позволяет изучить характер сосудистого рисунка, оценить различные фазы контрастирования, выявить участки деструкции или распада ткани органа или опухоли.
Для предотвращения быстрого разрушения микропузырьков при сканировании мы использовали низкие показатели механического индекса (МИ< 0.1). После внутривенного введения 2-4 мл эхоконтрастного препарата (Соновью) согласно инструкции производителя, в режиме реального времени, мы пошагово фиксировали контрастирование сосудов и паренхимы почки. Центральный эхо-комплекс почки (мозговое вещество) контрастировался в первую очередь, затем контрастное вещество проникало в пирамидки почки. Удовлетворительное контрастное усиление длится в течение 2-5 минут, затем концентрация контрастного вещества постепенно уменьшается и в течении 6-9 минут практически исчезает. [6]
Во время УЗ-исследования мы проводили записи видеоклипов в различные временные промежутки контрастирования почки. При необходимости выполнялось повторное введение еще одной дополнительной дозы эхоконтрастного препарата.
Побочных реакций на введение эхоконтрастного препарата ни у одного из обследованных нами пациентов не отмечалось.
Результаты и их обсуждение.
При эхоконтрастировании почек мы получали все те же фазы контрастного усиления, что и при рентгеновском или магнитно-резонансном контрастировании. Артериальная фаза при эхоконтрастировании почек значительно короче, чем при КТ и длится всего несколько секунд. Это зависит от скорости введения и от того в какую руку вводился препарат. Через примерно 15-20 секунд от начала введения фиксировалась кортико-медуллярная фаза, постепенно переходящая в паренхиматозную. Паренхиматозная фаза может длиться несколько минут. После 5-8 минут микропузырьки контрастного вещества разрушаются и перестают контрастировать сосуды и ткань почки. Следует особо отметить, что особенностью эхоконтрастирования почек является уникальная возможность повторять многократно все фазы контрастирования заново, используя технические возможности ультразвукового сканирования – так называемые, вспышки или мощный импульс ударной ультразвуковой волны, разрушающей микропузырьки. Это дает возможность многократной оценки перфузии в различных зонах коркового вещества почки.
Наличие контрастного усиления (накопление микропузырьков) непосредственно в самом образовании, его перегородках или стенках расценивалось нами как подозрение на неопластические изменения. При этом доброкачественные и злокачественные образования почек демонстрировали различные типы контрастирования. Для злокачественных образований характерно быстрое накопление контрастного препарата в опухоли и наличие в ней дезорганизованного сосудистого рисунка. У всех 7 пациентов с объемными образованиями в почках солидной эхоструктуры мы получили быстрое раннее накопление контрастного препарата. Также отмечалось наличие дезорганизованного обогащенного сосудистого рисунка в образовании, что тоже свидетельствовало в пользу злокачественной опухоли. Данные УЗИ с эхоконтрастированием полностью совпали в данными КТ у всех пациентов данной группы.
Наличие раннего контрастирования образования или отдельных структур в самом образовании является важным диагностическим признаком, особенно когда речь идет о кистозном раке почки. В группе из 13 пациентов с кистозными образованиями почек были выявлены различные варианты эхоконтрастирования. Если взять за основу общепринятую для рентгеновской контрастной КТ классификацию кист по Bosniak (I-IV), то можно заметить соответствие рентгеновских и ультразвуковых данных.
Это соответствие позволило нам сопоставить данные КТ и УЗИ и провести дифференциальную диагностику между доброкачественными и злокачественными поражениями почек на основе выделенных нами типов эхоконтрастирования. Так, при кистозной форме рака почки наблюдается контрастирование стенок кисты, внутренних перегородок или септ. Мы считаем это важным диагностическим критерием злокачественного поражения, на который следует опираться при эхоконтрастировании почек. Основываясь на выделенных нами критериях в 3-х случаях был заподозрен кистозный рак почки (Bosniak III-IV), подтвержденный после операции. Всего 10 пациентам из этой группы было выполнена компьютерная томография с контрастированием. В 3 из 10 случаев проведение КТ с контрастированием было невозможным из-за высоких рисков возникновения аллергических реакций. В 8 случаях результаты КТ и УЗИ с эхоконтрастированием полностью совпали. У 2-х пациентов при КТ отсутствовало контрастирование стенок кисты и перегородок, тогда как при эхоконтрастировании мы получили контрастирование перегородок. В этих обоих случаях после операции был подтвержден диагноз кистозного рака почки. Нужно признать, что некоторое минимальное контрастирование микропузырьками септ и миграция их во внутрисептальные компоненты, редко, но может встречаться и при доброкачественных кистозных образованиях почек. В нашем исследовании миграция единичных микропузырьков контраста в септы кистозного образования доброкачественного характера отмечалась в 2-х случаях.
Общеизвестно, что ультразвуковое исследование является методом первой линии в диагностике большинства заболеваний почек. Кроме успешного решения диагностических проблем с помощью эхоконтрастирования при дифференциации простых кист почек и кистозно-солидных опухолей уже на первом этапе инструментального обследования чрезвычайно полезной может оказаться оценка перфузии при острых и хронических воспалительных поражениях. Эхоконтрастирование помогает выявить наличие скрытых при стандартном УЗИ участков ишемии почечной паренхимы, воспалительных и травматических повреждений.
Данные ультразвукового исследования были полностью подтверждены результатами КТ с контрастированием. В дальнейшем при консервативном ведении пациентки мы проводили мониторинг состояния пораженной паренхимы почки только с помощью ультразвукового контроля. Перед выпиской было сделано контрольное исследование КТ, которое показало практически полное восстановление перфузии в пораженной почке, что соответствовало клиническому выздоровлению. Однако после эхоконтрастирования, выполненного по технологии Fusion [2], т.е. когда синхронно сопоставляются данные КТ и УЗИ мы обнаружили, что при эхоконтрастировании по периферии левой почки сохраняется небольшой участок еще не полностью восстановившейся перфузии. Потребовалось продлить лечение, а дальнейший мониторинг восстановления перфузии этой почки мы проводили только с помощью ультразвукового метода. В группе с деструктивно-воспалительными заболеваниями почек эхоконтрастирование 6является альтернативой КТ в связи с возможностью многократного динамического повторения. Применяя технологию фьюжн мы успешно мониторировали 3-х пациентов с деструктивно-воспалительными заболеваниями почек, когда данные КТ с контрастированием полностью коррелировали с данными УЗИ с эхоконтрастированием.
В нашем исследовании мы смогли подтвердить результаты других авторов, что эхоконтрастирование позволяет оценить микрососудистый кровоток в почке, выявить зоны воспаления и деструкции в почечной паренхиме, обнаружить очаги неоваскуляризации, оценить общую и локальную васкуляризацию паренхимы, основываясь на различиях характеристик перфузии, провести дифференциацию между солидными опухолями почек и псевдоопухолевыми образованиями, а также между кистозными и солидными структурами [2], хотя и имеет свои ограничения при характеристике «сложных» кист почек [8].
Общими ограничениями ультразвукового метода можно считать трудности визуализации почек, обусловленные глубоким расположением, экранирование почки газом кишечного содержимого.
Среди недостатков проведенного нами исследования можно выделить следующие: относительно небольшое число наблюдений, не во всех наблюдениях было доступно сопоставление с патоморфологическими данными послеоперационного материала и с данными КТ.
Таким образом, можно заключить, что контрастная эхография почек не уступает по информативности контрастной КТ почек, а в ряде случаев, например, при сложных кистозных образованиях и превосходит КТ. Эхоконтрастирование почек следует включить в диагностический алгоритм исследования пациентов с разнообразной почечной патологией уже на первом этапе инструментальной диагностики. С учетом таких преимуществ методики как отсутствие лучевой нагрузки и отсутствие нефротоксичности у используемого эхоконтрастного препарата она может рассматриваться как методика выбора.
Список использованной литературы.
-
А.В. Зубарев, В.Е Гажонова. Диагностический ультразвук. Уронефрология. Практическое руководство. 2002 стр. 8-22 [ Zubarev A.V., Gazhonova V.E. Diagnostic ultrasound. Uronefrology. Practical guide. 2002 pp. 8-22. In Russian.]
- < > визуализация. 2015;(1):94-114. [Zubarev A.V., Fedorova A.A., Chernishev V.V., Varlamov G.V., Sokolova N.A., Fedorova N.A. Application of Contrast Enhanced Ultrasound (Ceus) in the Clinic and Prospects of Synchronization Ultrasound, CT and MRI Images (Personal Experience and Literature Review). Medical Visualization. 2015;(1):94-114.
Demosthenes D. Cokkinos, Eleni G. Antypa, Maria SkilakakiContrast Enhanced Ultrasound of the Kidneys: What Is It Capable of? BioMed Research International Volume 2013, Article ID 595873, 13 pages
-
Jakobsen JA, Oyen R, Thomsen HS, Morcos SK; Members of Contrast Media Safety Committee of European Society of Urogenital Radiology (ESUR). Safety of ultrasound contrast agents. Eur Radiol 2005; 15: 941-945
-
Emilio Quaia Michele Bertolotto Vincenzo Cioffi Comparison of Contrast-Enhanced Sonography with Unenhanced Sonography and Contrast- Enhanced CT in the Diagnosis of Malignancy in Complex Cystic Renal Masses AJR 2008; 191:1239–1249 DOI:10.2214/AJR.07.3546
-
Robbin ML. Ultrasound contrast agents: a promising future. Radiol Clin North Am 2001; 39:399–414
-
Ashutosh Prakash, Gerald Jit Shen Tan, Gervais Khin-Lin Wansaicheong Contrast enhanced ultrasound of kidneys. Pictorial essayMedical Ultrasonography 2011, Vol. 13, no. 2, 150-156
-
J.-M. Correas, M. Claudon, F. Tranquart, and O. H´el´enon, “The kidney: imaging with microbubble contrast agents,” Ultrasound Quarterly, vol. 22, no. 1, pp. 53–66, 2006.
-
F. Piscaglia, C. Nolsøe, C. F. Dietrich et al., “The EFSUMB guidelines and recommendations on the clinical practice of contrast enhanced ultrasound (CEUS): update 2011 on nonhepatic applications,” Ultraschall in der Medizin, vol. 33, no. 1, pp. 33–59, 2012
-
Hélénon O, Correas JM, Balleyguier C, Ghoudani M, Cornud F. Ultrasound of renal tumors. Eur Radiol 2001; 11:1890–1901
-
Robbin ML, Lockhart ME, Barr RG. Renal imaging with ultrasound contrast: current status. Radiol Clin North Am 2003; 41:963–978
Статья добавлена 7 октября 2017 г.
Ультразвуковая диагностика в онкологии
04 Октября в 9:54 4129
Ультразвуковое исследование (УЗИ) основывается на изучении изображений структур, тканей, органов и систем организма, полученных в результате приема и преобразования зондирующего ультразвукового излучения. Впервые в клинике с диагностической целью ультразвук был использован австрийским невропатологом R. Dussik в 1942 году. Название метода ультразвуковой диагностики (лат. ultra — сверх, греч. diagnostikos — способный распознавать) имеет несколько синонимов в русскоязычной научной литературе: (эхография (греч. Echo — имя нимфы в греческой мифологии, которая от мук неразделенной любви к Нарциссу высохла так, что от нее остался только голос и греч. grapho — писать, изображать): эхология (греч. logos — понятие, учение), сонография (лат. sonos — звук); эхолокация (лат. locatio — размещение).
В англоязычной литературе для обозначения ультразвуковой диагностики чаще употребляются термины «sonography», «ultrasonography»,«ultrasound», «есподгарпу», «ultrasonic», в немецкой — «sonographie», «sonographische», «ultraschallsonographie». «ultraschall», «ultraschalldiagnostik». Очевидно, что синонимы различных языков во многом схожи. Аналогичные термины используются в итальянской, французской и другой специальной литературе.
УЗИ является одним из молодых и быстро совершенствующихся методов диагностики. К достоинствам метода относятся высокая разрешающая способность, быстрота постановки диагноза и возможность многократного повторения процедуры, минимальная подготовка. УЗ-установки сравнительно дешевы и просты в эксплуатации, не нуждаются в специально оборудованном помещении, включаются в обычную электрическую сеть. Эхография обладает определенными преимуществами перед компьютерной томографией, позволяя получать разнообразные (а не только стандартные поперечные) сечения тела, наблюдать механические движения органов (пульсацию сосудов, перистальтику кишечника, дыхательные экскурсии диафрагмы, почек, печени и пр.) без применения контрастных веществ. К важным преимуществам эхографии следует отнести ее неионизирующую природу и низкую интенсивность используемой энергии. Под ультразвуком подразумевают звуковые волны с частотой свыше 20000 Гц, т.е. выше порога слышимости человеческого уха. Наиболее часто используются частоты в диапазоне 2-10 МГц (1 Мгц = 1 миллион Гц). Длина волны зависит от частоты. Средняя скорость продвижения волны в биологических тканях составляет 1500 м/с, длина волны — от 1 до 0,1 мм. Ультразвуковая энергия вызывает колебательные движения вещества, на которое она воздействует, и поэтому относится к механическим видам излучения. УЗ-волны генерирует датчик (преобразователь, эхозонд, в англоязычной литературе — transducer, probe). Он представляет собой сложную конструкцию расположения пьезоэлементов, осуществляющих выработку УЗ-изпучения и восприятия его отражения. В преобразователе может быть размещен один пьезоэлемент, позволяющий получать статичные, неподвижные изображения-слайды. В современных сканерах, работающих в реальном времени (real-time) и позволяющих получать динамические, т.е. в естественном движении, изображения структур, преобразователь (датчик) содержит блок из многих (до 500) пьезокристалпов, работающих попеременно, как в гирлянде «бегущие огни». Таким способом осуществляется линейное сканирование. Правильный выбор датчика является важнейшим условием получения адекватного УЗ-изображения и определяется характером исследуемого объекта. Известно, чем выше частота ультразвука, генерируемого датчиком, тем выше его разрешающая способность, но ниже проникновение ультразвуковых волн в ткани. Поэтому для исследования органов брюшной полости, малого таза, забрюшинного пространства должны применяться датчики с частотой 3,0-5,0 МГц, щитовидной и молочной железы — 7,5-13,0 МГц, яичка — 7.05-10,0 МГц, поверхностных лимфатических узлов — 10,0-13,0 МГц, поверхностных сосудов — 10,0-20,0 МГц и т.д. В зависимости от режима работы, или способа регистрации информации об ультразвуковых волнах, отразившихся от исследуемых структур, различается несколько типов УЗ-аппаратов Если дать на экране монитора развертку отраженного УЗ-сигнала по его амплитуде, то будут регистрироваться вертикальные всплески, а метод носит название одномерного, или А-метода (от англ. amplitude). С такой аппаратуры начинались ультразвуковые исследования, в настоящее время аппаратуру на основе А-метода используют нейрохирурги. Для исследования циклического движения структур сердца применяют М-метод (от англ. motion), представляющий развертку во времени одномерной эхограммы. Наибольшее распространение в настоящее время приобрел метод двумерной (2D — two-dimensional) эхографии, дающей на дисплее плоскостную картину — эхограмму.
Его еще называют В-методом (от англ. brightness — яркость). Изображение при данном методе формируется в результате сканирования ультразвукового луча в заданной плоскости.
Ультразвук в зоне его действия на биологические объекты оказывает физические эффекты (поглощение, миграция, трансформация механической энергии), вызывает физико-химические процессы (образование электронных возбужденных состояний, конформационные изменения, образование свободных форм веществ и продуктов сонолиза, изменения рН среды, расщепление высокомолекулярных соединений и т.п.) и биологические реакции (изменение проницаемости мембран, микроциркуляторные сдвиги, активация лизосомных ферментов, усиление процессов перекисного окисления, изменение окислительного фосфорилирования, сдвиги в системе аминов, простагландинов и других биологически активных веществ), т.е. в конечном итоге происходит изменение гомеостаза клеток, тканей и организма в целом. Определяющее значение в биологических эффектах ультразвука имеет мощность и длительность его воздействия и может быть как терапевтическим (до 2-3 Вт/см2), так и разрушающим (свыше 4 Вт/см2). В диагностике используется ультразвук мощностью 0,00001-2,5 Вт/см2. Считается, что при увеличении мощности излучения свыше 2,5 Вт/смг возможно появление тепловых эффектов, особенно на поверхности костных структур. Опасных эффектов не возникает, если температура тканей при воздействии УЗ-излучения повышается менее чем на 1,5°С, однако нужна осторожность у лихорадящих пациентов из-за возможности локального повышения температуры тканей. При значительном увеличении интенсивности и времени воздействия ультразвука его энергия приводит к нагреву тканей и их разрушению вследствие кавитационных явлений, связанных с периодическими изменениями давления акустической волны. В фазе разряжения происходит своеобразный разрыв тканей пузырьками газа, растворенного в жидкости, что сочетается с выраженным повышением температуры. На эффекте кавитации основан принцип работы ультразвукового скальпеля. Ультразвук используется для решения двух основных задач: ультразвуковой диагностики (визуализации) и измерения скорости потока жидкости — допплерография. Ультразвуковая диагностика основана на пропускании через тело узконаправленного УЗ-луча, который отражается от различных тканей и возвращается к датчику в виде эха, создавая основу для формирования изображения, подобно эхолоту на рыболовецких судах. Ультразвук распространяется в тканях прямолинейно и ведет себя во многом подобно свету (отражается, преломляется, поглощается и рассеивается). Интенсивность передаваемого ультразвука по мере прохождения через ткани тела постепенно уменьшается вследствие поглощения его в виде тепла. Не поглощенная часть ультразвука может быть рассеяна или отражена от поверхностей раздела между средами с различными физическими (акустическими) свойствами назад к датчику. Испускаемый датчиком ультразвук пульсирует. В режиме излучения датчик работает лишь 0,1% времени цикла, тогда как в режиме приема возвращенных эхосигналов (как приемник) — 99,9% времени цикла. Воздействие отраженных механических колебаний на пьезокристалл датчика вызывает образование электрического импульса, который подвергается сложной обработке и, в конечном итоге, формирует изображение на экране аппарата. Ткани тела, отличаясь по плотности и другим физическим характеристикам, в разной степени отражает ультразвуковые волны, порождая неодинаковой силы эхо (различную эхогенность ткани) и тем самым — контраст в УЗ-изображении. В подавляющем большинстве УЗ-установок для построения изображения реализуется только один количественный параметр — отраженный сигнал. Легкость прохождения ультразвука через ткани частично зависит от массы частиц (которая определяет плотность ткани) и частично — от сил эластичности, притягивающих частицы друг к другу. Чем больше изменение акустического сопротивления, тем больше отражение ультразвука. Крайне большое различие в акустическом сопротивлении существует на границе мягкая ткань-газ, и почти весь ультразвук отражается от нее. Этим объясняется применение геля в качестве прослойки между кожей пациента и датчиком для устранения воздуха, который может задержать ультразвуковой луч.
По этой же причине ультрасонография не может быть использована для полноценного исследования таких содержащих газ органов, как кишечник и легочная ткань. Существует также и относительно большое различие в акустическом сопротивлении между мягкой тканью и кортикальной костью. Большинство костных структур, таким образом, мешает проведению ультрасонографии. Также трудно визуализировать наклоненные по отношению к датчику поверхности тканей и органов.
Анатомические структуры и патологические образования исследуются эхографически в продольной, поперечной и косых проекциях. При этом удается создать объемное представление об объекте исследования, точно определить размеры и количество опухолевых узлов, их отношение к магистральным сосудам, дифференцировать артерии и вены, выявить опухолевые тромбы в венах и пр. УЗИ обладает высокой чувствительностью и способно обнаружить образования до 0,5 см в диаметре. Эхографическая семиотика основывается на способности исследуемой ткани отражать эхосигнапы, что проявляется на эхограмме яркостью объекта. Изоэхогенной называют структуру, которая по яркости не отличается от окружающей нормальной ткани. Гипоэхогенным называют участок изображения пониженной эхогенности по сравнению с соседними или сравниваемыми зонами, а гиперэхогенным — повышенной эхоплотности. На общепринятом позитивном изображении гиперэхогенный объект выглядит светлым, близким к белой части серой шкалы, гипоэхогенный — темным, анэхогенный — близким к черному. Изоэхогенные, гиперэхогенные и гипоэхогенные объекты являются эхопозитивными структурами. Анэхогенное (эхонегативное) изображение соответствует жидкости, например, кисте. Чем больше жидкости содержится в том или ином образовании, тем более черным оно выглядит на экране, в то время, как фиброзная и другие ткани дают оттенки серого цвета, а структуры, отражающие ультразвук, отображаются лишь белой полоской их переднего контура, обращенного к датчику аппарата. Трактовка результатов УЗИ должна проводиться с большой осторожностью с учетом локализации образования, клинических, рентгенологических, радионукпидных и других данных.
В описании ультразвукового исследования используются и другие термины, характеризующие эхогенность. Гомогенной называют структуру, от которой регистрируются однородные эхосигналы одинаковой амплитуды, гетерогенной — различные. Под акустическим окном понимают орган или структуру, которые создают условия для лучшего прохождения ультразвука при исследовании расположенного за ними органа (например, печень для правой почки, мочевой пузырь для матки и яичников).
Допплеровская сонография, D-метод (doppler) позволяет определить скорость и направление кровотока. Измерение скорости кровотока с использованием ультразвука основано на общем физическом явлении, согласно которому частота восприятия звука, издаваемого движущимся объектом, изменяется при ее регистрации неподвижным приемником (проявление допплеровского эффекта). Суть эффекта заключается в том, что звук, например звуковой сигнал приближающегося автомобиля, воспринимается как более высокий, а удаляющегося — как более низкий, чем при неподвижном автомобиле. При допплеровском исследовании кровеносных сосудов или сердечной камеры через них пропускается генерируемый датчиком направленный ультразвуковой луч, небольшая часть которого отражается от эритроцитов. Частота волн эха, отраженного от этих клеток, будет выше, чем у волн, испускаемых датчиком. Разница между частотой принятого эха и частотой генерируемого датчиком ультразвука называется допплеровским частотным сдвигом (допплеровской частотой), который пропорционален скорости кровотока. Таким образом, если точно определить скорость ультразвуковых импульсов, отразившихся от движущейся крови в сосудах или в сердечных полостях, она окажется измененной на величину скорости потока крови. Кроме того, регистрируется направление движения кровотока (исходная частота увеличивается или уменьшается). При измерении потока частотный сдвиг непрерывно измеряется прибором и автоматически преобразует изменение частоты ультразвука в относительную скорость кровотока (например, в м/с). При измерении скорости кровотока допплеровский частотный сдвиг обычно лежит в пределах различимого человеческим ухом диапазона частот. Поэтому вся допплерографическая аппаратура оборудуется динамиками, что делает возможным слышать допплеровский частотный сдвиг. Этот «звук кровотока» очень полезен как для обнаружения сосудов, гак и для полуколичественной оценки характера тока крови и его скорости. Наиболее часто используемые аппараты объединяют в особую ультрасонографию в режиме реального времени и импульсную допплеровскую coнографию. При этом одновременно визуализируются допплеровская кривая кровотока и двумерная эхограмма с индикацией на ней точки исследования кровотока — т.н. дуплексное сканирование. При допплеровском исследовании параметров кровотока получают очень важную информацию о линейной и объемной скорости кровотока, наличии стеноза в мелких и крупных артериях, полостях сердца. Цветная визуализация кровотока — дальнейшее развитие дуплексного сканирования. Параметры гемодинамики можно закодировать цветом, который накладывается на изображение в масштабе реального времени, показывая наличие перемещающейся крови. Традиционно кровоток по направлению к УЗ-датчику отображается красным цветом, от датчика — синим, а переходными оттенками -значения скорости. Все это позволяет получить цветную карту кровотока, что дает возможность оценить кровоток в крупных сосудах, выявить в них стеноз, аневризму, тромбоз, идентифицировать более мелкие, чем при обычном УЗИ, сосуды, дифференцировать сосудистые структуры (аневризмы, гемангиомы) от несосудистых (кистозных образований). Однако обеспечиваемая данным методом количественная информация менее точная, чем при допплеровском исследовании. Поэтому цветная визуализация кровотока всегда комбинируется с импульсной допплеровской сонографией, и цветное изображение используют как хорошее подспорье при выборе контрольного объема для импульсного допплеровского режима. Еще одно новое направление усовершенствования ультразвуковой техники — формирование псевдотрехмерного изображения (3D-view, ЗD-УЗИ) на основе полученной с помощью специального приспособления серии двумерных эхограмм с небольшим шагом (расстояниями между плоскостями сечения). Существенным ограничением является отсутствие режима реального времени.
В настоящее время такая аппаратура является весьма дорогостоящей и недостаточно совершенной. Получение трехмерного изображения какого-либо органа повышает эстетичность ультразвукового изображения, позволяет более наглядно представить местоположение патологического образования и взаимоотношения с прилегающими структурами. Перспективы применения ЗD-УЗИ весьма заманчивы, особенно в кардиологии и гинекологии.
За исключением воздуха, жира и костей, естественные различия в акустическом сопротивлении между различными мягкими тканями тела малы и зависят от содержания таких веществ, как коллаген, жир и фиброэластическая ткань. В настоящее время для усиления количественных различий в ультразвуковой энергии, отраженной различными структурами тела, используются специальные контрастные средства. Они позволяют улучшать контрастное разрешение между нормальной и пораженной тканью, облегчать идентификацию опухолей (сосудов в них) и глубоко залегающих сосудов, увеличивают вероятность выявления зоны инфаркта и ишемии. Наиболее известными препаратами являются «Инфосон» (микропузырьки газа в оболочке из альбумина); «Эховист» (микропузырьки газа, внедренные в галактозу); «Левовист» (заключенные в галактозу и жировые кислоты микропузырьки газа); «ЭхоГен» (жидкость, которая вводится в кровь, а затем непосредственно в ней выделяет микропузырьки газа) и др.
Принципиально новые перспективы имеет применение эхоконтрастных коллагеновых микросфер, которые поглощаются сосудами и клетками ретикуло-эндотелиальной системы, т.е. происходит реализация принципа, подобного сцинтиграфичвскому.
В настоящее время детально анализируется биологическое действие ультразвука, используемого в диагностических аппаратах. Огромное достоинство ультразвукового исследования — отсутствие повреждений тканей при обычно используемых в диагностике мощностях УЗ-энергии. Рекомендуемая максимальная выходная акустическая мощность не должна превышать 0,1 Вт/см2, что, по мнению специалистов, значительно превышает пороговое значение риска. Непосредственно отрицательное воздействие на врача или обследуемого пациента диагностического УЗИ до сих пор не доказано. Тем не менее, опасения о возможном неблагоприятном действии УЗИ высказываются все чаще. Сформулирован принцип безопасного использования диагностического ультразвука — ALARA («As Low As Reasonably Achievable» — «так низко, как благоразумно достижимо»), т.е. ультразвуковое исследование должно производиться при минимальной экспозиции и минимальной интенсивности излучения. Как указывалось выше, УЗ-воздействие не вызывает ионизации в тканях, но может при определенных условиях повреждать их. К тепловому действию ультразвука наиболее чувствительны быстро делящиеся клетки. Поэтому вводятся ограничения для диагностического обследования плода в I и III триместре беременности. Пока не накоплена достаточная научная информация, исследования эмбриона с помощью импульсной допплерографии при максимальных уровнях мощности следует рассматривать как нецелесообразные. В последние годы раздаются призывы избегать неоправданных УЗ-воздействий и более ответственно относиться к назначению и проведению подобных исследований. Бесспорно, существует определенная «профессиональная вредность» при работе на УЗ-аппарате, связанная с ультразвуковым и электромагнитным излучениями. Врачи УЗ-диагностики должны использовать специальные меры защиты (ультразвуконепроницаемые перчатки — обычно хлопчатобумажные внутренние и тонкие резиновые снаружи, звукопоглощающее покрытие стен кабинета и т.д.).
Большое отрицательное значение имеют напряжение зрительного анализатора и длительная вынужденная поза врача, способствующая развитию и обострению остеохондроза и зрительного утомления.
Щитовидная железа в УЗ-отображении представлена мелкоячеистой, гомогенной эхоплотной структурой, хорошо дифференцируемой от окружающих ее мышц, сосудов и трахеи, а капсула железы — в виде тонкой эхогенной линии, окружающей орган. Это позволяет четко определить положение, форму, величину, объем и контуры органа. УЗИ имеет большое значение в диагностике заболеваний железы и в первую очередь рака. Метод дает возможность не только выявить опухолевый узел и оценить его структуру, но и осуществить прицельную пункционную биопсию и морфологическую верификацию. Важной составной частью УЗИ больных с заболеваниями железы является изучение лимфатических узлов области шеи. Нормальнью узлы не имеют УЗ-отображения, так как их акустическая плотность не отличается от таковой окружающих тканей. Метастатические узлы выглядят как гипоэхогенные образования шаровидной формы с гомогенной или негомогенной структурой. Пораженные метастазами и воспалительно измененные лимфоузлы не имеют специфических отличительных признаков, однако узлы диаметром свыше 8 мм считаются более характерными для метастазов. В области шеи эхография более эффективна, чем компьютерная томография.
Паращитовидные железы в норме вытянутой овальной формы до 1 см в диаметре образования, с пониженной эхогенностью, расположены между трахеей, общей сонной артерией и щитовидной железой, при глотании смещаются вместе с последней. Опухоли имеют овальную форму, пониженную эхогенность, отграничены от ткани щитовидной железы, дают высокое эхо по контуру и выявляются в 80% случаев.
При эхографии можно различить эхогенную кожу, жировую ткань низкой эхогенности, железистую и соединительную ткань различной эхогенности, млечные протоки, грудную фасцию и мышцы, ребра. Эхоструктура железы зависит от возраста и гормонального статуса (лактация, беременность, менопауза). Основным показанием к ультразвуковому исследованию молочных желез является наличие подозрительных на рак клинических признаков при неопределяемом пальпаторно и рентгенологически опухолевом узле. В этих случаях данные эхографии нередко позволяют визуализировать очаг и осуществить его прицельную пункционную биопсию. В основе получения УЗ-изображения карциномы железы лежит повышенное поглощение звука опухолью по сравнению с нормальными тканями в связи с фиброзированием стромы и обызвествлениями. При этом ткань опухоли, как правило, пониженной эхогенности, имеет нечеткие неровные контуры. При диффузной форме рака выявляются утолщенная кожа, расширенные лимфатические сосуды на фоне гиперэхогенной подкожной жировой клетчатки и гиперэхогенная с нечеткой дифференцировкой паренхима железы.
Хотя эхография представляет собой достаточно чувствительный метод выявления патологии в молочной железе, она не может рассматриваться как метод выбора в скрининге и диагностике рака. К недостаткам УЗИ относятся: трудности выявления микрокальцификатов. являющихся ранним признаком рака; отсутствие надежных дифференциально-диагностических критериев доброкачественных и злокачественных опухолей; достаточно высокая частота (до 15%) эхонегативных форм рака.
Поэтому в настоящее время УЗИ более успешно применяется в качестве дополнительного диагностического метода. В первую очередь это касается дифференциальной диагностики кистозных и солидных образований железы, где точность ультразвукового исследования достигает 96-100%, и возможности дифференцировать карциному и мастопатию у беременных и молодых женщин, а также у женщин любого возраста на фоне плотной железы. Печень легко доступна УЗИ, эхосемиотика опухолей ее изучена достаточно полно. Первичный рак печени в УЗ-изображении проявляются диффузными или очаговыми изменениями эхоструктуры. Диффузная форма рака характеризуется диффузным, равномерным увеличением печени с явлениями билиарной и портальной гипертензии.
Узловой рак по эхоплотности может быть как ниже, так и выше плотности окружающей паренхимы, а может и не отличаться от нее, вокруг опухоли имеется гипоэхогенный ободок (симптом «траурной каймы»). При сопоставлении эффективности ультразвукового исследования, рентгеновской компьютерной томографии (РКТ), ангиографии и радионуклидного исследования в диагностике рака печени установлено, что при опухолях размером 1-2 см УЗИ превосходит остальные методы, а при опухолях размером от 2 до 3 см незначительно уступает РКТ и ангиографии.
В тоже время под контролем УЗИ успешно применяется пункционная биопсия, что позволяет дифференцировать злокачественные и доброкачественные опухоли (см. ниже). Подавляющее большинство (90%) злокачественных процессов в печени являются метастатическими. Эхографически — это множественные или солитарные образования различной эхогенности (эхонегативные, пониженной и повышенной эхогенности), формы и контуров. Диффузное метастазирование проявляется множественными мелкими очажками, которые придают эхограммам печени вид «поеденных молью» или создают картину «снежной бури». Наиболее часто встречаются локальные метастазы повышенной эхогенности.
При этом решающее значение в постановке диагноза имеют наличие симптома гипоэхогенного ободка «halo sign») вокруг очагов, или симптома «бычьего глаза» («bull’s еуе» при центральном некрозе эхогенного метастаза, или симптом «мишени» («target sign») при гипоэхогенном метастазе с эхогенной центральной частью. Необходимо также помнить, что около 1% всех метастазов печени изоэхогенны с ее тканью и не видны даже при размерах 3 см.
Исследование производится натощак и в утренние часы (в это время нет аэрофагии). Очень важно, чтобы больной не курил, поскольку никотин в 12-перстной кишке стимулирует образование холецистокинина. вызывающего сокращение желчного пузыря. Проведенное многопозиционное исследование позволяет практически всегда диагностировать рак желчного пузыря. На ранней стадии развития карцинома может проявляться лишь утолщением стенки или полипом на широком основании, позднее представляют собой обычно мультицентрические бугристые экзофитные разрастания на стенке пузыря. Надо иметь в виду, что метастазы 8 желчном пузыре неотличимы от первичных опухолей. При раке печеночных протоков (опухоль Клацкина) имеются расширенные внутрипеченочные желчные протоки, а общий печеночный и общий желчный протоки не расширены, желчный пузырь — спавшийся. При карциноме общего печеночного протока расширены внутрипеченочные желчные протоки и проксимальная часть общего печеночного, в то время как общий желчный и пузырный протоки не расширены, а желчный пузырь — спавшийся.
При карциноме общего желчного протока расширены внутрипеченочные желчные протоки, общий печеночный проток, пузырный проток и часть общего желчного протока проксимальное опухоли, а желчный пузырь увеличен по типу Курвуазье.
Исследование производится натощак в различных положениях пациента и с желудком, наполненным водой. В норме эхогенность железы соответствует печеночной или слегка выше ее. Прямыми признаками опухоли при эхографии являются ограниченное увеличение объема железы, неровность контуров, пониженная эхогенность. При этом можно определить размеры и локализацию новообразования, а также метастазы в лимфатических узлах и печени. Удается выявлять опухоли до 1,5 см в диаметре. К косвенным признакам опухолей железы относятся расширение вирсунгова и желчных протоков, симптом Курвуазье или водянка желчного пузыря, асцит, компрессия нижней попой вены, окклюзия брыжеечной и портальной вен.
При локализации опухоли в теле железы может наблюдаться сдавление селезеночной вены со спленомегалией или без нее. Отрицательные данные ультразвукового исследования не исключают наличия опухоли железы.
В норме корковое вещество почки имеет эхогенность чуть ниже или равную эхогенности печени и селезенки, а почечные пирамиды — гипоэхогенны относительно коры. Злокачественные новообразования почки эхографически выглядят крупными, чаще с пониженной эхогенностью и неоднородной структурой, образованиями неправильной округлой формы с неровными контурами Минимальные размеры обнаруживаемой опухоли — 2,5-3 см.
Можно также выявить и оценить распространенность опухолевого тромба в почечной и нижней полой венах, врастание опухоли в сосуды, метастатические узлы в воротах органа, ограничение подвижности почки при дыхании в случае прорастания опухоли в соседние ткани.
Опухоли мочевого пузыря эхографически выявляются, если они превышают 0,5 см в диаметре и представляют собой ворсинчатое образование на широком основании. Часто выявляются признаки солевой инкрустации опухоли. При первично-инфильтратавном раке или инфильтрации опухолью стенки пузыря на эхограммах регистрируется утолщенная стенка органа, теряется ее обычная слоистая структура. Предстательная железа лучше всего эхографически исследуется с помощью ректального датчика. На начальных этапах опухолевого роста выявляется неоднородность структуры и асимметрия железы, а в дальнейшем — узел с неравномерной эхогенностью, нечеткими контурами, разрушением капсулы органа и инфильтрацией окружающих структур. При аденомах отмечается симметричное увеличение органа, его округление при сохранении гомогенной структуры и четких контуров. Дифференциальный диагноз рака и аденомы предстательной железы труден. Забрюшинные опухоли подразделяются на злокачественные (первичные и вторичные) и доброкачественные. Самыми частыми первичными опухолями являются злокачественные и доброкачественные аналоги новообразований мышечной, жировой, сосудистой тканей и нейрогенные опухоли. Среди вторичных преобладают злокачественные лимфомы, рецидивы и метастазы различных опухолей. Первичные опухоли обычно широким основанием расположены на пояснично-подвздошной мышце, растут вдоль телa, но преимущественно вентрально.
Эхографическая картина их может быть различной; гомогенные или гетерогенные, эхопозитивные или эхонегативные, с полостями и участками обызвествления и т.д. Центральные некрозы и кровоизлияния могут быть столь обширными, что имитируют кисту поджелудочной железы. Постоянно наблюдаются смещение соседних органов и гидронефроз той или иной степени.
Эхографически могут быть обнаружены увеличенные как париетальные, так и висцеральные лимфоузлы. Нормальные лимфатические узлы на эхограммах не видны. Минимальные размеры выявляемых узлов — 1-1,5 см для парааортальных и 2-3 см — для подвздошных групп Во всех случаях выявляются конгломераты округлых или овальных четко очерченных образований пониженной эхогенности.
При исследовании лимфоузлов в динамике необходимо помнить, что лучевая и химиотерапия приводит к повышению их эхогенности. В ряде случаев увеличение забрюшинных узлов можно определить по смещению сосудов. Самая частая причина ложноположительных заключений — трактовка жидкости в петлях кишечника как увеличение лимфоузлов.
Эхосемиотика опухолей мягких тканей пока что наименее изучена, однако на эхограммах отчетливо дифференцируются анатомические структуры (кожа, подкожная клетчатка, фиброзные перегородки, сухожилия и отдельные мышцы, крупные артерии и вены, полости суставов и кортикальный слой костей), на фоне которых хорошо различаются и патологические изменения. Эхография используется в дифференциальной диагностике опухолей и неопухолевых заболеваний мягких тканей (воспалительных процессов, аневризм и кист). УЗИ позволяет также установить истинные размеры и локализацию опухоли, ее связь с магистральными сосудами. Особое значение данный метод имеет в выявлении послеоперационных рецидивов, которые клинически обнаруживаются поздно.
Злокачественные опухоли (первичные саркомы, метастазы) представляются образованиями пониженной эхогенности, неоднородной структуры и с участками некроза и обызвествления. Среди доброкачественных опухолей мягких тканей УЗИ наиболее эффективно в диагностике десмоидов — фиброзных опухолей с местно-инфильтрирующим ростом. Для них характерны уплощенная дисковидная форма, пониженная эхогенность, однородная структура, тяжи инфильтрации в окружающую мышечную ткань.
Для успешного исследования органов малого таза необходимо хорошее наполнение мочевого пузыря, который служит «акустическим окном». В норме легко распознаются влагалище, шейка и тело матки, яичники. Визуализация органов возможна двумя способами: через переднюю брюшную стенку (трансабдоминально) и со стороны влагалища (трансвагинально). Эхографически выявляются опухолевые узлы и кисты более 1.5-2 см в диаметре, одновременно решается вопрос к матке или яичнику относится пальпируемое образование, солидный или кистозный его характер, выявляется наличие асцита даже в небольшом количестве и пр. При раке яичников конкретных ультразвуковых признаков нет, но чем больше опухоль, тем вероятнее ее злокачественная природа.
Рак вызывает увеличение яичника, как правило, одностороннее, стенка кистовидной опухоли имеет утолщения. Рак эндометрия характеризуется увеличением размеров матки, скоплением внутриматочного содержимого, гипоэхогенной опухолевой структурой в стенке матки.
В настоящее время наряду с термином чрескожные малоинвазивные вмешательства под ультразвуковым контролем, в литературе часто встречаются такие термины, как интервенционная эхография, интервенционная радиология (распространено за рубежом), чрескожные малоинвазивные операции, малоинвазивные вмешательства, малоинвазивные технологии. Внедрение в клиническую практику новых методов визуализации во многих случаях облегчает задачи дифференциальной диагностики. Однако и они не дают абсолютно достоверной информации для постановки правильного диагноза.
Указанные обстоятельства явились толчком к развитию в последние годы специальных методов исследования — биопсий под контролем ультразвукового исследования или компьютерной томографии (КТ), обеспечивающих надежный контроль за манипуляциями и положением иглы в исследуемых органах и высокую результативность пункций.
Применение целенаправленных пункций под контролем ультразвука послужило толчком к развитию лечебных инвазивных вмешательств. Выполнение биопсий и вмешательств под контролем РКТ менее распространено ввиду высокой лучевой нагрузкой на медперсонал и больного, высокой стоимости исследования, недоступности для основной массы больниц и поликлиник.
Под УЗ-контролем проводятся диагностические пункционные биопсии с забором материала для цитологического и гистологического исследований при очаговых и диффузных изменениях в паренхиматозных органах (печень, почки, щитовидная, предстательная и молочная железы) мягких тканях; при скоплении жидкости в естественных (перикард и плевральная полость) и образовавшихся полостях; для чрескожного рентгеноконтрастного исследования желчных путей, вирсунгова протока и др. Под УЗ-контропем могут выполняться лечебные пункции: чрескожное наружное дренирование желчных путей при механической желтухе (холецистостомия) или эндопротезирование, когда катетер с помощью проводника проводится из холедоха в просвет 12-перстной кишки, что при опухоли позволяет на определенное время сохранить проходимость общего желчного протока; лечение пункциями или дренированием под УЗ-контролем вне- и органных абсцессов, гнойных процессов перикарда и плевральной полости, кист, амниоцентез и др.
В последние годы сформировалось новое направление в использовании эхографии — ультразвуковая диапевтика — лечебные чрескожные вмешательства путем введения в патологический очаг (опухоль, кисты) лекарственных средств. Например, введение непосредственно в злокачественную опухоль или в метастатический очаг (печень) химиопрепаратов, спирта.
К противопоказаниям для пункции под УЗ-контролем относятся выраженные формы коагулопатий, повышенная проницаемость кровеносных сосудов, отсутствие согласия больного на проведение процедуры. Необходимо соблюдать осторожность при пункции гемангиомы печени. Наличие асцита при вмешательствах в брюшной полости требует проведения специальной подготовки. Применение специальной методики необходимо при пункции и лечении эхинококковой кисты. Методология чрескожных вмешательств под УЗ-контролем. Пункции выполняются под контролем УЗ-аппаратов, работающих в режиме реального времени, и с использованием специальных пункционных датчиков либо стандартных датчиков со специальными пункционными насадками. Необходимы также специальные иглы и катетеры. Для обозначения диаметра игл и других инструментов, в интервенционной радиологии традиционно используются собственные единицы измерения, не входящие в метрическую систему: дюйм (inch, сокращенно — i); френч (trench — Fr); годж (Gauge — G), соотношения между которыми составляют 1мм = 0,039i=3Fr=19G (1i=25,4 мм). Наибольшее распространение получила маркировка диаметра игл в годжах, причем, чем ниже цифра G, тем больше диаметр иглы. Например, диаметр иглы 14G=2,1mm; 20G=0,9 mm; 21G=0,8 мм. Все вмешательства выполняются в операционной, перевязочной или специальном кабинете инвазивной эхографии с соблюдением асептики и антисептики.
Пункция с целью получения материала для цитологического исследования проводится иглами диаметром 18-23G и называется тонкоигольной аспирационной биопсией (ТИАБ).
Забор материала для гистологического исследования (трепан-биопсия) производится иглами диаметром 14-16G. Пункции под УЗ-контролем могут выполняться методом «свободной руки» или с использованием специальных датчиков, либо боковых насадок к обычным датчикам.
На коже под контролем УЗ-исследования в двух проекциях находят наиболее близкую к очагу и удобную для пункции точку. По экрану оценивают глубину расположения середины очага и наиболее безопасный путь продвижения иглы (без подлежащих петель кишечника, крупных сосудов). После дезинфекций кожи и местной анестезии иглу вводят на соответствующую глубину. Положение кончика иглы в результате изменения наклона датчика можно видеть на экране в виде усиленного эхосигнала. Для лучшей визуализации в очаге и получения большего количества аспирата иглу следует слегка передвигать вперед и назад. После этого проводят забор материала шприцом. Метод получил распространение при ТИАБ щитовидной железы. Методика пунктирования различных органов и тканей методом «свободной руки» не является достаточно точной, особенно при глубоко расположенных очагах. Для повышения точности и возможности достоверно контролировать расположение иглы используется пункция с помощью боковой насадки на стандартные датчики или через центральный канал специального биопсийного датчика. После дезинфекции и местной анестезии делают разрез кожи или прокоп троакаром, затем пункционную иглу через гильзу насадки или датчика вводят в прокоп и при задержке дыхания направляют до середины очага. В очаге визуализируется кончик иглы в виде усиленного эхосигнала. На иглу надевают шприц, производят аспирацию, двигая при этом иглу в пределах очага взад и вперед, нивелируют давление в шприце и после этого удаляют иглу и воздухом выдувают содержимое на предметное стекло. Для получения достаточного материала пункцию можно повторить. Тонкоигольная аспирационная биопсия печени проводится с соблюдением правил асептики «секундным» методом по Менгини. После выбора места пункции проводят местную анестезию, а затем — собственно пункцию Для этого применяют стерильную иглу Менгини (диаметр 1,2-1,4 мм, с мандреном). После прокола кожи троакаром, вводится пункционная игла до печеночной капсулы, затем убирают мандрен из иглы, поршнем создается вакуум в шприце. В таком положении при задержке дыхания на высоте вдоха иглу быстрым движением вводят на желаемую глубину и тут же вынимают (отсюда название «секундный» метод). Аспират выдувают на предметные стекла. Вместо иглы Менгини широкое распространение получили биопсии с помощью специальных одноразовых наборов типа «Sonopsy» от 21 до 18G, включающие стерильные иглу, мандрен, специальный шприц. ТИАБ печени иглами 18-21G применяется только для диагностики очаговых образований и при невозможности выполнения трепанобиопсии печени.
В настоящее время применение «слепых биопсий» печени типа односекундного метода Менгини без УЗ-контроля считается грубой врачебной ошибкой, поскольку УЗ-контроль позволяет уменьшить число противопоказаний к проведению биопсии и снизить количество осложнений.
Недостатками биопсий тонкими иглами являются затруднения в интерпретации цитологического материала, поэтому в последнее время отмечается стремление получить материал для гистологического исследования. Для этой цели используют иглы с режущим концом от 14 до 16G, позволяющие получить материал для гистологического исследования. Трепанобиопсия иглой 14G позволяет получить столбик ткани длиной 15-22 мм и шириной до 2,1 мм. что обеспечивает проведение полноценного гистологического исследования. Для выполнения трепанобиопсии печени используют специальные иглы типа TRU-GUT, Quik-GUT, их модификации и аналоги. Широкое распространение получили специальные устройства (биопсийные пистолеты) для автоматического и полуавтоматического получения биоптатов. Помимо сокращения времени выполнения процедуры, упрощается техника получения биоптатов, улучшается их качество. Выбранное на коже место для пункции дезинфицируют, проводят местную анестезию. После разреза кожи скальпелем, под УЗ-контролем вводится игла до зоны биопсии и забирается материал. Полученный столбик ткани помещают во флакон с формалином и выполняют УЗ-контропь зоны биопсии. При отсутствии признаков кровотечения накладывают шов на кожу, асептическую повязку. В течение 2-5 часов обязателен строгий постельный режим. Пункция поджелудочной железы с диагностической и лечебной целью применяется реже, чем печени, что обусловлено плохой доступностью органа для проведения манипуляции, а также возможностью осложнений, вплоть до развития панкреонекроза. Основным показанием к проведению пункции железы является дифференциальная диагностика между очаговыми изменениями злокачественного и доброкачественного характера.
Наличие желтухи не является противопоказанием к манипуляции. Для диагностической биопсии применяют иглы диаметром от 0,7 до 1,2 мм, материал исследуется цитологически, хотя имеются сообщения о трудностях его интерпретации. Вместе с тем биопсия успешна в 90-95% случаев, если очаг составляет более 2 см в диаметре. В настоящее время все большее внимание привлекает целесообразность пункции и дренирования кист поджелудочной железы, оментобурситов.
Различают местные и общие осложнения диагностических и лечебных пункций. Местные связаны с введением в органы и ткани пункционной иглы (повреждение органов, кровотечение, истечение жидкостей из постпункционного канала, диссеминация опухолей и паразитарных заболеваний, нагноение и др.). Наиболее частые местные осложнения пункции — кровотечения и гематомы, которые возникают в течение первых 2-3 часов и сопровождаются болевым синдромом. Частота возникновения гематом прямо пропорциональна толщине пункционной иглы. Поэтому после проведения трепанобиопсии иглами 14-16G необходима особая осторожность. Общие осложнения связаны с ответной реакцией организма на отдельные компоненты вмешательства: болевой и вагусный синдром (головокружение, тошнота, потоотделение, гипотензия, коллапс), аллергические реакции на средства анестезии, премедикации и лечения.
Как местные, так и общие осложнения пункций могут быть ранними (в течение 24 часов после пункции) и отсроченными (поздними), появляющимися в течение 1-5 суток. Следует учитывать возможность осложнений, возникающих в 10-25% случаев выполнения дренирования при патологии органов брюшной полости (смещение дренажной трубки, развитие перитонита, профузного кровотечения), что часто требует выполнения хирургического вмешательства.
Аппараты для УЗИ в серой шкале со стандартным набором УЗ-датчиков гораздо дешевле современных импортных рентгенодиагностических аппаратов. Цена соответственно возрастает при оснащении дополнительными датчиками. Аппараты с цветной допплерографией значительно дороже. УЗИ в республике достаточно распространено и является вторым по доступности методом после рентгеновского исследования. В целом, ультразвуковое исследование, обладая высокой разрешающей способностью и специфичностью, является наиболее безвредным и экономически выгодным методом. Поэтому клиническое обследование онкологического больного начинают именно с эхографии. Нередко ее данных достаточно для определения стадии рака, выбора оптимальных лечебных мероприятий, а также для оценки их эффективности. Угляница К.Н., Луд Н.Г., Угляница Н.К.