Антитела синтезируются в
Ответы@Mail.Ru: Что такое антигены и антитела (только пожалуйста не научной статьёй)
Антиген (англ. antigen от antibody-generator — «производитель антител») — это любая молекула, которая специфично связывается с антителом. По отношению к организму антигены могут быть как внешнего, так и внутреннего происхождения. Хотя все антигены могут связываться с антителами, не все они могут вызвать массовую продукцию этих антител организмом, то есть иммунный ответ. Антиген, способный вызывать иммунный ответ организма, называют иммуногеном [1]. Антигены, как правило, являются белками или полисахаридами и представляют собой части бактериальных клеток, вирусов и других микроорганизмов. Липиды и нуклеиновые кислоты, как правило, проявляют иммуногенные свойства только в комплексе с белками. Простые вещества, даже металлы, также могут вызывать продукцию специфичных антител, если они находятся в комплексе c белком-носителем. Такие вещества называют гаптенами. Антитела (иммуноглобулины, ИГ, Ig) — особый класс гликопротеинов, присутствующих на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов и в сыворотке крови и тканевой жидкости в виде растворимых молекул, и обладающих способностью очень избирательно связываться с конкретными видами молекул, которые в связи с этим называют антигенами. Антитела являются важнейшим фактором специфического гуморального иммунитета. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов. Антитела выполняют две функции: антиген-связывающую и эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента). Антитела синтезируются плазматическими клетками, которыми становятся некоторые В-лимфоциты, в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом — характерным фрагментом поверхности или линейной аминокислотной цепи антигена. Антитела состоят из двух лёгких цепей и двух тяжелых цепей. У млекопитающих выделяют пять классов антител (иммуноглобулинов) — IgG, IgA, IgM, IgD, IgE, различающихся между собой по строению и аминокислотному составу тяжёлых цепей и по выполняемым эффекторным функциям. Сорри, но тут уже все разжевано как можно легче. Если знаний в химии/биологии нет или мало - то не поймешь
Биология для студентов - 19. История открытия антител. Биосинтез антител как основная форма иммунного ответа
Все началось в далеком 19 веке. В 1890 г. Э. Беринг и С. Китасато установили, что сыворотки кроликов, которым вводили дифтерийный токсин, приобретали способность нейтрализовать этот токсин и оказывать лечебное действие при дифтерийной инфекции. Так были открыты антитела.
Примерно в это же время, в конце 19 века, Пауль Эрлих установил, что антитела, отвечающие за иммунные реакции, имеют на своей поверхности специальные рецепторы, с помощью которых они прикрепляются к чужеродному объекту и связывают его. Он установил присутствие в плазме крови особых белков, способных нейтрализовать микробные тела (отсюда название – антитела, т.е. факторы против микробных тел). За обоснование гуморальной теории иммунитета П. Эрлих получил Нобелевскую премию в 1908 году.
В 1952 году О. Брутон впервые в мире описал клинический случай агаммаглобулинемии у людей (болезни отсутствия антител) и успешно апробировал заместительную терапию γ-глобулином, полученным из сыворотки крови здоровых доноров.
Всем известный термин «иммуноглобулины» предложил Дж. Хереманс в 1959 году. Это название оказалось весьма удачным, потому вмещало в себя и структурную, и функциональную характеристику антител. Позже Джеральд Эдельман и Родни Портер расшифровали химическую структуру антител, за что в 1972 году получили Нобелевскую премию.
В дальнейшем Нельс Эрне, Цезарь Мильштейн и Георг Келлер обосновали теорию идиотипической цепи (идиотип – участок антитела, ответственный за специфическое взаимодействие с антигеном), а также разработали методику получения гибридом, что позволило синтезировать моноклональные антитела к разнообразным молекулам. С тех пор моноклональные иммуноглобулины с успехом используются для диагностики и лечения многих болезней человека. За эти открытия учёные получили Нобелевскую премию в 1984 году.
Исследователь Сусуми Тонегава открыл механизм формирования неограниченного разнообразия антител, который получил название реаранжировки генов иммуноглобулинов. Стало ясно, что человеческий организм приспосабливается к условиям окружающей среды не только фенотипически, но и на генотипическом уровне. Молекулярной основой такой адаптации является пожизненное формирование новых генов антигенс-вязывающих сайтов иммуноглобулинов путём запуска процессов рекомбинативной изменчивости. В 1987 году С. Тонегава удостоен Нобелевской премии по физиологии и медицине.
Не сложно заметить, что за работы в области изучения антител уже получены 4 Нобелевские премии. Данный случай - уникальный прецедент в работе Нобелевского комитета, поскольку такому количеству наград не удостаивались открытия ни по одной другой теме физиологии и медицины. Это указывает на чрезвычайную важную роль иммуноглобулинов в иммунных процесса.
Антитела (иммуноглобулины, ИГ, Ig) — белковые соединения плазмы крови, образующиеся в ответ на введение в организм человека или теплокровных животных бактерий, вирусов, белковых токсинов и других антигенов. Связываясь активными участками (центрами) с бактериями или вирусами, антитела препятствуют их размножению или нейтрализуют выделяемые ими токсические вещества.
Антитела являются особым классом гликопротеинов, имеющихся на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов и в сыворотке крови. Антитела являются важнейшим фактором специфического гуморального иммунитета. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов.
Антитела выполняют две функции:
- антигенсвязывающую,
- эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками, которыми становятся некоторые В-лимфоциты, в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом — характерным фрагментом поверхности или линейной аминокислотной цепи антигена.
Общий план строения иммуноглобулинов: 1) Fab; 2) Fc; 3) тяжёлая цепь; 4) лёгкая цепь; 5) антиген-связывающийся участок; 6) шарнирный участок
Антитела являются относительно крупными (~150 кДа — IgG) гликопротеинами, имеющими сложное строение. Состоят:
- из двух идентичных тяжёлых цепей (H-цепи, в свою очередь состоящие из VH, CН1, шарнира, Ch3- и Ch4-доменов),
- из двух идентичных лёгких цепей (L-цепей, состоящих из VL- и CL- доменов).
К тяжёлым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding — антигенсвязывающий фрагмент) и один Fc (англ. fragment crystallizable — фрагмент, способный к кристаллизации). В зависимости от класса и исполняемых функций антитела могут существовать как в мономерной форме (IgG, IgD, IgE, сывороточный IgA), так и в олигомерной форме (димер-секреторный IgA, пентамер — IgM). Всего различают пять типов тяжёлых цепей (α-, γ-, δ-, ε- и μ-цепи) и два типа лёгких цепей (κ-цепь и λ-цепь).
Антитела
Глобулины сыворотки крови человека и животных, образующиеся в ответ на попадание в организм различных антигенов (принадлежащих бактериям, вирусам, белковым токсинам). Антитела вступают в реакции специфического взаимодействия с данными антигенами, в результате чего происходит дезактивация соответствующих бактерий, вирусов и токсинов.
Антитела являются важным элементом иммунной системы и принимают участие во многих процессах, отвечающих за защиту организма. Человек ежедневно сталкивается с огромным количеством чужеродных агентов, со многими из которых он встречается впервые, что создает потребность в постоянной адаптации защитных систем организма, представленных клеточным иммунитетом, исполнение задач которого возложено на специализированные клетки, и гуморальным, представленным специфическими (антитела) и неспецифическими структурами. Огромный прогресс в исследовании механизмов функционирования и регуляции иммунитета был достигнут в конце XIX века работой двух великих ученых – Ильи Мечникова, основоположника клеточной теории, и Пауля Эрлиха, основоположника гуморальной теории.

Антитела представлены белковыми молекулами Y-образной формы, состоящими из четырех полипептидных цепей (двух идентичных легких и тяжелых). Каждая легкая цепь соединена только с одной тяжелой цепью, в то время как тяжелые цепи соединены между собой. Антитела имеют три конца, два из которых называются Fab-фрагментами (fragment antigen binding, то есть фрагментами, отвечающими за связывание антигенов) и один – Fc -фрагментом (название обусловлено его тенденцией к кристаллизации в растворах). Fc фрагмент отвечает за выполнение биологических функций антител, связываясь с рецепторами на лимфоцитах и макрофагах или вызывая активацию комплемента.
Некоторые антитела объединены в мультимеры, состоящие из двух и более молекул, соединенных между собой.
Благодаря широкой вариабельности Fab-фрагментов, антитела способны связывать огромное количество антигенов, включающих как макромолекулы, так и маленькие химические соединения. Участки антигенов, содержащие уникальную последовательность химических соединений, узнаваемую антителами, называют эпитопами. Сила, с которой Fab-фрагмент взаимодействует с эпитопом, называется аффинитетом.
Антитела могут как свободно циркулировать, так и быть связанными с мембраной, являясь рецепторами В – лимфоцитов. У Т-лимфоцитов же рецепторами могут быть только ТCR (T cell receptor complex). Секретируемые антитела в норме представлены в крови и на слизистых, выполняя функции нейтрализации и удаления микробов и токсинов. Антитела также называют иммуноглобулинами, когда они попадают в кровоток, на слизистую или становятся рецепторами В-лимфоцитов.
После взаимодействия Fc фрагмента с антителом, связанным с антигенной детерминантой, сигнал через специальный комплекс передается внутрь клетки, приводя к ее активации.
Важно понять, что узнавание чужеродных агентов происходит в случайном порядке, и совпадение между индивидуальными участками антигенов и Fab-фрагментами антител обусловлено огромным количеством и вариабельностью клонов лимфоцитов.
Антитела у детей
Иммунитет у новорожденных не способен полноценно противостоять всем угрозам внешней среды, что обусловлено низкой степенью его развития. Постепенное совершенствование иммунного ответа происходит параллельно с развитием других органов и систем, однако на протяжении этого процесса можно наблюдать «критические периоды», сопровождаемые недостаточностью иммунной защиты.
Критические периоды:
Первый критический период длится первые 29 дней жизни и обусловлен тем, что иммунная защита ребенка представлена преимущественно антителами матери, попавшими в организм ребенка через плаценту или грудное молоко. В этом периоде повышен риск бактериальных и вирусных инфекций. Особое внимание следует уделить недоношенным.
Второй критический период наблюдается на 4-6 месяцах жизни и обусловлен истощением пула антител, попавших в организм ребенка от матери через плаценту и низкой способностью к синтезу своих антител. Кроме того, классом антител, производимым в этом периоде, являются антитела класса М. Почти полное отсутствие иммуноглобулинов G, являющихся главными защитниками, и других классов антител, приводит к низкой устойчивости ребенка в этом возрасте к инфекциям, передаваемым воздушно-капельным и кишечным путями.
Третий критический период можно наблюдать на 2-м году жизни, что связано с активной познавательной деятельностью ребенка и неполноценной иммунной защитой. В связи с недостаточной секрецией Ig А, отвечающего за местный иммунитет, сохраняется высокая восприимчивость к инфекциям, передаваемым воздушно-капельным и кишечным путями.
Четвертый критический период наблюдается на 6-7 годах жизни, что связано с физиологическим уменьшением количества лимфоцитов, однако сохраняющийся низкий уровень Ig A приводит к тому, что слизистые не способны полноценно противостоять инфекциям, передаваемым воздушно-капельным и кишечным путями. Кроме того, высокий уровень IgE, обусловленный значительной частотой глистных инвазий, повышает вероятность развития аллергических реакций в этой возрастной группе.
Пятый критический период наблюдается в подростковом возрасте и обусловлен относительным несоответствием объема органов иммунной системы фактическим размерам организма. Также повышение секреции половых гормонов приводит к угнетению клеточного компонента иммунной системы. Как правило, наблюдается высокая восприимчивость к заболеваниям вирусной природы.
У детей также могут встречаться наследственные заболевания, при которых наблюдается дефект гуморального звена иммунитета.
К дисгаммаглобулинемиям относят:
- Недостаток антител A класса;
- Недостаток антител G класса;
- Недостаток транскобаламина II;
- Гипер-IgM- синдром;
- Гипер-IgE синдром;
- Гипер-IgD синдром.
Антитела у взрослых

В зрелом возрасте у людей иммунная система, как правило, полностью сформирована и наделена большими компенсаторными возможностями, позволяющими адаптироваться к изменяющимся или тяжелым условиям окружающей среды. Однако вредное воздействие неблагоприятных факторов внешней среды может приводить к значительному снижению уровня иммунной защиты. Устранение вредных факторов, как правило, восстанавливает ее первоначальный уровень.
Антитела при беременности, влияющие на ее течение
Беременность является сложным физиологическим процессом, протекающим в течение длительного, порядка 40 недель в норме, срока. В этот период питание и дыхание плода, находящегося внутри материнского организма, осуществляется через гемоплацентарный барьер. Вместе с газами, растворенными в крови, и питательными веществами, через плаценту могут проходить иммуноглобулины. Однако, в норме не все антитела при беременности могут попадать в кровь плода. Этой способностью обладают только Ig G. Их основной целью в этом периоде является предотвращение развития внутриутробных инфекций или септических состояний.
К сожалению, не всегда антитела при беременности играют положительную роль. Так, развитие иммунных реакций, направленных против своего плода, не является редким явлением и может приводить к прерыванию беременности на ранних сроках.
Так, возможно формирование антител при беременности к белковым структурам на поверхности плода, отвечающим за резус-фактор или группу крови.
Резус-фактор присутствует у 85% населения и, при его наличии на поверхности эритроцитов, он считается положительным. При наличии положительного резус-фактора у плода, в то время как у матери он отрицателен, высока вероятность развития антител к эритроцитам и их последующему гемолизу. Выделяющийся при этом гемоглобин превращается в билирубин, в высоких концентрациях обладающий токсическим влиянием на нервную ткань. При условии, что мать не сталкивалась ранее с резус-положительной кровью и у нее отсутствуют антитела к резус-фактору, первая беременность может протекать без осложнений. Во время родов проводится инъекция анти-Д-иммуноглобулина, что в ряде случаев позволяет облегчить течение второй беременности и снизить риск резус-конфликта при повторной беременности до 10-15%. Однако, анализ на антитела может быть положительным и при несостоявшейся первой беременности и составляет 3% после выкидыша, после медицинского аборта в 5%, а при внематочной беременности- в 1% случаев.
Антитела при беременности к эритроцитам плода также могут вырабатываться у матери с I группой крови при рождении ребенка со II или III группами, что также может приводить к гемолизу эритроцитов, приводя к смерти плода.
Роль антител в материнском молоке

В связи с незрелостью иммунной защиты новорожденных, выработка собственных антител у них практически отсутствует, что значительно повышает риск развития инфекционных процессов. Сразу после родов в грудном молоке содержится огромное количество Ig A, отвечающих за защиту слизистых оболочек и значительно снижающих риск заболеваний инфекционной природы. Кроме того, в организме ребенка циркулируют антитела, попавшие в кровь ребенка через плаценту еще до родов.
Таким образом, использование заменителей грудного молока значительно ухудшает прогноз в отношении иммунной защиты и не должно происходить без серьезных показаний.
Антитела у пожилых
Так как антитела являются неотъемлемой частью иммунитета, нельзя оценивать их состояние отдельно от общего состояния иммунной системы.
У людей с возрастом в норме происходят изменения, затрагивающие иммунные процессы:
- инволюция тимуса;
- дегенеративные изменения костного мозга;
- дегенеративные изменения органов лимфоидной системы.
Инволютивные изменения в тимусе начинаются во время полового созревания и сказываются на эффективности клеточного компонента иммунитета, что повышает риск инфекционных и онкологических болезней.
В отличие от клеточного, гуморальный иммунитет меньше подвержен влиянию возраста, хоть и может наблюдаться незначительное снижение уровня естественных иммуноглобулинов.
Однако, из-за снижения эффективности клеточного и гуморального компонентов иммунитета, повышается вероятность образования аутоантител, что повышает риск развития ревматоидного артрита, тиреоидита и других аутоиммунных заболеваний. Одной из причин образования антител к собственным тканям является снижение контроля за клетками, которые подверглись мутациям и не были уничтожены клеточным иммунитетом.
Следует отметить, что отмечается снижение атопий при увеличении инфекционной и химической форм аллергии с повышением риска развития анафилактического шока.
Классы антител

Цепи, принимающие участие в образовании молекулы антитела, имеют вариабельные участки (формируются в результате сложного процесса отбора отдельных участков ДНК В-лимфоцитов и участвуют в формировании Fab-фрагментов) и константные участки (участвуют в формировании Fc-фрагментов и определяют биологические функции молекулы). В зависимости от того, какие константные участки были синтезированы, выделяют 2 вида легких цепей и 5 видов тяжелых цепей, однако определяющее значение играют тяжелые цепи, в зависимости от которых выделяют пять изотипов, или классов:
- Ig M;
- Ig D;
- Ig G;
- Ig E;
- Ig A.
Каждый изотип имеет определенные функции и биологические свойства.
Антигенными рецепторами неактивированных В-лимфоцитов являются связанные с мембраной Ig M или Ig D антитела. После одновременной стимуляции антигеном и Т-хелпером, В-лимфоцит, который соответствует конкретному антигену, активно делится и дифференцируется на разные клоны, синтезирующие определенные классы антител.
Антитела класса М
Продолжительность жизни составляет 5 дней.
Существуют в форме пентамера (состоят из пяти молекул антител формы Y, соединенных в области Fc-фрагмента).
Функции антител класса М:
- Активация комплемента;
- Рецептор В-лимфоцитов.
Антитела G класса
Продолжительность жизни составляет 23 дня. Существуют антитела G класса в качестве мономера, свободно циркулируя в кровотоке.
Функции Ig G:
- Опсонизация;
- Активация комплемента;
- Антитело-опосредованная цитотоксичность;
- Обеспечивают неонатальный иммунитет;
- Являются основными антителами, синтезирующимися в ответ на повторную активацию клеток памяти идентичным антигеном;
- Ингибирование активности В-лимфоцитов по способу обратной связи.
Антитела класса А
Продолжительность жизни составляет 6 дней. Существуют в форме мономеров, димеров и тримеров.
Функция антител класса Ig A заключается в защите слизистых от чужеродных агентов путем их связывания до попадания в ткани.
Антитела класса Е
Продолжительность жизни составляет 2 дня.
Антитела класса Е имеют две основные функции:
- Являются рецепторами базофилов;
- Отвечают на паразитарную инвазию.
Антитела класса D
Антитела класса D являются рецепторами В- лимфоцитов, в связи с чем продолжительность их существования определяется продолжительностью жизни иммунной клетки. В свободной, циркулирующей форме не существуют.
Как анализ на антитела помогает определить причину болезни
Анализ на антитела играет огромное, а в некоторых случаях даже решающее значение в постановке диагноза заболевания, так как он отражает протекающие в гуморальном звене иммунитета процессы.
Определение количества и подкласса антител позволяет судить о длительности и природе заболевания, а в некоторых случаях возможно определение конкретного возбудителя, вызвавшего болезнь, поэтому широко применяется в специализированных учреждениях при постановке таких диагнозов, как вирусный гепатит, ВИЧ и других.
Норма антител
В норме антитела можно обнаружить в кровотоке, на слизистых и, особенно, в лимфоидных органах, где в основном и происходит активация иммунного ответа. Это обусловлено постоянным контактом организма со внешней средой, состоящей из чужеродных агентов.
Для определения антител проводится ряд тестов, оценивающих количественные и качественные характеристики гуморального компонента иммунной системы. Также рекомендуется оценивать изменение их уровня в динамике.
Норма антител в сыворотке крови составляет:
- У мужчин: IgM (0,55-1,41 г/л); IgG (6,64-14,0 г/л); IgA (1,03-4,04 г/л);
- У женщин: IgM (0,37-1,95 г/л); IgG (5,87-16,3 г/л); IgA (0,54-3,43 г/л).
Повышены антитела одного или нескольких подклассов
Степень повышения антител может быть выражена в разной степени. Для правильной интерпретации результата на антитела важно оценивать изменение их уровня в динамике.
Если не произошло активации В-лимфоцита из-за отсутствия контакта с подходящим ему чужеродным антигеном, то последующей его трансформации в плазматическую клетку, являющуюся фабрикой про производству иммуноглобулинов, не происходит, и такие клетки ждут своего часа. Если же В-лимфоцит проконтактировал с чужеродным агентом, то большую роль играет место встречи и тип чужеродного агента, вызвавшего иммунную реакцию.
Возможно три варианта развития событий:
- В-лимфоциты в фолликулах селезенки после встречи с белковым антигеном и Т-хелпером активируются с последующим активным делением и дифференцировкой на длительно живущие плазматические клетки, синтезирующие Ig G, IgA и IgE;
- Краевые В-лимфоциты в селезенке после контакта с антигенами, являющимися общими чужеродными структурами для большинства инородных агентов, активируются с последующим активным делением и дифференцировкой на короткоживущие плазматические клетки, синтезирующие IgM;
- В-лимфоциты слизистых оболочек или брюшной полости после контакта с чужеродными агентами также активируются с последующим активным делением и дифференцировкой на короткоживущие плазматические клетки, синтезирующие IgM.
Таким образом, после проведения анализа крови на антитела и определения спектра и уровня антител, можно судить о происходящих в организме процессах.
Повышены антитела могут быть также при заболеваниях, сопровождающихся нарушениями в системе иммунитета. К ним относятся парапротеинемии, проявляющиеся наличием антител с функциональными и структурными дефектами при миеломной и ряде других болезней.
Для чего следует проводить определение антител
Анализ крови на антитела может существенно помочь в диагностике заболеваний, что имеет большое значение для выяснения природы заболевания и выбора наиболее верной тактики лечения. Также определение антител позволяет оценивать состояние искусственного активного иммунитета, полученного путем вакцинации и, таким образом, контролировать уровень заболеваемости и потребность в вакцинации.
Однако, к сожалению, антитела, призванные защищать организм человека, могут в результате различных нарушений атаковать нормальные ткани организма.
Основные причины этого явления:
- Высокая степень антигенной схожести чужеродных агентов с собственными тканями организма может приводить к тому, что вновь образованные антитела атакуют не только инородные структуры, но и свои собственные;
- Некоторые ткани организма, такие как хрусталик глаза и сперматозоиды в здоровом организме напрямую не омываются кровью, что защищает их от ошибочного распознавания организмом как чужеродных;
- В процессе созревания лейкоциты проходят несколько этапов отбора в лимфоидных органах, что позволяет выбраковывать дефектные клетки. Сбой этого сложного процесса приводит к образованию дефектных антител.
Положительные антитела
Положительные антитела, как правило, говорят о том, что пациент ранее встречался с чужеродным агентом, но это не всегда является результатом полноценного инфекционного процесса. Это стало возможным благодаря широкому введению вакцинации. Так, в качестве вакцины возможно применение живых, но ослабленнных организмов, или мертвых частиц, представленных продуктами их жизнедеятельности. Для борьбы с инфекциями, тяжесть которых зависит от выработки токсина, нашли применение вакцинации анатоксинами – токсинами, потерявшими свои опасные свойства в результате химической или физической обработки.
Тем не менее, положительные антитела с высокой уверенностью позволяют подтвердить или, напротив, исключить предполагаемого возбудителя заболевания.
Если результат на антитела положительный, это также можно использовать для контроля напряженности иммунитета с определением показаний к вакцинации или ревакцинации, проведение которых позволяет смягчать тяжесть заболеваний и предотвращать эпидемические вспышки.
Также положительные антитела могут определяться после переливания иммунной плазмы крови или прямого введения в кровоток уже готовых взятых у человека или животных иммуноглобулинов, что иначе называется искусственной пассивной профилактикой. Ее целью является предотвращение развития инфекционного процесса и заключается в быстром образовании иммунных комплексов с последующим развитием реакций, обусловленных биологическим эффектом антител.
Отрицательный результат на антитела

Отрицательный результат на антитела может наблюдаться в следующих ситуациях:
- ошибка в определении предполагаемого возбудителя, что говорит об отсутствии его роли в возникновении болезни;
- слишком раннее проведение диагностического теста;
- низкая чувствительность теста или его брак, что оправдывает возможность повторного проведения в ряде случаев диагностического теста.
Тем не менее, отрицательный результат на антитела не является абсолютным доказательством отсутствия заболевания. Примером может служить вирус иммунодефицита человека, антитела к которому определяются со значительной задержкой. Поэтому проведение полноценного физического и лабораторного обследования, а также оценка наличия антител являются частью единого комплекса мероприятий.
Антиспермальные антитела
Антиспермальные антитела взаимодействуют с антигенами на поверхности сперматозоидов. Впервые они были определены в крови мужчин, страдающих бесплодием, и описаны Rumke и Wilson в 1954 г. Эти антитела определяются у каждого пятого мужчины с бесплодием и представлены, как правило, IgG, реже IgA и IgM. Антиспермальные антитела в норме также можно обнаружить у мужчин без нарушений репродуктивной функции в 1-10% и у 5% бесплодных женщин.
Аутоиммунные антитела не возникают в норме благодаря гематотестикулярному барьеру, изолирующему клетки, принимающие участие в сперматогенезе. В основе этого барьера находятся клетки Сертоли и их отростки. В семявыносящих путях защита от образования антител осуществляется способностью сперматозоидов освобождаться от антигенов и антител на внешней оболочке, а также специальными иммуносупрессирующими факторами, находящимися в семенной жидкости.
При сбое защитных механизмов, травмах мошонки и воспалительных заболеваниях репродуктивной системы повышается вероятность образования антиспермальных антител.
Образование антиспермальных антител возможно и у женщин. В норме этого обычно не наблюдается, однако принято считать, что сопутствующие заболевания репродуктивной системы повышают риск развития этого явления.
На современном этапе не существует однозначного мнения о влиянии антиспермальных антител на репродуктивные свойства сперматозоидов, хотя и считается, что они несколько снижают их подвижность и выживаемость.
Антитела к тиреопероксидазе

В норме антитела к тиреопероксидазе (ТПО) не наблюдаются и, по факту, являются проявлением аутоиммунных процессов, направленных против щитовидной железы. У человека этот фермент отвечает за образование радикалов йода, необходимых для формирования Т3 и Т4, поэтому антитела к ТПО часто снижают синтез этих гормонов.
Антитела к тиреопероксидазе характерны для:
- тиреоидита Хашимото;
- диффузного токсического зоба;
- послеродового тиреоидита;
- аутоиммунного тиреоидита;
- гипертиреоза или гипотиреоза у новорожденных.
Показанием к определению антител к тпо является также подозрение на повреждение щитовидной железы аутоиммунной природы, что может проявляться:
- увеличением щитовидной железы без изменения ее функции;
- изменением функции щитовидной железы.
Антитела к ТПО могут приводить к нарушению регулирования синтеза гормонов, что клинически будет проявляться картиной гипотиреоза или гипертиреоза.
Уменьшение антител к тиреопероксидазе позволяет судить об успешности лечения.
Анализ на антитела к ТПО при получении результатов, вызывающих сомнение, рекомендуется проводить в сочетании с другими анализами повышающими точность проводимого исследования. К ним относят определение:
- антител к рецептору ТТГ (анти-pTTГ);
- антител к тиреоглобулину (антиТГ);
- кальцитонина в сыворотке крови;
- тиреоглобулина;
- тиреотропного гормона (ТТГ);
- тироксина свободного (Т4 свободный);
- тироксина общего (Т4);
- трийодтиронина общего (Т3);
- трийодтиронина свободного (Т3 свободный).
Антитела к ТПО и беременность
Определение антител к тпо у матери во время беременности позволяет предположить развитие гипертиреоза у ребенка как в течение внутриутробного развития, так и после рождения.
Показанием к определению антител к тпо могут быть такие патологические явления, как выкидыш, преэклампсия, преждевременные роды и неудачные попытки искусственного оплодотворения.
Также рекомендуется определение антител к тиреопероксидазе у новорожденного при их наличии у матери во время беременности или послеродового тиреоидита. Выявление отклонений позволяет предотвратить их прогрессирование путем своевременного начала лечения.
Антитела к гепатиту с,в,д,а,е

Определение антител к гепатитам С, В, D, А, Е играет большое значение в выявлении и дифференциальной диагностике этих, большей частью, небезобидных заболеваний. Так, из всех этих заболеваний только гепатит А протекает в большинстве случаев безвредно, в то время как остальные вирусные гепатиты могут приводить к тяжелым, необратимым последствиям.
Как правило, основным проявлением этих заболеваний является повышение печеночных ферментов и выраженная интоксикация. Однако понять, какой именно из вирусов поразил печень, может позволить только анализ на антитела к гепатитам С, В, D, А или Е.
Антитела к вирусу гепатита А класса Ig M определяются одновременно с манифестацией болезни, после чего их титр нарастает на протяжении месяца, снижаясь до нормальных значений в течение 10-12 месяцев.
При гепатите В диагностическое значение имеет определение антител к HBs-антигену. Их наличие может быть обусловлено как перенесенным инфекционным заболеванием, так и эффективной вакцинацией.
Анти-HBs-антитела появляются на 4-12-й неделе после инфицирования и образуют комплексы с HBsAg, в связи чем они могут не определяться, что называется «серологическим пробелом», продолжительностью от недели до месяца. Титры антител достигают максимума к 6-12 месяцам, и сохраняют высокий уровень 5 лет и больше. Иногда антитела могут определяться в течение всей жизни. Также имеет диагностическое значение анализ на антитела HBsAg, anti-HBc IgM, anti-HBc, HBeAg и anti-HBe.
Гепатит В в 90% случаев заканчивается выздоровлением, однако в 10% случаев его течение приобретает хронический, прогрессирующий характер поражения печени, что заканчивается чаще всего циррозом.
В ряде случаев к вирусу гепатита В присоединяется вирус гепатита D, не способный существовать самостоятельно. В этом случае определяется anti-HD IgM.
Антитела к гепатиту С у большинства инфицированных определяются спустя 1-3 месяца после заражения, но также возможно их отсутствие больше года. Антитела могут не определяться в 5% случаев.
Антитела к гепатиту С классов IgM и IgG возникают в начале болезни и образуются к нуклеокапсиду. При длительном, латентном течении или повторной активации заболевания отмечается появление IgG в крови.
Антитела G класса в течение 8-10 лет после манифестации болезни определяются в высоких титрах, после чего их концентрация постепенно снижается. Тем не менее, анализ на антитела к гепатиту С остается положительным до конца жизни.
В отличие от гепатита В, гепатит С более предрасположен к хроническому течению, что наблюдается в 90% случаев заболевания. Исходы те же, что и при гепатите В.
Проведение анализа на антитела к вирусу гепатита Е особенно важно для диагностики заболевания во втором периоде беременности, так как оно в 40% случаев заканчивается смертью матери, и почти всегда – плода.
Антитела к вирусу иммунодефицита
Вирус иммунодефицита человека является одной из самых болезненных проблем современного общества. В настоящее время, распространение ВИЧ носит характер пандемии, число случаев смерти от СПИДа превысило 20 млн. человек, а число инфицированных ВИЧ – 50 млн.
Основными путями передачи вируса являются половой (во время незащищенного полового акта) и парентеральный (характерен для внутривенных инъекций инфицированными шприцами или иглами). Однако, на сегодняшний день огромной проблемой стало распространение вируса при таких обыденных действиях, как лечение зубов у стоматолога, процедурах маникюра, педикюра и пирсинга. Также в особой зоне риска находятся врачи, в особенности – хирурги, анестезиологи и акушеры-гинекологи.
Особенностью ВИЧ-инфекции является отсутствие специфических клинических симптомов, в результате чего манифестация носит характер простуды или мононуклеозоподобного синдрома. Поэтому решающее значение в постановке диагноза имеет определение антител к вирусу иммунодефицита.
Для диагностики ВИЧ применяются скрининговый и подтверждающий тесты. Потребность в таком разделении методов диагностики обусловлено большей стоимостью и потребностью в наличии специализированного оборудования для проведения подтверждающего теста, что затруднило бы массовое проведение анализа на антитела к вирусу иммунодефицита.
Алгоритм диагностики ВИЧ:
- Проведение скринингового теста;
- При положительном результате первого, проводится второй скрининговый тест;
- При положительном втором скрининговом анализе показано проведение подтверждающего теста;
- Положительный подтверждающий тест позволяет поставить диагноз ВИЧ инфекции.
Как правило, в качестве скрининга используется метод ИФА.
В качестве подтверждающего теста во всем мире признан метод иммунного блоттинга.
Проведение ПЦР, даже при выявлении антигенов возбудителя, не является основанием для постановки диагноза вируса иммунодефицита человека.
Согласно требованиям ВОЗ, анализ на иммунный блот принято считать положительным при обнаружении антител ко всем, или к двум из трех гликопротеинам ВИЧ (gp160, gp 120, gp 41). Таким образом, при наличии антител только к одному гликопротеину, результат считают сомнительным и показано проведение повторного исследования с использованием тест-системы другого производителя или серии. При получении очередного сомнительного результата рекомендовано проведение наблюдения в течение последующих 6 месяцев, с повторным проведением анализа через 90 дней.
Через какое время можно учитывать анализ крови на антитела в оценке картины болезни
Однако определение антител ранее определенного момента не имеет смысла в связи с особенностями функционирования иммунной системы. Эффективность анализа крови на антитела в большей степени зависит от того, в какой раз человек встречается с чужеродным агентом. Так, если человек встречается с возбудителем болезни повторно, гуморальный ответ не только развивается быстрее, но обладает большей эффективностью, что обусловлено большей степенью соответствия эпитопов антигенам.
Для первой встречи с чужеродным агентом наблюдается преимущественное повышение антител класса М, достигающее пика и, соответственно, наибольшей эффективности через 5-10 дней. Антитела G класса появляются еще позже.
Для повторной встречи с чужеродным агентом характерно более быстрое формирование иммунного ответа в течение 1-3 дней, которое характеризуется более эффективным приростом количества антител. Антитела G класса играют основную роль в развитии иммунной защиты. Кроме того, при определенной стимуляции, возникает дифференцировка плазматических клеток с производством антител класса А или Е.
Таким образом, брать анализ крови на антитела ранее, чем через 5 дней после инфицирования в большом количестве случаев не имеет смысла, что обусловлено слишком коротким сроком для активации иммунного ответа, хотя при повторной встрече с возбудителем, анализ определит положительные антитела уже на 1-2 сутки после инфицирования. Однако, в связи с тем, что у большинства заболеваний инкубационный период длится более суток, точно определить идеальный момент для определения антител практически невозможно, из-за чего рекомендуется оценка их уровня в начале и конце заболевания.
Виды анализов на наличие антител в крови

Методом, позволяющим определить количественные характеристики антител каждого типа в организме, является электрофорез. Его действие основано на разнице в поведении белков на после их помещения в электрическое поле. Этот метод позволяет определить, повышены антитела или нет, но не дает возможности выяснить, против какого чужеродного агента они образованы и, таким образом, показывает лишь общую картину.
Серологические реакции позволяют определить отсутствие или наличие антител, обладающих специфичностью в отношении искомого антигена в биологических жидкостях.
К ним относят реакции:
- Агглютинации;
- Преципитации;
- Нейтрализации;
- С участием комплемента;
- С мечеными антителами или антигенами.
Агглютинацией называют связывание антигенов, связанных с крупными нерастворимыми частицами, такими как бактерии или эритроциты, при взаимодействии с антителами.
Агглютинация бывает следующих видов:
- прямая агглютинация (позволяет выявить антитела в сыворотке больного и проводится путем смешивания взвеси убитых микробов с кровью, что приводит к появлению хлопьевидного осадка);
- непрямая гемагглютинация (позволяет выявить антитела в изучаемом материале и проводится путем смешивания эритроцитов, на которых находятся фиксированные антигены, что приводит к появлению фестончатого осадка);
- реакция торможения гемагглютинации (в результате связывания антител с рецепторами вирусов, обладающих гемаглютинирующей способностью, склеивания эритроцитов животных, не происходит);
- реакция коагглютинации (антигены возбудителя определяются добавлением специально обработанных диагностической сывороткой стафилококков).
При реакции преципитации наблюдается выпадение в осадок комплексов антиген-антитело, где антигены должны быть растворимыми (не связанными с крупными, нерастворимыми частицами). После образования комплексов антиген-антитело выпадает осадок, называемый преципитатом. Положительным считается результат на антитела, при котором можно увидеть кольцо преципитата.
Реакцией нейтрализации называется блокирование повреждающего действия микробов или их токсинов после взаимодействия с иммунной сывороткой, что обусловлено их связыванием с антителами с образованием комплексов антиген-антитело.
Комплементом называют сложную систему врожденного гуморального ответа, которая после активации получает способность к опсонизации, облегчению фагоцитоза и цитолизу чужеродных агентов. При проведении реакции с участием комплемента используется его способность к взаимодействию с иммунными комплексами. Поэтому сначала смешивается интересуемая сыворотки с известными антигенами. Затем, если образовались комплексы антиген-антитело, белки комплемента исчерпываются. Если же образования комплексов не произошло, то система комплемента остается способной к активации. Для того, чтобы это выяснить, добавляются эритроциты и антиэритроцитарные антитела, которые связываются с образованием иммунных комплексов, после чего наблюдается гемолиз эритроцитов, обусловленный действием комплемента, или наблюдается хлопьевидный осадок, если активации не произошло.
Реакция с мечеными антителами или антигенами, или реакция иммунофлюоресценции основана на обработке изучаемого материала сывороткой, содержащей антигены или антитела, помеченные флюорохромами, что в случае образования иммунных комплексов дает возможность наблюдать свечение при освещении ультрафиолетовой лампой при изучении через микроскоп.
При применении не флюорохромов, а ферментов (пероксидазы или щелочной фосфатазы), метод называют иммуноферментным анализом. Результат оценивается по изменению окраски.
Радиоиммунологический метод позволяет определить наличие антител или антигенов, помеченных радионуклидами и их количество после взаимодействия с изучаемым материалом (антигенами или антителами в сыворотке пациента).
Моноклональные антитела и их применение
Одна клетка В-лимфоцитов способна производить антитела, комплементарные исключительно к одному антигену. Это было использовано для получения моноклональных антител, которые по праву можно считать одним из самых важных технических достижений в области иммунологии, с колоссальными перспективами для клинической медицины и научных исследований. Для того, чтобы получить моноклональные антитела, В-клетки от животного, иммунизированного антигеном, которые имеют короткий срок жизни, скрещивают с клетками миеломы (опухоли плазматических клеток), которые могут быть размножены бесконечное количество раз при обеспечении необходимых условий. Клетки, полученные путем такого слияния, называют гибридомами. Из популяции полученных гибридом можно выбрать и клонировать непрерывно растущие клетки, которые секретируют нужные антитела, которые называют моноклональными.
Огромное количество вариантов синтезируемых антител позволяет подобрать практически любые моноклональные антитела против практически любого антигена. Однако на пути широкого применения этого метода имелись определенные препятствия. Так как вещества, синтезируемые в чужом организме, чужеродны и вызывают иммунный ответ, повторное введение тех же препаратов не вызывало преследуемого эффекта. Впоследствии эта проблема была решена сохранением вариабельных областей, отвечающих за их соответствие антигенам, с заменой константных участков на человеческие.
Совсем недавно моноклональные антитела были синтезированы с использованием технологии рекомбинантной ДНК, кодирующей антитела человека. Это позволило выбирать антитела, имеющих желаемые Fab-фрагменты.
Моноклональные антитела широко применяются в качестве терапевтических и диагностических средств в борьбе со многими заболеваниями людей.
Антитела / лимфоциты
Антитела — молекулы, синтезируемые В-лимфоцитами. Их единственная цель — связывание с веществом, инородным для организма. Каждое антитело имеет сродство к определенной молекуле или группе молекул, образующих очень специфическую конфигурацию. В этом антитела отличаются от антибиотиков, которые врач назначает для борьбы с инфекцией. Антибиотики токсичны для целого ряда организмов. Например, пенициллин токсичен для всех грамотрицательных бактерий. Антитело же специфично к определенному участку или антигену на поверхности только одного вида бактерий.
Когда антитела были впервые выделены, их назвали глобулинами. Позже, когда доказали участие антител в иммунном ответе, их стали называть иммуноглобулинами. Дальнейшие исследования показали, что большинство иммуноглобулинов крови имеют гамма-конфигурацию. Таким образом, антитела стали называть гамма-глобулинами. Однако это не совсем точно, так как не все гамма-глобулины являются антителами.
Каждый В-лимфоцит может синтезировать только один специфический тип антител. Пока В-лимфоцит не встретит свой антиген, он находится в покоящемся (неактивном) состоянии с антителами, выступающими на поверхности в ожидании своих антигенов. Как только антиген встречается с В-лимфоцитом, имеющим на поверхности соответствующие антитела, он связывается с антителом. Образующуюся связь антитела с антигеном обычно сравнивают с тем, как ключ подходит к замку или перчатка к руке. Как только образуется комплекс антиген-антитело, В-лимфоцит активируется (рис. 5.3). Антитела, которые синтезирует В-лимфоцит, модифицируются так, что не просто выступают на поверхности клетки, а особым образом изгибаются в просвет сосудов кровеносной или лимфатической систем. В-лимфоцит начинает активно делиться, образуя колонии идентичных клеток, называемые клонами, которые образуют тот же тип антител. Когда антиген обезвреживается, колонии В-лимфоцитов снижают свою активность, но их число остается повышенным. Если организм опять встретится с тем же самым антигеном, возникнет усиленный во много раз вторичный иммунный ответ. Вторичный ответ отражает специфическую иммунологическую память об антигене. Способность организма обеспечивать усиленный ответ на антиген лежит в основе иммунитета, или невосприимчивости, к данному виду бактерий.
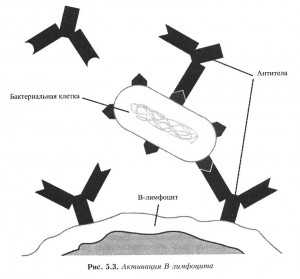
Рис. 5.3. Активация В-лимфоцита
Вы можете удивиться, как организм формирует специфические рецепторы для потенциально бесконечного разнообразия антигенов. В действительности это случайный процесс. Инородный белок оказывается подходящим к одному из сотен или тысяч рецепторов, с которыми мы все рождаемся и которые рассеяны по нашей иммунной системе. Конечно, случайное присутствие таких рецепторов может оказаться эволюционным преимуществом. Представьте себе популяцию организмов, постоянно подвергающуюся воздействию оспы. Спустя много поколений в такой популяции может сформироваться «хранилище» лимфоцитов с рецепторами к антигенам оспы. Таким образом, образуется популяция, устойчивая к оспе.
Во время созревания внутри В-лимфоцитов проходят уникальные процессы. Их генетический материал претерпевает изменения. Они заключаются в перемещении последовательностей ДНК, которые в структуре антитела кодируют участки узнавания и связывания антигена. Эта молекулярная перестройка называется соматической рекомбинацией. В иммунологическом плане мы не ограничены тем, что нам передали по наследству родители. Состав рецепторов для антигенов меняется, таким образом, с каждым индивидуумом, увеличивая разнообразие антител внутри популяции. В результате соматической рекомбинации даже однояйцовые близнецы будут иметь разные популяции В-лимфоцитов.
Обычно антиген подходит к одним рецепторам лучше, чем к другим. Иными словами, он имеет высокое сродство к одним рецепторам и низкое — к другим рецепторам. Таким образом, определенный антиген будет индуцировать образование ряда различных антител, некоторые из которых будут более эффективными, нежели другие (рис. 5.4). Популяция активных лимфоцитов не является моноклональной (происходящей от одного клона). Она скорее поликлональна, то есть происходит от целого ряда различных клонов лимфоцитов. Степень ответа отдельных клонов имеет тенденцию соответствовать степени сродства антигена к рецепторам данных клонов В-лимфоцитов. После того как лимфоцит активируется и получает способность к образованию антител, В клетка может претерпеть соматическую рекомбинацию. Это приводит к образованию нескольких новых типов клеток и позволяет организму отбирать клетки, имеющие наибольшее сродство к антигену.
Рис. 5.4. Клоны лимфоцитов образуют антитела с разным сродством к антигену
Фотокерамика на памятник фотокерамика на памятник цена. September 22nd, 2010 in Биотехнологии Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе