Альбумины и глобулины их свойства
Альбумины
В количественном отношении среди белков плазмы наиболее представлен альбумин(около 45 г/л), который играет существенную роль в поддержании коллоидно-осмотического давления в крови и служит для организма важным резервом аминокислот. Альбумин обладает способностью связывать липофильные вещества, вследствие чего он может функционировать в качестве белка-переносчика длинноцепочечных жирных кислот, билирубина, лекарственных веществ, некоторых стероидных гормонов и витаминов. Кроме того, альбумин связывает ионы Са2+и Mg2+. Альбумин также переносит некоторые лекарственные препараты.
К альбуминовой фракции принадлежит также транстиретин (преальбумин), который вместе с тироксинсвязывающим глобулином и альбумином транспортирует гормон тироксин и его метаболит иодтиронин.
Альбумины – простые низкомолекулярные гидрофильные белки. В молекуле альбумина содержится 600 аминокислот. Молекулярная масса 67 кДа. Альбумины, как и большинство других белков плазмы крови, синтезируются в печени. Примерно 40% альбуминов находится в плазме крови, остальное количество - в интерстициальной жидкости и в лимфе.
Глобулины
В отличие от альбуминов глобулины не растворимы в воде, а растворимы в слабых солевых растворах.
1-ГЛОБУЛИНЫ
В эту фракцию входят разнообразные белки. 1-глобулины имеют высокую гидрофильность и низкую молекулярную массу - поэтому при патологии почек легко теряются с мочой. Однако их потеря не оказывает существенного влияния на онкотическое давление крови, потому что их содержание в плазме крови невелико.
Функции 1-глобулинов
1. Транспортная. Транспортируют липиды, при этом образуют с ними комплексы - липопротеины. Среди белков этой фракции есть белки, предназначенные для транспорта гормонов: тироксин-связывающий белок – перенос тироксина, транскортин – транспорт кортизола, кортикостерона и прогестерона, кислый гликопротеин – транспорт прогетерона.
2. Участие в функционировании системы свертывания крови и системы комплемента- протромбин.
3. Регуляторная функция. Некоторые белки фракции1-глобулинов яляются эндогенными ингибиторами протеолитических ферментов. Наиболее высока в плазме концентрация1-антитрипсина. Содержание его в плазме от 2 до 4 г/л (очень высокое), молекулярная масса - 58-59 кДа. Главная его функция - угнетение эластазы - фермента, гидролизующего эластин (один из основных белков соединительной ткани).1-антитрипсин также является ингибитором протеаз: тромбина, плазмина, трипсина, химотрипсина и некоторых ферментов системы свертывания крови. К фракции1-глобулинов относят также1-антихимотрипсин. Он угнетает химотрипсин и некоторые протеиназы форменных элементов крови.
2-ГЛОБУЛИНЫ.
Высокомолекулярные белки. Эта фракция содержит регуляторные белки, факторы свертывания крови, компоненты системы компемента, транспортные белки. Сюда относится и церулоплазмин. Он является переносчиком меди, а также обеспечивает постоянство содержания меди в различных тканях, особенно в печени. При наследственном заболевании - болезни Вильсона - уровень церулоплазмина понижается. Вследствие этого повышается концентрация меди в мозге и печени. Это проявляется развитием неврологической симптоматики, а также циррозом печени.
Гаптоглобины.Содержание этих белков составляет приблизительно 1/4 часть от всех2-глобулинов. Гаптоглобин образует специфические комплексы с гемоглобином, освобождающимся из эритроцитов при внутрисосудистом гемолизе. Вследствие высокой молекулярной массы этих комплексов они не могут выводиться почками. Это предотвращает потерю железа организмом.
Комплексы гемоглобина с гаптоглобином разрушаются клетками ретикуло-эндотелиальной системы (клетки системы мононуклеарных фагоцитов), после чего глобин расщепляется до аминокислот, гем разрушается до билирубина и экскретируется желчью, а железо остается в организме, и может быть реутилизировано.
К этой же фракции относится и 2-макроглобулин. Молекулярная масса этого белка 720 кДа, концентрация в плазме крови 1.5-3 г/л. Он является эндогенным ингибитором протеиназ всех классов, а также связывает гормон инсулин.
С1-ингибитор- гликопротеид, является основным регуляторным звеном в классическом пути активации комплемента (КПК), способен угнетать плазмин, калликреин.
Транспортные белки:ретинолсвязывающий белок – транспорт витамина А, витамин Д- связывающий белок – транспорт витамина Д.
Компоненты системы свертывания крови и фибринолиза: антитромбинIIIи плазминоген.
-ГЛОБУЛИНЫ
К этой фракции относятся:
фибриноген- белок системы свертывания крови
белки компонентов системы активации комплемента
транспортные белки:трансферин (транспорт ионов железа), транскобаламин (перенос витамина В12), глобулин-связывающий половые гормоны (транспорт тестостерона и эстрадиола), ЛНП (транспорт липидов).
гемопексинпереносит свободный гем, порфирин. Связывает гемсодержащие белки и переносит их в печень для разрушения.
-ГЛОБУЛИНЫ
В этой фракции содержатся в основном антитела- белки, синтезируемые в лимфоидной ткани и в клетках РЭС, а также некоторые компоненты системы комплемента.
Функция антител - защита организма от чужеродных агентов (бактерии, вирусы, чужеродные белки), которые называютсяантигенами.
Главные классы антител в крови:
- иммуноглобулины G (IgG)
- иммуноглобулины M (IgM)
- иммуноглобулины A (IgA), к которым относятся IgD и IgE.
IgG и IgM способны активировать систему комплемента. Подробнее об иммуноглобулинах читайте в приложении 1 данного пособия.
К группе гамма-глобулинов относится также криоглобулины. Это белки, которые способны выпадать в осадок при охлаждении сыворотки. У здоровых людей их в сыворотке нет. Они появляются у больных с ревматическим артритом, миеломной болезнью.
Среди криоглобулинов существует белок фибронектин. Это высокомолекулярный гликопротеин (молекулярная масса 220 кДа). Он присутствует в плазме крови и на поверхности многих клеток (макрофагов, эндотелиальных клеток, тромбоцитов, фибробластов). Функциифибронектина: 1. Обеспечивает взаимодействие клеток друг с другом; 2. Способствует адгезии тромбоцитов; 3. Предотвращает метастазирование опухолей.
Плазменный фибронектин является опсонином - усиливает фагоцитоз. Играет важную роль в очищении крови от продуктов распада белков, например, распада коллагена. Вступая в связь с гепарином, участвует в регуляции процессов свертывания крови. В настоящее время этот белок широко изучается и используется для диагностики особенно при состояниях, сопровождающихся угнетением системы макрофагов (сепсис и др.)
Интерферон- это гликопротеин. Имеет молекулярную массу около 26 кДа. Обладает видовой специфичностью. Вырабатывается в клетках в ответ на внедрение в них вирусов. У здорового человека его концентрация в плазме мала. Но при вирусных заболеваниях его концентрация увеличивается.
Альбумины, глобулины, свойства. Сходство и отличие их друг от друга. Значение для животного организма, распространение в природе.
Альбумины, глобулины. Свойства. Сходство и отличия друг от друга. Значения для животного организма, распространения в природе.
А и Г белки, которые есть во всех тканях. Сыворотка крови наиболее богата этими белками. Содержание альбуминов в ней составляет 40-45 г/л, глобулинов 20-30 г/л, т.е на долю альбуминов приходится более половины белков плазмы крови.
Альбумины-белки относительно небольшой молекулярной массы (15-70 тыс. Да); они имеют отрицательный заряд и кислые свойства, ИЭТ - 4,7, содержат много глутаминовой аминокислоты. Это сильно гидратированые белки, поэтому они осаждаются только при большой концентрации водоотнимающих веществ.
Благодаря высокой гидрофильности, небольшим размерам молекул, значительной концентрации альбумины играют важную роль в поддержании осмотического давления крови. Если концентрация альбуминов ниже 30 г/л, изменяется осмотическое давление крови, что приводит к возникновению отеков. Около 75-80 % осмотического давления крови приходится на долю альбуминов.
Характерным свойством альбуминов является их высокая адсорбционная способность. Они адсорбируют полярные и неполярные молекулы, выполняя транспортную роль. Это неспецифические переносчики они транспортируют гормоны, холестерол, билирубин, лекарственные вещества, ионы кальция. Связывание и перенос длинноцепочных жирных кислот - основная физиологическая функция сывороточных альбуминов. Альбумины синтезируются преимущественно в печени и быстро обновляются, период их полураспада 7 дней.
Глобулины - белки с большей, чем альбумины молекулярной массой. Глобулины слабокислые или нейтральные белки ( ИЭТ = 6 – 7,3 ). Некоторые из глобулинов обладают способностью к специфическому связыванию веществ (специфические переносчики).
Возможно фракционирование белков сыворотки крови на альбумины и глобулины методом высаливания с помощью (Nh5)2SO4. В насыщенном растворе осаждаются альбумины как более легкая фракция, в полунасыщенном – глобулины.
Глобулины(от лат. globulus шарик) — семейство глобулярных белков крови, имеющих более высокую молекулярную массу и растворимость в воде, чем альбумины. Глобулины вырабатываются печенью и иммунной системой. Глобулины, альбумины и фибриноген называют основными белками плазмы крови. Нормальная концентрация глобулинов в крови 2.6-4.6 г/децилитр.
· составляют почти половину белков крови;
· определяют иммунные свойства организма;
· определяют свертываемость крови;
· участвуют в транспорте железа и в других процессах.
Протамины, гистоны, свойства. Сходство и отличие их друг от друга. Значение для животного организма, распространение в природе.
Гистоны (от греч. histos - ткань) - тканевые белки многоклеточных организмов, связанных с ДНК хроматина. Это белки небольшой молекулярной массы (11000-24000); по электрохимическим свойствам относятся к белкам с резко выраженными основными признаками (изоэлектрическая точка у разных гистонов колеблется в пределах 9,5-12,0). Гистоны имеют только третичную структуру. Выделяют 5 главных типов или фракций гистонов: Н1, Н2а, Н2b, Н3, Н4.
В естественных условиях гистоны прочно связаны с ДНК и выделяются в составе нуклеопротеида. Связь гистон - ДНК электростатическая, так как гистоны имеют большой положительный заряд, а цепь ДНК - отрицательный. Гистоноподобные белки встречаются в составе рибосом цитоплазмы клеток. У одноклеточных организмов некоторые из фракций гистонов отсутствуют. У бактерий нет типичных гистонов, а у вирусов есть гистоно-подобные белки.
Основные функции гистонов - структурная и регуляторная. Структурная функция состоит в том, что гистоны участвуют в стабилизации пространственной структуры ДНК, а следовательно, хроматина и хромосом. Четыре фракции гистонов, за исключением Н1, составляют основу нуклеосом, являющихся структурными единицами хроматина; фракция Н1 заполняет фрагменты ДНК между нуклеосомами. Регуляторная функция заключается в способности блокировать передачу генетической информации от ДНК к РНК.
Протамины - своеобразные биологические заменители гистонов, но качественно отличающиеся от них аминокислотным составом и структурой. Это самые низкомолекулярные белки (М 4000-12000), они обладают резко выраженными основными свойствами из-за большого содержания аргинина (до 80%). Как и гистоны, протамины - поликатионные белки; они связываются с ДНК в хроматине спермиев. Замена гистонов на протамины в хроматине спермиев наблюдается не у всех животных. Наиболее типично присутствие протаминов в составе нуклеопротамина в сперматозоидах рыб (в молоках). Отдельные протамины получили свое название по источнику получения: cальмин - протамин из молоки лосося; клупеин - из икры сельди; труттин - из молоки форели; скумбрин - из молоки скумбрии.
· Протамины делают компактной ДНК сперматозоидов, т. е. выполняют, как и гистоны, структурную функцию. Однако они, по-видимому, не выполняют регуляторных функций, поэтому и присутствуют в клетках, не способных к делению. Возможно, этим и объясняется биологическая замена в некоторых клетках гистонов на протамины.
· Свойства:
· Хорошо растворяются в воде, кислой и нейтральной среде.
· Осаждаются щелочами.
· Отсутствует денатурации при нагревании.
· Образуют соли с кислотами и комплексы с кислыми белками
Альбумины и глобулины
Наиболее известный вид альбумина — сывороточный альбумин. Он содержится в крови в сыворотке ,также может встречаться в других жидкостях (например, в спинно-мозговой жидкости).
Сывороточный альбумин синтезируется в печени и составляет большую часть среди всех сывороточных белков. Альбумин, содержащийся в крови человека, называется человеческий сывороточный альбумин, он составляет около 55 % от всех белков, содержащихся в плазме крови.
Нормальный уровень сывороточного альбумина у взрослых составляет от 35 до 50 г/л. Для детей в возрасте менее 3-х лет нормальный уровень — в пределах 25—55 г/л.
Низкий уровень альбумина (гипоальбуминемия) может возникать из-за болезни печени, нефритического синдрома, ожогов, энтеропатии с потерей белка, недоедания, на поздних сроках беременности, злокачественных новообразований. Приём ретинола (витамина А) может повысить уровень альбумина до высоких субнормальных значений(49 г/л).
Высокий уровень альбумина (гиперальбуминемия) почти всегда возникает в результате обезвоживания.
Глобулины (от лат. globulus шарик) — семейство глобулярных белков крови, имеющих более высокую молекулярную массу и растворимость в воде, чем альбумины. Глобулины вырабатываются печенью и иммунной системой. Глобулины, альбумины и фибриноген называют основными белками плазмы крови. Нормальная концентрация глобулинов в крови 2.6-4.6 г/децилитр.
составляют почти половину белков крови;определяют иммунные свойства организма;определяют свертываемость крови;участвуют в транспорте железа и в других процессах.
Гемоглобин в моче.
В первом случае, обнаружение в моче гемоглобина параллельно с эритроцитами – явление довольно обычное. Так как эритроциты достаточно быстро разрушаются (выщелачиваются)в моче из-за высокого рН или низкой осмоляльности мочи.
Во втором случае, истинная гемоглобинурия вызвана внутрисосудистым гемолизом эритроцитов (разрушением эритроцитов в крови). У здорового человека в крови ежедневно разрушается часть эритроцитов, поэтому в плазме содержится небольшое количество свободного гемоглобина. Свободный гемоглобин крови связывается гаптоглобином и таком виде не может проходить почечный фильтр.
Гемоглобинурия возникает, когда выделяется слишком много гемоглобина, который не успевает связываться гаптоглобином и способен проникать через почечный фильтр в мочу. Цвет мочи при гемоглобинурии приобретает темно-бурую (черную) окраску, выявляется анемия с ретикулоцитозом, повышается уровень непрямого билирубина в сыворотке крови, нередко появляются боли в пояснице. В отличие от гематурии (эритроциты в моче) при гемоглобинурии эритроциты в осадке мочи не обнаруживаются.
Дата добавления: 2016-06-18; просмотров: 1424; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Похожие статьи:
1.5. Классификация белков
В организме человека содержится свыше 50 000 индивидуальных белков, отличающихся первичной структурой, конформацией, строением активного центра и функциями. Однако до настоящего времени нет единой и стройной классификации, учитывающей различные особенности белков. В основе имеющихся классификаций лежат разные признаки. Так белки можно классифицировать:
по форме белковых молекул (глобулярные – округлые или фибриллярные – нитевидные)
по молекулярной массе (низкомолекулярные, высокомолекулярные)
по выполняемым функциям (транспортные, структурные, защитные, регуляторные и др.)
по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.)
по структурным признакам и химическому составу белки делятся на две группы: простые и сложные. Простые белки представлены только полипептидной цепью, состоящей из аминокислот. Сложные белки имеют в своем составе белковую часть и небелковый компонент (простетическую группу). Однако и эта классификация не является идеальной, поскольку в чистом виде простые белки встречаются в организме редко.
Характеристика простых белков.
К простым белкам относят гистоны, протамины, альбумины и глобулины, проламины и глютелины, протеиноиды.
Гистоны - тканевые белки многочисленных организмов, связаны с ДНК хроматина. Это белки небольшой молекулярной массы (11-24 тыс.Да). По электрохимическим свойствам относятся к белкам с резко выраженными основными свойствами (поликатионные белки), ИЭТ у гистонов колеблется от 9 до 12. Гистоны имеют только третичную структуру, сосредоточены в основном в ядрах клеток. Гистоны связаны с ДНК в составе дезоксирибонуклеопротеинов. Связь гистон-ДНК электростатическая, так как гистоны имеют большой положительный заряд, а цепь ДНК-отрицательный. В составе гистонов преобладают диаминомонокарбоновые аминокислоты аргинин, лизин.
Выделяют 5 типов гистонов. Деление основано на ряде признаков, главным из которых является соотношение лизина и аргинина во фракциях, четыре гистона Н2А, Н2В, Н3 и Н4 образуют октамерный белковый комплекс, который называют «нуклеосомный кор». Молекула ДНК «накручивается» на поверхность гистонового октамера, совершая 1,75 оборота (около 146 пар нуклеотидов). Такой комплекс гистоновых белков с ДНК служит основной структурной единицей хроматина, ее называют «нуклеосома».
Основная функция гистонов - структурная и регуляторная. Структурная функция состоит в том, что гистоны участвуют в стабилизации пространственной структуры ДНК, а следовательно, хроматина и хромосом. Регуляторная функция заключается в способности блокировать передачу генетической информации от ДНК к РНК.
Протамины - своеобразные биологические заменители гистонов, но отличаются от них составом и структурой. Это самые низкомолекулярные белки (М - 4-12 тыс. Да), обладают резко выраженными основными свойствам из-за большого содержания в них аргинина (80%).
Как и гистоны, протамины - поликатионные белки. Они связываются с ДНК в хроматине спермиев и находятся в молоках рыб.
Сальмин - протамин из молоки лосося.
Скумбрин - из молоки скумбрии.
Протамины делают компактной ДНК сперматозоидов, т.е. выполняют как и гистоны, структурную функцию, однако не выполняют регуляторную.
Альбумины и глобулины.
Альбумины (А) и глобулины (Г).
А и Г белки, которые есть во всех тканях. Сыворотка крови наиболее богата этими белками. Содержание альбуминов в ней составляет 40-45 г/л, глобулинов 20-30 г/л, т.е на долю альбуминов приходится более половины белков плазмы крови.
Альбумины-белки относительно небольшой молекулярной массы (15-70 тыс. Да); они имеют отрицательный заряд и кислые свойства, ИЭТ - 4,7, содержат много глутаминовой аминокислоты. Это сильно гидратированые белки, поэтому они осаждаются только при большой концентрации водоотнимающих веществ.
Благодаря высокой гидрофильности, небольшим размерам молекул, значительной концентрации альбумины играют важную роль в поддержании осмотического давления крови. Если концентрация альбуминов ниже 30 г/л, изменяется осмотическое давление крови, что приводит к возникновению отеков. Около 75-80 % осмотического давления крови приходится на долю альбуминов.
Характерным свойством альбуминов является их высокая адсорбционная способность. Они адсорбируют полярные и неполярные молекулы, выполняя транспортную роль. Это неспецифические переносчики они транспортируют гормоны, холестерол, билирубин, лекарственные вещества, ионы кальция. Связывание и перенос длинноцепочных жирных кислот - основная физиологическая функция сывороточных альбуминов. Альбумины синтезируются преимущественно в печени и быстро обновляются, период их полураспада 7 дней.
Глобулины - белки с большей, чем альбумины молекулярной массой. Глобулины слабокислые или нейтральные белки ( ИЭТ = 6 – 7,3 ). Некоторые из глобулинов обладают способностью к специфическому связыванию веществ (специфические переносчики).
Возможно фракционирование белков сыворотки крови на альбумины и глобулины методом высаливания с помощью (Nh5)2SO4. В насыщенном растворе осаждаются альбумины как более легкая фракция, в полунасыщенном – глобулины.
В клинике широкое распространение получил метод фракционирования белков сыворотки крови путем электрофореза. При электрофоретическом разделении белков сыворотки крови можно выделить 5–7 фракций: Характер и степень изменения белковых фракций сыворотки крови при различных патологических состояниях представляет большой интерес для диагностических целей. Уменьшение альбуминов наблюдается в результате нарушения их синтеза, при дефиците пластического материала, нарушении синтетической функции печени, поражении почек. Содержание глобулинов увеличивается при хронических инфекционных процессах.
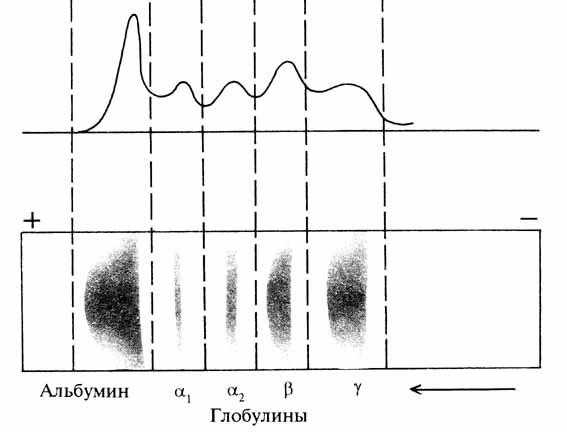
Электрофорез белков сыворотки крови.
Проламины и глютелины.
Это группа растительных белков, которые содержатся исключительно в клейковине семян злаковых растений, где выполняют роль запасных белков. Характерной особенностью проламинов является то, что они не растворимы в воде, солевых растворах, щелочах, но растворимы в 70% растворе этанола, в то время как все другие белки выпадают в осадок. Наиболее изучены белки глиадин (пшеница) и зеин (кукуруза). Установлено, что проламины содержат 20-25% глутаминовой кислоты и 10-15 % пролина. Эти белки, например, глиадин, в норме у человека расщепляются, но иногда при рождении фермент, расщепляющий этот белок, отсутствует. Тогда этот белок превращается в продукты распада, обладающие токсическим действием. Развивается заболевание целиакия - непереносимость растительных белков.
Глютелины – тоже растительные белки, не растворимые в воде, в растворах солей, этаноле. Они растворимы в слабых щелочах.
Протеиноиды.
Белки опорных тканей ( костей, хрящей, сухожилий, связок ), кератины - белки волос, рогов, копыт, коллагены - белки соединительной ткани, эластин - белок эластических волокон.
Все эти белки относятся к фибриллярным, не гидролизуются в желудочно - кишечном тракте. Коллаген составляет 25-33 % от общего количества белка организма взрослого человека или 6 % от массы тела. Пептидная цепь коллагена содержит около 1000 аминокислотных остатков, из которых каждая 3-я аминокислота – глицин, 20% составляют пролин и гидроксипролин, 10% аланин. При формировании вторичной и третичной структур этот белок не может давать типичных a-спиралей, поскольку аминокислоты пролин и оксипролин могут давать только одну водородную связь. Поэтому полипептидная цепь на участке, где находятся эти аминокислоты, легко изгибается, так как не удерживается, как обычно, второй водородной связью.
Эластин – это основной структурный компонент эластических волокон, которые содержатся в тканях обладающих значительной эластичностью (кровеносные сосуды, связки, легкие). Свойства эластичности проявляются высокой растяжимостью этих тканей и быстрым восстановлением исходной формы и размера после снятия нагрузки. В составе эластина содержится много гидрофобных аминокислот (глицина, валина, аланина, лейцина, пролина).
СЛОЖНЫЕ БЕЛКИ
Сложные белки кроме полипептидных цепей содержат в своем составе небелковую (простетическую) часть, представленную различными веществами. В зависимости от химической природы небелковой части выделяют следующие группы сложных белков:
хромопротеины
углевод – белковые комплексы
липид – белковые комплексы
нуклеопротеины
фосфопротеины
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе