ПОИСК
Высаливание. Классический метод разделения альбуминов и глобулинов сыворотки крови основан на осаждении последних, 2 М сульфатом аммония (50%-ное насыщение). Альбумины осаждаются лишь 4 М сульфатом аммония (100%-ное насыщение). Вместо сульфата аммония могут быть использованы и другие нейтральные соли — сульфат натрия, сульфат магния, смеси одно- и двухзамещенных фосфатов и др. Однако наибольшее распространение в качестве солевого осадителя — белков получил именно сульфат аммония. Это обусловлено главным образом тем, что высокая растворимость в воде сочетается у него с практической независимостью растворимости от температуры. Так, концентрация насыщенного раствора сульфата аммония при переходе от 25 к 0° снижается лишь с 4,1 до 3,9 М. Напротив, такие осадители, как, например, сульфат натрия, имеют ограниченную область применения из-за низкой растворимости при температуре, близкой к 0°. Сульфат аммония весьма удобен также тем, что не оказывает денатурирующего воздействия на самые лабильные из известных белков. [c.17] Свойства. Является представителем альбуминов. Альбумины — простейшие природные глобулярные белки, присутствующие во всех растительных и животных тканях в виде соединений с липидами, углеводами и другими компо- нентами клетки. Содержатся в белке яиц, сыворотке крови, молоке, семенах-, растений и др. Альбумины входят вместе с глобулинами в группу-растворимых белков, но отличаются от них способностью растворяться в дистиллированной воде и в полунасыщенном (50% насыщения) растворе сульфата аммония. Способны к образованию хорошо оформленных кристаллов, при нагревании кри- сталлы белков свертываются. При гидролизе альбуминов образуются различные аминокислоты (характерно наличие серусодержащих и дикарбоновых аминокислот и отсутствие или относительно низкое содержание гликокола), [c.26]
Глобулярные белки (от латинского слова 1оЬи1а — шарик) состоят из макромолекул шаровидной, эллипсовидной, реже веретенообразной формы. Характерной особенностью этих белков является хорошая растворимость в воде, т. е. высокая гидрофильность. Глобулярные белки находятся главным образом в биологических жидкостях в крови, лимфе, протоплазме клеток. Белки этой группы — альбумины, а также глобулины яичного белка, молока, сыворотки крови, пепсин желудочного сока и другие — выполняют в организме очень важные биологические функции. [c.338]
В других случаях желательно избирательно выделить некоторые группы белков. Тогда используют свойства растворимости этих групп в воде или солевых растворах для альбуминов и глобулинов в разбавленном спирте для проламинов в кислой или щелочной среде для белков с наиболее выраженной структурой. При экстрагировании проламинов и глютелинов в качестве растворителей нередко используют 2-меркаптоэтанол, разрывающий дисульфидные связи, додецилсульфат натрия, разрывающий совокупность нековалентных связей, этилендиамин, диоксан. [c.77]
АЛЬБУМИНЫ, ГЛОБУЛИНЫ И ДРУГИЕ РАСТВОРИМЫЕ БЕЛКИ [c.171]
АЛЬБУМИНЫ, ГЛОБУЛИНЫ и ДРУГИЕ РАСТВОРИМЫЕ БЕЛКИ 177 [c.177]
Альбумины, глобулины и другие растворимые белки 9 [c.189]
Растворимые белки. 1. Животные альбумины и глобулины. Белки этих двух классов, широко распространенные в природе, часто встречаются вместе, и их трудно отличить друг от друга. Альбумины обычно [c.443]
В семенах масличных культур, как правило, ведущей фракцией белков является глобулиновая. Так, в семенах подсолнечника высокомасличного сорта Передовик альбумины составляют до 5,2%, глобулины — 79,0%, глютелины — 15,8% от общей суммы растворимых белков. Еще выше содержание глобулиновой фракции в семенах других масличных культур клещевины около 90%, сои 85—90%, арахиса 97%. [c.28]
В большинстве случаев белки из растительных источников — белковых растительных материалов — представляют собой альбумины, но в основном глобулины, если следовать классификации Осборна. Глобулины растворимы в разбавленных солевых растворах, а альбумины — еще и в чистой воде. Другие белковые компоненты в меньшем количестве, чем те, которые связаны с клеточными стенками, могут быть экстрагированы сильными щелочными растворами [63]. [c.417]
Что касается растворимых глобулярных белков (например, гемоглобина, инсулина, гамма-глобулина, яичного альбумина), то вопрос о характере вторичной структуры еще сложнее. Накапливаются данные, согласно которым и в этом случае а-спираль играет ключевую роль. Подобные длинные пептидные цепи не одинаковы по структуре по всей длине отдельные их участки свернуты в спирали и являются относительно жесткими другие участки образуют петли, скручены случайным образом и довольно подвижны. Установлено, что при денатурации белка спиральные участки раскручиваются и цепь в целом приобретает неупорядоченное строение. (Однако опыт показывает, что в определенных условиях раскручивание и возникновение спирали могут быть обратимыми процессами белок возвращается к исходной вторичной структуре, поскольку это расположение является наиболее стабильным для цепи с данной последовательностью аминокислот.) [c.1061]
Время от времени в литературе появляются сообщения о превращениях альбумина в глобулин при воздействии различных реагентов, например смеси этилового спирта с диэтиловым эфиром, гепарина и некоторых других соединений. Само собой разумеется, что речь идет не о подлинном превращении такое превращение было бы невозможно, так как альбумины по своему аминокислотному составу отличаются от глобулинов (см. табл. 1). Речь может идти только о том, что при определенных экспериментальных условиях растворимость альбумина изменяется, в результате чего он по своим физико-химическим свойствам становится похожим на глобулин. Поэтому вполне возможно, что в нативной плазме крови имеется лишь небольшое количество белков и что многие из выделенных белковых фракций образованы путем соединения этих основных белков с липидами, углеводами, друг с другом, а также с некоторыми ионами. [c.178]
Техника высаливания оказалась исключительно полезной для очистки белков, поскольку индивидуальные белки по характеру их высаливания, как это видно на рис. 4.14, сильно отличаются друг от друга. Одним из классических критериев, позволяющих отличить альбумины от глобулинов, является их различная растворимость в растворах сульфата аммония. В связи с тем, что сульфат аммония представляет собой соль слабого основания [c.259]
И структурные белки. Несомненно, что их роль не только механическая. Доказано, что структурным белкам присущи и каталитические функции. Эти функции особенно ярко проявляются у мышечного сократительного белка миозина. Исследования В. В. Эн-гельгардта и Н. А. Любимовой показали, что миозин ускоряет взаимодействие с водой (т. е. гидролиз) важнейшего аккумулятора энергии — аденозинтрифосфорной кислоты (АТФ). При этом получается аденозиндифосфорная кислота и фосфат. Энергия реакции используется мышцей, во время работы которой нити белка миозина сокращаются. Следовательно, этот белок выполняет двойную нагрузку он регулирует освобождение энергии и он же потребляет энергию, сокращаясь в процессе работы мышцы. Молекула миозина представляет собой длинную цепь — ее длина равна примерно 160 нм, а молекулярная масса достигает 600000, Кроме миозина, известны и другие мышечные белки (актин, тро-помиозин), Для того чтобы эти белки могли осуществлять обратимое сокращение, необходимо присутствие катионов металлов, вообще активно поглощаемых мышечными белками. Для работы мышцы требуются ионы калия, кальция, магния, нужен также запас фосфатов, используемых для синтеза АТФ, Связывание ионов металлов и водорода с ионными группами белков сильно влияет на взаимодействие участков цепи и приводит к изменению ее длины. Однако механизм мышечного сокращения более сложен и, по-видимому, связан с особым расположением нитей миозина и актина в мышце, позволяющих частицам актина при работе мышцы скользить вдоль нитей миозина. Из числа растворимых белков особенно важны альбумины и глобулины. [c.62]
Другие белки осаждаются из водного раствора добавлением этилового спирта или иных подобных ему растворителей в умеренных концентр ащиях. При низких температурах, которые обычно требуются для предотвращения денатурации (0° или ниже) и при значениях рН, соответствующих минимальной растворимости, для осаждения большинства белков достаточно 40% этилового спирта. Многие белки осаждаются при значительно меньших концентрациях спирта например в интервале температур от О до —2° фибриноген осаждается при содержании этилового спирта, меньшем 10% [181]. При добавлении этилового спирта к сложной смеси, например >к плазме, компоненты ее постепенно осаждаются в порядке их растворимостей, причем большинство глобулинов выпадает в осадок гораздо легче, чем альбумины. Соответствующим регулированием дополнительных переменных, например рН, ионной силы раствора и температуры, можно достигнуть значительно более четкого разделения некоторых компонентов системы. [c.62]
Исследования Кона и сотр. [35] по фракционированию плазмы человека этанолом при низкой температуре явились основой для разработки метода 10 , по которому соосаждаются альбумины, (-липопротеины, аа-гликопротеины и (-металлсодержащие белки, а также ряд других менее растворимых глобулинов. Из полученного этим методом фильтрата Шмид [18, 19] выделил -кислый гликопротеин в чистом виде. Для этого из раствора, содержащего ионы цинка и этанол, при pH 10,4 осаждали фракцию VI . Образовавшуюся при этом пастообразную гидроокись цинка, которая содержала 1,5% общего количества белков плазмы, фракционировали снижением pH до 5,8. Осадок удаляли центрифугированием, а надосадочную жидкость обрабатывали при pH 9,5 ацетатом бария. После центрифугирования (-кислый гликопротеин осаждали из надосадочной жидкости повышением концентрации этанола. Содержащийся в осадке гликопротеин очищали повторным переосаждением, после чего его можно было получить в кристаллической форме в виде свинцовой соли. Перед кристаллизацией выход препарата составлял около 0,7—0,8 г на 1 д плазмы. [c.71]
Альбумины, глобулины и другие растворимые белкй // i [c.179]
Многие реагенты способны вызывать осаждение или коагуляцию коллоидно-растворимых белков. Осаждение может быть обратимым и необратимым иными словами, выпавшее в осадок вещество может снова растворяться или же становится нерастворимым. Кипячение растворов белков, особенно при добавлении уксусной кислоты и хлористого натрия или других электролитов, приводит к необратимой коагуляции белка. Эта реакция является одной из наиболее часто применяемых для обнаружения растворенных белковых веществ (например, для открытия белка в моче). Необратимое осаждение вызывают также минеральные кислоты (азотная, платимохлористоводородная, фосфорновольфрамовая, фосфорномолибдеповая, метафосфорная, железосннеродистая), пикриновая кислота, таннин и соли тяжелых металлов. Белки сохраняют растворимость, если их осаждать из водных растворов спиртом и ацетоном кроме того, обратимое осаждение может быть вызвано различными нейтральными солями, например сульфатами аммония, натрия и магния. Для этого необходимы определенные концентрации солей, минимальная величина которых зависит от вида белка (ср. альбумины и глобулины). [c.397]
При такой экстракции водой в раствор переходят не только водорастворимые белки (альбумины), но и другие растворимые в воде соединения, т. е. свободные аминокислоты, сахара, минеральные соли, а также значительная часть солерастворимых белков (глобулинов) Таким образом, полученный раствор условно можно рассматривать как слабосолевой. [c.45]
В последние годы белки растительного происхождения все в большей степени используют для питания не только животных, но и человека. Прямое потребление человеком растительных белков касается в первую очередь зерно-вьгх культур, бобовых, а также различных других овощей. Выделение высоко-очищенных белков (изолятов) происходит в несколько стадий. На первой стадии белки избирательно переводятся в растворимое состояние. Эффективность разделения твердой (примеси) и жидкой (белки) фаз является залогом получения в дальнейшем высокоочищенного продукта. В большинстве случаев белки из растительных источников являются альбуминами или глобулинами, причем глобулины растворимы в слабых солевых растворах, а альбумины — еще и в чистой воде. Белковый экстракт содержит много сопутствующих растворимых продуктов, поэтому на второй стадии белки отделяют осаждением или, используя различия в размерах или в электрическом заряде, применяют мембранную технологию, а также другие приемы (электродиализ, ионообменные смолы, молекулярные сита и др.). Когда оптимальные условия растворимости белков определены, выбор конкретного технологического процесса зависит от вида сырья и целевого продукта. [c.58]
Между альбуминами и глобулинами существует постепенный переход, образующий почти непрерывный спектр растворимости, а так как растворимость и тех и других увеличивается с повышением концентрации соли, эти две группы белков нельзя резко разграничить. Ряд глобулинов, встречающихся в некоторых семенах в качестве запасных белков, выделен в кристаллической форме, например эдестин из конопляного семени, эксцельсин из бразильского ореха, арахин и конарахин из земляного ореха. Альбумины, вероятно, не являются запасными белками, и не все глобулины относятся к этой группе. Так, например, р-амилаза, содержащаяся в семенах ячменя, представляет собой альбумин, а а-амилаза — глобулин. Основные запасные белки хлебных злаков это проламины и глютелины. [c.10]
Метод, разработанный Коном и Эдсоллом, включает фракционное осаждение спиртом при низкой температуре и подходящей вариации значений pH и имеет то преимущество, что в этих условиях на растворимость белков заметно влияет ничтожно малое изменение концентрации солей. Этим методом были получены пять основных фракций, которые не были гомогенными, но оказались пригодными для клинических целей и дальнейшего фракционирования на индивидуальные компоненты. Одна фракция состоит в основном из альбумина и особенно эффективна как противошоковое средство. Другая фракция содержит у-глобулин, который захватывает большое количество антител. Эти белки образуются в живом организме ш ответ на проникновение чужеродных тел (антигенов), например белков различных патогенных организмов. Эта фракция находит клиническое применение для предохранительной временной пассивной иммунизации к различным болезням. Примерно десять глобулинов, принадлежащих к этим трем типам, были получены в индивидуальном, состоянии. Два, из них являются липопротеннами или, может быть, различными формами одного и того же липопротеина. Липопротеины крови состоят из белка, фосфолипи- [c.656]
При обработке тканей растений водой в раствор переходят не только белки, но и другие растворимые в воде соединения, в том числе свободные аминокислоты, сахара, минеральные соли, и полученный экстракт можно рассматривать как слабосолевой раствор. В такой рас-створ могут переходить не только водорастворимые белки альбумины, но и значительная часть солерастворимых белков — глобулинов. Поэтому для того чтобы отделить альбумины от глобулинов, необходимо проводить диализ экстракта против дистиллированной воды. [c.49]
Общего правила, выражающего влияние температуры на растворимость белка, нет. Растворимость многих белков растет с повышением температуры. В случае одних белков растворимость увеличивается в разбавленном, а в случае других — в концентрированном растворе соли, а также в водно-спиртовых смесях. К числу белков, очищенных или выделенных в кристаллическом состоянии путем использования различия в растворимости, относятся глобулины семян [32], фосфорилаза мышц [23] и пепсин [14]. В то же время растворимость белка часто резко убывает с повышением температуры, что изображено на рис. 6. Альдолаза мышц [96] и карбокоигемоглобин человека [29] были выделены в кристаллическом состоянии из концентрированных растворов (Nh5)2SO4 или фосфатов калия путем повышения температуры насыщенного раствора от 0 до 20°. Указанное явление, невидимому, чаще наблюдается в условиях, при которых происходит высаливание, однако оно не ограничивается этими случаями. Согласно опубликованным данным [9г], сульфат альбумина плазмы и сульфат инсулина обнаруживают отрицательный температурный коэффициент растворимости в воде. [c.49]
Хотя различия растворимости белков в тех или иных растворителях неоднократно использовались для их классификации, тем не менее ни одна из предложенных до сих пор схем классификации не может считаться достаточно удовлетворительной. Впервые фракционирование растворимых белков было произведено путем высаливания сернокислым аммонием. Фракция, осаждаемая сернокислым аммонием при полунасыщении раствора, была названа глобулином фракция, осаждаемая сернокислым аммонием при более высоком проценте насыщения, получила название альбумина. Впоследствии было найдено, что фракция глобулина при диализе дает осадок, тогда как альбумин остается в растворе даже в отсутствие солей. В соответствии с этим глобулины определялись так же, как белки, растворимые в растворах нейтральных солей, но нерастворимые в чистой воде. В настоящее время мы, однако, знаем, что только некоторые из белков, входящих во фракцию глобулинов, так называемые эвглобулины нерастворимы в чистой воде, другие же белки этой фракции, так называемые псевдоглобулины, хорошо растворяются в чистой воде. Глобулиноподобные белки были выделены не только из животных тканей, но также и из семян злаков некоторые из этих белков, так называемые проламины, растворимы в водном спирте. Одни авторы выделяли проламины в отдельную группу белков, другие считали их подгруппой глобулинов . [c.257]
Белки чрезвычайно разнообразны. При переходе от одного белка к другому не только и зменяется качественный и количественный аминокислотный состав, но наблюдаются также большие различия в ф изико-химических свойствах. Многие белки, подобно альбуминам, образуют в воде коллоидные растворы другие, например глобулины, не растворяются в воде, но растворимы в растворах нейтральных солей (поваренная соль и др.) кератин, эластин, фиброин и аналогичные им белки характеризуются полной нерастворимостью. Между белками, образующими коллоидные растворы, в свою очередь, существуют различия в отношении способности к высаливанию и осаждению. Эти различия в растворимости используются для разделения белков наряду с описанными [c.395]
Обычно для изучения генетического детерминизма используют фракции альбуминов и глобулинов, которые в основном представлены ферментами, и проламиновую фракцию, представляющую часть запасных белков, вследствие их значительного биохимического полиморфизма, с одной стороны, и их роли в определении качества — с другой. Глютелиновую фракцию изучают всего лищь несколько лет, так как работы, в которых удалось добиться полной растворимости, были проведены совсем недавно. [c.52]
Были предложены и применены многочисленные альтернативные классификации, ни одна из которых не является вполне удовлетворительной [7]. Термину глобулин придают по край- ней мере три различных значения… Но ни одно из них не определяет точно тот же класс белков, что и другие [192] . Термин звглобулин имеет, по меньшей мере, два значения, а термин альбумин более одного в зависимости от того, применяется ли в качестве классифицирующего признака растворимость или же состав. Здесь не будет сделано попыток ни формулировать новую схему классификации белков, ни точно следовать какой-либо имеющейся частной схеме. Однако в тех случаях, когда путаница В названиях маловероятна, мы будем пользоваться о.б.щеприня- [c.41]
Классификация белков по растворимости сложилась довольно давно и в последнее время теряет свое значение, так как обнаружено, что часть белков (глобулины, альбумины) содержит в своем составе сахара, т. е. но является простыми в точном значении этого понятна, а другие (гистоны, протамины) входят в состав сложных белков (пуклеоиротеидов). Однако эти эмпирические названия еще употребляются довольно часто. [c.25]
Глобулины — белки с большей, чем у альбуминов, молекулярной массой (свыше 100 ООО). В отличие от альбуминов они нерастворимы в чистой воде, а растворимы только в разбавленных солевых растворах. Глобулины — слабокислые или нейтральные белки (р/лежит в интервале от 6,0 до 7,3) содержат меньше, чем альбумины, остатков кислых аминокислот. Эти белки плохо гидратируются, поэтому они легко осаждаются из растворов с низкой концентрацией (Nh5)2SU4. Некоторые из глобулинов обладают способностью к специфическому связыванию веществ (специфические переносчики), другие, как и альбумины, — к неспецифическому связыванию жирорастворимых веществ. [c.87]
ПОИСК
Альбумины и глобулины. Эти белки относятся к белкам, широко распространенным в органах и тканях животных. Наиболее богаты ими белки сыворотки крови, молока, яичный белок, мышцы и др. В плазме крови человека в норме содержится около 7% белков, представленных преимущественно альбуминами и глобулинами. Альбумины и глобулины—это глобулярные белки, различающиеся по растворимости (табл. 1.6). [c.73] Глобулярные белки (от латинского слова 1оЬи1а — шарик) состоят из макромолекул шаровидной, эллипсовидной, реже веретенообразной формы. Характерной особенностью этих белков является хорошая растворимость в воде, т. е. высокая гидрофильность. Глобулярные белки находятся главным образом в биологических жидкостях в крови, лимфе, протоплазме клеток. Белки этой группы — альбумины, а также глобулины яичного белка, молока, сыворотки крови, пепсин желудочного сока и другие — выполняют в организме очень важные биологические функции. [c.338]
Глобулины содержатся в молоке (молочный глобулин) и сыворотке крови (сывороточный глобулин). Сывороточные глобулины имеют молекулярную массу приблизительно 150 ООО и более, тогда как сывороточный альбумин вдвое меньшую—около 70 ООО. Некоторые фракции сывороточного глобулина обусловливают жжг/ны/иет — невосприимчивость к ряду заразных заболеваний. Глобулины содержатся также в мышцах. [c.311]
Альбумин и глобулин молока. Помимо казеина в молоке находятся другие белковые вещества — альбумин и глобулин. Количество их значительно меньше, нежели казеина, а именно казеина от 2,2 до 3,50/0, альбумина от 0,4 до 0,8%, глобулина 0,1%. Соотношение этих белковых веществ непостоянно, оно колеблется в зависимости от периода дойки. Непосредственно после отела в молоке много альбумина, и он, оказывая значительное действие на коллоиды, мешает коагуляции казеиногена. Такое молоко негодно для получения казеина. По аминокислотному составу перечисленные белковые вещества значительно разнятся друг от друга, как это видно из табл. 7. [c.69]
В состав молока входят казеиноген , молочный альбумин и молочный глобулин. [c.309]
Свойства. Является представителем альбуминов. Альбумины — простейшие природные глобулярные белки, присутствующие во всех растительных и животных тканях в виде соединений с липидами, углеводами и другими компо- нентами клетки. Содержатся в белке яиц, сыворотке крови, молоке, семенах-, растений и др. Альбумины входят вместе с глобулинами в группу-растворимых белков, но отличаются от них способностью растворяться в дистиллированной воде и в полунасыщенном (50% насыщения) растворе сульфата аммония. Способны к образованию хорошо оформленных кристаллов, при нагревании кри- сталлы белков свертываются. При гидролизе альбуминов образуются различные аминокислоты (характерно наличие серусодержащих и дикарбоновых аминокислот и отсутствие или относительно низкое содержание гликокола), [c.26]
Молоко является прекрасной средой для жизнедеятельности микроорганизмов. В нем содержатся белки (казеин, альбумин, глобулин) молочный жир, фосфолипиды, молочный сахар, кальциевые и магниевые соли неорганических и органических кислот и витамины. Поэтому при благоприятных температурных условиях микроорганизмы бурно размножаются в молоке и ухудшают его качество. [c.204]
Глобулины — белки, не растворимые в воде, но растворимые в разбавленных солевых растворах свертываются при нагревании. Имеют большую молекулярную массу, чем альбумины. Представители глобулины молока, яйца, крови белки мышц (миозин), семян растений. [c.297]
Структурообразующие белки тела человека называют фибриллярными белками (или волокнистыми, они имеют вытянутую, нитеобразную форму). Важнейшие фибриллярные белки животных — это кератин и коллаген белок кератин входит в состав волос, ногтей, мышц, рогов, игл и перьев коллаген — структурный компонент сухожилий, кожи, костей, соединительной ткани. При кипячении коллаген гидролизуется и образует растворимый в воде белок, называемый желатиной. В теле человека имеются растворимые белки, именуемые глобулярными белками. Альбумины, такие, как сывороточный альбумин, получаемый из крови животных, овальбумин яичного белка, лактальбумин молока, растворяются в холодной воде и слабом растворе соли. Глобулины, например глобулины плазмы крови, фибриноген, глобулин яичного белка, глобулин молока, растворяются в разбавленных растворах солей, но не в холодной воде. [c.384]
Среди пластических масс, приготовляемых из белковых веществ, наибольший успех и наибольшее распространение получили пластические массы из казеина молока. Но для приготовления пластических масс употребляются и другие белковые вещества — альбумин крови, глобулины растений, белковые вещества дрожжей. [c.36]
Для получения пластических масс из белковых веществ ни альбумин, ни глобулин молока не могут представлять значительного интереса, во-первых, потому, что их в молоке мало, а во-вторых,—-ввиду высокой пищевой ценности молочного альбумина, содержащего ценную в пищевом отношении аминокислоту—триптофан в очень большом количестве. Высокая гидрофильность также делает их менее ценным сырьем для пластических масс. [c.69]
При сепарировании и при переливании обрата в чаны он покрывается обильной пеной. Если ее не удалять, в казеин могут попасть коагулированные альбумин и глобулин, что при получении продукта для внутреннего употребления не имеет особого значения, но понижает ценность экспортного казеина. Поэтому пене дают устояться, а потом снимают верхний слой, молока, в котором плавают свернув,-шиеся частицы белковых веществ (эта операция требует около 20—25 мин.) и прибавляют сычужного фермента в виде раствора готового сычужного порошка или самодельной закваски. Внесенный фермент легким размешиванием равномерно распределяют по всей массе обрата и оставляют последний в спокойном состоянии на 20 — 30 мин. при оптимальной температуре 35°. Время, потребное для коагуляции, может быть и меньшим, если брать большое количество фермента. Удлинять срок коагуляции нежелательно, так как деятельность при- [c.77]
Сырье для клея, предварительно промытое водой, обрабатывается при нормальной температуре известковым молоком от одного до нескольких месяцев. Масса время от времени перемешивается и подвергается действию свежей извести. Гидрат окиси кальция вызывает набухание белка волокон (стр.222 и 223) и в то же время удаляет или растворяет ненужные вещества волосы, кровь и легко растворимые белки (муцины, глобулины и альбумины), загрязняющие желатину. [c.314]
B. Белки молока. 1. К 50 жл молока добавляют равный объем воды и затем пе каплям при помешивании 0,2—0,5 мл концентрированной уксусной кислоты до образования хлопьев. Через 5—10 мин смесь фильтруют через полотно (см. пункт А). Фильтрование идет быстро для получения более прозрачного раствора первые, мутные, порции фильтрата пропускают через полотно повторно. Полученный чуть желтоватый прозрачный раствор содержит альбумин и часть глобулина молока, а также молочный сахар (см. опыт 136). [c.348]
Фосфопротеиды. Наиболее важным и широко изученным фосфопротеидом является казеин молока, в котором он находится наряду с глобулином и альбумином, присутствующими в меньшей концентрации. Казеин содержится в молоке в виде растворимой кальциевой соли кислоты осаждают его мгновенно. Казеин [c.451]
Белки этой группы — альбумины, а также глобулины,яичного белка, молока, сыворотки крови, пепсин желудочного сока и другие выполняют в организме очень важные биологические функции. [c.426]
В молоке различают три белковые фракции 1) казеиноген, 2) молочный альбумин и 3) молочный глобулин. [c.319]
Молоко является ценнейшим пищевым продуктом, так как в его состав входят такие важнейшие питательные вещества, как белки (казеиноген, молочный альбумин и молочный глобулин), углеводы (молочный сахар), липиды, минеральные соли и ряд витаминов. [c.484]
У молекул большинства изученных глобулярных белков длина малой оси эллипсоида колеблется между 20 и 60, а длина большой оси — между 40 и 200 ангстремами (1 ангстрем= 1/100 ООО ООО см и обозначается А). Отношение большой оси эллипсоида к малой у молекул яичного альбумина, например, приближается к 3, у альбумина и глобулина молока и гемоглобина (лошади) — около 4,5, у глобулина сыворотки крови — около 7,5, у таких же глобулярных белков, как глютелины (белки злаков), — около 11, а у зеина (белок кукурузы) — даже около 20. Следовательно, частицы этих белков имеют скорее веретенообразную, чем округлую форму. Таким образом, объединение названных белков по форме их частиц в общую группу глобулярных белков условно. [c.45]
Основная масса белков, находящихся в плазме крови, в сыворотке молока, в яичном белке и др., состоит из альбуминов и глобулинов. Соотношение альбуминов и глобулинов в различных тканях удерживается в определенных границах в норме оно сохраняется и в крови на постоянном уровне. Однако при многих заболеваниях отношение количества находящихся в крови альбуминов к глобулинам, так называемый белковый к о э ф- [c.51]
Основная масса белков, находящихся в плазме крови, в сыворотке молока, в яичном белке и др., состоит из альбуминов и глобулинов. Соотношения альбуминов и глобулинов в различных тканях удерживается в определенных границах в норме оно сохраняется и в крови на постоянном уровне. Однако при многих заболеваниях отношение количества находящихся в крови альбуминов к глобулинам, так называемый белковый коэффициент ( уд ) изменяется. Таким образом, определение белкового коэффициента в крови больного может представлять клинический интерес. [c.50]
Были также найдены отличия и в химическом составе альбуминов и глобулинов. Глобулины содержат гликокол обычно в количестве 3,5%. Содержание гликокола в альбуминах значительно ниже. В альбумине сыворотки крови гликокола даже нет совсем. Но в альбумине молока содержание гликокола доходит уже до 0,4%, а в яичном альбумине — даже до 1,9%, Таким образом, это отличие имеет лишь относительное значение. [c.50]
Имеются данные о том, что белки плазмы находятся в равновесии с белками тканей иначе говоря, тканевые белки могут быть использованы для образования белков плазмы, и наоборот [590, 591]. Вероятно, это использование в том и другом случае связано с распадом исходного белка и ресинтезом нового белка [592—594]. Согласно этим представлениям, белки плазмы могут служить источником аминокислот для синтеза белков тканей. Не исключена возможность использования при этом пептидных фрагментов. Белки плазмы используются тканями весьма эффективно это можно объяснить, по крайней мере отчасти, тем, что эти белки легко проникают через клеточные мембраны. Альбумин, фибриноген и значительная часть фракции глобулинов, вероятно, синтезируются в печени. Опыты с введением меченых аминокислот лактирующим животным показали, что белки плазмы не являются прямыми предшественниками белков молока [595, 596], поскольку степень включения метки в белки молока значительно превышает степень ее включения в белки плазмы. Подобное же заключение можно сделать относительно синтеза яичного альбумина у кур [597, 598]. Найдено также, что [c.274]
Альбумины и глобулины очень широко распространены в природе они входят в состав почти всех клеток животных и растений. К альбуминам относятся альбумин яйца, альбумин крови, альбумин молока и т. д. [c.710]
С физико-химической стороны оба белковые вещества — и альбумин и глобулин — являются ясно выраженными эмульсоидами, в растворе они удерживаются не только силой заряда, но и водной оболочкой. Поэтому после выделения казеина из молока в молочной сыворртке продолжают оставаться и альбумин и глобулин. Между собою они отличаются температурой тепловой денатурации, которая у альбумина ниже, нежели у глобулина, и наступает при 72°. Коагуляцией альбумина нагреванием сыворотки можно отделить его от глобулина, который останется в сыворотке. [c.69]
К другой группе — сферопротеинам (они называются также глобулярными белками) — относятся белки, третичная структура которых напоминает сферические объекты. Они встречаются во всех видах тканей и имеют самое разное назначение. Так, многие из них являются ферментами, другие — антителами. В крови (а также в мышцах, молоке и яйцах) присутствуют альбумины и глобулины. В ядрах клеток содержатся гисто-ны. Тромбин участвует в превращении растворенного в крови [c.194]
Глобулины. Они нерастворимы в воде, но растворяются в очень слабых растворах солей. Более концентрированными растворами солей они вновь осаждаются осаждение происходит при меньшей концентрации, чем та, которая необходима для осаждения альбуминов. Эти белки являются очень слабыми кислотами. Примерами глобулинов могут служить фибриноген, глобулин кровяной сыворотки, глобулин мускульной ткани, глобулин Селка куриного яйца. Таким образом, в белке куриного яйца, I крови, в мускульной ткани находятся и глобулины и альбумины. В отличие от этого в молоке почти не содержится глобулинов. Из глобулинов состоят и многие растительные белки. [c.390]
Из простых белков следует назвать альбумин и глобулин. К более сложным белкам относятся казеин, кератины и коллагиг, К,азеин — сложный белок, образующийся из казеиногена (важнейшая составная часть молока, творога и сыра) при его сверты- [c.36]
Раствор молочных альбуминов, К 200 мл снятого молока добавляют равный объем пасыгценного раствора сернокислого аммония, перемешивают и оставляют на 10— 15 мин., после чего фши.труют через складчатый бумажный фильтр. I3 растворе — альбумины, в осадке — глобулины и казеин. [c.6]
К альбуминам относят протеины, растворимые в дестиллированной воде, типичным представителем которых является альбумин куриного яйца, называемый яичным альбумином. Кроме яичного различают альбумин кровяной сыворотки, находящийся в крови животных, и молочный, называемый лактоальбумином, присутствующий в молоке совместно с казеином и глобулином. [c.191]
Ход работы,. I. Получение казеина. Дать люлоку отстояться и тщательно снять верхний слой (жир). Снятое молоко разбавить двумя объемами воды и затем при помешивании по каплям осторожно добавить 0,1—0,5%-ную уксусную кислоту до прекращения выделения осадка белка (следует избегать значительного избытка уксусной кисдоты). Осадок казеина отсосать, промыть два-три раза водой и затем спиртом, отжать на воронке под вакуумом и высушить на воздухе. В кислом фильтрате (молочная сыворотка). находятся молочный глобулин и альбумин. Их осадить насыщением фильтрата сернокислым аммонием или кипячением раствора после подкисления. [c.180]
Кроме этих белков, в молоке были найдены и некоторые другие белки. К ним следует причислить опализин, выделенный из сыворотки женского молока высаливанием хлористым натрием. Имеются также указания на присутствие в молоке белка, похожего на проламин. Однако эти белки (кроме казеиногена, альбумина и глобулина) находятся в молоке в весьма незначительных количествах и в настоящее время мало изучены. [c.319]
В результате этих исследований было установлено, что частицы многих белков обладают округлой, эллипсоидной формой. Такие белки получили название глобулярных белков (лат. globulus — шарик). К таким белкам относятся главным образом белки, растворимы ев воде или в слабых солевых растворах, например альбумины и глобулины яичного белка, молока, сыворотки крови, органов и тканей, гемоглобин крови, фермент желудочного сока (пепсин) и др. [c.45]
Из других белков молока интерес представляют молочные альбумины и глобулины. Белки эти, так же как и казеиноген, отличаются своей несвертываемостью при нагревании до 100° при нейтральной реакции. Однако после небольшого подкисления молочные альбумины и и глобулины, обладающие слабокислым характером, выпадают в осадок. Альбумина содержится в молоке в несколько раз большем количестве, чем глобулина. [c.451]
Альбумины и глобулины яичного белка, сыво(ротки крови и молока, 01ргаиов и тканей являются белками глобулярного типа и при низких концентрациях студней не образуют. Эти белки в норме ие обладают необходимым условием застудневания. Молекулы их, в отличие от желатины, не имеют резко удлиненной формы и, будучи скрученными в глобулу, практически защищены от атт ракции и взаимодействия гидратационными оболочками. [c.300]
ПОИСК
Статьи Рисунки Таблицы О сайте Реклама
Плазма крови. Общее количество крови у взрослого человека в норме составляет примерно 5 л. Из них на долю плазмы приходится 2,75 л, а на долю эритроцитов —2,22 л. Лейкоциты занимают объем 0 мл, тромбоциты — около 20 мл. Основным компонентом плазмы являются белки. В плазме всего идентифицировано более 70 различных белков. В основе классификации белков лежат их растворимость и методы выделения. Например, если к плазме добавить равный объем насыщенного раствора сульфата аммония, выпадают глобулины. Если затем удалить глобулины и добавить твердый сульфат аммония, выпадают альбумины. Хотя этот метод классификации кажется произвольным, белки, находящиеся в этих фракциях, близки не только по растворимости, но и по функции. [c.438] Высаливание. При добавлении растворов солей щелочных и щелочноземельных металлов происходит осаждение белков из раствора. Обычно белок не теряет способности растворяться вновь в воде после удаления солей методами диализа или гельхроматографии. Высаливанием белков обычно пользуются в клинической практике при анализе белков сыворотки крови и других биологических жидкостей, а также в препаративной энзимологии для предварительного осаждения и удаления балластных белков или выделения исследуемого фермента. Различные белки высаливаются из растворов при разных концентрациях нейтральных растворов сульфата аммония. Поэтому метод нашел широкое применение в клинике для разделения глобулинов (выпадают в осадок при 50% насыщении) и альбуминов (выпадают при 100% насыщении). [c.26]
Выделение отдельных белковых фракций. Для более детального изучения белков не ограничиваются выделением из растений лишь суммы всех белковых веществ, а проводят их фракционирование. Наиболее часто при фракционировании белков пользуются их различной растворимостью в разных растворителях и белки из растительных тканей последовательно экстрагируют водой (альбумины), слабыми растворами нейтральных солей (глобулины), спиртом (проламины) и щелочными растворами (глютелины). [c.48]
Острое ингаляционное воздействие С. в концентрации 5460 мг/м в течение 1 —4 ч вызывало у крыс раздражение слизистых оболочек (слезотечение, саливация, слизистые выделения из носа). При более длительном воздействии животные погибали, изменения в легких варьировали от легкой гиперемии до мнолжственных кровоизлияний, экссудации и лейкоцитарной инфильтрации ( Гиг. критерии… ). Двухчасовое вдыхание С. в концентрации 40 ООО мг/м вызывало у крыс и кроликов нейтрофильный лейкоцитоз, лимфопению и снижение абсолютного числа эозинофилов в периферической крови (Панковец), изменение альбумино-глобулинового коэффициента за счет снижения уровня альбуминов и возрастания количества грубодисперсных белков, особенно у-глобулинов в сыворотке крови. Снижались массовые коэффициенты вилочковой железы. Нарушались гуморальные и клеточные реакции естественного и искусственного иммунитета. Отмечались фазные изменения содержания аскорбиновой кислоты и липидов в надпочечниках. По данным Ивановой и др., концентрация С. 1020 142 мг/м является пороговой для крыс по изменению функциональных показателей однократного действия. Концентрация 35—40 мг/м —недействующая в однократном эксперименте, близкая к ПКхр. [c.192]
Белки, их химические и физико-химические свойства. Методы выделения и очистки белков классические — диализ, высаживание из растворов современные — распределительное и ионообменное хроматографирование, хроматографирование на молекулярных ситах, электрофорез. Индивидуальность белков.. Цветные реакции белков биуретовая, ксантопротеиновая, сульфгидрильная, Милона, нингидринная. Первичная, вторичная и третичная структуры белков, факторы, определяющие эту структуризацию. Проблема установления первичной структуры белка. Вторичная структура а-спираль и Р-структура, третичная структура. Классификация белков простые и сложные. Простые белки альбумины, глобулины, проламины, прот амины, гистоны и склеропротеины. Сложные белки (протеиды) нуклеопротеиды, глюкопротеиды, липопротеиды, фосфопротеиды, хромопротеиды, металлопротеиды. Заменимые инезаменимые аминокислоты. Проблема синтеза искусственной пищи. [c.189]
Как и в предыдущих разделах, мы попытаемся кратко рассмотреть применение ионообменной хроматографии на примере изучения белков сыворотки. До сих пор наиболее популярным методом разделения сывороточных белков является хроматография на колонке анионообменной ДЭАЭ-целлюлозы по методу Собера и Петерсона [18]. Предложено несколько модификаций этого метода. Фракции сыворотки элюируются с колонки различными способами градиентного элюирования и выходят обычно в следующем порядке IgG (как правило, имеет несколько пиков), р-, а-глобулины и затем альбумин. Этот метод особенно эффективен для приготовления препаратов IgQ высокой иммунохимической чистоты из нативной сыворотки. Его можно комбинировать с другими способами очистки, например с осаждением риванолом, Na2S04 и т. п. Подобным образом в качестве одного из этапов препаративного выделения анионообменная хроматография может применяться для очистки других белков сыворотки. При изучении структуры белка ее можно использовать для выделения и очистки полипептидов после расщепления белка ферментами или какими-либо другими веществами. [c.23]
Белки типа альбумина и глобулина можно выделить не только из жидкостей тела, но таклразличных органов. В этих случаях желательно предварительно удалить кровь из органов путем перфузии их изотоническим раствором хлористого натрия. Обескровленный орган после размельчения и растирания подвергается экстракции растворами хлористого натрия или буферными растворами. Белки, полученные таким способом из мышцы, описаны в разделе Мышечные белки . Многие из белков, выделенные из органов, обладают ферментативной активностью они будут рассмотрены в гл. XII. Белковые гормоны, выделенные из эндокринных желез, рассматриваются в гл. XIV. Экстракты из органов содержат белки, относящиеся главным образом к глобулинам, т. е. к тем белкам, которые выпадают в осадок при нодкислении растворов, при высаливании или при диализе против дестиллированной воды. В подобных экстрактах редко можно обнаружить белки типа альбумина. Так, например, 51,5% всего количества белков хрусталика глаза составляет глобулин и только 0,5% —альбумин остальные 48% приходятся на долю нерастворимого белка — склеропротеина. Из фракции глобулинов хрусталика выделены два белка, названные а- и -кристал-линамн [161]. [c.195]
Для объяснения этого превращения было высказано предположение, что большинство белков содержит сахара. Серьезным доводом в пользу этой концепции явилась тщательно выполненная работа фон Удранцкого [36]. Этот автор исследовал на присутствие сахаров по фурфурольной реакции тщательно очищенные обычные белки, т. е. не такие, как найденные в слизистых выделениях. Так как было известно, что фурфурол образуется только из сахаров, положительный результат рассматривался как более убедительное доказательство присутствия сахаров, чем простое появление восстанавливающей способности у гидролизатов белков. Фон Удранцкий показал с несомненностью, что летучее вещество, образующееся при обработке альбумина, глобулина, казеина и фибрина концентрированной серной кислотой, дает положительную реакцию на фурфурол с а-нафтолом но Молишу [37] и с ацетатом ксилидина по Шиффу [38]. Аналогичные результаты получил и Зиген [39]. Наиболее горячим защитником этой концепции был английский врач Пэйви [40]. В сообщении на заседании Королевского [c.12]
Белки после электрофореза на бумаге или ацетате целлюлозы окрашивают также бромкрезоловым зеленым (0,2%-ный раствор в этаноле, содержащем 2% ледяной уксусной кислоты). Обесцвечивание фона проводят в 2%-ной уксусной кислоте. После обесцвечивания и высушивания электрофореграммы помещают в пары аммиака. Синняя окраска медленно исчезает [336]. Уэбстер и др., [1381] исследовали возможность применения этого красителя для определения сывороточного альбумина после электрофореза на ацетате целлюлозы. Для количественной оценки окрашенную зону альбумина элюируют 3%-ным (объем/объем) раствором детергента Teepol 610. Элюция занимает всего несколько минут. Количество альбумина определяют по оптической плотности при 520 им. Было изучено также взаимодействие выделенных фракций глобулинов сыворотки с бромкрезоловым зеленым, [1381]. [c.272]
Методика опыта (кристаллизация альбумина). Источником получения альбумина обычно служит белок куриного яйца. В 10 свежих куриных яйцах тщательно отделяют белок от желтка и к выделенному белку добавляют равный объем насыщенного (ЫН4)2304. Выпадает осадок глобулина, который отделяют в центрифуге при 2500 об/мин. Центрифугат осторожно сливают на складчатый фильтр или в воронку Бюхнера и отсасывают его. При температуре 20° С отмеряют определенный объем фильтрата и добавляют к нему тонко измельченный (Nh5)2S04 из расчета 8,5 г (ЫН4)2504 на 100 мл фильтрата. При этом выпадает желтовато-розовый осадок альбумина, который отфильтровывают на воронке Бюхнера или через складчатый фильтр. Отфильтрованный осадок альбумина растворяют (стакан погружают в ледяную воду) в возможно меньшем количестве воды. В раствор добавляют по каплям (при помешивании) 5%-ный раствор СН3С6ОН до pH = 4,7 (проверяют ионометром). Раствор отфильтровывают, чтобы исчезла муть. К фильтрату добавляют большими порциями насыщенный раствор (Nh5)2S04 (при встряхивании) до появления так называемой муаровой мути. При температуре от О до 2° С через 1—2 суток образуются игольчатые кристаллы альбумина. Кристаллический альбумин следует хранить в растворе с 2—3 каплями толуола, который применяют в качестве антисептика. [c.43]
Высаливание белков концентрированными растворами ЫагЗО или (Nh5)2S04 применяется при выделении ферментов из экстрактов тканей и является одним из методов фракционирования белковых смесей на альбумины и глобулины. Растворимость белков уменьшается также при добавлении дегидратирующих веществ (спирта, ацетона). [c.114]
Этим обстоятельством воспользовались для электрофоретического анализа белкового состава биологических жидкостей. Давно было известно, что сыворотка крови неоднородна и состоит, по крайней мере, из двух белков — альбумина и глобулина, причем последний также не является однородным компонентом крови. Наличие различных фракций сыворотки устанавливалось путем высаливания ртдельных белков различными концентрациями соответствующих солей. Анализ выделенных фракций показал, что альбумин и глобулин отличаются своими изоэлектрическими пунктами. Поэтому при электрофоретическом анализе сыворотки, имеющей pH выше 7, эти белки, заряжаясь отрицательно, должны передвигаться к аноду с различной скоростью в силу различной величины своих зарядов. [c.278]
Безводный фтористый водород является прекрасным растворителем для белков. В нем легко растворяются белки, растворимые в воде, а также многие нерастворимые в воде волокнистые белки, например шелковое волокно. Хорошо растворимы в жидком НР рибонуклеазы, инсулин, трипсин, альбумин сыворотки, глобулин сыворотки, эдестин, гемоглобин и коллаген. При этом возможны х имические реакции, но они не нарушают биологических свойств белковых веществ. Из раствора в жидком фтористом водороде можно выделить инсулин, почти полностью сохранив его биологические свойства Рибонуклеазы и лизоцимы можно растворить в жидком НР или в смеси НР—302- Выделенные из раствора п гтем отгонки растворителя эти вещества также не теряют своих ферментных свойств при условии, что температура процесса отгонки достаточно низкая, а продолжительность небольшая . При болёе высоких те 4пературах происходит инактивация фермента. Это связано, [c.76]
МИНЫ — при концентрации 2,57 моль1л [12]. Для получения больших количеств глобулинов этот метод удобнее электрофоретического получаемые отдельные фракции содержат, однако, некоторое количество примесей белков других смежных фракций. Сернокислый аммоний в качестве осадителя обладает и еше одним недостатком он содержит азот, что делает невозможным прямое определение азота в выделенных белках по методу Кьельдаля. Поэтому в клинике для количественных определений альбуминов и глобулинов в сыворотке крови вместо сульфата аммония пользуются сернокислым натрием [9]. [c.173]
Высаливание белков концентрирохшнными растворами солей является одним из основных методов фраЕ ционирования белковых смесей на альбумины и глобулины. Понижения растворимости белков можно достичь также добавлением спирта и действием низкой температуры. На тонком сочетании действия спирта, солей и охлаждения до —5° основаны способы детального фракционирования белковых смесей но Кону например, из сыворотки крови этим путем выделено свыше 12 белков. Растворимость белков также сильно зависит от рИ и имеет минимум в изоточке (рис. ИЗ). При смеш,ении от изоточки вырастают заряд и гидратация белковых молекул, что повышает их растворимость. Поэтому ири высаливании белков всегда поддерживают pH близким к изоточке. 1000 Растворимость полимеров и условия их выделения из растворов при добавлении осадителя сильно зависят от их молекулярного веса. [c.259]
Скиталось, что многие фракции, выделенные из сыворотки, являлись результатом изменения сыворотки в процессе их выделе-ВИЯ. Хотя работы с ультрацентрифугой и дали много ценных сведений (см. т. II, гл. XX) относительно природы сыворотки и ее белков в нормальных и патологических условиях, лишь Тизелиусу удалось найти простой и точный метод разделения и отбора фракций сыворотки. Тизелиус обнаружил, что необработанная человеческая сыворотка без добавления осаждающих солей начинает разделяться в электрическом поле на четыре компонента. Было найдено, что наиболее быстрый из этих компонентов является альбумином, а три более медленных компонента соответственно а-, р- и 7- глобулинами. Фибриноген появляется в плазме между 8- и 7- глобулинами. Было обнаружено, что сыворотки ряда животных дают похожие, хотя и специфические, электрофоретические изображения [39, 40]. После электрофоретического выделения отдельные компоненты сыворотки при повторном измерении проявляют те же электрические подвижности, которые были обнаружены и в. цельной сыворотке. Это является важным доказательством того, что в сыворотке находятся индивидуальные компоненты и что сыворотка не является равновесной смесью компонентов. Невозможно, однако, переоценить значение состава буферного растворителя для получаемых электрофоретических изображений, так как число, относительная величина и подвижность компонентов, а также контуры и симметричность изображений возрастающих и убывающих границ являются функцией применяемого электролита. На рис. 168 представлены результаты электрофоретического анализа фракций, полученных из патологической и нормальной сывороток. Фильтрат после добавления 13,5% сульфата натрия представляет собой фракцию, полученную после удаления эуглобина, 17,4%-ный фильтрат—фракцию лосле удаления псевдоглобулина I, 21,5%-ный фильтрат—фракцию после удаления всех белков за исключением альбумина. Значительные количества а-и р-глобулина остаются с альбумином. Подобг яые же результаты были получены Коном и другими исследователями [42] при применении различных солей. Мур и Линн [43] определили соотношения альбумина и глобулина А С для 25 [c.375]
Методом электрофореза с подвижной границей при использовании, как правило, буферных растворов с pH 8,4—8,6 белки плазмы можно разделить на 5 или 6 фракций альбумин и несколько групп глобулинов, обозначаемых какаг,а2-, Р и -гло-булины. С помощью данного метода на ранних этапах его развития были установлены многие важные свойства белков плазмы. Результаты этих исследований были суммированы в ряде обзоров [560, 1149, 1462]. Электрофорез с подвижной границей применялся также для проверки чистоты белков, получаемых в препаративных количествах для клинических целей. И до сих пор этот метод используется для тестирования выделенных из плазмы белковых фракций (следует сказать, что для контроля качества необходимы также и другие методы, такие, как ультрацентрифугирование или иммунохимический анализ). Так, например, согласно существующим стандартам (Комитет экспертов по биологической стандартизации при Всемирной организации здравоохранения, 1967), препараты иммуноглобулинов человека должны содержать не менее 90% глобулинов с электрофоретической подвижностью, не превышающей —2,8-10 см /В [c.328]
Иммобилизовалпые овомукоиды. Мукоиды, впервые обнаруженные в синовиальной суставной жидкости и стекловидном теле глаза, были выделены в отдельную группу по общему признаку все они представляют собой ковалентно связанные белково-углеводные комплексы (по некоторым версиям термина — еще и не осаждающиеся из подкисленного раствора). Гликопротеид, выделенный из белка куриных яиц, называется овомукоидом. Он не коагулирует при нагревании и поэтому может быть сравнительно легко отделен от других белков. После удаления денатурированных яичного альбумина и яичного глобулина овомукоид осаждают из фильтрата этанолом. Овомукоид содержит около 20 % углеводов его К-концевой аминокислотой является аланин, а С-концевой — фенилаланин. В состав углеводного компонента входят остатки К-ацетилглюкозамина, маннозы и галактозы в соотношении 7 3 1 [38, с. 296]. [c.546]
Смотреть страницы где упоминается термин Белки выделение альбуминов и глобулинов: [c.396] [c.38] [c.194] [c.489] [c.178] [c.194] [c.16] [c.389] [c.219] [c.488] [c.236] [c.488] [c.353] [c.16] [c.68] [c.333] Методы биохимии растительных продуктов (1978) — [ c.0 ]
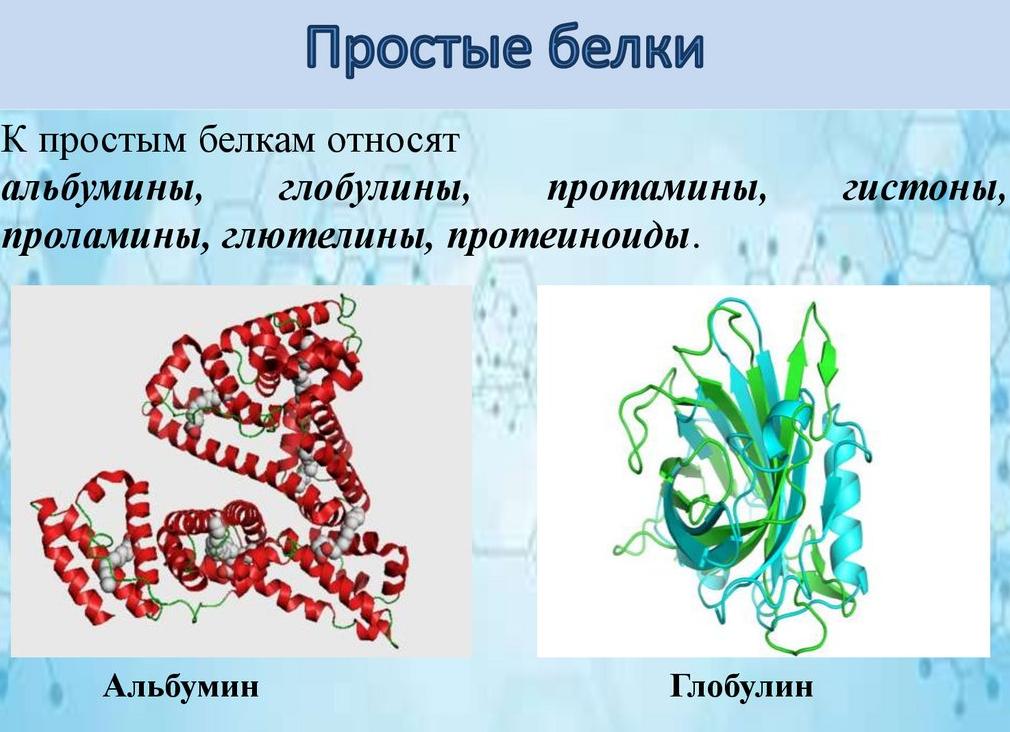
Альбумины
Альбумины и глобулины
Глобулины
© 2018 chem21.info Реклама на сайте
Основные белки плазмы крови — альбумины и глобулины
Основой плазмы крови являются белки, содержащиеся в пределах от 60 до 80 г/л, что составляет примерно четыре процента от всех белков организма. В плазме человеческой крови насчитывается около сотни различных белков. По подвижности их делят на альбумины и глобулины. Первоначально такое деление было основано на методе растворимости: альбумины растворяются в чистой жидкости, а глобулины – только при наличии нитратов.
Белки плазмы
Среди белков больше в крови альбумина – около 45 г/л. Он играет огромную роль в поддержании КО давления в крови, а также служит резервуаром для резерва аминокислот.
Альбумины и глобулины имеют различные способности. Первый вид белков может связывать липофильные вещества. Таким образом у конгломератов появляется возможность работать в качестве белков-переносчиков длинноцепочечных жирных кислот, различных медикаментов, билирубина, витаминов, стероидных гормонов. Также альбумин способен связывать ионы магния и кальция.
Белки альбумины и глобулины выступают в роли транспорта для тироксина, его метаболита иодтиронина.
Разрушение и образование белков
Большая часть белков плазмы формируется в печени, за исключением иммуноглобулинов (продуцируются клетками иммунной системы) и пептидов (вырабатываются эндокринной системой).
Альбумины и глобулины разные по строению. Все белки, кроме альбумина, относятся к гликопротеинам, содержание олигосахариды и прикрепляются к остаткам аминокислот. В качестве концевого остатка часто выступает ацетилнейраминовая кислота. Если она отщепляется нейраминидазой, на поверхности белка появляются концевые остатки галактозы. Остатки десиалированных белков распознаются, начинают менять галактозы на гепатоцитах. В печени эти уже устарелые белки удаляются методом эндоцитоза. Таким образом сахариды на поверхности устанавливают время жизни белков плазмы, а также определяют полупериод выведения, который может составлять до нескольких недель.
В здоровом организме концентрация альбуминов и глобулинов в крови поддерживается на постоянном уровне. Но бывают ситуации, когда показатели изменяются. Это происходит при заболеваниях органов, принимающих участие в синтезе и катаболизме белков. Повреждение клеток посредством цитокинов повышает формирование белков альбуминов, глобулинов, фибриногенов и некоторых других.
Электрофорез
Белки и прочие заряженные макромолекулы можно разделить электрофорезом. Среди всех существующих методов деления особенно важно выделить электрофорез на носителе, а именно – на ацетилцеллюлозной пленке. При этом сыворочные белки движутся к аноду, разделяясь на несколько фракций. После деления белки окрашиваются с помощью красителя, что позволяет оценить количество белка в окрашенных полосах.
Соотношение белков
При анализе количества белка в плазме крови, определяют не только уровень альбумина и глобулина, но и определяют отношение этих веществ друг к другу. В норме должно быть соотношение 2:1 При отклонении от этих показателях говорят о патологии.
Снижение отношения альбумина к глобулину может указывать на следующее:
- снижение синтеза альбумина — цирроз печени;
- низкий уровень альбумина может наблюдаться при патологиях почек.
Повышение отношения альбумина к глобулину может говорить о таких патологиях:
- гипотиреоз;
- лейкемия;
- новообразования;
- нарушение выработки гормона роста.
При снижении глобулина также в некоторых случаях выявляют аутоиммунные болезни, миелома.
Альбумины помогают поддерживать осмотическое давление в организме. Проведенный тест на общий белок позволяет оценить, как протекает болезнь, вести мониторинг онкологии, выявлять нарушения функций почек и печени, определять причину отеков, а также оценивать качество питания.