Выработка антител является функцией
Как работают антитела
Антигеном называют вещество или формы вещества, способные, при попадании внутрь организма, вызвать (индуцировать) иммунный ответ. Такие вещества в медицинской литературе часто называют иммуногенами.
Оглавление:
Процедура введения антигена в организм называется иммунизацией.
Антигены (иммуногены) – это крупные молекулы с большой молекулярной массой. Но бывают и исключения, когда иммунная система отвечает и на не слишком большие молекулы. Может получиться антиген при связывании маленьких молекул (например, молекулы ароматических веществ) с большой молекулой (макромолекулой), которая будет носителем, а маленькую молекулу в этом случае называют гаптеном. Случаи аллергических реакций немедленного или замедленного типа связывают часто именно с гаптенами.
В роли антигена могут выступать разнообразные объекты, содержащие в себе соответствующие вещества. Это могут быть пищевые, пыльцевые, инсектицидные, бытовые объекты, латекс, красители, ксенобиотики, различные виды имплантатов, опухолевые клетки и много других объектов. По своей химической природе антигенами являются белки, полисахариды, фосфолипиды и их комбинации.
Антигены несут признаки чужеродной информации. Но что именно и каким образом распознает иммунная система организма? Иммунная система обладает разнообразным арсеналом клеточных структур для распознавания и дестабилизации антигенов. Важную роль в деле идентификации антигена играют Т- и В-лимфоциты, они наделены специальными рецепторами (анализаторами) для узнавания антигена. И с помощью этих рецепторов лимфоциты анализируют молекулы наружных мембран клеток и межклеточных тканей чужеродного объекта. Зарождаясь в органах иммунной системы, лимфоциты наделяются рецепторами, которые изначально «заточены» на определение любого вида антигена, поступающего в организм, даже потенциально неизвестного иммунной системе.
В-лимфоцит находит антиген, поглощает и начинает процесс расщепления антигена, превращая его в антигенпрезентирующий комплекс (набор веществ «удобоваримый» для Т-лимфоцита), подготавливая его к презентации для Т-лимфоцита (без такой подготовительной работы Т-лимфоцит не в состоянии распознать антиген). Т-лимфоцит распознает подходящий для него подготовленный антиген и начинает делиться, то есть формировать клон себе подобного Т-лимфоцита. Число таких клонов может достигать нескольких миллионов, и каждый имеет специфические рецепторы для того же антигена. Клоны необходимы для того, чтобы на все молекулы антигена хватило клеток Т-лимфоцитов. Элиминируя молекулы антигена Т-лимфоциты привлекают к работе и другие фагоциты, чтобы с их помощью вывести из организма антигены. Весь процесс называется гуморальным иммунным ответом.Существует интересная особенность иммунной системы строить иммунный ответ на антигены с помощью Т-лимфоцитов и В-лимфоцитов или с помощью только В-лимфоцитов. В этом смысле все антигены подразделяют на тимусозависимые, когда участвуют Т- и В-лимфоциты, и тимусонезависимые, когда участвуют только В-лимфоциты. Тимусонезависимые антигены обозначают как ТН-антигены.
Антитела - это ответ иммунной системы на наличие в организме антигена. Антитела представляют собой молекулы иммуноглобулинов, особых растворимых белков. За выработку антител отвечают В-лимфоциты. Иммуноглобулины связывают молекулы антигенов, нейтрализуя их. Далее путем фагоцитоза молекулы элиминируют (выводят) из организма. Антитела, то есть иммуноглобулины, имеют уникальную возможность связывать молекулы антигена в том виде, в котором эти молекулы попадают в организм (без предварительной обработки молекулы, как в случаях с Т-лимфоцитами), поэтому иммуноглобулины называют антигенраспознающими и антигенсвязывающими молекулами. В таких случаях тратится меньше времени на ответную иммунную реакцию организма. Такие иммуноглобулины (антитела) участвуют в иммунном ответе, когда речь идет о нахождении в организме тимусонезависимых антигенов (ТН-антигенов).
Вот такая довольно замысловатая схема работы иммунной системы при попадании антигена в организм позволяет человеку бороться с вредоносными микроорганизмами и веществами, обеспечивая себе дальнейшую жизнь.
Источник: http://medicalfairway.ru/page_stat.php?ids=41&n_word=
Как и где вырабатываются антитела?
Антитела присутствуют в каждом организме как иммунный ответ на различные воздействия. Они вырабатываются лимфоцитами в случае необходимости, и по их количеству и классу можно судить о наличии того или иного заболевания.
Однако антитела важны не только в диагностических целях, они отвечают за работу иммунитета. Именно эта их функция используется во время вакцинации. С течением жизни человек накапливает в крови те или иные антитела, что и составляет его иммунитет. Для стимуляции выработки определенного вида антител используются вакцины.
Антитела: что это такое, группы и их действие
Антитела – специфические белки в крови, которые связывают антигены
Антитела представляют собой белковые соединения, которые являются частью иммунной системы человека. Для самого организма это своего рода защита, а в лабораторном исследовании – маркеры определенных заболеваний. Первые антитела вырабатываются еще в утробе. Они передаются ребенку от матери, но их немного. После рождения ребенок постоянно сталкивается с враждебной средой, вырабатывая все новые антитела. Этот процесс может продолжаться в течение всей жизни.
Действие антител основывается на связывании цепочки «антиген-антитело». Антиген того или иного возбудителя заболевания попадает в кровь, провоцируя выработку антител определенного класса. Для выработки определенных антител в течение жизни человеку делают различные прививки. Суть вакцинации заключается во введении определенного количества антигена, который провоцирует выработку тех или иных антител в количестве, достаточном для формирования иммунитета. Они остаются в организме человека в течение всей жизни, защищая его от заражения.
Выделяют 5 классов антител.
Выработка антител того или иного класса зависит не только от самого заболевания, но и его этапа: одни антитела вырабатываются сразу же после заражения, другие – только после окончания инкубационного периода:
- Класс G. Этот класс указывает на выработку стойкого иммунитета к возбудителю. Антитела класса G начинают вырабатываться через 2-3 недели после начала заболевания и могут сохраняться в организме всю жизнь, не указывая при этом на наличие самого возбудителя.
- Класс Е. Антитела, которые вырабатываются при аллергических реакциях атопического типа (обычно кожные реакции, отеки, зуд, аллергический ринит), а также при паразитарных поражениях.
- Класс А. Этот класс иммуноглобулинов вырабатывается в случае возникновения различных респираторных инфекций и при поражениях печени различной этиологии (вирусные гепатиты, цирроз, алкоголизм). Они появляются в крови через 1-2 недели после возникновения инфекции и исчезают примерно через 2-3 месяца. Есть уровень IgA остается прежним, это говорит о хронической форме заболевания.
- Класс М. Антитела, которые вырабатываются самыми первыми при инфекциях и снижаются в течение месяца после начала заболевания.
- Класс D. Этот класс иммуноглобулинов еще мало изучен и пока не используется в диагностических целях.
Где и как вырабатываются антитела? О чем они говорят?
Антитела вырабатываются лимфоцитами!
Антитела вырабатываются иммунными клетками под названием В-лимфоциты. Антитела содержатся в мембране этих клеток и в самой сыворотке крови. В случае возникновения инфекции антитела начинают поступать в кровь, познавая те или иные антигены и подавая сигнал иммунной системе.
Иммунологический анализ определяет не только класс антител, но и их количество. Это позволяет выявить определенные заболевания и даже примерный срок заражения:
- Вирусные и бактериальные инфекции. С помощью антител можно определить наличие той или иной инфекции, причем инфекция может быть совершенно различной: туберкулез, пневмония, герпес, ВИЧ и т.д. К определенному антигену вырабатывается свой иммуноглобулин, который и провоцирует иммунный ответ.
- Аллергии. Для определения аллергии существуют кожные пробы и иные тесты, но анализ на иммуноглобулины позволяет выявить вероятность появления аллергических реакций еще до того, как они проявятся. Этот анализ используют для обследования людей, с наследственной предрасположенностью к аллергии, чтобы узнать вероятность ее возникновения.
- Паразитарные инфекции. Анализ кала на гельминты не всегда эффективен, так как яйца глистов не всегда обнаруживаются в кале. Анализ крови в этом случае куда более информативен. Он показывает повышенное количество иммуноглобулина Е в плазме крови, что говорит о том, что паразитарная инфекция в организме присутствует.
- Половые инфекции. С помощью антител можно определить также различные половые инфекции: микоплазму, токсоплазму, уреаплазму, сифилис и другие. Именно ИФА (иммуноферментный анализ) является наиболее информативным в плане диагностирования всех существующих ЗППП.
- Заболевания щитовидной железы. Для определения заболеваний щитовидной железы определяют количество антител к тиреоглобулину, специфическому белку, вырабатываемому щитовидной железой.
- Аутоиммунные заболевания. Антитела являются показателем большинства аутоиммунных заболеваний. Они называются аутоантителами, то есть это те иммуноглобулины, которые выбрасываются в кровь в ответ не на внешний раздражитель, а на собственные клетки организма. Антигенами в этом случае могут выступать какие-либо соединения, липиды, гормоны и т.д.
Анализ крови на антитела, его расшифровка
Анализ крови на антитела назначается с целью выяснения состояния иммунитета человека
Анализ крови на антитела сдается из вены. Эта процедура стандартная, проводится быстро и безболезненно. Небольшая подготовка к сдаче анализа требуется. Например, накануне не рекомендуется употреблять жирную и жареную, острую пищу, алкоголь, так как это может повлиять не только на состав крови, но и свертываемость. Если кровь быстро свернется или сыворотка окажется мутной, обследование провести будет невозможно.
Перед сдачей анализа нужно отменить все препараты, но с разрешения врача. Если прием некоторых препаратов обязателен, это учитывается при расшифровке анализа.
Некоторые антитела чувствительны к эмоциональным и физическим напряжениям, поэтому перед сдачей крови желательно избегать стрессов и занятий спортом. Утреннюю зарядку также делать нежелательно, а перед входом в лабораторию нужно немного посидеть и отдышаться.
Расшифровкой должен заниматься врач, так как наличие некоторых антител трактуется по-разному, может потребоваться дополнительное обследование.
- IgA. В норме он присутствует в крови в небольших количествах, не более 3,5 г/л. Если количество этого иммуноглобулина значительно повышается, можно говорить о наличии инфекции. Среди возможных заболеваний: туберкулез, гепатит, цирроз, заболевания ЖКТ, инфекции дыхательных путей. Чтобы уточнить диагноз, собирают анамнез и проводят другие тесты. Пониженное количество IgA встречается при приеме некоторых препаратов, подавляющих иммунитет, при раке крови, облучении.
- IgE. Уровень этого иммуноглобулина нестабилен. Она может повышаться при аллергии или глистных инвазиях, а может оставаться на прежнем уровне, что не отрицает возможность аллергии и паразитарной инфекции.
- IgM. Эти иммуноглобулины вырабатываются в больших количествах при заболеваниях ЖКТ, инфекциях, дыхательных путей, поражениях печени, паразитарных инфекциях, а во время беременности указывают на возможность внутриутробного инфицирования.
- IgG. У взрослого человека эти антитела присутствует в сыворотке крови в количестве 7-18 г/л. Это показатель наличия иммунитета к тому или иному заболеванию, но повышение уровня этих иммуноглобулинов может указывать и на такие заболевания, как туберкулез, аутоиммунные заболевания, ВИЧ. Снижение уровня IgG встречается при онкологии, аллергических реакциях.
Антигены и антитела
Антигены - это вещества, чужеродные для организма, вызывающие образование антител
Организм начинает вырабатывать антитела на любой антиген, который сочтет враждебным. В зависимости от самого антигена отличаются и иммуноглобулины, атакующие его.
Не все антитела способны атаковать антиген, некоторые служат исключительно для распознавания враждебных клеток и активизации иммунной реакции. Антитело вступает в реакцию с антигеном, что провоцирует выброс определенных веществ, выполняющих защитную функцию в организме.
Если говорить о цепочке «антиген-антитело», то существует другая классификация антител:
- Антитела к белкам щитовидной железы. В крови обнаруживают антитела к рецепторам ТТГ и различным белкам, вырабатываемым щитовидной железой. Как правило, это указывает на тиреотоксикоз – синдром, связанный с гиперфункцией щитовидной железы, когда выработка гормонов идет слишком активно.
- Антиспермальные антитела. Это явление носит также название «иммунологическое бесплодие». Оно может быть выявлено как у мужчин, так и у женщин. Иммунитет распознает сперматозоиды как враждебные клетки и атакует их, что исключает зачатие.
- Антитела к ядерным антигенам. Это специфические антитела, которые атакуют собственные клетки организма, распознавая их как антигены, что является причиной неизлечимых аутоиммунных заболеваний.
- Антитела к инсулину. Это разновидность аутоантител, которые связываются с инсулином, вызывая реакцию организма на него, что встречается при врожденном сахарном диабете.
- Антитела к резус-фактору. Часто этот анализ проводится во время беременности у женщин с отрицательным резус-фактором. Если количество антител в крови велико, значит организм матери воспринимает клетки ребенка как враждебные и борется с ними.
- Антитела к двухспиральной ДНК. Встречаются при системной красной волчанке. Это антитела, которые направлены против собственной цепочки ДНК, что приводит к разрушению организма.
Больше информации о том, что такое антитела и антигены можно узнать из видео:
Это не весь список специфических антител. Анализ крови на антитела позволяет определить большое количество заболеваний с высокой точностью. Он играет большое значение в лабораторной диагностике.
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.
Источник: http://diagnozlab.com/analysis/immunolog/antitela-vyrabatyvayutsya.html
Антитела в крови повышены что это значит
Антитела к ТПО повышены – что это значит?
Анализ на антитела к тиреоидной пероксидазе на сегодняшний день считается одним из самых популярных. Доктора назначают его своим пациентам все чаще и чаще. Понимая, что значит этот показатель, и почему антитела к ТПО повышаются, чувствовать себя при получении результатов анализов можно гораздо спокойнее.
Кому назначается анализ на антитела к ТПО?
Этот анализ достовернее многих других исследований способен определить, развивается ли в организме аутоиммунное заболевание или нет. Говоря понятнее, показатель антиТПО позволяет выявить, насколько агрессивно иммунная система ведет себя по отношению к организму. ТПО отвечает за образование активного йода, способного йодифицировать тиреоглобулин. А антитела блокируют вещество, что приводит к снижению секреции тиреоидных гормонов.
Отправлять всех пациентов поголовно на анализ крови на антитела к ТПО, чтобы выяснить, не повышены ли они, неправильно. Исследование показано только при определенных условиях:
- Новорожденным. Их проверяют на антиТПО, если эти антитела обнаружены в организме матери, или же при послеродовом тиреоидите.
- Пациентам с увеличившейся щитовидной железой.
- Лицам, принимающим препараты лития и интерферона.
- Людям с гипотиреозом. Исследование нужно для того, чтобы выяснить причину заболевания.
- При наследственной предрасположенности. Если у кого-то из родственников были проблемы из-за повышенных антител к ТПО, пациент автоматически попадает в группу риска и нуждается в регулярных осмотрах.
- После выкидыша. Иногда выкидыши или незапланированные преждевременные роды случаются как раз из-за выработки иммунной системой специфических антител.
О чем говорит повышенный уровень антител к ТПО?
Появление антител к ТПО главным образом указывает на то, что клетки щитовидной железы постепенно разрушаются, и в органе вырабатывается недостаточное количество нужного фермента. Бывают и другие объяснения:
- Незначительно повышаться антитела к ТПО могут при аутоиммунных отклонениях: ревматоидном артрите, сахарном диабете, системном васкулите, красной волчанке.
- Если антитела к ТПО повышены у беременных, это означает, что у ребенка может развиться гипертиреоз с вероятностью практически в 100%.
- У пациентов с антителами к ТПО повышенными в 10 раз, скорее всего, будет диагностирован диффузный токсический зоб или тиреоидит Хашимото.
- Увеличенное количество антител к ТПО в анализе, сделанном после пройденного курса терапии, указывает на неэффективность выбранного метода лечения.
Иногда антитела к ТПО могут повышаться и без видимых причин. Происходить это может в основном в женском организме, и объясняется, как правило, возрастными изменениями. В таком случае явление расценивается как вполне нормальное. Но впоследствии пациентке все-таки рекомендуется некоторое время понаблюдаться у специалиста.
Лечение повышенных антител к ТПО
Определить, что показатель увеличился, главное вовремя. Проблема в том, что вылечить повышенные антитела к ТПО нельзя. Этот показатель может изменяться только в том случае, если что-то будет предпринято в отношении заболевания, ставшего причиной его повышения. Если же никаких мер не принимать, недуг сможет беспрепятственно развиваться, а количество специфических антител увеличиваться.
Начальный этап лечения – полное обследование с целью определения первопричины увеличения количества антител к ТПО. Очень многие доктора обращаются к заместительной гормональной терапии. Применение этого метода целесообразно только тогда, когда причина проблемы в болезнях щитовидной железы.
Антитела в крови – защита организма от инфекции
Природа создала человека в виде совокупности множества сложнейших систем и процессов, от каждого из которых зависит состояние здоровья индивидуума. Иммунная система является одной из важнейших функциональных единиц, которая отвечает за взаимодействие человека с окружающим миром и призвана защищать его от различных микроорганизмов. Для этого она использует специальные гликопротеины, которые мы называем антителами.
Антитела в крови – что это такое
Из курса школьной биологии всем нам известно, что антитела в крови присутствуют у человека постоянно, причем они есть у каждого из нас. Их набор различается в зависимости от того, какие именно заболевания переносил человек в течение жизни и от каких болезней ему делали прививки, определенный вид антител может обезвредить только определенный вид возбудителя. Именно поэтому врачи могут для диагностики того или иного заболевания назначать анализ на антитела в крови, норма которых для каждого конкретного заболевания разная.
Особое значение количеству антител придается во время беременности, поэтому всех беременных обследуют на антитела в крови в обязательном порядке. В период ожидания появления ребенка на свет у беременной женщины могут обостриться многие болезни, которые ранее не доставляли ей никаких хлопот, но которые теперь могут угрожать жизни или нормальному развитию ее ребенка. Комплекс обязательных анализов включает в себя исследование на антитела в крови к основным вирусным инфекциям, которые опасны для плода, то есть к краснухе, герпесу и токсоплазмозу.
В каких случаях нужно сдавать кровь на антитела
Кроме того, подобные исследования проводятся при различных паразитарных инфекциях. При условии здорового иммунитета организм человека остро реагирует на любой инородный организм, который попадает в сети иммунной системы, и совершенно неважно, бактерия это или какой-либо паразит. На активизацию защитных сил организма нужно некоторое время, за которое начинают вырабатываться антитела в крови, после чего их количество резко увеличивается и на этом основании можно говорить о наличии инфекции в организме.
Если у больного есть подозрение на какую-либо инфекцию, бывает так, что приходится проводить анализ на антитела несколько раз, ведь некоторые возбудители могут присутствовать в организме в латентном состоянии дни и даже недели. Например, для обнаружения лямблиоза от момента заражения должно пройти не менее 10 дней, а если результат будет сомнительным, возможно назначение дополнительного анализа еще через неделю.
Виды антител человеческого организма
Существует несколько типов антител, которые различаются в зависимости от тех функций, которые они должны выполнять. Например, антипаразитарные и антиинфекционные антитела направлены на уничтожение возбудителя болезни или хотя бы на нарушение его деятельности. Антитоксические иммуноглобулины не оказывают непосредственно возбудителю никакого вреда, зато эффективно обезвреживают его токсины, которые вызывают симптоматику заболевания. Следует помнить, что иногда повышенные антитела в крови говорят не о существовании инфекции в организме в данный момент, а о том, что она когда-либо была. Такие агенты не могут побороть инфекцию, а просто сообщают о ней. Аутоантитела являются признаками аутоиммунных заболеваний, суть которых состоит в том, что иммунная система организма перестает различать собственные клетки и вырабатывает к ним антитела, попросту их уничтожая. Аллоантитела являются именно теми стражами, которые защищают организм от клеток подобного ему типа, но принадлежащие другому организму. Именно из-за их деятельности возникает отторжение органов при пересадке или проявляется негативная реакция при переливании крови.
Антитела в крови: их виды и значение
Антитела (АТ) — вещества белковой природы, которые содержатся в сыворотке крови или в других биологических жидкостях. Они синтезируются в организме при попадании в него антигенов (чужеродных соединений). Эти вещества являются важным фактором гуморального иммунитета и выполняют следующие функции: активируют систему комплемента, усиливают фагоцитоз и взаимодействуют с различными клетками человеческого организма. Повышенные антитела в крови обнаруживаются при различных заболеваниях и инфекциях. Их концентрация указывает на степень нарушений в иммунной системе.
Виды иммунных белков
Антитела в крови относятся к гамма-глобулиновой фракции. Это иммуноглобулины — сывороточные белки, которые синтезируются различными плазматическими клетками и бывают пяти классов. Данные соединения состоят из длинных и коротких полипептидных цепей. Все антитела имеют связующий элемент, который содержит белковые петли разного аминокислотного состава в зависимости от типа. Другие их структурные части практически одинаковы, что облегчает взаимодействие с иными компонентами иммунной системы. Стоит отметить, что антитела в крови бывают разных видов (их более 100 миллионов), причем каждый из них взаимодействует только с определенным антигеном. Такое широкое разнообразие АТ связано с рекомбинацией генов в лимфоцитах и клетках крови, которые их синтезируют. Надо также сказать, что антитела в крови бывают полными и неполными. Первые содержат в своей структуре не менее двух активных центров и дают видимую серологическую реакцию. Они способны соединяться с антигенными веществами при низких температурах (холодовые антитела) и при высоких (тепловые). Полные антитела бывают всех пяти классов, а моновалентные (неполные) — это только те соединения, которые образуются в организме при резус-конфликте. Существуют также природные (нормальные) АТ, которые обнаруживаются в крови при отсутствии явной инфекции или иммунизации. Бактериальные иммуноглобулины синтезируются в случае контакта с различными антигенами, чаще бактериями. Они определяют индивидуальную устойчивость к инфекциям и обусловливают появление защитного ответа вторичного типа, что лежит в основе развития иммунологической памяти и формирования невосприимчивости организма к вторичному попаданию отдельных антигенов.
Антитела в крови: норма каждого вида данных соединений имеет свои индивидуальные значения. Увеличение их концентрации указывает на то, с какой именно инфекцией борется организм. Данное свойство помогает диагностировать различные патологии или делать вывод о том, какие именно заболевания человек перенес в прошлом. Кроме этого, когда выявляются антитела в крови против собственных структур организма, это дает возможность подтверждать наличие многих аутоиммунных нарушений. Также следует отметить, что именно АТ в составе иммунных сывороток широко применяются в клинической практике для профилактики и терапии инфекционных патологий. Чаще всего используют антитела против бактериальных токсинов при дифтерии, столбняке, ботулизме. С помощью иммунных белков определяют совместимость крови при ее переливании, а также подбирают оптимального донора для пересадки органов или тканей. Важную роль антитела играют и в судебно-медицинской практике при определении природы антигенов.
Антитела к тиреопероксидазе
Тиреопероксидаза – фермент, вырабатываемый клетками щитовидной железы, участвующий в синтезе гормонов тироксина и трийодтиронина и служащий для образования в организме активной формы йода. Антитела к тиреоипероксидазе (антитела к микросомальной тиреопероксидазе) являются аутоантителами к данному ферменту, которые образуются тогда, когда иммунная система неправильно воспринимает клетки щитовидной железы как чужеродную субстанцию.
Анализ на антитела к тиреопероксидазе
Проведение анализа на антитела к тиреопероксидазе позволяет выявить различные нарушения функционирования щитовидки. Появление в крови этих веществ приводит к снижению выработки гормонов и разрушению клеток щитовидной железы, что вызывает определенные патологии. Антитела к тиреопероксидазе могут быть обнаружены в небольшом количестве и у здоровых людей (до 20 % среди женщин). Значение нормы содержания антител к тиреопероксидазе в крови зависит от используемой методики исследования, которая характеризуется установленными значениями чувствительности и пределами нормальных показателей.
Причины повышения уровня антител к тиреопероксидазе:
- Небольшое превышение нормы может быть связано со многими патологиями щитовидной железы, а также различными аутоиммунными заболеваниями (системная красная волчанка, ревматоидный артрит, системный аутоиммунный васкулит, сахарный диабет, рак щитовидки и т.д.).
- Если антитела к тиреопероксидазе повышены существенно, то это зачастую свидетельствует об аутоиммунном заболевании щитовидной железы (тиреоидит Хашимото, диффузный токсический зоб).
- Повышенное значение содержания антител к тиреопероксидазе у женщины во время беременности может указывать на гипертериоз у будущего ребенка.
- При определении уровня антител к тиреопероксидазе в период лечения для оценки его результативности повышенные значения свидетельствуют об обострении имеющегося заболевания или о недостаточной эффективности терапии (если же, наоборот, антитела к тиреопероксидазе понижены, это говорит об успешности лечения).
Симптомы при повышенном уровне антител к тиреопероксидазе
Если показатель количества антител к тиреопероксидазе в крови повышен, то возможно наличие таких симптомов:
- ломкость и выпадение волос;
- сухость кожи;
- отечность;
- снижение слуха;
- изменение голоса;
- повышенное потоотделение;
- учащенное сердцебиение;
- нарушения сна и др.
Последствия повышения антител к тиреопероксидазе
Повышенный уровень антител к тиреопероксидазе – сигнал об иммунологическом неблагополучии в организме. Вследствие этого может поражаться опорно-двигательная, сердечнососудистая, нервная, пищеварительная системы. У женщин также может страдать репродуктивная система, а именно, превышение нормы содержания антител к тиреопероксидазе является фактором риска развития самопроизвольного прерывания беременности.
Лечение при увеличенном уровне антител к тиреопероксидазе
Если уровень антител к тиреопероксидазе повышен значительно, то перед лечением назначаются дополнительные анализы:
- уровень тиреотропного гормона;
- уровень тироксина;
- уровень трийодтиронина;
- уровень свободных тиреоидных гормонов.
Также требуется провести УЗИ щитовидной железы. На основании полученных результатов возможна постановка точного диагноза и назначение лечебного курса. Как правило, рекомендуется медикаментозное лечение. В дальнейшем потребуется постоянный контроль и проведение анализов с целью динамики изменения количества гормонов и антител к тиреопероксидазе.
Что такое антитела? и на что влияет их увеличение в крови?
Антитела (иммуноглобулины, ИГ, Ig) — это белки, относящиеся к подклассу гамма-глобулинов, находящиеся в крови, слюне, молоке и других биологических жидкостях позвоночных животных. Иммуноглобулины синтезируются В-лимфоцитами в ответ на чужеродные вещества определенной структуры — антигены. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов. Антитела выполняют две функции: антиген-связывающую функцию и эффекторную (например запуск классической схемы активации комплемента и связывание с клетками) , являются важнейшим фактором специфического гуморального иммунитета, состоят из двух лёгких цепей и двух тяжелых цепей. У млекопитающих выделяют пять классов иммуноглобулинов — IgG, IgA, IgM, IgD, IgE, различающиеся между собой по строению и аминокислотному составу тяжелых цепей.
Антитела представляют собой особые белки (протеины) , которые продуцируются клетками иммунной системы. Антитела способны бороться со специфичными антигенами. Для ясности, давайте разберемся, что такое антитела. Антителами выступают обычно только белковые молекулы, но иногда это могут и небелковые молекулыЧто такое белковые молекулы в качестве антигена? Это, например, болезнетворные бактерии, вирусы, клетки опухоли, чужеродные клетки, которые попали в организм искусственно (переливание крови, пересадка органов и тканей) , а также другие белковые вещества. Следует сказать, что антитела имеют свою специфичность. То есть, определенные антитела могут воздействовать только на определенные антигены. К примеру, сыворотка, в которой содержатся антитела, вводится в организм при определенном заболевании и не оказывает какого-либо эффекта при других заболеваниях, так как в этом случае в организме – другой антиген.
Антитела могут бороться с антигенами несколькими путями:
Они склеивают антигены (клетки) в кучки таким образом, что они не могут передвигаться, после чего они поглощаются макрофагами.
Образуют «дыры» в стенке клеток-антигенов, в результате чего их содержимое вытекает и клетки погибает.
Блокируют антигены, что позволяет клеткам иммунной системы (в особенности, макрофагам) , пожирать эти клетки.
Белые кровяные тельца - белые кровяные клетки – это лейкоциты. Их очень много в крови и они циркулируют по всему организму, как бы, будучи на страже, чтобы в любой момент отразить атаку антигенов. Вы наверняка сталкивались с количеством лейкоцитов, когда сдавали общий анализ крови. В норме их число составляет от 4 до 9 миллиардов в одном литре крови (обозначается как 4 – 9 х 109 на л) .Лейкоциты в свою очередь делятся на 5 типов:
Лимфоциты. Этот вид белых кровяных телец представляет собой ключевой элемент иммунной системы. лимфоциты обладают уникальным свойством – они могут помнить любой антиген, с которым они когда-то сталкивались. Благодаря этому их свойству, в частности, и существует иммунитет от различных инфекционных болезней. Это означает, что при попадании в организм какого-либо антигена лимфоциты «помнят» , как с ними бороться. Дело в том, что лимфоциты делятся на два больших класса:
Т-лимфоциты. Эти лимфоциты взаимодействуют с антигеном только после того, как им «дадут знать» о них особые клетки. После взаимодействия с антигеном, Т-лимфоциты начинают продуцировать вещества, привлекающие другие иммунные клетки – макрофаги, которые и атакуют антиген, пожирая его. Иногда иммунная система не в состоянии полностью уничтожить антиген, а лишь как бы изолирует его, окутав как будто сетью. Итак, функция Т-лимфоцитов – это сбор клеток иммунной системы на борьбу с антигеном.
В-лимфоциты. Эти клетки иммунной системы играют очень важную роль – они продуцируют антитела. В-лимфоциты так же обладают памятью и могут в течение длительного времени помнить, какие антитела нужно вырабатывать против того или иного антигена. На этом основан и принцип вакцинации. При этом в организм вводится антиген, но не обычный, а но много ослабленный или даже погибший. Иногда в состав вакцины входит не полностью антиген, а лишь его часть, та самая, которую и «запомнит» иммунная система. Как только такой ослабший или убитый антиген оказывается в организме, иммунная система вырабатывает антитела к нему и таким образом формируется «память» - это и есть иммунитет. В следующий раз, когда а организм поступит настоящий антиген, Ваша иммунная система уже будет знать, как лучше всего бороться с этим антигеном, в результате чего болезнь протекает весьма легко или даже не успевает перейти в клиническую стадию.
Следующий тип клеток иммунной системы – это макрофаги. Само слово макрофаг образовано от двух слов: макро – большой и фаг – пожирать. Эти клетки и есть те лейкоциты, которые пожирают антиген.
Остальные три типа клеток: нейтрофилы, базофилы и эозинофилы отвечают за развитие и течение воспаления.
Источник: http://zna4enie.ru/opredelenie/antitela-v-krovi-povysheny-chto-jeto-znachit.html
Антитела
На кончике каждого антитела содержится паратоп, который является специфичным для каждого конкретного эпитопа на антигене, что позволяет связываться этим структурам вместе с абсолютной точностью. Данный процесс связывания позволяет антителам помечать патогенные молекулы или клетки для последующей атаки клетками иммунной системы для их нейтрализации. Такой процесс препятствует развитию заболевания, а также может активировать макрофаги для уничтожения вредных микроорганизмов. Производство антител возложено на гуморальную иммунную систему, это является основной ее функцией. Взаимодействие антител с другими компонентами иммунной системы происходит через Fc-область.
Секреция антител происходит B-клетками адаптивной иммунной системы, чаще всего дифференцированными B-клетками (плазматическими клетками). Антитела присутствуют в двух формах, а именно в растворимой, свободно распространяющиеся в плазме крови, а также в форме, связанной с мембраной, прикрепляющейся к поверхности B-клетки, называемыми B-клеточными рецепторами. B-клеточные рецепторы присутствуют только на поверхности B-клеток, что облегчает активацию этих клеток и их дифференциацию на различные области производства антител (плазматические клетки или клетки памяти) B-клеток, которые выживают в организме, запоминая определенный (тот же) антиген, что позволяет реагировать B-клеткам быстрее при следующем попадании этого антигена в организм. Работа растворимых антител продолжается после их высвобождения в кровь и в другие жидкости организма, где они продолжают обследование чужеродных микроорганизмов.
Строение антител
Антитела это тяжелые примерно 150 кДа белки, содержащие сахарные цепи (гликаны), т.е. антитела это гликопротеины. Основной функциональной единицей каждого антитела является мономер иммуноглобулина.
В общем все антитела имеют примерно схожую структуру, но небольшая область на кончике белка очень изменчива, что позволяет существовать миллионам антител с различиями именно на этом кончике. Данное место называется гипервариабельной областью. Каждый вариант кончика способен связываться с определенным антигеном. Такой огромный вариант антител-паратопов дает возможность иммунной системе связывать множество чужеродных микроорганизмов, вторгающихся в организм человека. Большое разнообразие паратопов антител достигается за счет рекомбинации - процесса их случайной мутации в области гена антитела. Паратоп антителя является полигенным и состоит из трех генов V, D, J. Паратопный локус полиморфен, поэтому при продуцировании антитела выбирается по одному аллелю из генов V, D, J, после чего сегменты генов соединяются вместе случайно генетической рекомбинацией для создания паратопа. Области, в которых гены случайным образом рекомбинируются вместе называются гиперпеременной областью, которая используется для распознавания антигенов. В ходе процесса под названием коммутация классов, происходит реорганизация генов антител, в результате чего один тип фрагмента Fc тяжелой цепи меняется на другой, создавая другой изотип антитела. Такой процесс дает возможность использовать одно антитело различными типами Fc-рецепторов.
В состав антитела входят несколько основных структурных единиц с двумя большими тяжелыми и двумя небольшими легкими цепями. Тяжелые цепи антител имеют несколько различных типов, определяемых пятью типами кристаллизующихся фрагментов Fc, способные присоединяться к антигенсвязывающимся фрагментам. Пять различных типов областей Fc дают возможность антителам группироваться в пять изотипов. При этом каждая область Fc конкретного изотипа антитела имеет возможность связываться со своим специфическим Fc-рецептором, кроме lgD, являющимся по существу B-клеточным рецептором. Это позволяет структуре антиген-антитело опосредовать разные роли, которые будут зависеть от Fc-рецептора с которым он связывается. При этом структуры гликанов, присутствующие в области Fc модулируют способность антител связываться с его соответствующим Fc-рецептором. Такая способность антител способствует направлению необходимого иммунного ответа на каждый отдельный тип патогенного объекта. Так например, lgE несет ответственность за аллергическую реакцию, которая представляет собой дегрануляцию тучных клеток и высвобождение гистамина. В данном случае Fab-паратоп lgE связывается с аллергеном (антигеном), чем может быть частицы клещей, пыли и т.д., его Fc-область связывается с Fc-рецептором ε. Такая связь активирует аллергическую трансдукцию сигнала, индуцируя например астму.
Как действуют антитела
В ходе работы антител, паратоп антитела взаимодействует с эпитопом антигена, которых содержится несколько прерывисто расположенных вариантов вдоль его поверхности. При этом доминирующие эпитопы на поверхности антигена называют детерминантами. Взаимодействие антитела и антигена строится по принципу замок-ключ в пространственной комплементарности. Следует отметить, что молекулярные силы, которые участвуют во взаимодействии Fab-эпитопов слабые и неспецифические. К таким силам относятся электростатические силы, водородные связи, гидрофобные взаимодействия и силы Ван-дер-Ваальса. Это говорит о том, что связь антитела с антигеном не является абсолютной и может быть обратимым. Это также позволяет антителу перекрестно реагировать с разными антигенами.
Бывает и так, что при связывании антитела с антигеном они становятся сами по себе иммунным комплексом, функционирующим как единый объект и действующим как антиген, на борьбу с которым будут направлены другие антитела. Пример таких молекул это гаптены, которые сами по себе не активируют иммунную систему, а делают это только после связывания с белками.
Основные функции антител следующие:
- Агглютация. В данном процессе антитела склеивают посторонние клетки в комки, комки в свою очередь атакуются фагоцитами.
- Активация комплемента или фиксация. При этом процессе происходит фиксация антител на враждебной клетке, что способствует ее атаке комплексом мембранной атаки, вызывая лизис враждебной клетки или процесс воспаления, притягивая клетки воспалители.
- Нейтрализация. В ходе нейтрализации они блокируют части поверхности чужеродного антигена, делая его атаку неэффективной.
- Осаждение. Осаждение начинается склеиванием сывороточно растворимых антигенов, которые затем выпадают в осадок в виде комков, которые также атакуются фагоцитами.
Происходит дифференцирование активированных B-клеток в продуцирующие антитела клетки или в клетки памяти, выживающие в организме следующие годы, что позволяет иммунной системе помнить антиген и осуществлять быструю реакцию на вторжение такого же объекта в будущем.
Антитела, связывающиеся с поверхностными антигенами, такими как бактерии, привлекают первый компонент каскада комплемента с их Fc областью, инициируя активацию классической системы комплемента. Происходит уничтожение бактерии путем опсонизации - ее маркирования молекулой антитела для уничтожения фагоцитами или путем бактериолиза - комплекса мембранной атаки, позволяя уничтожать бактерию антителами напрямую.
При агглютинирование антитела связываются с патогенами, соединяя их вместе. Этому способствует наличие у антитела более одного паратопа. После того, как антитела покрыли патоген активируются эффекторные функции против патогена в клетках, распознающих свою Fc область.
Источник: http://anatomus.ru/imunn/antitela.html
Антитела
Глобулины сыворотки крови человека и животных, образующиеся в ответ на попадание в организм различных антигенов (принадлежащих бактериям, вирусам, белковым токсинам). Антитела вступают в реакции специфического взаимодействия с данными антигенами, в результате чего происходит дезактивация соответствующих бактерий, вирусов и токсинов.
Антитела являются важным элементом иммунной системы и принимают участие во многих процессах, отвечающих за защиту организма. Человек ежедневно сталкивается с огромным количеством чужеродных агентов, со многими из которых он встречается впервые, что создает потребность в постоянной адаптации защитных систем организма, представленных клеточным иммунитетом, исполнение задач которого возложено на специализированные клетки, и гуморальным, представленным специфическими (антитела) и неспецифическими структурами. Огромный прогресс в исследовании механизмов функционирования и регуляции иммунитета был достигнут в конце XIX века работой двух великих ученых – Ильи Мечникова, основоположника клеточной теории, и Пауля Эрлиха, основоположника гуморальной теории.
Антитела
Антитела представлены белковыми молекулами Y-образной формы, состоящими из четырех полипептидных цепей (двух идентичных легких и тяжелых). Каждая легкая цепь соединена только с одной тяжелой цепью, в то время как тяжелые цепи соединены между собой. Антитела имеют три конца, два из которых называются Fab-фрагментами (fragment antigen binding, то есть фрагментами, отвечающими за связывание антигенов) и один – Fc -фрагментом (название обусловлено его тенденцией к кристаллизации в растворах). Fc фрагмент отвечает за выполнение биологических функций антител, связываясь с рецепторами на лимфоцитах и макрофагах или вызывая активацию комплемента.
Некоторые антитела объединены в мультимеры, состоящие из двух и более молекул, соединенных между собой.
Благодаря широкой вариабельности Fab-фрагментов, антитела способны связывать огромное количество антигенов, включающих как макромолекулы, так и маленькие химические соединения. Участки антигенов, содержащие уникальную последовательность химических соединений, узнаваемую антителами, называют эпитопами. Сила, с которой Fab-фрагмент взаимодействует с эпитопом, называется аффинитетом.
Антитела могут как свободно циркулировать, так и быть связанными с мембраной, являясь рецепторами В – лимфоцитов. У Т-лимфоцитов же рецепторами могут быть только ТCR (T cell receptor complex). Секретируемые антитела в норме представлены в крови и на слизистых, выполняя функции нейтрализации и удаления микробов и токсинов. Антитела также называют иммуноглобулинами, когда они попадают в кровоток, на слизистую или становятся рецепторами В-лимфоцитов.
После взаимодействия Fc фрагмента с антителом, связанным с антигенной детерминантой, сигнал через специальный комплекс передается внутрь клетки, приводя к ее активации.
Важно понять, что узнавание чужеродных агентов происходит в случайном порядке, и совпадение между индивидуальными участками антигенов и Fab-фрагментами антител обусловлено огромным количеством и вариабельностью клонов лимфоцитов.
Антитела у детей
Иммунитет у новорожденных не способен полноценно противостоять всем угрозам внешней среды, что обусловлено низкой степенью его развития. Постепенное совершенствование иммунного ответа происходит параллельно с развитием других органов и систем, однако на протяжении этого процесса можно наблюдать «критические периоды», сопровождаемые недостаточностью иммунной защиты.
Первый критический период длится первые 29 дней жизни и обусловлен тем, что иммунная защита ребенка представлена преимущественно антителами матери, попавшими в организм ребенка через плаценту или грудное молоко. В этом периоде повышен риск бактериальных и вирусных инфекций. Особое внимание следует уделить недоношенным.
Второй критический период наблюдается на 4-6 месяцах жизни и обусловлен истощением пула антител, попавших в организм ребенка от матери через плаценту и низкой способностью к синтезу своих антител. Кроме того, классом антител, производимым в этом периоде, являются антитела класса М. Почти полное отсутствие иммуноглобулинов G, являющихся главными защитниками, и других классов антител, приводит к низкой устойчивости ребенка в этом возрасте к инфекциям, передаваемым воздушно-капельным и кишечным путями.
Третий критический период можно наблюдать на 2-м году жизни, что связано с активной познавательной деятельностью ребенка и неполноценной иммунной защитой. В связи с недостаточной секрецией Ig А, отвечающего за местный иммунитет, сохраняется высокая восприимчивость к инфекциям, передаваемым воздушно-капельным и кишечным путями.
Четвертый критический период наблюдается на 6-7 годах жизни, что связано с физиологическим уменьшением количества лимфоцитов, однако сохраняющийся низкий уровень Ig A приводит к тому, что слизистые не способны полноценно противостоять инфекциям, передаваемым воздушно-капельным и кишечным путями. Кроме того, высокий уровень IgE, обусловленный значительной частотой глистных инвазий, повышает вероятность развития аллергических реакций в этой возрастной группе.
Пятый критический период наблюдается в подростковом возрасте и обусловлен относительным несоответствием объема органов иммунной системы фактическим размерам организма. Также повышение секреции половых гормонов приводит к угнетению клеточного компонента иммунной системы. Как правило, наблюдается высокая восприимчивость к заболеваниям вирусной природы.
У детей также могут встречаться наследственные заболевания, при которых наблюдается дефект гуморального звена иммунитета.
К дисгаммаглобулинемиям относят:
- Недостаток антител A класса;
- Недостаток антител G класса;
- Недостаток транскобаламина II;
- Гипер-IgM- синдром;
- Гипер-IgE синдром;
- Гипер-IgD синдром.
Антитела у взрослых
В зрелом возрасте у людей иммунная система, как правило, полностью сформирована и наделена большими компенсаторными возможностями, позволяющими адаптироваться к изменяющимся или тяжелым условиям окружающей среды. Однако вредное воздействие неблагоприятных факторов внешней среды может приводить к значительному снижению уровня иммунной защиты. Устранение вредных факторов, как правило, восстанавливает ее первоначальный уровень.
Антитела при беременности, влияющие на ее течение
Беременность является сложным физиологическим процессом, протекающим в течение длительного, порядка 40 недель в норме, срока. В этот период питание и дыхание плода, находящегося внутри материнского организма, осуществляется через гемоплацентарный барьер. Вместе с газами, растворенными в крови, и питательными веществами, через плаценту могут проходить иммуноглобулины. Однако, в норме не все антитела при беременности могут попадать в кровь плода. Этой способностью обладают только Ig G. Их основной целью в этом периоде является предотвращение развития внутриутробных инфекций или септических состояний.
К сожалению, не всегда антитела при беременности играют положительную роль. Так, развитие иммунных реакций, направленных против своего плода, не является редким явлением и может приводить к прерыванию беременности на ранних сроках.
Так, возможно формирование антител при беременности к белковым структурам на поверхности плода, отвечающим за резус-фактор или группу крови.
Резус-фактор присутствует у 85% населения и, при его наличии на поверхности эритроцитов, он считается положительным. При наличии положительного резус-фактора у плода, в то время как у матери он отрицателен, высока вероятность развития антител к эритроцитам и их последующему гемолизу. Выделяющийся при этом гемоглобин превращается в билирубин, в высоких концентрациях обладающий токсическим влиянием на нервную ткань. При условии, что мать не сталкивалась ранее с резус-положительной кровью и у нее отсутствуют антитела к резус-фактору, первая беременность может протекать без осложнений. Во время родов проводится инъекция анти-Д-иммуноглобулина, что в ряде случаев позволяет облегчить течение второй беременности и снизить риск резус-конфликта при повторной беременности до 10-15%. Однако, анализ на антитела может быть положительным и при несостоявшейся первой беременности и составляет 3% после выкидыша, после медицинского аборта в 5%, а при внематочной беременности- в 1% случаев.
Антитела при беременности к эритроцитам плода также могут вырабатываться у матери с I группой крови при рождении ребенка со II или III группами, что также может приводить к гемолизу эритроцитов, приводя к смерти плода.
Роль антител в материнском молоке
В связи с незрелостью иммунной защиты новорожденных, выработка собственных антител у них практически отсутствует, что значительно повышает риск развития инфекционных процессов. Сразу после родов в грудном молоке содержится огромное количество Ig A, отвечающих за защиту слизистых оболочек и значительно снижающих риск заболеваний инфекционной природы. Кроме того, в организме ребенка циркулируют антитела, попавшие в кровь ребенка через плаценту еще до родов.
Таким образом, использование заменителей грудного молока значительно ухудшает прогноз в отношении иммунной защиты и не должно происходить без серьезных показаний.
Антитела у пожилых
Так как антитела являются неотъемлемой частью иммунитета, нельзя оценивать их состояние отдельно от общего состояния иммунной системы.
У людей с возрастом в норме происходят изменения, затрагивающие иммунные процессы:
- инволюция тимуса;
- дегенеративные изменения костного мозга;
- дегенеративные изменения органов лимфоидной системы.
Инволютивные изменения в тимусе начинаются во время полового созревания и сказываются на эффективности клеточного компонента иммунитета, что повышает риск инфекционных и онкологических болезней.
В отличие от клеточного, гуморальный иммунитет меньше подвержен влиянию возраста, хоть и может наблюдаться незначительное снижение уровня естественных иммуноглобулинов.
Однако, из-за снижения эффективности клеточного и гуморального компонентов иммунитета, повышается вероятность образования аутоантител, что повышает риск развития ревматоидного артрита, тиреоидита и других аутоиммунных заболеваний. Одной из причин образования антител к собственным тканям является снижение контроля за клетками, которые подверглись мутациям и не были уничтожены клеточным иммунитетом.
Следует отметить, что отмечается снижение атопий при увеличении инфекционной и химической форм аллергии с повышением риска развития анафилактического шока.
Классы антител
Цепи, принимающие участие в образовании молекулы антитела, имеют вариабельные участки (формируются в результате сложного процесса отбора отдельных участков ДНК В-лимфоцитов и участвуют в формировании Fab-фрагментов) и константные участки (участвуют в формировании Fc-фрагментов и определяют биологические функции молекулы). В зависимости от того, какие константные участки были синтезированы, выделяют 2 вида легких цепей и 5 видов тяжелых цепей, однако определяющее значение играют тяжелые цепи, в зависимости от которых выделяют пять изотипов, или классов:
Каждый изотип имеет определенные функции и биологические свойства.
Антигенными рецепторами неактивированных В-лимфоцитов являются связанные с мембраной Ig M или Ig D антитела. После одновременной стимуляции антигеном и Т-хелпером, В-лимфоцит, который соответствует конкретному антигену, активно делится и дифференцируется на разные клоны, синтезирующие определенные классы антител.
Антитела класса М
Продолжительность жизни составляет 5 дней.
Существуют в форме пентамера (состоят из пяти молекул антител формы Y, соединенных в области Fc-фрагмента).
Функции антител класса М:
Антитела G класса
Продолжительность жизни составляет 23 дня. Существуют антитела G класса в качестве мономера, свободно циркулируя в кровотоке.
- Опсонизация;
- Активация комплемента;
- Антитело-опосредованная цитотоксичность;
- Обеспечивают неонатальный иммунитет;
- Являются основными антителами, синтезирующимися в ответ на повторную активацию клеток памяти идентичным антигеном;
- Ингибирование активности В-лимфоцитов по способу обратной связи.
Антитела класса А
Продолжительность жизни составляет 6 дней. Существуют в форме мономеров, димеров и тримеров.
Функция антител класса Ig A заключается в защите слизистых от чужеродных агентов путем их связывания до попадания в ткани.
Антитела класса Е
Продолжительность жизни составляет 2 дня.
Антитела класса Е имеют две основные функции:
- Являются рецепторами базофилов;
- Отвечают на паразитарную инвазию.
Антитела класса D
Антитела класса D являются рецепторами В- лимфоцитов, в связи с чем продолжительность их существования определяется продолжительностью жизни иммунной клетки. В свободной, циркулирующей форме не существуют.
Как анализ на антитела помогает определить причину болезни
Анализ на антитела играет огромное, а в некоторых случаях даже решающее значение в постановке диагноза заболевания, так как он отражает протекающие в гуморальном звене иммунитета процессы.
Определение количества и подкласса антител позволяет судить о длительности и природе заболевания, а в некоторых случаях возможно определение конкретного возбудителя, вызвавшего болезнь, поэтому широко применяется в специализированных учреждениях при постановке таких диагнозов, как вирусный гепатит, ВИЧ и других.
Норма антител
В норме антитела можно обнаружить в кровотоке, на слизистых и, особенно, в лимфоидных органах, где в основном и происходит активация иммунного ответа. Это обусловлено постоянным контактом организма со внешней средой, состоящей из чужеродных агентов.
Для определения антител проводится ряд тестов, оценивающих количественные и качественные характеристики гуморального компонента иммунной системы. Также рекомендуется оценивать изменение их уровня в динамике.
Норма антител в сыворотке крови составляет:
- У мужчин: IgM (0,55-1,41 г/л); IgG (6,64-14,0 г/л); IgA (1,03-4,04 г/л);
- У женщин: IgM (0,37-1,95 г/л); IgG (5,87-16,3 г/л); IgA (0,54-3,43 г/л).
Повышены антитела одного или нескольких подклассов
Степень повышения антител может быть выражена в разной степени. Для правильной интерпретации результата на антитела важно оценивать изменение их уровня в динамике.
Если не произошло активации В-лимфоцита из-за отсутствия контакта с подходящим ему чужеродным антигеном, то последующей его трансформации в плазматическую клетку, являющуюся фабрикой про производству иммуноглобулинов, не происходит, и такие клетки ждут своего часа. Если же В-лимфоцит проконтактировал с чужеродным агентом, то большую роль играет место встречи и тип чужеродного агента, вызвавшего иммунную реакцию.
Возможно три варианта развития событий:
- В-лимфоциты в фолликулах селезенки после встречи с белковым антигеном и Т-хелпером активируются с последующим активным делением и дифференцировкой на длительно живущие плазматические клетки, синтезирующие Ig G, IgA и IgE;
- Краевые В-лимфоциты в селезенке после контакта с антигенами, являющимися общими чужеродными структурами для большинства инородных агентов, активируются с последующим активным делением и дифференцировкой на короткоживущие плазматические клетки, синтезирующие IgM;
- В-лимфоциты слизистых оболочек или брюшной полости после контакта с чужеродными агентами также активируются с последующим активным делением и дифференцировкой на короткоживущие плазматические клетки, синтезирующие IgM.
Таким образом, после проведения анализа крови на антитела и определения спектра и уровня антител, можно судить о происходящих в организме процессах.
Повышены антитела могут быть также при заболеваниях, сопровождающихся нарушениями в системе иммунитета. К ним относятся парапротеинемии, проявляющиеся наличием антител с функциональными и структурными дефектами при миеломной и ряде других болезней.
Для чего следует проводить определение антител
Анализ крови на антитела может существенно помочь в диагностике заболеваний, что имеет большое значение для выяснения природы заболевания и выбора наиболее верной тактики лечения. Также определение антител позволяет оценивать состояние искусственного активного иммунитета, полученного путем вакцинации и, таким образом, контролировать уровень заболеваемости и потребность в вакцинации.
Однако, к сожалению, антитела, призванные защищать организм человека, могут в результате различных нарушений атаковать нормальные ткани организма.
Основные причины этого явления:
- Высокая степень антигенной схожести чужеродных агентов с собственными тканями организма может приводить к тому, что вновь образованные антитела атакуют не только инородные структуры, но и свои собственные;
- Некоторые ткани организма, такие как хрусталик глаза и сперматозоиды в здоровом организме напрямую не омываются кровью, что защищает их от ошибочного распознавания организмом как чужеродных;
- В процессе созревания лейкоциты проходят несколько этапов отбора в лимфоидных органах, что позволяет выбраковывать дефектные клетки. Сбой этого сложного процесса приводит к образованию дефектных антител.
Положительные антитела
Положительные антитела, как правило, говорят о том, что пациент ранее встречался с чужеродным агентом, но это не всегда является результатом полноценного инфекционного процесса. Это стало возможным благодаря широкому введению вакцинации. Так, в качестве вакцины возможно применение живых, но ослабленнных организмов, или мертвых частиц, представленных продуктами их жизнедеятельности. Для борьбы с инфекциями, тяжесть которых зависит от выработки токсина, нашли применение вакцинации анатоксинами – токсинами, потерявшими свои опасные свойства в результате химической или физической обработки.
Тем не менее, положительные антитела с высокой уверенностью позволяют подтвердить или, напротив, исключить предполагаемого возбудителя заболевания.
Если результат на антитела положительный, это также можно использовать для контроля напряженности иммунитета с определением показаний к вакцинации или ревакцинации, проведение которых позволяет смягчать тяжесть заболеваний и предотвращать эпидемические вспышки.
Также положительные антитела могут определяться после переливания иммунной плазмы крови или прямого введения в кровоток уже готовых взятых у человека или животных иммуноглобулинов, что иначе называется искусственной пассивной профилактикой. Ее целью является предотвращение развития инфекционного процесса и заключается в быстром образовании иммунных комплексов с последующим развитием реакций, обусловленных биологическим эффектом антител.
Отрицательный результат на антитела
Отрицательный результат на антитела может наблюдаться в следующих ситуациях:
- ошибка в определении предполагаемого возбудителя, что говорит об отсутствии его роли в возникновении болезни;
- слишком раннее проведение диагностического теста;
- низкая чувствительность теста или его брак, что оправдывает возможность повторного проведения в ряде случаев диагностического теста.
Тем не менее, отрицательный результат на антитела не является абсолютным доказательством отсутствия заболевания. Примером может служить вирус иммунодефицита человека, антитела к которому определяются со значительной задержкой. Поэтому проведение полноценного физического и лабораторного обследования, а также оценка наличия антител являются частью единого комплекса мероприятий.
Антиспермальные антитела
Антиспермальные антитела взаимодействуют с антигенами на поверхности сперматозоидов. Впервые они были определены в крови мужчин, страдающих бесплодием, и описаны Rumke и Wilson в 1954 г. Эти антитела определяются у каждого пятого мужчины с бесплодием и представлены, как правило, IgG, реже IgA и IgM. Антиспермальные антитела в норме также можно обнаружить у мужчин без нарушений репродуктивной функции в 1-10% и у 5% бесплодных женщин.
Аутоиммунные антитела не возникают в норме благодаря гематотестикулярному барьеру, изолирующему клетки, принимающие участие в сперматогенезе. В основе этого барьера находятся клетки Сертоли и их отростки. В семявыносящих путях защита от образования антител осуществляется способностью сперматозоидов освобождаться от антигенов и антител на внешней оболочке, а также специальными иммуносупрессирующими факторами, находящимися в семенной жидкости.
При сбое защитных механизмов, травмах мошонки и воспалительных заболеваниях репродуктивной системы повышается вероятность образования антиспермальных антител.
Образование антиспермальных антител возможно и у женщин. В норме этого обычно не наблюдается, однако принято считать, что сопутствующие заболевания репродуктивной системы повышают риск развития этого явления.
На современном этапе не существует однозначного мнения о влиянии антиспермальных антител на репродуктивные свойства сперматозоидов, хотя и считается, что они несколько снижают их подвижность и выживаемость.
Антитела к тиреопероксидазе
В норме антитела к тиреопероксидазе (ТПО) не наблюдаются и, по факту, являются проявлением аутоиммунных процессов, направленных против щитовидной железы. У человека этот фермент отвечает за образование радикалов йода, необходимых для формирования Т3 и Т4, поэтому антитела к ТПО часто снижают синтез этих гормонов.
Антитела к тиреопероксидазе характерны для:
- тиреоидита Хашимото;
- диффузного токсического зоба;
- послеродового тиреоидита;
- аутоиммунного тиреоидита;
- гипертиреоза или гипотиреоза у новорожденных.
Показанием к определению антител к тпо является также подозрение на повреждение щитовидной железы аутоиммунной природы, что может проявляться:
- увеличением щитовидной железы без изменения ее функции;
- изменением функции щитовидной железы.
Антитела к ТПО могут приводить к нарушению регулирования синтеза гормонов, что клинически будет проявляться картиной гипотиреоза или гипертиреоза.
Уменьшение антител к тиреопероксидазе позволяет судить об успешности лечения.
Анализ на антитела к ТПО при получении результатов, вызывающих сомнение, рекомендуется проводить в сочетании с другими анализами повышающими точность проводимого исследования. К ним относят определение:
- антител к рецептору ТТГ (анти-pTTГ);
- антител к тиреоглобулину (антиТГ);
- кальцитонина в сыворотке крови;
- тиреоглобулина;
- тиреотропного гормона (ТТГ);
- тироксина свободного (Т4 свободный);
- тироксина общего (Т4);
- трийодтиронина общего (Т3);
- трийодтиронина свободного (Т3 свободный).
Антитела к ТПО и беременность
Определение антител к тпо у матери во время беременности позволяет предположить развитие гипертиреоза у ребенка как в течение внутриутробного развития, так и после рождения.
Показанием к определению антител к тпо могут быть такие патологические явления, как выкидыш, преэклампсия, преждевременные роды и неудачные попытки искусственного оплодотворения.
Также рекомендуется определение антител к тиреопероксидазе у новорожденного при их наличии у матери во время беременности или послеродового тиреоидита. Выявление отклонений позволяет предотвратить их прогрессирование путем своевременного начала лечения.
Антитела к гепатиту с,в,д,а,е
Определение антител к гепатитам С, В, D, А, Е играет большое значение в выявлении и дифференциальной диагностике этих, большей частью, небезобидных заболеваний. Так, из всех этих заболеваний только гепатит А протекает в большинстве случаев безвредно, в то время как остальные вирусные гепатиты могут приводить к тяжелым, необратимым последствиям.
Как правило, основным проявлением этих заболеваний является повышение печеночных ферментов и выраженная интоксикация. Однако понять, какой именно из вирусов поразил печень, может позволить только анализ на антитела к гепатитам С, В, D, А или Е.
Антитела к вирусу гепатита А класса Ig M определяются одновременно с манифестацией болезни, после чего их титр нарастает на протяжении месяца, снижаясь до нормальных значений в течениемесяцев.
При гепатите В диагностическое значение имеет определение антител к HBs-антигену. Их наличие может быть обусловлено как перенесенным инфекционным заболеванием, так и эффективной вакцинацией.
Анти-HBs-антитела появляются на 4-12-й неделе после инфицирования и образуют комплексы с HBsAg, в связи чем они могут не определяться, что называется «серологическим пробелом», продолжительностью от недели до месяца. Титры антител достигают максимума к 6-12 месяцам, и сохраняют высокий уровень 5 лет и больше. Иногда антитела могут определяться в течение всей жизни. Также имеет диагностическое значение анализ на антитела HBsAg, anti-HBc IgM, anti-HBc, HBeAg и anti-HBe.
Гепатит В в 90% случаев заканчивается выздоровлением, однако в 10% случаев его течение приобретает хронический, прогрессирующий характер поражения печени, что заканчивается чаще всего циррозом.
В ряде случаев к вирусу гепатита В присоединяется вирус гепатита D, не способный существовать самостоятельно. В этом случае определяется anti-HD IgM.
Антитела к гепатиту С у большинства инфицированных определяются спустя 1-3 месяца после заражения, но также возможно их отсутствие больше года. Антитела могут не определяться в 5% случаев.
Антитела к гепатиту С классов IgM и IgG возникают в начале болезни и образуются к нуклеокапсиду. При длительном, латентном течении или повторной активации заболевания отмечается появление IgG в крови.
Антитела G класса в течение 8-10 лет после манифестации болезни определяются в высоких титрах, после чего их концентрация постепенно снижается. Тем не менее, анализ на антитела к гепатиту С остается положительным до конца жизни.В отличие от гепатита В, гепатит С более предрасположен к хроническому течению, что наблюдается в 90% случаев заболевания. Исходы те же, что и при гепатите В.
Проведение анализа на антитела к вирусу гепатита Е особенно важно для диагностики заболевания во втором периоде беременности, так как оно в 40% случаев заканчивается смертью матери, и почти всегда – плода.
Антитела к вирусу иммунодефицита
Вирус иммунодефицита человека является одной из самых болезненных проблем современного общества. В настоящее время, распространение ВИЧ носит характер пандемии, число случаев смерти от СПИДа превысило 20 млн. человек, а число инфицированных ВИЧ – 50 млн.
Основными путями передачи вируса являются половой (во время незащищенного полового акта) и парентеральный (характерен для внутривенных инъекций инфицированными шприцами или иглами). Однако, на сегодняшний день огромной проблемой стало распространение вируса при таких обыденных действиях, как лечение зубов у стоматолога, процедурах маникюра, педикюра и пирсинга. Также в особой зоне риска находятся врачи, в особенности – хирурги, анестезиологи и акушеры-гинекологи.
Особенностью ВИЧ-инфекции является отсутствие специфических клинических симптомов, в результате чего манифестация носит характер простуды или мононуклеозоподобного синдрома. Поэтому решающее значение в постановке диагноза имеет определение антител к вирусу иммунодефицита.
Для диагностики ВИЧ применяются скрининговый и подтверждающий тесты. Потребность в таком разделении методов диагностики обусловлено большей стоимостью и потребностью в наличии специализированного оборудования для проведения подтверждающего теста, что затруднило бы массовое проведение анализа на антитела к вирусу иммунодефицита.
Алгоритм диагностики ВИЧ:
- Проведение скринингового теста;
- При положительном результате первого, проводится второй скрининговый тест;
- При положительном втором скрининговом анализе показано проведение подтверждающего теста;
- Положительный подтверждающий тест позволяет поставить диагноз ВИЧ инфекции.
Как правило, в качестве скрининга используется метод ИФА.
В качестве подтверждающего теста во всем мире признан метод иммунного блоттинга.
Проведение ПЦР, даже при выявлении антигенов возбудителя, не является основанием для постановки диагноза вируса иммунодефицита человека.
Согласно требованиям ВОЗ, анализ на иммунный блот принято считать положительным при обнаружении антител ко всем, или к двум из трех гликопротеинам ВИЧ (gp160, gp 120, gp 41). Таким образом, при наличии антител только к одному гликопротеину, результат считают сомнительным и показано проведение повторного исследования с использованием тест-системы другого производителя или серии. При получении очередного сомнительного результата рекомендовано проведение наблюдения в течение последующих 6 месяцев, с повторным проведением анализа через 90 дней.
Через какое время можно учитывать анализ крови на антитела в оценке картины болезни
Однако определение антител ранее определенного момента не имеет смысла в связи с особенностями функционирования иммунной системы. Эффективность анализа крови на антитела в большей степени зависит от того, в какой раз человек встречается с чужеродным агентом. Так, если человек встречается с возбудителем болезни повторно, гуморальный ответ не только развивается быстрее, но обладает большей эффективностью, что обусловлено большей степенью соответствия эпитопов антигенам.
Для первой встречи с чужеродным агентом наблюдается преимущественное повышение антител класса М, достигающее пика и, соответственно, наибольшей эффективности через 5-10 дней. Антитела G класса появляются еще позже.
Для повторной встречи с чужеродным агентом характерно более быстрое формирование иммунного ответа в течение 1-3 дней, которое характеризуется более эффективным приростом количества антител. Антитела G класса играют основную роль в развитии иммунной защиты. Кроме того, при определенной стимуляции, возникает дифференцировка плазматических клеток с производством антител класса А или Е.
Таким образом, брать анализ крови на антитела ранее, чем через 5 дней после инфицирования в большом количестве случаев не имеет смысла, что обусловлено слишком коротким сроком для активации иммунного ответа, хотя при повторной встрече с возбудителем, анализ определит положительные антитела уже на 1-2 сутки после инфицирования. Однако, в связи с тем, что у большинства заболеваний инкубационный период длится более суток, точно определить идеальный момент для определения антител практически невозможно, из-за чего рекомендуется оценка их уровня в начале и конце заболевания.
Виды анализов на наличие антител в крови
Методом, позволяющим определить количественные характеристики антител каждого типа в организме, является электрофорез. Его действие основано на разнице в поведении белков на после их помещения в электрическое поле. Этот метод позволяет определить, повышены антитела или нет, но не дает возможности выяснить, против какого чужеродного агента они образованы и, таким образом, показывает лишь общую картину.
Серологические реакции позволяют определить отсутствие или наличие антител, обладающих специфичностью в отношении искомого антигена в биологических жидкостях.
К ним относят реакции:
- Агглютинации;
- Преципитации;
- Нейтрализации;
- С участием комплемента;
- С мечеными антителами или антигенами.
Агглютинацией называют связывание антигенов, связанных с крупными нерастворимыми частицами, такими как бактерии или эритроциты, при взаимодействии с антителами.
Агглютинация бывает следующих видов:
- прямая агглютинация (позволяет выявить антитела в сыворотке больного и проводится путем смешивания взвеси убитых микробов с кровью, что приводит к появлению хлопьевидного осадка);
- непрямая гемагглютинация (позволяет выявить антитела в изучаемом материале и проводится путем смешивания эритроцитов, на которых находятся фиксированные антигены, что приводит к появлению фестончатого осадка);
- реакция торможения гемагглютинации (в результате связывания антител с рецепторами вирусов, обладающих гемаглютинирующей способностью, склеивания эритроцитов животных, не происходит);
- реакция коагглютинации (антигены возбудителя определяются добавлением специально обработанных диагностической сывороткой стафилококков).
При реакции преципитации наблюдается выпадение в осадок комплексов антиген-антитело, где антигены должны быть растворимыми (не связанными с крупными, нерастворимыми частицами). После образования комплексов антиген-антитело выпадает осадок, называемый преципитатом. Положительным считается результат на антитела, при котором можно увидеть кольцо преципитата.
Реакцией нейтрализации называется блокирование повреждающего действия микробов или их токсинов после взаимодействия с иммунной сывороткой, что обусловлено их связыванием с антителами с образованием комплексов антиген-антитело.
Комплементом называют сложную систему врожденного гуморального ответа, которая после активации получает способность к опсонизации, облегчению фагоцитоза и цитолизу чужеродных агентов. При проведении реакции с участием комплемента используется его способность к взаимодействию с иммунными комплексами. Поэтому сначала смешивается интересуемая сыворотки с известными антигенами. Затем, если образовались комплексы антиген-антитело, белки комплемента исчерпываются. Если же образования комплексов не произошло, то система комплемента остается способной к активации. Для того, чтобы это выяснить, добавляются эритроциты и антиэритроцитарные антитела, которые связываются с образованием иммунных комплексов, после чего наблюдается гемолиз эритроцитов, обусловленный действием комплемента, или наблюдается хлопьевидный осадок, если активации не произошло.
Реакция с мечеными антителами или антигенами, или реакция иммунофлюоресценции основана на обработке изучаемого материала сывороткой, содержащей антигены или антитела, помеченные флюорохромами, что в случае образования иммунных комплексов дает возможность наблюдать свечение при освещении ультрафиолетовой лампой при изучении через микроскоп.
При применении не флюорохромов, а ферментов (пероксидазы или щелочной фосфатазы), метод называют иммуноферментным анализом. Результат оценивается по изменению окраски.
Радиоиммунологический метод позволяет определить наличие антител или антигенов, помеченных радионуклидами и их количество после взаимодействия с изучаемым материалом (антигенами или антителами в сыворотке пациента).
Моноклональные антитела и их применение
Одна клетка В-лимфоцитов способна производить антитела, комплементарные исключительно к одному антигену. Это было использовано для получения моноклональных антител, которые по праву можно считать одним из самых важных технических достижений в области иммунологии, с колоссальными перспективами для клинической медицины и научных исследований. Для того, чтобы получить моноклональные антитела, В-клетки от животного, иммунизированного антигеном, которые имеют короткий срок жизни, скрещивают с клетками миеломы (опухоли плазматических клеток), которые могут быть размножены бесконечное количество раз при обеспечении необходимых условий. Клетки, полученные путем такого слияния, называют гибридомами. Из популяции полученных гибридом можно выбрать и клонировать непрерывно растущие клетки, которые секретируют нужные антитела, которые называют моноклональными.
Огромное количество вариантов синтезируемых антител позволяет подобрать практически любые моноклональные антитела против практически любого антигена. Однако на пути широкого применения этого метода имелись определенные препятствия. Так как вещества, синтезируемые в чужом организме, чужеродны и вызывают иммунный ответ, повторное введение тех же препаратов не вызывало преследуемого эффекта. Впоследствии эта проблема была решена сохранением вариабельных областей, отвечающих за их соответствие антигенам, с заменой константных участков на человеческие.
Совсем недавно моноклональные антитела были синтезированы с использованием технологии рекомбинантной ДНК, кодирующей антитела человека. Это позволило выбирать антитела, имеющих желаемые Fab-фрагменты.
Моноклональные антитела широко применяются в качестве терапевтических и диагностических средств в борьбе со многими заболеваниями людей.
Источник: http://medaboutme.ru/zdorove/spravochnik/slovar-medicinskih-terminov/antitela/
ПОИСК
Марганец является одним из важнейших биогенных элементов. Принадлежит к числу микроэлементов. Его присутствие в разных количествах установлено во всех растительных и животных организмах, прежде всего в составе многих металлоферментов, в тканях, в крови. С наличием марганца в растениях и животных связаны многие биохимические функции фотосинтез, окислительновосстановительные процессы, синтез хлорофилла, витаминов. Он оказывает существенное влияние на кроветворение, минеральный обмен, способствует выработке антител, повышающих сопротивляемость организма различным заболеваниям. [c.490] Существуют два основных типа иммунных ответов. Гуморальный ответ состоит в выработке антител, которые циркулируют в крови и специфически [c.6]Известно иммуностимулирующее действие хитина и хитозана. В частности установлено, что при степени деацетилирования хитина 0,7 он проявляет длительную способность к активации макрофагов. Кроме того, у хитозана обнаружена способность к ингибированию роста опухолей. Иммуностимулирующие средства на основе хитина и хитозана повышают выработку антител организма [116]. Алкил-Ы-ацетил-глюкозамин обладает свойством способствовать росту бифидобактерий, присутствие которых в кишечнике подавляет рост гнилостных и [c.392]
Далее возникает следующий вопрос может ли небольшой участок белковой молекулы (домен) служить эффективной субъединичной вакциной и индуцировать выработку антител Интуитивно кажется, что те домены, которые доступны [c.231]
При введении в кровь человека чужеродных клеток или биополимеров (антигенов) происходит выработка антител, способных специфически связываться с введенными антигенами. При повторном введении антигена могут наблюдаться две различных реакции 1. Антиген взаимодействует с антителом и быстро удаляется из тока крови, в результате чего наблюдается невосприимчивость, например, к заражению бактериями данного вида (иммунитет). 2. Взаимодействие антитела с антигеном сопровождается выделением веществ, возбуждающих нервные окончания, в результате чего происходит резкое повышение чувствительности организма к данному антигену (анафилаксия). В некоторых случаях анафилаксия может приводить к смерти. Подробнее о явлениях иммунитета и анафилаксии см. . [c.604]
Генно-инженерные вакцины. Вакцинация человека и животных основана на выработке антител в ответ на введение антигена — ослабленного или инактивированного вируса. Применение живых вакцин чревато заражением, а инактивация вирусов может резко снизить их иммуногенность. Антигенные свойства вирусных частиц определяются в основном их белковыми компонентами, поэтому вьщеление индивидуального вирусного белка дает возможность получения вакцины, лишенной указанных выше недостатков. [c.504]
Термостабильный токсин не вызывает выработки антител, его не обнаруживают в серологических тестах. [c.366]
Общее число лимфоцитов в организме очень велико (у человека 2-10 ) по клеточной массе иммунная система сравнима с печенью или мозгом. Хотя лимфоциты уже давно признаны одним из клеточных компонентов крови, их центральная роль в иммунитете была продемонстрирована лишь в конце 50-х годов. В решающих экспериментах крыс подвергали сильному облучению, приводившему к гибели большинства лейкоцитов, в том числе лимфоцитов. Облученным крысам, неспособным к иммунному ответу, можно было вводить клетки различных типов, чтобы выяснить, какие из них восстанавливают иммунную реактивность. Таким свойством обладали только лимфоциты (рис. 17-2). Поскольку восстанавливались как клеточные формы иммунного ответа, так и выработка антител, полученные результаты доказывали, что лимфоциты ответственны за оба класса иммунных ответов. [c.8]
Единственная известная функция В-лимфоцит в-выработка антител. Уникальная особенность антител, отличающая их от всех других известных белков, состоит в том, что они могут существовать в миллионах разновидностей-каждая со своим уникальным участком для связывания антигена. В совокупности называемые иммуноглобулинами (сокращенно ) антитела образуют один из основных классов белков крови, составляя по весу примерно 20% суммарного белка плазмы. [c.19]
Переключение синтеза с мембраносвязанной формы антител на секретируемую форму-не единственный вид изменений, которые могут происходить в С-области тяжелой цепи в ходе развития В-клеток. Все В-клетки начинают свою деятельность по синтезу антител с выработки IgM, но многие из них затем переключаются на выработку антител других классов, например IgG или IgA. Этот процесс называют переключением класса. Способность В-клеток изменять вырабатываемый ими класс антител без изменения антиген-связываю-щего участка означает, что один и тот же собранный Уц-ген может последовательно ассоциироваться с разными Сн-генами. [c.43]
Для создания любой субъединичной вакцины прежде всего нужно идентифицировать те компоненты патогенного микроорганизма, которые индуцируют выработку антител. В случае HSV типа 1 (HSV-1) таким компонентом является гликопротеин D оболочки (gD). В ответ на введение этого гликопротеина мышам у них вырабатываются антитела, нейтрализующие интактный HSV. Ген gD HSV-I был изолирован, клонирован в одном из экспрессирующих векторов в клетках млекопитающих и введен в яйцеклетки китайского хомячка (СНО), в которых в отличие от Е. соН происходит гликолизирова-ние чужеродных белков. Полноразмерный ген gD кодирует белок, в норме связывающийся с мембраной клетки млекопитающего (рис. 11.2, А). Такой белок труднее очистить, чем раствори- [c.230]
Итак, в организме заранее имеются лимфоциты, способные узнать практически любой белок, даже тот, который ни разу до того не попадал в этот организм. Но если, скажем, вирус впервые проник в организм, то, хотя и найдется лимфоцит, на поверхности которого будет образец иммуноглобулина, способного связаться с белком оболочки вируса, и он включится на выработку антител, чтобы наработать достаточное количество свободных антител, требуется время. Поэтому, прежде чем сработает иммунная система, вирус успеет наделать много бед, а то и вообще погубить организм. Другое дело, если вирус уже до этого, скажем, в неинфекционной форме, побывал когда-то в этой [c.82]
Основной вопрос, на который очень долго не удавалось получить ответ, состоит в следующем. Что обеспечивает реакцию организма на самые разные антигены Ведь каждый организм готов к выработке антител в ответ практически на любой чужеродный белок, В то же время иммуноглобулины очень специфичны — одна молекула, как правило, узнает только вполне определенный белок и теряет способность узнавать, если в молекулу белка внести минимальные изменения. Чтобы обеспечить одновременно и огромную специфичность и разнообразие иммунных реакций, организм держит наготове массу лимфоцитов, способных вырабатывать различные антитела. Их в каждом организме великое разнообразие — многие миллионы. [c.83]
Другой способ защиты — это выработка антител. Назовем постороннее вещество или даже сложную частицу, например вирус, попавший в организм (в кровь или лимфу), антигеном. [c.184]
До сих пор мы говорили о том, что организм порой относится к собственным веществам как к чужим и борется с ними посредством аутоантител. Теперь следует упомянуть о противоположном явлении, о так называемом иммунологическом параличе. Оказывается, в некоторых случаях проникновение в организм очень больших количеств антигена задерживает выработку антител именно против этого антигена. Правда, пока еще неизвестно, как и почему это происходит. Однако существование таких полярных явлений, как иммунологический паралич, с одной стороны, и образование аутоантител — с другой, свидетельствует о том, что не всегда можно провести четкую границу между своим и не своим . [c.356]
Как только плод начинает утрачивать иммунологическую толерантность, снимается блокада с выработки антител и приводится в действие собственный индивидуальный иммунологический аппарат. С появлением первых антител материнский организм начинает воспринимать плод как нечто чуждое и выталкивает его прочь. (К этому времени и иммунологический барьер становится более проницаемым, что как раз и проявляется в утечке ВЬ-фактора.) [c.357]
ТОКСЙНЫ, токсичные в-ва рряр. происхождения. Обычно к Т. относят высокомол. соединения (белки, полш1ептиды и др.), при попадании к-рых в организм происходит выработка антител. Иногда Т. наз. также низкомол. в-ва (напр., тетродотоксин и др. яды животных), к-рые более правильно относить к прир. ядам. [c.601]
Как и при иммуногистологических методах можно обходиться без мечения специфичных к белку антител, обычно вырабатываемых в организме кролика, используя вместо этого имеющиеся в продаже меченые специфические антитела против иммуноглобулинов кролика. Однако это усложняет процедуру исследования. Для описанного варианта метода необходимо, чтобы сорбированные антитела, специфичные к белку, индуцировались У иного животного, чем кролик, — это означает дополнительную выработку антител против белка, например, у козы (этап /). [c.107]
Защита организма от чужеродных биоиолимеров и, тем самым,, от инфекционных микроорганизмов осуществляется посредством клеточного и гуморального иммунитета (см. 17.9). Во втором случае иммунитет определяется взаимодействием антител (АТ) — особых белков, производимых лимфатическими клетками,— с чужеродными биополимерами, именуемыми в зтом случае антигенами (АГ). Иммунный ответ, т. е. появление антител в организме, есть результат узнавания антигенов определенными популяциями лимфоцитов. Процесс развивается на уровне организма, в нем участвуют различные клеточные узнающие системы, являющиеся обучающимися , так как они приобретают память об однажды введенном антигене и отвечают на его вторичное введение усиленной выработкой антител. [c.122]
Скорость выработки антител пропорциональна наличному количеству плазматических клеток, которое определяется числом В-лимфоцитов, АГ-стимулированных ранее, в момент времени, отстоящий от текущего на время запаздывания и. Аналогично, выработка клеток памяти определяется числом актов стимуляции Влимфоцитов в момент, отстоящий от текущего аа время запаздывания i ,. [c.580]
Антиген (Antigen) Вещество, воспринимаемое организмом как чужеродное и вызывающее специфический иммунный ответ — выработку антител. [c.543]
Первые успехи в изучении строения иммуноглобулинов были связаны с изучением иммуноглобулинов, полученных от больных миеломой (см. 1.4). Как уже говорилось, у таких больных в результате присутствия одного злокачественно разросшегося клона В-лимфоцитов вырабатывается огромное количество индивидуального иммуноглобулина, который сравнительно леп о отделить от всех остальных. Дальнейшие успехи в получении индивидуальных антител связаны с достижениями клеточной биологии, позволившими осуществлять слияние клеток миеломы как носителей способности к неограниченному размножению с нормальными В-лимфоцитами как носителями программы для выработки антител определенной, задаваемой экспериментатором специфичности. Получающиеся клетки, гибридоми сохраняют способность к неограниченному размножению и вырабатывают индивидуальные антитела. Так как в этом случае гибридомы происходят от одной исходной слитной клетки, то они представляют собой единый клон получающиеся из них антитела называют поэтому моноклональными антителами. [c.39]
Антигенпрезентирующие клетки передают фрагмент антигена Тх-клеткам. Последние прямо или посредством специальных секретируемых белков-цитокинов воздействуют на другие типы Т-клеток, а также способствуют В-клеткам в выработке антител. Активированные ци-токинами Тх-клеток макрофаги, в свою очередь, способны продуцировать цитокины, имеющие существенное значение в формировании эффективного иммунного ответа. [c.479]
Аминогликозиды вызывают поражения кохлеарного и вестибулярного аппаратов, развитие нейромышечной блокады стрептомицин, амфотерицин В и циклосерин — полиневриты пенициллин, стрептомицин, левомицетин — поражения ЦНС (судорожный синдром, галлюцинации). Поражения почек имеют место при воздействии амфотерицина В, цефалоридина, аминогликозидов. Ге-патотоксические явления характерны для тетрациклинов, рифампицина, эритромицина. Токсическое действие на ЖКТ, обусловленное раздражением слизистых оболочек и проявляющееся в виде тошноты, рвоты, болей в области живота, поносе, свойственно тетрациклинам, эритромицину, амфотерицину В. Тяжелые поражения костного мозга (гипопластическая анемия) могут возникать при длительном воздействии левомицетина в больших дозах. Некоторые А. вызывают понижение свертываемости крови, что приводит к кровотечениям. Наиболее часто кровотечения отмечены при применении цефокситина и мокса-лактама. Общим свойством, присущим большинству А., является их способность вызывать аллергические реакции. Поступив в организм, А. связываются белками, образуя полноценные антигены и стимулируя выработку антител. Наиболее выражено аллергическое действие у пенициллинов, стрептомицина и ванкомицина. Другие А. вызьшают эти реакции значительно реже. Возникновение аллергических реакций и их выраженность определяются свойствами А., путем его поступления в организм и индивидуальной чувствительностью человека. Сенсибилизация к А. наблюдается не только у лиц, имевших длительный профессиональный контакт с этими веществами, но приблизительно у 10 % больных, применявших А. Повышенная чувствительность к А. зарегистрирована и у людей, употреблявших продукты питания (мясо, молоко, яйца и др.), источником которых являются животные или птицы, получавшие с кормом антибиотики. Положительные кожные пробы на пенициллин выявлены у 2,2- [c.746]
Кровь содержит много типов клеток, вьшолняющих совершенно различные функции-от транспорта кислорода до выработки антител. Однако жю-ненный цикл всех клеток крови до некоторой степени сходен. Часть своей жизни все они проводят, находясь в других тканях, а часть-свободно циркулируя в кровотоке У всех клеток крови время существования ограничено, и они непрерывно образуются в течение всей жизни животного. И наконец, что весьма примечательно, все они восходят к одному и тому же тнпу стволовых клеток. Эта гемопоэтическая, или кроветворная, стволовая клетка является, таким образом, плюрипотентной, т. е. дает начало всему разнообразию типов терминально дифференцированных клеток крови. [c.160]
В 60-х годах было установлено, что два основных класса иммунных реакций опосредуются двумя различными классами лимфоцитов Т-клетки, развивающиеся в тимусе, ответственны за клеточный иммунитет В-клеткя, которые развиваются независимо от тимуса, вырабатывают антитела. Поэтому удаление тимуса у новорожденного животного сильно ослабляет у него клеточные иммунные реакции, но гораздо меньше сказывается на продукции антител. У птиц можно продемонстрировать обратный эффект поскольку В-лимфо-цнты развиваются у них в фабрициевой сумке (свойственный только птицам лимфоидный орган, связанный с кишечником удаление у цыплят фабрициевой сумки нарушает выработку антител, но мало влияет на клеточный иммунитет. Аналогичные различия обнаруживаются у детей, родившихся с нару- [c.8]
При исследовании животных с дефшщтом Т-клеток (следствие раннего удаления или повреждения тимуса) было обнаружено загадочное явление у этих животных ие только отсутствовали клеточные иммунные реакщ1и, но была также несколько понижена способность к выработке антител. Как мы увидим позже, это обусловлено тем, что некоторые из Т-клеток играют важную роль в регулящ1и иммунитета и функционируют как помощники В-кле-ток в процессе гуморального ответа. [c.9]
Эти два эксперимента показывают, что 1) лимфоциты коммитнруются к реакции на определенный антиген еще до того, как они подвергнутся воздействию этого антигена 2) лимфоциты обладают поверхностными рецепторами, специфически связывающими тот нли иной антиген. Таким образом, подтверждаются два основных предсказания теории клональной селекции Хотя в большинстве экспериментов такого рода изучались В-клетки н ответы, связанные с выработкой антител, сходные эксперименты с Т-клетками позволяют предполагать, что гипотеза клональной селекции справедлива н в отно-шеинн ответа с участием Т-лимфоцитов. [c.14]
Большинство антигенов имеют на своей поверхности целый набор различных антигенных детерминант, которые стимулируют выработку антител нли Т-клеточные ответы. Некоторые детерминанты более иммуногенны (т.е. лучше индуцируют иммунитет), чем другие, н реакция на них может доминировать в общем ответе такие детерминанты называют иммунодомииантны-ми. [c.14]
Можно стимулировать выработку антител В-клетками в культуральной чапше [13] [c.20]
Первые прямые данные о перестройке ДНК в процессе развития В-клеток были получены в 1976 г. в экспериментах, в которых ДНК из ранних мышиных эмбрионов, неспособных к выработке антител, сравнивали с ДНК из клеток мышиной миеломы, вырабатывающих антитела. Эти два вида ДНК переваривали рестрикционной нуклеазой и полученные фрагменты гибридизо-вали с радиоактивными последовательностями ДНК, приготовленными путем копирования in vitro V- или С-последовательности молекул информационной РНК для L-цепей, выделенной из клеток миеломы (см. разд. 4.5.3). Как показали результаты этих опытов, специфические V- и С-кодирующие последовательности находились у эмбрионов в разных рестрикционных фрагментах ДНК, а в клетках миеломы-в одном и том же рестрикционном фрагменте (рис. 17-39). Таким образом, у зародыша, где гены иммуноглобулинов не экспрессируются, последовательности ДНК, кодирующие V- и С-области той или иной цепи, локализуются в различных участках генома между тем в клетке миеломы, где уже образуются цепи иммуноглобулинов, эти две последовательности соединены вместе. [c.37]
Можно ожидать, что животное, иммунизированное антигеном А, будет сначала вырабатывать большие количества антител к А, затем антитела к идиотипам антител к А, а затем в свою очередь-антитела к антиидиотипи-ческим антителам и т.д. Действительно, такой тип реакций, дающих сеть антител, был продемонстрирован в условиях, когда большая часть антител, выработанных в ходе первоначального ответа на антиген, имела одииакошд идиотип. При такого рода ограниченных ответах активируются как процессы выработки антител, специфически узнающих доминантный идиотип, так и соответствующие Т-клетки и те и другие могут либо ингибировать, либо усиливать ответ лимфоцитов, имеющих рецепторы с данным идиотипом. Можно показать, что такие антиидиотипические взаимодействия играют важную роль в регуляции ограниченных ответов, однако не ясно, регулируют ли ош более обычные ответы, при которых вырабатываются антитела с множеством различных идиотипов. [c.44]
Разнообразные реакции Т-клеток в совокупности называют иммунным ответом клеточного типа. Как и образование антител, эти реакции играют у позвоночных важную роль в защите от нифекцин, особенно пря заражении определенными вирусами и грибами. Так же как и ответы, связанные с выработкой антител, они высокоспецифнчны в отношении антигена. О Т-клетках н их реакциях известно значительно меньше, чем о В-клетках,-главным образом потому, что рецепторы н продукты Т-клеток пока еще плохо охарактеризованы по сравнению с антителами. [c.51]
При тяжелых хронических отравлениях снижается сопротивляе-.мость по отношению к инфекциям (снижение выработки антител, уменьшение числа лейкоцитов и ослабление их фагоцитарной активности). У инфицированных кроликов, предварительно вдыхавших бензол, почти отсутствует лейкоцитарная реакция, зато налицо эндотелиальная (Шмидтман и соавторы). [c.88]
То, что кажется на первый взгляд нарушением принципа иммунитета (который направлен на поддержание биологической индивидуальности), в сущности в высшей степени разумный и полезный механизм. Мы отлично знаем, что зародыш обязательно содержит как материнский, так и отцовский геномы, а следовательно, и контролируемые ими материнские и отцовские белки. Если главная цель полового процесса, т. е. рекомбинация наследственных зачатков, не ставится под сомнение с самого начала, то тогда все эти вещества, сколь бы ни были они различны в иммунологическом отношении, должны сосуществовать друг с другом. Совершенно очевидно, что в эмбриональный период выработка антител с самого начала полностью блокирована (не происходит ли здесь нечто вроде предполага- [c.356]
Именно в наше время с характерной для него большой частотой несчастных случаев особенно актуальна проблема замены поврежденных органов или тканей. При этом часто возникает необходимость заместить отсутствующую кожу, пересадить новую почку и т. п. Уже давно известно, что это может удаться лишь тогда, когда трансплантат, т. е. пересаживаемый орган или лоскут кожи, взят от самого пострадавшего, иными словами, является иммунологически своим . Трансплантация удается также у однояйцовых близнецов, имеющих, естественно, одинаковую генетическую конституцию. Но уже просто у сестер и братьев опыты по трансплантации не удаются никогда. Правда, трансплантат вначале приживается довольно легко, но уже через несколько недель, часто даже дней он отторгается. В этом случае чужеродные вещества, например белки пересаженных тканей, попадают в круг кровообращения реципиента. Здесь они воспринимаются как чужие, и организм поступает с ними как с антигенами начинается выработка антител и в результате иммунологических реакций разрушаются не только сами антигены, но постепенно также и пересаженные клетки, которые производили антигены. [c.358]
выработка антител является функцией
Иммунная система, ответственная за биосинтез антител, состоит из ряда органов, основными из которых являются тимус, селезенка и периферические лимфоидные структуры в которых формируются три основных типа клеток: Т- и В-лимфоциты и макрофаги.
Антитела вырабатываются В-лимфоцитами, на поверхности которых уже имеются рецепторы, специфически связывающие антиген. В этот же комплекс включаются Т-лимфоциты и макрофаги. В результате межклеточной кооперации происходит активация В-лимфоцитов и их трансформация в плазматические клетки. Большая часть образовавшихся плазматических клеток синтезирует антитела, аналогичные по специфичности рецепторам на поверхности В-лимфоцитов, и секретирует их в кровь. Другая часть превращается в клетки «иммунологической памяти», способные выделять антитела при повторном введении антигена.
Каждый В-лимфоцит содержит на поверхности около 100 тыс. рецепторов одинаковой специфичности. Антиген, встречаясь в кровотоке с комплементарным рецептором, проводит отбор соответствующего В-лимфоцита, который затем, трансформируясь в плазматическую клетку и многократно делясь, образует клон клеток. Эта теория биосинтеза антител, впервые сформулированная П. Эрлихом, а затем модифицированная в соответствии с уровнем развития науки Ф. Бернетом, получила название клонально-селекционной. Важно отметить, что каждый клон плазматических клеток секретирует гомогенные по своей структуре антитела. Однако так как антиген активирует в крови сразу несколько типов В-лрмфоцитов, которые содержат рецепторы различной степени специфичности по отношению к исходному антигену, такой иммунный ответ называется поликлональным, а антитела — поликлональными.
Сыворотку животного, содержащую специфические к данному антигену антитела, называют антисывороткой. При этом обычно указывают, против какого антигена она выработана. Например, когда говорят об антисыворотке кролика против эритроцитов человека, подразумевают, что в ответ на введение в кровь кролика эритроцитов человека образуются специфические к ним антитела. Принципиально важным является то, что поликлональные антитела даже против одной-единственной антигенной детерминанты гетерогенны как по структуре активного центра, так и по физико-химическим свойствам. В том случае, если антиген поливалентен, например белок, то в сыворотке крови образуются антитела, направленные против каждой индивидуальной детерминанты, что еще более усложняет состав антител. Состав антител зависит от вида животного, а также стадии иммунного процесса.
Все перечисленные выше факторы влияют на гетерогенность антител и обусловливают определенные трудности как в изучении их структуры, так и в получении воспроизводимых стандартных препаратов антисывороток. Работы Келера и Мильштейна по гибридизации животных клеток открыли принципиально новый путь получения антител. Сущность метода заключается в том, что из организма иммунизированного животного выделяются лимфоциты, которые специальным образом «сливаются» с миеломными клетками. Образующиеся клетки получили название гибридом.
Особенностью таких клеток является их способность размножаться и продуцировать антитела в искусственных условиях вне организма. С помощью специальных методов клонирования можно выделить одну гибридную клетку, которая, размножаясь, будет секретировать в неограниченных количествах антитела только одного вида — моноклональные антитела. Подчеркнем, что моноклональные антитела гомогенны как по специфичности, так и по физико-химическим свойствам.
В иммунной реакции организма наряду с фагоцитами участвуют лимфоциты. По функции и месту созревания лимфоциты разделяются на Т-лимфоциты (тимусзависимые) и В-лимфоциты (бурсазависимые). Известно, что макрофаги обнаруживают антигены и в процессе фагоцитоза выводят на клеточную поверхность неразрушенную часть антигена, где он распознается Т- и В-лимфоцитами.
Различают несколько разновидностей Т-лимфоцитов. Т-киллеры (убийцы) способны убивать чужеродные клетки, например, опухолевые, клетки-мутанты, клетки чужеродных тканей трансплантантов. Т-супрессоры (угнетатели) блокируют чрезмерные реакции В-лимфоцитов, благодаря чему поддерживают гармоничное развитие иммунитета. Т-хелперы (помощники) стимулируют реакции иммунитета путём взаимодействия с В-лимфоцитами, превращая их в плазматические клетки, которые синтезируют антитела (иммуноглобулины) и выделяют их в кровь, лимфу, тканевую жидкость. Иммуноглобулины способны нейтрализовать (обезвредить) чужеродные вещества (антигены). Антитела по-разному действуют на антигены: либо склеивают их, либо разрушают, либо растворяют, то есть выводят из строя.
Основная функция В-лимфоцитов – создание гуморального иммунитета путём выработки антител. Согласно теории гуморального иммунитета, все иммунные процессы происходят в жидких средах организма (от лат.humor – жидкость).
Процесс выработки антител схематически представляется в следующем виде. Существует необозримо большое количество клонов мезенхимальных клеток, отличающихся своей способностью реагировать на антиген. Антиген отбирает из предсуществующих клонов клеток только те, с которыми он может реагировать, стимулируя их размножение. Следствием этого является увеличение количества клеток, обладающих сродством к данному антигену, образуется «клон» этих клеток, вырабатывающих специфические к данному клону антитела. Если антигенная стимуляция чрезмерна в силу избытка антигена или повышенной возбудимости клеток (во время их усиленного размножения в эмбриональном периоде), то клетка отвечает торможением своей активности. Явление иммунологической толерантности и распознавание «своего» объясняется подавлением в эмбриональном периоде клонов клеток, преадаптированных к своим и вводимым извне антигенам.
Клонально-селекционная теория хорошо соответствует большинству известных в настоящее время в иммунологии фактов. Однако и против нее выставлен целый ряд вполне обоснованных доводов. Наиболее часто подвергается сомнению возможность существования в организме клонов клеток, иммунологически компетентных по отношению ко всем антигенам, в том числе и вновь синтезированным и даже еще не синтезированным.
в организме существуют клоны клеток, в большей или меньшей степени преадаптированные к определенным антигенам. Под влиянием антигенного стимула начинается усиленная пролиферация этого клона. В ходе случайных мутаций клеток в силу продолжающегося антигенного раздражения усиленно размножаются клетки, обладающие все возрастающим родством к антигену вплоть до формулы «как ключ к замку».
Гуморальный иммунитет
Гуморальный иммунитет открыл немецкий фармаколог Пауль Эрлих, который был современником И.И.Мечникова, открывшего клеточный иммунитет. Пауль Эрлих знал о том факте, что в сыворотке крови животных, зараженных бактериями, появляются белковые вещества, способные убивать патогенные микроорганизмы. Эти вещества впоследствии были названы «антителами», а болезнетворные микробы и их токсины были названы «антигенами». Самое характерное свойство антител – это их ярко выраженная специфичность. Как отмечал Пауль Эрлих, «отношения между токсином (антигеном) и антитоксином (антигеном) носят строго специфичный характер – например, столбнячный антитоксин нейтрализует исключительно яд столбняка… противозмеиная сыворотка – только яд змеи и т.д.».
Характерными особенностями гуморального иммунитета являются:
1) иммунологическая специфичность (один антиген – одно антитело);2) при инфекциях усиленная продукция соответствующих антител;3) способность сохранять память о первой встрече с антигеном.
Именно последнее свойство специфического иммунитета лежит в основе вакцинации.
Выработка антител является функцией - Про паразитов
Многие годы безуспешно боретесь с ПАРАЗИТАМИ?
Глава Института: «Вы будете поражены, насколько просто можно избавиться от паразитов просто принимая каждый день...
Читать далее »
В нескончаемом перечне вирусных, грибковых и паразитарных заболеваний своё законное место занимает токсоплазмоз. Паразит может поражать не только взрослых, но даже детей в утробе матери.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для избавления от паразитов наши читатели успешно используют Intoxic. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию. Подробнее здесь…
Что это такое и как лечить подобный недуг, можно выяснить, изучив данную статью.
Данная паразитарная инфекция рассматривается как наиболее опасная из числа известных человеку. Основная причина этому – длительность скрытого периода болезни, сопровождаемого целым рядом патологических деформаций в сердечной, нервной и мышечной системах. Также, могут появиться значительные нарушения зрительной и пищеварительной функции.
Спустя непродолжительное время с момента заражения недуг становится хроническим, начиная серьёзно угрожать здоровью и благополучию больного, особенно если это плод, находящийся в материнском организме, или уже появившийся на свет маленький ребёнок. У детей, заразившихся ещё до рождения, явные симптомы болезни проявятся лишь спустя несколько дней или месяцев.
Токсоплазмоз у детей может проявляться по-разному в зависимости от того, на каком этапе беременности произошло инфицирование.
| Наименование периода | Симптомы |
| I и II триместр (вероятность заражения плода – 15%) | Мозговые, сердечные и зрительные патологии. Заметное интеллектуальное и физическое недоразвитие. |
| начало и середина III-го триместра (вероятность заражения плода – 70%) | Менингиты, энцефалиты, отмирание сетчатки. |
| конец III-го триместра (недуг приобретает острую форму) | Интенсивная желтуха, пневмония и малокровие. |
Кроме того, у всех инфицированных младенцев отмечаются:
- отёки ног;
- увеличение печени и селезёнки;
- желтушность;
- подъём температуры до субфебрильного уровня (37,1–38 ˚C).
Если возбудитель проник в организм контактным путём, либо через слизистую оболочку пищеварительного тракта, то болезнь будет носить острый характер, а её симптоматика проявится уже спустя 3-4 дня.
Токсоплазмоз у взрослых
У взрослого человека заболевание также может принимать хроническую, либо острую форму. С учётом этого, недуг демонстрирует различную симптоматику.
Острый токсоплазмоз у взрослых сопровождается следующими признаками:
- скорое и частое переутомление;
- воспаление слизистых оболочек глаз, либо самих глазных яблок;
- ощущение общей слабости в организме;
- нарушения в тканях головного мозга и сердечной оболочки;
- повышенная температура тела;
- воспалительные процессы в лёгочном отделе дыхательной системы;
- постоянные головные боли;
- увеличенный размер селезёнки и печени;
- увеличение лимфоузлов в области шеи;
- болезненность в мышечных и суставных тканях.
При хронической форме перечень симптомов заболевания несколько изменяется:
- отмечается незначительный рост температуры тела;
- тревога, страх без видимой причины, панические состояния;
- лимфоузлы, селезёнка и печень увеличиваются в размерах;
- проблемы с аппетитом;
- постоянные мигрени;
- нарушен режим сна/бодрствования, возможна бессонница;
- ухудшение способности к запоминанию;
- апатия.
При отсутствии соответствующего лечения, органы, поражённые болезнью, медленно разрушаются. В результате, к уже перечисленным проблемам добавляются новые обусловленные дисфункцией той или иной системы организма.
Токсоплазмоз при беременности
Особенно опасно появление данной паразитарной инфекции во время беременности, когда значительному риску подвергается не только женщина, но и ещё не рождённый малыш.
Поэтому значительным моментом при планировании беременности является прохождение обследования на предмет подобных заболеваний (анализ на антитела к токсоплазме). При выявлении первичного заражения потребуется обязательно проконсультироваться со специалистом относительно предпочтительной методики лечения.
Максимально оперативно требуется действовать, если недуг затронул:
- головной мозг;
- печень;
- головной мозг;
- сетчатку глаз;
- миокард.
Токсоплазмоз при беременности первого триместра – это серьёзный повод задуматься об аборте, поскольку весьма вероятно, что впоследствии у младенца будут диагностированы пороки развития.
К началу второго триместра врачи могут назначить сильнодействующие медикаменты, которые тоже оказывают влияние на состояние плода. В редких случаях инфекционное воздействие может привести к выкидышу или смерти матери.
Существует несколько факторов, провоцирующих возникновение недуга:
- Игнорирование правил гигиены (например, нерегулярное мытьё рук);
- Приготовление блюд из яиц и мяса (прежде всего, относится к баранине и свинине), которые прошли недостаточно интенсивную термическую обработку, либо контакт с этими же ингредиентами в сыром виде;
- Вдыхание запаха свежих кошачьих фекалий (во время уборки), если животное было заражено, а также контакт с «лежалыми» испражнениями даже здоровых кошек;
- Контакт с почвой или пылью, в которой обитает паразит (он может проникать даже через микротрещины в коже;
- Употребление в пищу немытых овощей, фруктов и загрязнённой воды.
Женщине, знающей об этих факторах, будет нетрудно обезопасить себя и своего будущего ребёнка от инфекционного заражения.

Последствия гельминта у человека
Последствия токсоплазмоза тем хуже, чем слабее собственные защитные силы организма. Поэтому заселение паразита при наличии болезней иммунной системы можно считать практически смертельным приговором. При этом людям изначально здоровым токсоплазма не способна нанести никакого вреда.
Определить со 100%-й вероятностью источник инфекции затруднительно, поэтому многие даже не знают о том, что заболели, либо путают паразитарное влияние с обычной простудой. Их предположения находят подтверждающие факторы, когда несколько дней спустя общее состояние организма улучшается. В это время завершается выработка антител, позволяющих преодолеть заболевание и выполняющих эту функцию до конца жизни человека.
Если же иммунитет дал слабину, то можно ожидать следующих последствий:
- При острой форме:
- пневмония;
- проблемы в функционировании ЖКТ;
- лихорадка;
- судороги;
- паралич.
- При хронической форме:
- повышенная температура;
- слабость;
- поражение сердечной мышцы;
- неврологические заболевания.
При слабости иммунитета в первую очередь нужно ожидать проблем с нервной системой, спинным и головным мозгом.
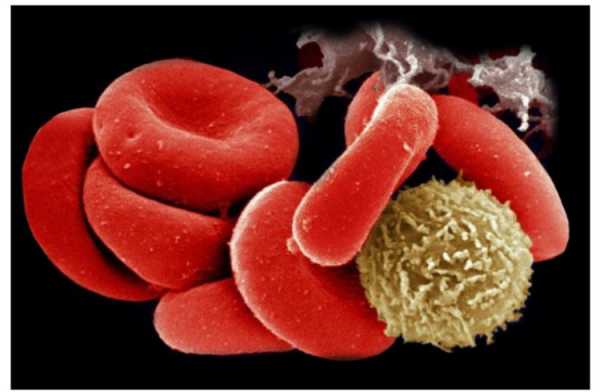
Как лечить паразитов?
Болезнь провоцируется паразитом под названием токсоплазм, который проникает в полость желудка и там начинает активно размножаться. После новоявленные особи с током крови распространяются по всему телу.
Появившийся у человека токсоплазмоз провоцирует нарушения в работе ЦНС, печени, селезёнки, лимфоузлов, а также других органов и систем.
Полностью избавиться от червя невозможно, он всегда будет присутствовать в организме заражённого. Но продолжительное и своевременное лечение позволяет избежать тяжёлых последствий. Для медикаментозной терапии гельминтозов подобного типа применяются следующие лекарственные средства:
- «Пираметамин», «Сульфадимезин» (противогельминтные препараты);
- макролидные антибиотики;
- противогрибковые и противовирусные препараты.
На данный момент, для излечения острой формы заболевания используются не только медикаменты, но и химиотерапия. На прохождение полного терапевтического курса (или даже нескольких курсов) потребуется много времени. Для каждого пациента разрабатывается индивидуальная схема лечения, позволяющая добиться максимального эффекта.
В противовес острой, хроническая форма болезни почти не «отзывается» на химиотерапевтическое воздействие. Поэтому для подобных случаев применяют преимущественно иммуномодулирующие средства и процедуры, помогая организму самостоятельно преодолеть болезнь.
Зачастую к лечению хронического инфицирования приступают только, когда он находится на этапе обострения, однако в некоторых ситуациях недопустимо ждать, пока болезнь проявит себя. Обычно это относится к следующим ситуациям:
- угроза выкидыша;
- риск появления бесплодия;
- стремительное ухудшение зрения.
Сама тактика лечения направлена на избавление от клинических проявлений заболевания и улучшения общего самочувствия пациента. На начальных этапах, когда недуг ещё не вошёл в силу, больному назначают приём «Пираметамина», «Сульфадиазинона» и фолиевой кислоты. Такая терапия может продолжаться целый год.
Черви у человека на фото
После того, как токсоплазм оказался в организме хозяина, начинается трёхнедельный инкубационный период. Почти у каждого человека на протяжении этого периода происходит выработка антител, которые обеспечивают защиту ещё до того, как заболевание проявит себя.
Этот этап был назван первично-латентным. Определить присутствие инфекции в этот момент можно только на основании специальных анализов. Если антитела не появились, то осуществляется переход в хроническую стадию, симптоматика становится более яркой. Далее следует бурное развитие острой фазы (внешние проявления схожи с менингитом и энцефалитом).
Для наглядности можно изучить фото токсоплазмоза у человека (что это такое было объяснено ранее).
Заключение
Искоренить симптоматику хронической формы болезни довольно трудно, хотя бы потому, что её трудно зафиксировать. Особенно она опасна для беременных женщин, которые обязательно должны получить максимум информации о токсоплазмозе: что это такое, каковы основные симптомы, как лечится.
В противном случае высок риск смерти будущей матери или её плода из-за несвоевременно начатого лечения или его отсутствия.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для избавления от паразитов наши читатели успешно используют Intoxic. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию. Подробнее здесь…
Бабезиоз у человека и животных
Бабезиоз представляет собой инфекционное заболевание, протекающее в острой стадии в организме человека или животного. При этом возникает общая интоксикация организма, появляется лихорадка и развивается анемия. Развиться такая инфекционная болезнь, как бабезиоз может у собак, кошек, лошадей и коров. Отнести данное заболевание можно к распространенной паразитарной зоонозной инфекции, которая впервые была выявлена и зафиксирована на территории Югославии в начале 1956 года.
- Характеристика возбудителя
- Патогенез бабезиоза
- Симптоматика инфекционного процесса
- Постановка диагноза
- Лечение заболевания
- Лечение животных
- Лечение бабезиоза у человека
- Меры профилактики
Бабезиоз у человека характеризуется появлением не только лихорадки и прогрессирующей анемии, но и желтушных проявлений и гемоглобинурии. На сегодняшнее время данная инфекция распространена практически на всех континентах. Только в Антарктике не было зафиксировано ни одного случая. Чаще всего бабезиоз проявляется у собак, лошадей, кошек, грызунов и коров. Переносчиком данной инфекции является достаточно распространенный повсеместно пастбищный и аргасовый клещ. Наиболее подвержены инфицированию туристы, работники в сфере сельского хозяйства и пастухи.
Характеристика возбудителя
Бабезиоз крупного рогатого скота, человека, лошадей, кошек и собак развивается после укуса инфицированного клеща. Следует отметить, что до сегодняшнего дня было зафиксировано не много случаев заражения человека на территории Европы. Практически все они протекали в тяжелой форме и закончились летальным исходом.
После проникновения в организм бабезии размещаются в пораженных эритроцитах на периферической стороне или в центре клеток. При проведении диагностической процедуры – окраски по Граму, они выглядят в качестве небольших тонких колец, которые в диаметре имеют не более 3 мкм или же имеют грушевидную форму, в диаметре достигающую 5 мкм. Симптомы болезни становятся заметны только у людей с ослабленной иммунной системой, что особенно характерно для ВИЧ-инфицированных. При нормальном состоянии иммунной системы симптомы бабезиоза отсутствую даже в том случае, когда паразитемия достигает уровня в 2%.
Патогенез бабезиоза
Бабезиоз человека, собак, лошадей, коров, кошек и грызунов до настоящего времени изучен не достаточно. Заражение происходит в момент укуса клеща, инфекция поступает в кровь через слюну. Среди естественных инфекционных резервуаров в природе можно выделить зараженных животных, а среди промежуточных – грызунов. После того, как животное переболеет бабезиозом, его организм становится невосприимчивым к нему на протяжении 2 или 3 лет.
После того, как слюна клеща попадает в кровоток, происходит проникновение возбудителя бабезиоза в область эритроцитов. При этом происходит выработка антиэритроцитарных антител в организме. Симптомы болезни проявляются только тогда, когда концентрация пораженных кровяных клеток достигает отметки в 5%. После того, как происходит разрушение эритроцитов, в кровь поступают гетерогенные протеины и токсические продуты распада паразитических особей, что способствует развитию общих токсических признаков. При этом наблюдаются следующие клинические симптомы:
- Анемия нарастает и провоцирует клеточную гипоксию. Для данного процесса характерно нарушение микроциркуляции в области мягких тканей.
- В районе почечных структур происходит оседание гемоглобина в свободной форме и эритроцитарных оболочек. Для данных изменений характерно развитие гематурии и серьезной степенью поражения почечных функций.
- Вследствие массивной эритроцитарной патологии наблюдается нарушение обменных процессов пигментации. Данный процесс совмещается с накоплением в кровотоке билирубина.
Симптоматика инфекционного процесса
У человека и у животных (кошек, собак, лошадей, грызунов) продолжение инкубационного периода после укуса инфицированного клеща составляет от 10 до 15 суток, а после заражения инфекцией через кровь – от 6 до 12 дней. Симптомы бабезиоза проявляются постепенно следующим образом:
- Повышение субфебрильной температуры до отметок в 41 градус.
- Нарушение работы сердечной системы.
- Изменение дыхательных функций.
- Чередование жидкого стула и запоров.
- Достаточно быстрое снижение массы тела.
У коров в несколько раз снижаются удои, при этом приобретает желтый цвет молоко, которое становится достаточно горьким. Бабезиоз проявляется у собак, лошадей и кошек в виде появления крови в моче. У мелкого и рогатого скота вследствие этого может быть прервана беременность.
Важно! Людям, проживающим в местах с возможными очагами заражения, необходимо проводить вакцинацию своих животных, а также самим и членам семьи.
При развитии острого периода бабезиоза, симптоматика инфекционного процесса продолжается на протяжении от 4 до 8 суток. Смертность при этом составляет у человека 80%, у лошадей и коров – 40%, у собак, кошек и грызунов – 70%. Симптомы бабезиоза закономерно осложняются почечной, полиорганной и печеночной недостаточностью. Часто патологический инфекционный процесс осложняется неспецифическими пневмониями.
Постановка диагноза
В настоящее время проводится работа по улучшению диагностических мер бабезиоза у людей и крупного рогатого скота. Клиническая картина инфекции затруднена, поэтому при длительной лихорадке при неэффективности антибиотиков рекомендуется проводить диагностические меры для выявления бабезиоза.
Для людей и животных (собак, кошек, лошадей, грызунов) важно учитывать наличие таких факторов, как эпидемиологические данные и нарушения защитных сил организма. Диагноз бабезиоз подтверждается наличием возбудителя в кровотоке и реакции непрямого типа иммунофлуоресценции.
Лечение заболевания
Лечение бабезиоза у человека и у кошек, собак, лошадей и грызунов различно. Важно перед тем. Как принимать лечебные меры посоветоваться с врачом, который рассчитает дозировку наиболее безопасного лекарственного препарата в каждом случае индивидуально.
Лечение животных
Животным в первую очередь назначаются противопротозойные лекарственные средства, представляющие собой лекарственные красители. Некоторое время назад для уничтожения возбудителей бабезиоза, в организм животных вводили синьку метиленового типа. В настоящее время лечение осуществляется при помощи препаратов современного типа: Азидина, Пирацида, Беренила. Вводятся лекарства специалистами в строго определенной концентрации, чаще всего дважды. Не следует лечить бабезиоз самостоятельно у собак, котов или рогатого скота, так как используемые препараты токсичны, что может стать причиной летального исхода.
Разрушение бабезий происходит на протяжении 12 часов. В этот период состояние животного может существенно ухудшиться. Именно поэтому бабезиоз требует комплексное лечение, что предотвращает риски развития осложнений.
Лечение бабезиоза у человека
Лечение инфекционного заболевания у людей осуществляется при помощи многократного переливания крови и назначения Хлороквина. Смертность при данном заболевании достаточно высокая, но если лечение начать вовремя, то шансы на выздоровление есть. При легкой форме заболевания лечение не требуется, то есть при отсутствии симптоматики, рисков развития осложнений практически нет. Организм при этом самостоятельно справляется с инфекцией и лечение не назначается.
Эффективностью обладают и такие лекарственные средства, как Хинин и Клиндамицин, а также Атоваквон и Азитромицин. Их следует принимать комплексно, что позволяет предупредить развитие осложнений инфекционного процесса. Терапию против бабезиоза должен назначать врач, так как очень важно правильно рассчитать дозировки лекарственных средств.
Меры профилактики
Лечение бабезиоза является достаточно длительным и сложным, поэтому повсеместно принимаются меры для предотвращения заражения инфекционным заболеванием. Важно принимать самостоятельно меры для защиты от укусов инфицированных насекомых. Для этого, отправляясь на поле или в лес в периоды активности данных насекомых, следует надевать одежду, которая максимально защищает кожный покров. Незащищенные участки тела в обязательном порядке обрабатываются специальными растворами, которые предназначены для отпугивания клещей. После возвращения домой в обязательном порядке следует осмотреть свою одежду и принесенные с собой вещи на предмет содержания клеща.
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе