Валентность железа в гемоглобине
Гемоглобин
Гемоглобин — железосодержащий дыхательный пигмент крови позвоночных и многих беспозвоночных животных, осуществляющий перенос кислорода от органов дыхания к тканям организма. В крови позвоночных и некоторых беспозвоночных гемоглобин содержится внутри эритроцитов в растворенном состоянии. Молекула гемоглобина позвоночных животных состоит из белка — глобина и железосодержащей группы — гема. В состав гема входят четыре протопорфириновых кольца, каждое из которых содержит атом двухвалентного железа. Молекулярный вес гемоглобина — 66 000— 68 000. Физиологическая функция гемоглобина как переносчика кислорода основана на его способности обратимо связывать кислород в зависимости от концентрации последнего в крови. В присутствии кислорода железо гема связывает одну молекулу кислорода, при этом гемоглобин превращается в оксигемоглобин. При взаимодействии гемоглобина с окисью углерода (например, при отравлении этим газом) образуется более стабильный комплекс — карбоксигемоглобин. Продуктами распада гемоглобина являются многочисленные железопорфириновые комплексы. При этом происходит полное отделение гема от белка (хромопротеида); это отделение протекает с превращением железа в трехвалентную форму. Получаемый железопротопорфирин называется гемином, а его соединения — геминодериватами. Обычно большую часть гемоглобина в эритроцитах составляет гемоглобин А, или нормальный гемоглобин взрослого человека. При врожденных аномалиях и заболеваниях кроветворного аппарата в эритроцитах появляются аномальные гемоглобины. Это наблюдается, например, при серповидноклеточной анемии (см. Анемия у детей), талассемии (см.), врожденной метгемоглобинемии (см.).
Техника определения гемоглобина в крови — см. Кровь.
Гемоглобин выполняет в организме важную роль переносчика кислорода и принимает участие в транспорте углекислоты. Гемоглобин представляет собой сложное химическое соединение (молекулярный вес 68 800). Он состоит из белка глобина и четырех молекул гема. Молекула гема, содержащая атом железа, обладает способностью присоединять и отдавать молекулу кислорода. При этом валентность железа, к которому присоединяется кислород, не изменяется, т. е. железо остается двухвалентным. Если обработать гемоглобин раствором соляной кислоты, то от глобина отщепляется гем. Вступая в соединение с соляной кислотой, он превращается в гемин (Ca34h42N4O4FeCl), образующий кристаллы характерной формы. Проба на образование гемина производится для доказательства присутствия крови при судебно-медицинских исследованиях.
Рис. 5. Спектры поглощения оксигемоглобина (сверху) и гемоглобина.
В состав молекулы гема входят четыре пиррольных кольца (два из них имеют характер щелочи, а два — кислоты). Атом железа, содержащийся в теме, связывает гем с белковой частью глобином. Если гем теряет атом железа, а пирроловая его структура сохраняется, то получается гематопорфирин. Это вещество в больших количествах образуется в организме при некоторых отравлениях или нарушениях обмена и может выделяться с мочой. Гем является активной, или так называемой простетической, группой гемоглобина, а глобин — белковым носителем гема. Гемоглобин, присоединивший кислород, превращается в оксигемоглобин (его обозначают символом HbO2). Оксигемоглобин, отдавший кислород, называется восстановленным, или редуцированным, гемоглобином (Hb). Оксигемоглобин, гемоглобин и некоторые другие соединения и производные гемоглобина дают характерные полосы поглощения лучей спектра. Так, пропуская луч света через раствор оксигемоглобина, можно обнаружить две характерные темные полосы поглощения в желто-зеленой части спектра, между фрауэнгоферовыми линиями D и Е. Для восстановленного гемоглобина характерна одна широкая полоса поглощения в желто-зеленой части спектра (рис. 5). Оксигемоглобин несколько отличается по цвету от гемоглобина, поэтому артериальная кровь, содержащая оксигемоглобин, имеет ярко-алый цвет, притом тем более яркий, чем полнее произошло ее насыщение кислородом. Венозная кровь, содержащая большое количество восстановленного гемоглобина, имеет темно-вишневый цвет. Значительно большее поглощение световых лучей с длиной волны 620—680 ммк гемоглобином по сравнению с оксигемоглобином легло в основу методики измерения степени насыщения крови кислородом — оксигемометрии. При этой методике ушную раковину или кювету с кровью просвечивают небольшой электрической лампой и определяют с помощью фотоэлемента интенсивность светового потока указанной длины волны, проходящего через ткань уха или кювету с кровью. По показаниям фотоэлемента определяют степень насыщения гемоглобина кислородом.
Кровь взрослых людей содержит в среднем 14—15% гемоглобина (у мужчин 13,5—16%, у женщин 12,5—14,5%). Общее содержание гемоглобина равно примерно 700 г.
В эмбриональном периоде в крови человека имеются разные типы гемоглобина, отличающиеся способностью присоединять кислород и некоторыми другими химическими свойствами. Для определения и разделения разных типов гемоглобина применяют методику измерения оптической плотности растворов гемоглобина до и после денатурации его едкой щелочью. Разные типа гемоглобина условно обозначают НbА, HbF, НbР. Гемоглобин НЬР встречается только в первые 7—12 недель внутриутробного развития зародыша. На 9-й неделе появляется в крови зародыша гемоглобин HbF и гемоглобин взрослых НbА. Существенно важным представляется тот факт, что эмбриональный гемоглобин HbF обладает более высоким сродством к кислороду и может насыщаться на 60% при таком напряжении кислорода, когда гемоглобин матери насыщается всего на 30%. У разных видов позвоночных животных имеются различия в структуре гемоглобина. Гем разных типов гемоглобина при этом одинаков, глобины же различаются по своему аминокислотному составу.В организме постоянно происходит синтез и распад гемоглобина, связанные с образованием и разрушением эритроцитов. Синтез гемоглобина совершается в эритробластах красного костного мозга. При разрушении эритроцитов, которое происходит в ретикуло-эндотелиальной системе, главным образом в печени и селезенке, из красных кровяных клеток выходит гемоглобин. В результате отщепления железа от гема и последующего окисления образуется из гемоглобина пигмент билирубин, который затем с желчью выделяется в кишечник, где превращается в стеркобилин и уробилин, которые выводятся с калом и мочой. За сутки разрушается и превращается в желчные пигменты около 8 г гемоглобина, т. е. несколько более 1 %. В организме человека и животных могут образовываться и другие соединения гемоглобина, при спектральном анализе которых обнаруживаются характерные спектры поглощения. К числу таких соединений гемоглобина относятся метгемоглобин и карбоксигемоглобин. Вещества эти образуются в результате некоторых отравлений. Метгемоглобин (MetHb) представляет собой прочное соединение гемоглобина с кислородом; при образовании метгемоглобина меняется валентность железа: двухвалентное железо, входящее в молекулу гемоглобина, превращается в трехвалентное. В случае накопления в крови больших количеств метгемоглобина отдача кислорода тканям становится невозможной и наступает смерть от удушения. Метгемоглобин отличается от гемоглобина коричневым цветом и наличием полосы поглощения в красной части спектра. Метгемоглобин образуется при действии сильных окислителей: феррицианида (красной кровяной соли), марганцовокислого калия, амил- и пропилнитрита, анилина, бертолетовой соли, фенацетина.
Карбоксигемоглобин (HbСО) представляет собой соединение железа гемоглобина с окисью углерода (СО) — угарным газом. Это соединение примерно в 150—300 раз прочнее, чем соединение гемоглобина с кислородом. Поэтому примесь даже 0,1% угарного газа во вдыхаемом воздухе ведет к тому, что 80% гемоглобина оказываются связанными окисью углерода и не присоединяют кислород, что является опасным для жизни.
Слабое отравление угарным газом — обратимый процесс. При дыхании свежим воздухом СО постепенно отщепляется от карбоксигемоглобина и выделяется. Вдыхание чистого кислорода увеличивает скорость расщепления карбоксигемоглобина в 20 раз. В тяжелых случаях отравления необходимо искусственное дыхание газовой смесью с 95% содержания O2 и 5% CO2, а также переливание крови.Миоглобин. В скелетной и сердечной мышце находится мышечный гемоглобин, называемый миоглобином. Его простетическая группа — гем — идентична этой же группе молекулы гемоглобина, а белковая часть — глобин — обладает меньшим молекулярным весом, чем белок гемоглобина.
Миоглобин человека способен связывать до 14% от общего количества кислорода в организме. Это его свойство играет важную роль в снабжении кислородом работающих мышц. Если при сокращении мышцы кровеносные капилляры ее сжимаются и кровоток в некоторых участках мышцы прекращается, то все же благодаря наличию кислорода, связанного с миоглобином, в течение некоторого времени сохраняется снабжение мышечных волокон кислородом.Гемопротеины
К группе гемопротеинов относятся гемоглобин и его производные, миогло-бин, хлорофиллсодержащие белки и ферменты (вся цитохромная система, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо- (или магний)порфирины, но различные по составу и структуре белки, обеспечивая тем самым разнообразие их биологических функций. Далее более подробно рассмотрено химическое строение гемоглобина, наиболее важного для жизнедеятельности человека и животных соединения.
Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина.
Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Последний состоит из четырех замещенных пирролов:
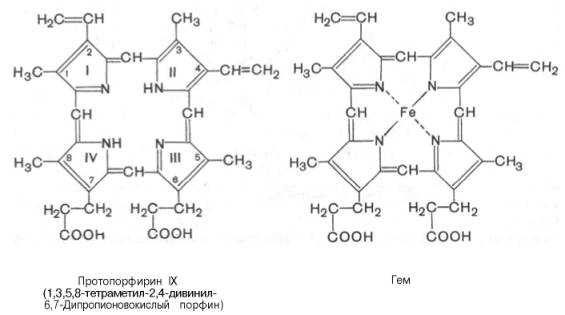
соединенных между собой метиновыми мостиками (—СН=). Незамещенный порфирин называется порфином. В молекуле гема порфин представлен в виде протопорфирина IX, содержащего четыре метильные группы (—СН3), две винильные группы (—СН=СН2) и два остатка пропионовой кислоты. Протопорфирин, присоединяя железо, превращается в гем.
Из формулы видно, что железо связано с двумя атомами азота молекулы протопорфирина ковалентно и с двумя другими – координационными связями, обозначенными пунктирными линиями. В зависимости от химической природы групп, находящихся в боковой цепи, порфирины классифицируют на этио-, мезо-, копро- и протопорфирины. Последние наиболее распространены в природе. Из возможных 15 изомеров протопорфиринов благодаря наличию трех разных заместителей самым распространенным оказался протопорфирин IX.
Гем в виде гем-порфирина является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы и цитохромов b, с и c1 (см. главу 9); в то же время в цитохромах а и a3, входящих в состав интегрального комплекса, названного цитохромокси-дазой, содержится гем а, называемый также формилпорфирином:
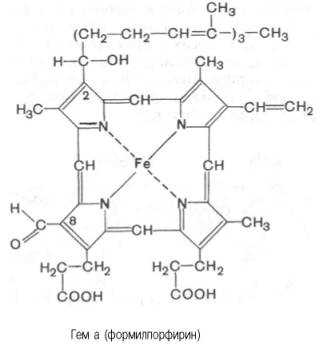
Гем а вместо метильной группы содержит формильный остаток (в 8-м положении) и вместо одной винильной группы (во 2-м положении) – изопре-ноидную цепь. Железо своими четырьмя связями образует комплекс с порфирином, а оставшиеся 5-я и 6-я координационные связи железа в молекулах гемоглобина и цитохромов связываются с белковыми компонентами по-разному. В частности, в гемоглобинах (и миоглобине) благодаря 5-й координационной связи железо соединяется с атомом азота имидазольной группы гистидина белковой молекулы. Шестая координационная связь железа предназначена для присоединения кислорода (с образованием оксигемоглобина и оксимиоглобина) или других лигандов: СО, цианидов и др. (рис. 2.1). В цитохромах, напротив, и 5-я, и 6-я координационные связи железа соединены с остатками гистидина и метио-нина (в цитохроме с обе винильные группы соединены еще и с остатками цистеина) белковой молекулы. Этим, вероятнее всего, могут быть объяснены функции железа в гемоглобине, валентность которого не изменяется при присоединении кислорода (в отличие от валентности железа в цитохромах): в гемоглобине железо остается двухвалентным независимо от присоединения или отдачи кислорода.
Структурная организация гемоглобина (и миоглобина) была описана в главе 1. Дж. Кендрью и М. Перутц расшифровали конформацию этих молекул (Нобелевская премия 1962 г.). Дыхательная функция гемоглобина крови подробно рассматривается в курсе физиологии. Здесь следует указать на уникальную роль гемоглобина в траспорте кислорода от легких к тканям и диоксида углерода от тканей к легким. Это элементарное проявление жизни – дыхание, хотя и выглядит простым, основано на взаимодействии многих типов атомов в гигантской молекуле гемоглобина. Подсчитано, что в одном эритроците содержится около 340000000 молекул гемоглобина, каждая из которых состоит примерно из 103 атомов С, Н, О, N, S и 4 атомов железа.
Атом железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Каждая из 4 молекул гема «обернута» одной полипептидной цепью. В молекуле гемоглобина взрослого человека HbА (от англ. adult – взрослый) содержатся четыре полипептидные цепи, которые вместе составляют белковую часть молекулы – глобин. Две из них, называемые α-цепями, имеют одинаковую первичную структуру и по 141 аминокислотному остатку. Две другие, обозначаемые β-цепями, также идентично построены и содержат по 146 аминокислотных остатков. Таким образом, вся молекула белковой части гемоглобина состоит из 574 аминокислот. Во многих положениях α- и β-цепи содержат разные аминокислотные последовательности, хотя и имеют почти одинаковые пространственные структуры. Получены доказательства, что в структуре гемоглобинов более 20 видов животных 9 аминокислот в последовательности оказались одинаковыми, консервативными (инвариантными), определяющими функции гемоглобинов; некоторые из них находятся вблизи гема, в составе участка связывания с кислородом, другие – в составе неполярной внутренней структуры глобулы.
Рис. 2.1. Координационные связи атома железа в молекуле гема. Все 4 связи с атомами азота пиррольных колец расположены в одной плоскости, 5-я и 6-я координационные связи (с атомом азота имидазольного кольца гистидина и с кислородом соответственно) – по разные стороны перпендикулярно к этой плоскости.
В дополнение к основному гемоглобину HbA1в крови взрослого человека доказано существование мигрирующего с меньшей скоростью при электрофорезе гемоглобина НbА2, также состоящего из 4 субъединиц: двух α-цепей и двух δ-цепей. На долю НbА2 приходится около 2,5% от всего гемоглобина. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух γ-цепей. Фетальный гемоглобин отличается от HbA1не только составом аминокислот, но и физико-химическими свойствами: спектральным показателем, электрофоретической подвижностью, устойчивостью к щелочной денатурации и др. Кровь новорожденного содержит до 80% HbF, но к концу 1-го года жизни он почти целиком заменяется на НbА (все же в крови взрослого человека открывается до 1,5% HbF от общего количества гемоглобина). Последовательность аминокислот в γ- и δ-цепях гемогло-бинов окончательно не расшифрована.
Установление первичной структуры субъединиц молекулы гемоглобина стимулировало исследования по расшифровке структуры так называемых аномальных гемоглобинов. В крови человека в общей сложности открыто около 150 различных типов мутантных гемоглобинов. Появляются мутантные формы гемоглобинов в крови вследствие мутации генов. Обычно мутации делят на 3 класса в соответствии с топографией измененного участка молекулы. Если замена аминокислоты происходит на поверхности молекулы гемоглобина, то это мутация первого класса; подобные мутации обычно не сопровождаются развитием тяжелой патологии, и болезнь протекает бессимптомно; исключение составляет серповидно-клеточная анемия. При замене аминокислоты вблизи гема нарушается связывание кислорода – это мутация второго класса, сопровождающаяся развитием болезни. И наконец, если замена происходит во внутреннем участке молекулы гемоглобина, говорят о третьем классе мутации; подобные мутации приводят к нарушению пространственной структуры и соответственно функции гемоглобина.
Аномальные гемоглобины, различающиеся по форме, химическому составу и величине заряда, были выделены при помощи электрофореза и хроматографии. Передающиеся по наследству изменения чаще всего являются результатом мутации единственного триплета, приводящей к замене одной какой-либо аминокислоты в полипептидных цепях молекулы гемоглобина на другую. В большинстве случаев происходит замена кислой аминокислоты на основную или нейтральную (табл. 2.1). Поскольку это замещение осуществляется в обеих полипептидных цепях одной из пар (α или β), образовавшийся аномальный гемоглобин будет отличаться от нормального величиной заряда и соответственно электрофоретической подвижностью.

В табл. 2.1 представлены некоторые типы аномальных гемоглобинов, составы их полипептидных цепей с указанием известной или вероятной локализации замены либо в α-, либо в β-цепях. Замены необычной аминокислотой в аномальных гемоглобинах имеют место как в α-, так и в β-цепях. Исключение составляет гемоглобин Н, все 4 полипептида которого представлены β-цепями, идентичными по структуре β-цепям нормального гемоглобина A1.
Следует указать, что некоторые мутации, вызывающие существенное изменение структуры и соответственно функции гемоглобина, оказываются летальными, и индивидуумы с подобным гемоглобином умирают в раннем возрасте. Однако при ряде мутаций замена аминокислот не вызывает заметного изменения функции гемоглобина, в этих случаях болезнь протекает бессимптомно.
Болезни гемоглобинов (их насчитывают более 200) называют гемогло-бинозами. Принято делить их на гемоглобинопатии, в основе развития которых лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина (часто их относят также к «молекулярным болезням»), и талассемии, обусловленные наследственным нарушением синтеза какой-либо нормальной цепи гемоглобина. Различают также же-лезодефицитные анемии.
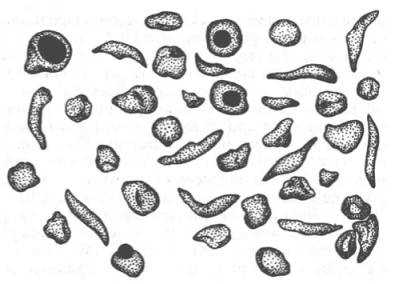
Рис. 2.2. Нормальные и серповидные эритроциты.
Классическим примером наследственной гемоглобинопатии является серповидно-клеточная анемия, широко распространенная в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода принимают форму серпа (рис. 2.2). Гемоглобин S, как показали Л. Полинг и др., отличается рядом свойств от нормального гемоглобина: в частности, после отдачи кислорода в тканях он превращается в плохо растворимую дез-окси-форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Последние деформируют клетку и приводят к массивному гемолизу. Болезнь протекает остро, и дети, гомозиготные по мутантному гену, часто умирают в раннем возрасте.
Химический дефект при серповидно-клеточной анемии был раскрыт В. Ингремом и сводится к замене единственной аминокислоты, а именно глутаминовой, в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина HbS (см. табл. 2.1, рис. 2.2). Это результат мутации в молекуле ДНК, кодирующей синтез β-цепи гемоглобина. Все остальные аминокислоты располагаются в той же последовательности и в таком же количестве, как и в нормальном гемоглобине НbА:
Одной этой замены оказалось достаточно не только для нарушения формы эритроцита, но и для развития тяжелой наследственной болезни – серповидно-клеточной анемии.
Талассемии, строго говоря, не являются гемоглобинопатиями. Это генетически обусловленное нарушение синтеза одной из нормальных цепей гемоглобина. Если угнетается синтез β-цепей, то развивается β-талассемия; при генетическом дефекте синтеза α-цепей развивается α-талас-семия. При β-талассемии в крови наряду с HbA1появляется до 15% НbА2 и резко повышается содержание HbF – до 15–60%. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, селезенки, деформацией черепа и сопровождается тяжелой гемолитической анемией. Эритроциты при талассемии приобретают мишеневидную форму. Механизм изменения формы эритроцитов объяснить пока не удалось.
В медицинской практике часто проводят анализ кровяных пигментов, который основан на исследовании спектроскопических свойств гема гемоглобина, точнее продуктов его окисления (хлорида гемина и гематина, образующихся соответственно при обработке гемоглобина уксусной кислотой в присутствии хлорида натрия или разведенными растворами щелочей). При восстановлении гематина сульфитом аммония в присутствии глобина образуется производное гемоглобина – гемохромоген, в котором денатурированный глобин соединен с гемом. Полученный комплекс имеет характерный спектр поглощения. Этот метод широко применяется в судебно-медицинской практике при исследовании кровяных пятен.
Из многообразия производных гемоглобина, представляющих несомненный интерес для врача, следует прежде всего указать на оксигемоглобин НbО2 – соединение молекулярного кислорода с гемоглобином. Кислород присоединяется к каждому гему молекулы гемоглобина при помощи координационных связей железа, причем присоединение одной молекулы кислорода к тетрамеру облегчает присоединение второй молекулы, затем третьей и т.д. Поэтому кривая насыщения гемоглобина кислородом имеет сиг-моидную форму, свидетельствующую о кооперативности связывания кислорода. Эта кооперативность обеспечивает не только связывание максимального количества кислорода в легких, но и освобождение кислорода в периферических тканях; этому способствует также наличие Н+ и СО2 в тканях с интенсивным обменом. В свою очередь кислород ускоряет высвобождение СО2 и Н+ в легочной ткани. Эта аллостерическая зависимость между присоединением Н+, О2 и СО2 получила название эффекта Бора.
Помимо кислорода, гемоглобин легко соединяется с другими газами, в частности с СО, NO и др. Так, при отравлении оксидом углерода гемоглобин прочно с ним связывается с образованием карбоксигемо-глобина (НbСО). При этом вследствие высокого сродства к СО гемоглобин теряет способность связывать кислород и наступает смерть от удушья, недостаточного снабжения тканей кислородом. Однако при быстром повышении парциального давления кислорода во вдыхаемом воздухе можно добиться частичного вытеснения СО из связи с гемоглобином и предотвратить летальный исход.
При отравлении оксидами азота, парами нитробензола и другими соединениями часть гемоглобина окисляется в метгемоглобин (НbОН), содержащий трехвалентное железо. Метгемоглобин также теряет способность к переносу кислорода от легких к тканям, поэтому при метгемо-глобинемии (вследствие отравления окислителями) в зависимости от степени отравления может наступить смерть от недостатка кислорода. Если вовремя оказать помощь, т.е. повысить парциальное давление кислорода (вдыхание чистого кислорода), то и в этом случае можно вывести больного из опасного состояния.
Следует отметить, что самым надежным методом качественного определения различных производных гемоглобина является исследование их спектров поглощения.
У беспозвоночных роль переносчика кислорода часто выполняют пигменты негеминовой природы – гемэритрин и гемоцианин. Они не относятся к гемсодержащим хромопротеинам, хотя в их названиях содержится корень «гем». Эти белки, как и гемоглобин, несмотря на то что выполняют одну и ту же функцию, сильно различаются между собой по молекулярной массе и четвертичной структуре, химической природе активного центра, характеру связывания железа (гемэритрин) и меди (гемоцианин) с кислородом и др. (табл. 2.2).
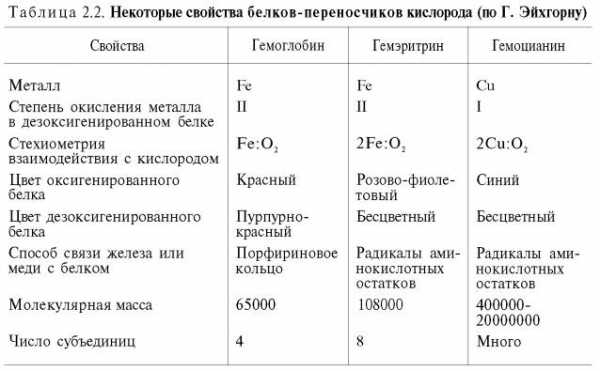
Трансферрины (сидерофилины) – группа сложных белков, полученных из разных источников и характеризующихся способностью специфично, прочно и обратимо связывать ионы железа Fe (III) и других переходных металлов. Наиболее подробно из этой группы белков изучен трансферрин сыворотки крови. Функция трансферрина заключается в транспорте ионов железа в ретикулоциты, в которых осуществляется биосинтез гемоглобина. Система трансферрин–ретикулоцит считается весьма перспективной для изучения взаимодействия металла с белком и белковой молекулы с клеткой.
Предыдущая страница | Следующая страница
СОДЕРЖАНИЕ
 ___
___ Гемоглобин. Его разновидности и функции.
Гемоглобин (Нb) это хемопротеин, содержащийся в эритроцитах. Его молекулярная масса 66000 дальтон. Молекулу гемоглобина образуют четыре субъединицы, каждая из которых включает гем, соединенный с атомом железом, и белковую часть глобин. Гем синтезируется в митохондриях эритробластов, а глобин в их рибосомах. У взрослого человека гемоглобин содержит две a- и две b-полипептидных цепи. Он называется А-гемоглобином (adult-взрослый). В зрелом возрасте он составляет основную часть гемоглобина. В первые три месяца внутриутробного развития в эритроцитах находится гемоглобин типа GI и G2 (Gover). В последующие периоды внутриутробного развития и в первые месяцы после рождения основную часть составляет фетальный гемоглобин (F-гемоглобин). В его структуре две a- и две g-полипептидные цепи. При рождении до 50-80% гемоглобина составляет F-гемоглобин, а 20-40 % А-гемоглобин. Ранние гемоглобины имеют большую кислородную емкость.
Гем содержит атом 2-х валентного железа, который легко соединяется с кислородом и легко отдает его. При этом валентность железа не изменяется. Один грамм гемоглобина способен связывать 1,34 мл кислорода. Соединение гемоглобина с кислородом, образующееся в капиллярах легких называется оксигемоглобином (HbO2). Он имеет ярко алый цвет. Гемоглобин, отдавший кислород в капиллярах тканей, называется дезоксигемоглобином или восстановленным (Hb). У него темно-вишневая окраску. От 10 до 30% углекислого газа, поступающего из тканей в кровь, соединяются с амидной группировкой гемоглобина. Образуется легко диссоциирующее соединение карбгемоглобин (HbCO2). В этом виде часть углекислого газа транспортируется к легким.
В некоторых случаях гемоглобин образует патологические соединения. При отравлении угарным газом образуется карбоксигемоглобин (HbCO). Сродство гемоглобина с окисью углерода значительно выше, чем с кислородом, а скорость диссоциации карбоксигемоглобина в 200 раз меньше, чем оксигемоглобина. Поэтому присутствие в воздухе даже 1% угарного газа приводит к прогрессирующему увеличению количества карбоксигемоглобина и опасному угарному отравлению. Кровь теряет способность переносить кислород. Развивается гипоксия мозга и других тканей. Угарное отравление сопровождается сильной головной болью, тошнотой, рвотой, судорогами, потерей сознания и смертью.
При отравлении сильными окислителями, например нитритами, марганцевокислым калием, красной кровяной солью, образуется метгемоглобин (MetHb). В этом соединении гемоглобина железо становится трехвалентным. Поэтому метгемоглобин очень слабо диссоциирующее соединение. Он не отдает кислород тканям.
Все соединения гемоглобина имеют характерный спектр. Восстановленный гемоглобин дает одну широкую полосу поглощения в желто-зеленой части спектра между линиями D и E. Оксигемоглобин дает 2 узких полосы поглощения в желто-зеленой части спектра между линиями D и E. У карбоксигемоглобина такая же спектральная картина, как и оксигемоглобина. Поэтому для диагностики отравления угарным газом, в исследуемую кровь добавляют восстановитель, например реактив Стокса. Под их влиянием оксигемоглобин превращается в дезоксигемоглобин и появляется спектр восстановленного гемоглобина. Карбоксигемоглобин не восстанавливается. Метгемоглобин, в зависимости от рН крови, дает 3-5 полос поглощения. Одна из них находится в красной части, другие в желто-зеленой области спектра.
Гемоглобин образует с соляной кислотой соединение коричневого цвета - солянокислый гематин. Форма его кристаллов зависит от видовой принадлежности крови. В частности, кристаллы солянокислого гематина человека имеют форму прямоугольных пластинок.
Содержание гемоглобина определяют методом Сали. Гемометр Сали состоит из 3 пробирок, находящихся в специальном штативе. Две из них, расположенные сбоку от центральной, заполнены стандартным раствором солянокислого гематина коричневого цвета. Средняя пробирка имеет градуировку в единицах гемоглобина. В нее наливают 0,2 мл соляной кислоты. Затем мерной пипеткой набирают 20 мкл крови и выпускают ее в соляную кислоту. Перемешивают содержимое пробирки и выдерживают 5 мин. Полученный раствор солянокислого гематина разводят водой до тех пор, пока его цвет не станет таким же, как в боковых пробирках. По уровню жидкости в средней пробирке определяется содержание гемоглобина. В норме в крови мужчин содержится 132-164 г/л (13,2-16,4 г %) гемоглобина. У женщин - 115-145 г/л (11,5-14,5 г %). Количество гемоглобина снижается при кровопотерях, интоксикациях, нарушениях эритропоэза, недостатке железа, витамина В12 и т.д.
Кроме этого определяют цветовой показатель. Он отражает степень насыщения эритроцитов гемоглобином. Это отношение содержания гемоглобина в крови к количеству эритроцитов. В норме его величина составляет 0,85-1,05.
Дата добавления: 2016-07-27; просмотров: 1132; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Похожие статьи:
Российский Университет Дружбы Народов
Аграрный факультет
Кафедра морфологии, физиологии животных и ветсанэкспертизы
Курсовая работа по нормальной физиологии
«Гемоглобин. Химическое строение, физиологическое значение»
выполнила Шуралёва Н. И.
группа: СВ-21
руководитель: к.в.н., доцент Забалуев Г.И.
зав. кафедрой: д.в.н., профессор Никитченко В.Е.
дата сдачи – 26.05.2005
личная подпись
г. Москва, 2005г.
ХИМИЧЕСКОЕ СТРОЕНИЕ
Гемоглобин является наиболее распространенным кровяным пигментом. Он содержится в эритроцитах всех позвоночных и некоторых беспозвоночных животных (черви, моллюски, членистоногие, иглокожие), а также в корневых клубеньках некоторых бобовых растений.
В одном эритроците находится 340-400 млн. молекул гемоглобина. [1]
Гемоглобин позвоночных (за исключением круглоротых) – это вещество с молекулярной массой порядка 64 500дальтон, которое с химической точки зрения представляет собой сложный белок – хромопротеид, состоящий из белковой части и небелковой (пигментной) группировки, придающей гемоглобину, а следовательно и крови, красный цвет. [4]
В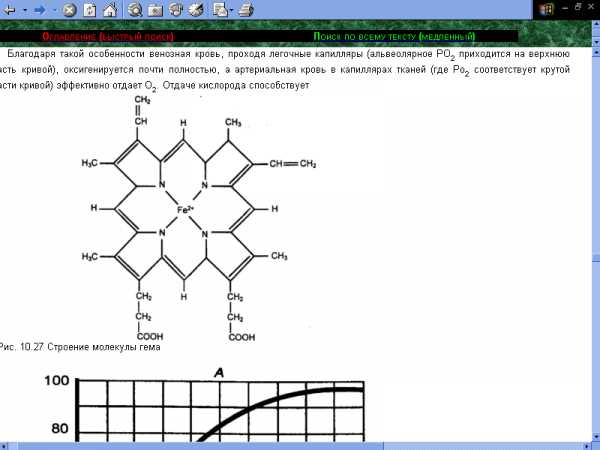 составе гемоглобина различают белокглобин, и небелковую пигментную группу – гем, соединенные между собой гистидиновым мостиком; каждая молекула гемоглобина содержит четыре гема и четыре полипептидные цепи. На долю гема по массе приходится 4% молекулы гемоглобина, глобина - 96 %. [8]
составе гемоглобина различают белокглобин, и небелковую пигментную группу – гем, соединенные между собой гистидиновым мостиком; каждая молекула гемоглобина содержит четыре гема и четыре полипептидные цепи. На долю гема по массе приходится 4% молекулы гемоглобина, глобина - 96 %. [8]
Б
Рис.1 Схема строения гема
елковая и простетическая части молекулы не только связаны, но и постоянно оказывают друг на друга сильное влияние. Глобин изменяет свойства гема определяя его способность к связыванию кислорода. В свою очередь, гем обеспечивает устойчивость глобина к действию физических факторов, расщеплению ферментами и т. д. [1]Строение небелкового компонента
У всех видов животных гем имеет одинаковое строение, в то время как глобин несколько отличается по аминокислотному составу. [6] Гем в виде гем-порфирина является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы и группы цитохромов. [5]
Гем построен из четырёх пирроловых колец и содержит двухвалентное железо. Атом двухвалентного железа образует координационные связи с четырьмя атомами азота, входящими в состав пиррольных группировок, точнее, с двумя атомами азота координационные связи, а с двумя другими – связи с замещением водорода. Оставшиеся две координационные связи используются для присоединения гема к имидазольному кольцу глобина и для связывания кислорода. Структура гема целиком расположена в одной плоскости.
При потере железа гем превращается в гематопорфирин. [5]
Строение белкового компонента, пространственная конфигурация молекулы
Б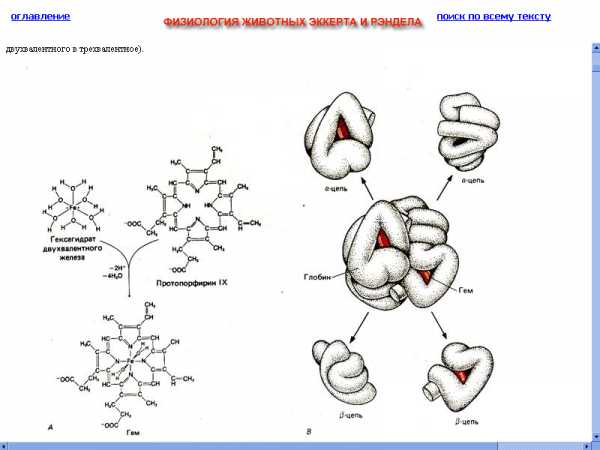 ольшая часть молекулы гемоглобина, состоящей примерно из 10000 атомов, приходится на долю белкового компонента.
ольшая часть молекулы гемоглобина, состоящей примерно из 10000 атомов, приходится на долю белкового компонента.
Э
Рис.2 Схематизированное изображение молекулы гемоглобина в «разобранном» виде. (McGilvery, 1970)
тот компонент состоит из четырех отдельныхполипептидных цепей, в состав каждой из которых входит более 140 аминокислотных остатков. Путем химического анализа установленыоаминокислотные0последователь-ности полипептидных цепей.При помощи рентгеноструктурного анализа было установлено пространственное расположение этих цепей (Дж. Кендрью, М. Перутц, Нобелевская премия 1962 г.)
Вся молекула имеет приблизительно сферическую форму. Гемовые группы, изображенные в виде красных дисков, располагаются в нишах вблизи поверхности. [3]
Глобин относится к олигомерным белкам (состоящим из нескольких отдельных полипептидных цепей, которые связаны между собой нековалентными связями) и является тетрамером. Молекула состоит из двух одинаковых частей, каждая из которых включает две полипептидные цепи (α–, содержат каждая 141 аминокислотный остаток и β–, содержат по 146 аминокислотных остатков). α– и β–цепи во многом сходны между собой, во многих последовательностях содержат одинаковые аминокислотные последовательности. Соответственно, гемоглобин диссоциирует на четыре субъединицы (протомера) примерно одинакового молекулярного веса, в состав каждой из которых входит одна полипептидная цепь и один гем. [5]
Диссоциация на две α– и две β–цепи как правило обратима, и может быть обусловлена присутствием солей, мочевины или резким изменением рН. После удаления этих факторов происходит автоматическая асоциация исходной молекулы гемоглобина. [5]
Химические свойства
Гемоглобин представляет собой своеобразное химическое вещество, вступающее в обратимое соединение с кислородом при любом его напряжении. [1]
Ключевую роль в активности гемоглобина играет ион железа, расположенный в центре молекулы протопорфирина. В процессе переноса кислорода гемоглобином молекула O2 обратимо связывается с гемом, при этом валентность железа не изменяется.
П
Рис.3 Соединения, образуемые гемом (железо двухвалентное) и окисленным гемом (железо трёхвалентное). Протопорфириновые кольца лежат в одной плоскости.
рисоединяя кислород, гемоглобин (Нb) превращается в оксигемоглобин (НbO2). Оксигемоглобин (НbО2) имеет ярко-алый цвет, что и определяет цвет артериальной крови. Чтобы подчеркнуть тот факт, что валентность железа при этом связывании не меняется, реакцию называют не окислением, а оксигенацией; обратный процесс называется дезоксигенацией. [3]Гемоглобин, отдавший кислород, называют дезоксигемоглобином, или редуцированным гемоглобином (Нb). Именно он определяет вишневый цвет венозной крови. [1]
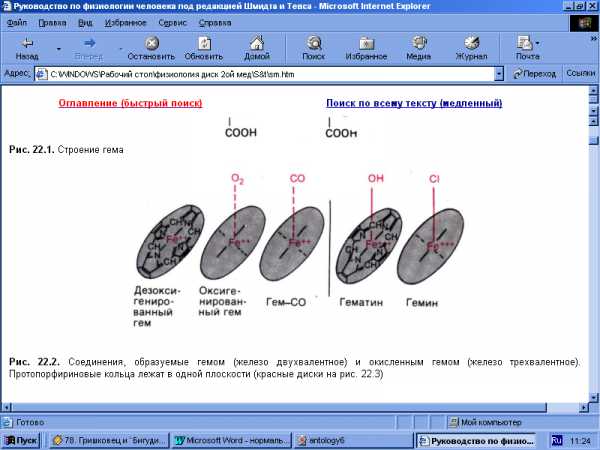
Рис.3 Соединения, образуемые гемом (железо двухвалентное) и окисленным гемом (железо трёхвалентное). Протопорфириновые кольца лежат в одной плоскости.
Гем может подвергаться не только оксигенации, но и истинному окислению при действии сильных окислителей, таких как бертолетова соль, нитробензол, анилин и др. При этом железо становится из двухвалентного трехвалентным, гем приобретает коричневую окраску. [6]
Окисленный гем называется гематином (метгемом), а вся полипептидная молекула в целом – метгемоглобином. Метгемоглобин образуется в организме в естественных условиях, однако в эритроцитах содержится фермент метгемоглобинредуктаза, восстанавливающий его до «нормального» гемоглобина с двухвалентным железом. [4] В крови человека и животных метгемоглобин в норме содержится в незначительных количествах, но при некоторых заболеваниях и отравлениях некоторыми токсинами его содержание возрастает. [3]
В результате истинного окисления гемоглобин прочно удерживает кислород и в итоге перестает быть его переносчиком. При наследственной метгемоглобинемии происходит нарушение равновесия между процессами окисления гемоглобина и метгемоглобина и восстановления гемоглобина. [1]
Реакция связывания гемоглобина с СО2. сложнее, чем присоединение 02. Это объясняется прежде всего ролью СO2 в создании кислотно-щелочного равновесия в организме. Механизмы, обеспечивающие транспорт газа, призваны также поддерживать и это равновесие. Гемоглобин, связанный с С02, называют карбогемоглобином. [1]
Гемоглобин особенно легко соединяется с угарным газом — оксидом углерода — СО. Происходит образование карбоксигемоглобина (НbСО), не способного к переносу 02. В этом случае закономерности его реакции те же, что и для кислорода, но химическое сродство СО к гемоглобину почти в 300 раз выше, чем к 02. Это означает, что достаточно в воздухе оказаться небольшому количеству СО, чтобы произошло образование значительного числа связанных молекул гемоглобина. Образовавшееся соединение — блокированный угарным газом гемоглобин — уже не может служить переносчиком кислорода. Так, при концентрации СО в воздухе, равной 0,1%, около 80% гемоглобина крови оказываются связанными не с кислородом, а с угарным газом. В результате в организме возникают тяжелые последствия кислородного голодания (рвота, головная боль, потеря сознания).
Слабые отравления угарным газом являются процессом обратимым: СО постепенно отщепляется и выводится при дыхании свежим воздухом. Использование искусственного дыхания чистым кислородом ускоряет примерно в 20 раз эту реакцию. При концентрации СО, равной 1%, через несколько минут наступает гибель организма. В нормальных условиях на долю НbСО приходится лишь 1% общего количества гемоглобина крови. [1]
При действии соляной кислоты на гемоглобин образуется гемин. В этом соединении железо находится в окисленной трёхвалентной форме. Для его получения каплю высушенной крови нагревают на предметном стекле с кристалликами поваренной соли и 1-2 каплями ледяной уксусной кислоты. Коричневые ромбические кристаллы гемина, хорошо различимые в микроскоп различаются по своей форме у разных видов животных. Данная реакция, получившая название геминовой пробы, может применятся для обнаружения следов крови и их видовой идентификации [6]
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе