Укажите количество изоферментов лактатдегидрогеназы у человека
Лактатдегидрогеназа
Лактатдегидрогеназа (L‑лактат:НАД‑оксидоредуктаза, ЛДГ, КФ 1.1.1.27) является гликолитическим ферментом и катализирует следующую реакцию:
Лактат + НАД Пируват + НАДНМолекула ЛДГ представляет собой тетрамер, состоящий из одного или двух типов субъединиц, обозначаемых как M (англ: muscle) и H (англ: heart). В сыворотке крови фермент существует в пяти молекулярных формах, различающихся по первичной структуре, кинетическим свойствам, электрофоретической подвижности (ЛДГ‑1 быстрее движется к аноду по сравнению с ЛДГ‑5, то есть более электрофоретичеки подвижна). Каждая форма имеет характерный полипептидный состав: ЛДГ‑1 состоит из 4 H‑субъединиц, ЛДГ‑2 — из 3 H‑субъединиц и 1 M‑субъединицы, ЛДГ‑3 представляет собой тетрамер из 2 H‑субъединиц и 2 M‑субъединиц, ЛДГ‑4 содержит 1 H‑субъединицу и 3 M‑субъединицы, ЛДГ‑5 состоит только из M‑субъединиц.
По степени убывания общей каталитической активности энзима все органы и ткани располагаются в следующем порядке: почки, сердце, скелетные мышцы, поджелудочная железа, селезенка, печень, легкие, сыворотка крови.
От того, какой изофермент наиболее представлен, зависит преимущественный способ окисления глюкозы в ткани: аэробный (до CO2 и h3O) или анаэробный (до молочной кислоты). Подобное различие обусловлено разной степенью сродства изоферментов к пировиноградной кислоте. Изоферменты, содержащие в основном H‑субъединицы (ЛДГ‑1 и ЛДГ‑2), обладают низким сродством к пирувату и поэтому неспособны эффективно конкурировать за субстрат с пируватдегидрогеназным комплексом. В результате пируват подвергается окислительному декарбоксилированию и в виде ацетил‑КоA вступает в цикл Кребса. Напротив, изоферменты, обладающие главным образом M‑субъединицами (ЛДГ‑4 и ЛДГ‑5), имеют более высокое сродство к пирувату и, как следствие, превращают его в молочную кислоту. Для каждой ткани установлены наиболее типичные изоферменты. Для миокарда и мозговой ткани основным изоэнзимом является ЛДГ‑1, для эритроцитов, тромбоцитов, почечной ткани — ЛДГ‑1 и ЛДГ‑2. В легких, селезенке, щитовидной и поджелудочной железах, надпочечниках, лимфоцитах преобладает ЛДГ‑3. ЛДГ‑4 находится во всех тканях с ЛДГ‑3, а также в гранулоцитах и мужских половых клетках, в последних дополнительно обнаруживается ЛДГ‑5. В скелетных мышцах изоферментная активность располагается в порядке убывания в ряду: ЛДГ‑5, ЛДГ‑4, ЛДГ‑3. Для печени наиболее характерен изофермент ЛДГ‑5, выявляется также ЛДГ‑4.
В норме основным источником активности ЛДГ в плазме крови являются разрушающиеся клетки крови. В сыворотке активность изоферментов распределяется следующим образом: ЛДГ‑2 > ЛДГ‑1 > ЛДГ‑3 > ЛДГ‑4 > ЛДГ‑5. При электрофорезе между фракциями ЛДГ‑3 и ЛДГ‑4 иногда обнаруживается дополнительная полоса изофермента ЛДГ‑X, данный изофермент локализован в тех же органах, что и ЛДГ‑5.
Для определения общей активности ЛДГ в сыворотке крови используют две группы методов:
1. Спектрофотометрические, основанные на прямом оптическом тесте Варбурга: различие в разности поглощения окисленной и восстановленной форм НАД.
2. Колориметрические:
- динитрофенилгидразиновые, базирующиеся на исследовании содержания пирувата с помощью 2,4‑динитрофенилгидразина:
| ◊ из методов этой группы наиболее точным и чувствительным является метод Нательсона, состоящий в определении концентрации непрореагировавшего в реакции пирувата. Однако вследствие нестабильности раствора пировиноградной кислоты метод не получил широкого распостранения. |
| ◊ метод Севела и Товарека, заключающийся в определении количества образовавшегося пирувата. |
- редоксиндикаторные методы — точны и просты технически, в них используется способность некоторых веществ (индикаторов) менять цвет в реакциях окисления‑восстановления.
Для определения активности изоферментов ЛДГ наиболее распостраненным является электрофоретическое разделение на ацетате целлюлозы и агарозе. Наиболее простыми и быстро выполнимыми являются методы, основанные на различном отношении ЛДГ‑1 и ЛДГ‑5 к температуре, но для получения воспроизводимых результатов требуется точное соблюдение температурных условий, так как у всех изоферментов имеется некоторая тепловая нестабильность. Методы, основанные на химическом ингибировании изоферментов мочевиной или лактатом дают недостаточно достоверные результаты. Хроматографические методы основаны на разной степени адсорбции изоферментов ЛДГ на сефадексе. Возможно определение изоферментов по выбору оптимальной концентрации субстрата для каждого изофермента.
В качестве унифицированных методов определения общей активности ЛДГ выбраны метод по оптимизированному оптическому тесту и метод Севела‑Товарека; для изучения изоферментной активности — электрофорез на ацетате целлюлозы.
Определение общей активности лактатдегидрогеназы в сыворотке крови методом Севела‑Товарека
Принцип
Пировиноградная кислота, образованная в результате ферментативной реакции, в щелочной среде взаимодействует с 2,4‑динитрофенилгидразином и образует окрашенный комплекс.
Нормальные величины
| Сыворотка | (указанный метод) | 220‑1100 нмоль/с×л или 13‑67 МЕ |
| (оптический тест) | 140‑320 МЕ |
Определение активности фракций ЛДГ с помощью термоингибирования
Принцип
Ферменты, с преимущественным содержанием М‑субъединиц (ЛДГ‑4 и ЛДГ‑5) более термолабильны по сравнению с изоферментами, содержащими H‑субъединицы (ЛДГ‑1 и ЛДГ‑2).
Нормальные величины
| Сыворотка | при 56°С | инактивация на 30% |
| при 65°С | инактивация на 80% |
Определение активности фракций ЛДГ по инактивации мочевиной
Принцип
Заключается в ингибировании мочевиной активности изофермента ЛДГ‑5 почти на 100%.
Нормальные величины
| Сыворотка | (ингибирование мочевиной) | 25‑36% общей активности | |
| (электрофорез на ацетате целлюлозы) | ЛДГ‑1 | 19‑29% общей активности | |
| ЛДГ‑2 | 23‑37% общей активности | ||
| ЛДГ‑3 | 17‑25% общей активности | ||
| ЛДГ‑4 | 8‑17% общей активности | ||
| ЛДГ‑5 | 8‑18% общей активности |
Влияющие факторы
Наркотические анальгетики и другие обезболивающие препараты, этанол, дикумарин завышают результаты исследования. Необходимо избегать гемолиза, так как в эритроцитах активность фермента выше, чем в сыворотке. Оксалаты и мочевина ингибируют фермент.
Клинико‑диагностическое значение
Все заболевания, протекающие с разрушением клеток, сопровождаются резким повышением активности ЛДГ в сыворотке крови. Нарастание общей активности фермента обнаруживается при таких заболеваниях как инфаркт миокарда, некротическое поражение почек, гепатит, панкреатит, воспаление и инфаркт легкого, опухоли различной локализации, повреждения, дистрофия и атрофия мышц, гемолитические анемии и физиологическая желтуха новорожденных, лимфогранулематоз, лейкозы. При инфаркте миокарда начало роста активности фермента в сыворотке крови отмечается на 8‑10 час от момента приступа, максимальное увеличение наступает к 24‑48 часу, нередко в 15‑20 раз превышая норму. Повышенная активность ЛДГ сохраняется до 10‑12 суток от начала заболевания. Степень нарастания активности фермента не всегда коррелирует с размерами поражения сердечной мышцы и для прогноза исхода заболевания может являться лишь ориентировочным фактором. У больных стенокардией активность фермента не изменяется, что позволяет применять тест для дифференциальной диагностики в пределах 2‑3 суток после сердечного приступа.
Наличие органной специфичности ферментов позволяет применять исследование их активности с целью топической диагностики .
| Заболевание | Общая активность ЛДГ | Изоферменты | ||||
| ЛДГ‑1 | ЛДГ‑2 | ЛДГ‑3 | ЛДГ‑4 | ЛДГ‑5 | ||
| Инфаркт миокарда | ++ | + | + | |||
| Заболевания легких | + | + | + | |||
| Вирусный гепатит | + | + | + | |||
| Токсический гепатит | + | + | + | |||
| Цирроз печени | + | + | + | |||
| Миелолейкоз | ++ | + | + | |||
| Гранулоцитоз | ++ | + | + | |||
| Разрушение тромбоцитов(эмболии, гемотрансфузии) | + | + | + | + | ||
| Панкреатит | + | + | + | |||
| Мегалобластическая анемия | +++ | + | + | |||
| Гемолитическая анемия | +++ | + | + | |||
| Почечные заболевания | ++ | + | + | |||
| Миопатия | ++ | + | + |
При заболеваниях печени сыворотка после инкубации при 56°С теряет около 50% своей активности, при 65°С — до 90%. При сердечных поражениях инактивация при 56°С достигает 10%, при 65°С — около 60%. Активность мочевиностабильной фракции при заболеваниях печени снижается до 20% от общей, инфаркт миокарда сопровождается возрастанием свыше 40% активности данной фракции.
Вы можете спросить или оставить свое мнение.
- ВКонтакте
Лактатдегидрогеназа
Лактатдегидрогеназа (ЛДГ, L-лактат: NAD-оксидоредуктаза; К.Ф. 1.1.1.27) – цитоплазматический , Zn-содержащий гликолитический фермент, обратимо катализирующий восстановление пировиноградной кислоты в молочную кислоту:
Фермент широко распространён в организме человека. По степени убыли активности ЛДГ органы и ткани можно расположить в следующей последовательности: почки, сердце, скелетные мышцы, поджелудочная железа, селезёнка, печень, лёгкие, сыворотка крови. ЛДГ содержится в значительном количестве в эритроцитах, поэтому исследуемая сыворотка не должна содержать следов гемолиза. ЛДГ имеет пять изоферментов, представляющих различные комбинации из четырёх субъединиц двух основных типов – Н (от англ. heart – сердце) и М (от англ. muscle – мышца):
ЛДГ1 – 4Н;
ЛДГ2 – 3Н1М;
ЛДГ3 – 2Н2М;
ЛДГ4 – 1Н3М;
ЛДГ5 – 4М.
Изоферменты ЛДГ нумеруются в соответствии с электрофоретической подвижностью по направлению к аноду (рис. 5.2.2). На рисунке показано распределение и относительное количество изоферментов ЛДГ в различных органах. Экстракты нанесены на линию, отмеченную надписью «Старт». При заданных условиях опыта (рН) 4 изофермента ЛДГ движутся к аноду, а один (ЛДГ5) к катоду.
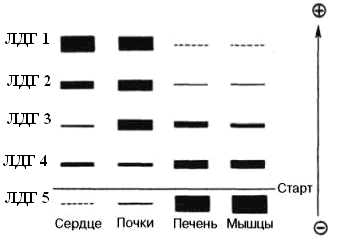
Рис. 5.2.2 Распределение и относительное количество изоферментов ЛДГ в различных органах
Протекание прямой реакции превращения пирувата в лактат обеспечивает М субъединица ЛДГ, протекание обратной реакции – Н субъединица (рис. 5.2.3).
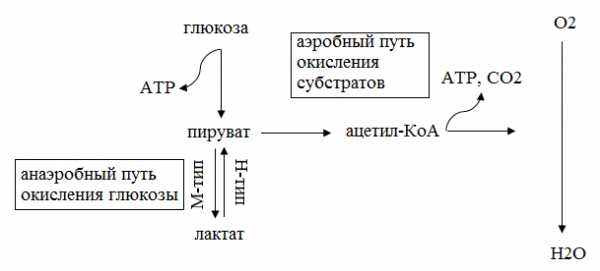
Рис. 5.2.3. Обратимая реакция превращения пирувата в лактат, катализируемая ЛДГ
Изоферментный спектр и тип обмена веществ в ткани коррелируют между собой. Так, в тканях с преимущественно аэробным обменом веществ (мозг, сердце, почки и др.) наибольшей активностью обладают ЛДГ1 и ЛДГ2, в тканях с выраженным анаэробным обменом веществ (печень, скелетная мускулатура и др.) преобладают ЛДГ4 и ЛДГ5. Наиболее высокое содержание ЛДГ3 отмечают в лимфоидной ткани, тромбоцитах и опухолях. Это распределение имеет большой биологический смысл. Изофермент ЛДГ1 in vitro активен при низкой концентрации пирувата и ингибируется его избытком, в то время как ЛДГ5 сохраняет активность при сравнительно высоких концентрациях пирувата. Поскольку восстановление пирувата в лактат, катализируемое ЛДГ1, сильно ингибируется уже небольшими концентрациями пирувата, то в ткани, богатой этим изоферментом, например в сердце, пируват подвергается преимущественно аэробному окислению. Кроме активной переработки собственного (эндогенного) лактата, сердечная мышца способна поглащать лактат из крови, затем превращать его в пировиноградную кислоту и подвергать дальнейшему окислению для пополнения запасов АТР. С другой стороны, в тканях, где преобладают изоферменты ЛДГ4 и ЛДГ5 (печень, скелетная мускулатура), АТР в значительной степени образуется за счёт гликолиза. Высокая активность ЛДГ5 в них обеспечивает быстрое превращение пирувата в лактат, который затем выбрасывается в кровь, поскольку в скелетной мускулатуре дальнейшее превращение лактата почти не осуществляется. Однако в некоторых тканях нет зависимости между типом обмена и изоферментным спектром. Так в эритроцитах, тромбоцитах, хрусталике глаза, где преобладает анаэробный обмен, фермент представлен в основном изоферментами ЛДГ1 ЛДГ2.
Молекулярная масса каждой изоформы ЛДГ составляет 135 кДа (по другим данным 140 кДа), а каждой субъединицы – 34 кДа (по другим данным – 33,5 кДа). Вместо лактата ЛДГ может окислять α-гидроксибутират до α-оксибутирата. Особенно высокую активность в отношении α-гидроксибутирата по сравнению с лактатом проявляет ЛДГ1. Вследствие этого ЛДГ1 обычно измеряют с использованием именно этого субстрата, а данный изофермент (ЛДГ1) имеет второе название – α-гидроксибутиратдегидрогеназа (α-ГБДГ).
Соотношение между изозимами ЛДГ, по данным разных авторов при электрофорезе на ацетатцеллюлозных плёнках составляет у взрослых:
| ЛДГ1 | 19-29% |
| ЛДГ2 | 23-27% |
| ЛДГ3 | 17-25% |
| ЛДГ4 | 8-17% |
| ЛДГ5 | 8-18% |
Это соотношение может изменяться как при адаптации к меняющимся условиям среды, так и в ходе онтогенеза. Эмбрионы всех млекопитающих проходят стадию развития, когда митохондрии ещё не готовы к окислению субстратов. В этих условиях особенно велика роль анаэробного гликолиза. Как показано для развивающихся мышей, на стадии эмбриона основной формой фермента является тетрамер типа М4. После рождения постепенно нарабатываются другие формы ЛДГ, и к периоду, соответствующему взрослому организму, устанавливается соотношение разных изоформ, типичное для каждой ткани.
Клиническое значение определения ЛДГ
Рост общей активности ЛДГ сыворотки крови не несёт достаточно специфической информации. Можно отметить, что общая активность ЛДГ резко повышена при миелобластных и пернициозных анемиях, обширных опухолевых процессах, вирусных гепатитах, шоке и гипоксии. Выраженное повышение наблюдается при циррозах печени, обтупационных желтухах, заболеваниях почек, опорно-мышечного аппарата, опухолях, при сердечной недостаточности. Активность фермента повышается при любых патологических процессах, связанных с цитолизом клеток органов и тканей (например, при инфарктах миокарда, лейкозах, гемолитических анемиях, гепатитах и др.). Определение отдельных изоферментов ЛДГ в сыворотке крови имеет большую диагностическую значимость, чем определение суммарной активности.
Активность ЛДГ1 и ЛДГ2 увеличивается при инфаркте миокарда, различных видах анемий, острых поражениях (некрозах) почечной ткани. Уровень ЛДГ1 повышается при опухолевых заболеваниях яичников. Повышение активности ЛДГ5 выявляется при повреждении скелетных мышц, любых воспалительных или дегенеративных заболеваниях скелетных мышц, многих заболеваниях печени (циррозе, всех типах гепатитов) и при раковых опухолях. Повышение активности изоферментов средней зоны, то есть ЛДГ2 и ЛДГ3 ЛДГ4 встречается при массивном разрушении тромбоцитов (эмболия лёгочной артерии, массивная гемотрансфузия) и вовлечении в патологический процесс лимфатической системы, например, при таких заболеваниях, как инфекционный мононуклеоз, лимфомы, лимфоцитарный лейкоз.
У здоровых новорожденных, в первые дни жизни содержание ЛДГ2 ниже, а содержание ЛДГ5 выше чем у взрослого человека. Максимальная активность фермента наблюдается на 2-4 день жизни. К 6-7 годам соотношение фракций ЛДГ примерно соответствуют таковому у взрослого человека.
Рекомендации по определению ЛДГ:
1. Сыворотка не должна быть гемолизирована, так как ЛДГ содержится в эритроцитах и результаты могут быть завышены;
2. Не рекомендуется использовать в качестве антикоагулянта оксалаты, так как соли щавелевой кислоты являются ингибиторами лактатдегидрогеназной реакции;
3. Рекомендуется использовать свежую сыворотку или плазму крови, лучше плазму, так как ЛДГ много в тромбоцитах и при их разрушении активность ЛДГ повышается.
5. Изоферменты. Строение, биологическую роль, диагностическое значение определения. Изоферменты лактатдегидрогеназы (лдг), креатинкиназы (кк)
Изоферменты– это множественные формы одного фермента, катализирующие одну и ту же реакцию, но отличающие по физическим и химическим свойствам (сродству к субстрату, максимальной скорости катализируемой реакции, электрофоретической подвижности, разной чувствительности к ингибиторам и активаторам, оптимуму рН и термостабильности). Изоферменты имеют четвертичную структуру, которая образована четным количеством субъединиц (2, 4, 6 и т.д.). Изоформы фермента образуются в результате различных комбинаций субъединиц.
В качестве примера можно рассмотреть лактатдегидрогеназу (ЛДГ), фермент, который катализирует обратимую реакцию:
НАДН2 НАД+
пируват ←ЛДГ→ лактат
ЛДГ существует в виде 5 изоформ, каждая из которых состоит из 4-х протомеров (субъединиц) 2 типов М (muscle) и Н (heart). Синтез протомеров М и Н типа кодируется двумя разными генетическими локусами. Изоферменты ЛДГ различаются на уровне четвертичной структуры: ЛДГ1(НННН), ЛДГ2(НННМ), ЛДГ3(ННММ), ЛДГ4(НМММ), ЛДГ5(ММММ).
Полипептидные цепи Н и М типа имеют одинаковую молекулярную массу, но в составе первых преобладают карбоновые аминокислоты, последних – диаминокислоты, поэтому они несут разный заряд и могут быть разделены методом электрофореза.
Кислородный обмен в тканях влияет на изоферментный состав ЛДГ. Где доминирует аэробный обмен, там преобладают ЛДГ1, ЛДГ2(миокард, надпочечники), где анаэробный обмен - ЛДГ4, ЛДГ5(скелетная мускулатура, печень). В процессе индивидуального развития организма в тканях происходит изменение содержания кислорода и изоформ ЛДГ. У зародыша преобладают ЛДГ4, ЛДГ5. После рождения в некоторых тканях происходит увеличение содержания ЛДГ1, ЛДГ2.
Существование изоформ повышает адаптационную возможность тканей, органов, организма в целом к меняющимся условиям. По изменению изоферментного состава оценивают метаболическое состояние органов и тканей.
Изоформы креатинкиназы. Креатинкиназа (КК) катализирует реакцию образования креатинфосфата:
Молекула КК - димер, состоящий из субъединиц двух типов: М (от англ, muscle - мышца) и В (от англ, brain - мозг). Из этих субъединиц образуются 3 изофермента - ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и MB - в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2-36).
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
6. Локализация и компартментализация ферментов в клетке и тканях: ферменты общего назначения, органоспецифические и органеллоспецифические (маркерные) ферменты.
Ферменты по локализации делят на 3 группы:
I– общие ферменты (универсальные)
II- органоспецифические
III- органеллоспецифические
Общие ферментыобнаруживаются практически во всех клетках, обеспечивают жизнедеятельность клетки, катализируя реакции биосинтеза белка и нуклеиновых кислот, образование биомембран и основных клеточных органелл, энергообмен. Общие ферменты разных тканей и органов, тем не менее, отличаются по активности.
Органоспецифичные ферментысвойственны только определенному органу или ткани. Например: Для печени – аргиназа. Для почек и костной ткани – щелочная фосфатаза. Для предстательной железы – КФ (кислая фосфатаза). Для поджелудочной железы – α-амилаза, липаза. Для миокарда – КФК (креатинфосфокиназа), ЛДГ, АсТ и т.д.
Внутри клеток ферменты также распределены неравномерно. Одни ферменты находятся в коллоидно-растворенном состоянии в цитозоле, другие вмонтированы в клеточных органеллах (структурированное состояние).
Органеллоспецифические ферменты. Разным органеллам присущ специфический набор ферментов, который определяет их функции.
Органеллоспецифические ферменты это маркеры внутриклеточных образований, органелл:
Клеточная мембрана: ЩФ (щелочная фосфатаза), АЦ (аденилатциклаза), К-Nа-АТФаза
Цитоплазма: ферменты гликолиза, пентозного цикла.
ЭПР: ферменты обеспечивающие гидроксилирование (микросомальное окисление).
Рибосомы: ферменты обеспечивающие синтез белка.
Лизосомы: содержат гидролитические ферменты, КФ (кислая фосфатаза).
Митохондрии: ферменты окислительного фосфорилирования, ЦТК (цитохромоксидаза, сукцинатдегидрогеназа), β-окисления жирных кислот.
Ядро клетки: ферменты обеспечивающие синтез РНК, ДНК ( РНК-полимераза, НАД-синтетаза).
Ядрышко: ДНК-зависимая-РНК-полимераза
В результате в клетке образуются отсеки (компартменты), которые отличаются набором ферментов и метаболизмом (компартментализация метаболизма).
Среди ферментов выделяется немногочисленная группа регуляторных ферментов,которые способны отвечать на специфические регуляторные воздействия изменением активности. Эти ферменты имеются во всех органах и тканях и локализуются в начале или в местах разветвления метаболических путей.
Строгая локализация всех ферментов закодирована в генах.
Определение в плазме или сыворотке крови активности органо- органеллоспецифических ферментов широко используется в клинической диагностике.
3.6. Лактатдегидрогеназа (лдг)
Лактатдегидрогеназа (ЛДГ; L-лактат-НАД-оксидоредуктаза, КФ 1.1.1.27) - цинксодержаший фермент, катализирует обратимую реакцию восстановления пировиноградной кислоты в молочную кислоту при участии НАД-Н2.
Фермент в кристаллической форме был получен из мышцы сердца. Подобным же образом были получены кристаллические ферментные препараты из скелетных мышц и печени. При рН 7,0 равновесие реакции смещено в сторону образования лактата, в щелочной среде реакция проходит в обратном направлении. ЛДГ может также реагировать с НАДФ в качестве кофермента, но значительно медленнее, чем с НАД.
ЛДГ - тетрамер; два локуса генов кодируют синтез двух олигомеров — М- и Н-субъединиц. М-субъединица синтезируется главным образом в тканях с анаэробным метаболизмом, в то время как Н-субъединица присутствует в тканях с преобладанием аэробных процессов. Молекулярная масса каждой субъединицы составляет 35 кДа, каждого тетрамера - 140 кДа. Полипептидная цепь обеих субъединиц содержит 330 аминокислотных остатков; различия в их последовательности в субъединицах обнаружены на протяжении более чем 25% длины полипептидной цепи. В тетрамерной структуре ЛДГ субъединицы связаны силами ионных и водородных взаимодействий. На каждой субъединице расположен каталитический центр; диссоциация тетрамера на димеры или мономеры приводит к потере ферментативной активности.
В цитоплазме клеток и сыворотке крови ЛДГ имеет 5 изоферментов, обозначаемых в соответствии с их подвижностью к аноду в электрическом поле: ЛДГ1 (НННН), ЛДГ2 (НННМ), ЛДГ3, (ННММ), ЛДГ4 (НМММ) и ЛДГ5 (ММММ). ЛДГ, участвует в окислении лактата в пируват в тканях с аэробным типом метаболизма (миокард, мозг, почки, эритроциты, тромбоциты). ЛДГ5 оптимизирована природой для превращения пирувата в лактат в тканях с высоким уровнем гликолиза (скелетные мышцы, печень). Не все изоферменты ЛДГ гомогенны: при электрофоретическом разделении изоферментов ЛДГ сыворотки и эритроцитов в полиакриламидном геле обнаружено расщепление ЛДГ3 на две полосы, которое позволяет предположить синтез двух форм ЛДГ3 в тканях. Наличие молекулярных структур двух форм, подтвержденное в реакции с антисывороткой, объясняют различием пространственного (цис и транс) расположения Н-субъединиц и М-субъединиц в тетрамере.
В тканях человека активность ЛДГ на 1 г сухой массы уменьшается в последовательности: почки - скелетная мышца – поджелудочная железа — селезенка — печень — плацента. Изоферменты ЛДГ, и ЛДГ2 преобладают в эритроцитах, лейкоцитах, миокарде, почках, ЛДГ4 и ЛДГ5 — в печени, скелетных мышцах, неопластических тканях, наиболее высокое содержание ЛДГ3 отмечают в лимфоидной ткани, тромбоцитах и опухолях.
Свойства изоферментов ЛДГ определены особенностями входящих в них субъединиц. Изоферментам ЛДГ присущи разные кинетические характеристики: рН, при котором они проявляют максимальную активность, сродство к субстратам и кофакторам.
Клиническое значение определения активности ЛДГ
Активность ЛДГ в сыворотке крови повышается при многих патологических состояниях, поэтому для дифференциальной диагностики заболеваний более целесообразно исследовать изменения спектра изоферментов ЛДГ. В настоящее время накоплено большое количество данных о распределении изоферментов ЛДГ в тканях и об изменении спектра изоферментов ЛДГ в сыворотке крови при различных заболеваниях. Изоферментный спектр скелетной мускулатуры показывает преобладание ЛДГ5. При мышечной дистрофии отмечены увеличение более подвижных изоферментов ЛДГ и снижение активности ЛДГ5, что характерно и для многих нейромышечных заболеваний. Причиной изменения спектра изоферментов может быть быстрое удаление малоподвижных изоферментов из циркуляции. Активность ЛДГ5 в сыворотке крови — чувствительный индикатор гепатоцеллюлярного поражения, увеличение его активности обычно наблюдают при гепатите, гипоксии печени (включая застой крови в печени вследствие сердечной недостаточности), лекарственной интоксикации, циррозе, опухолях и травме. Активность ЛДГ в сыворотке крови не повышается при хронических заболеваниях почек и уремии, но иногда возрастает после гемодиализа или плазмафереза, что может быть объяснено удалением из крови ингибиторов (мочевина, оксалаты).
Общая активность ЛДГ при инфаркте миокарда наиболее значительно повышается в течение первых 2 сут после приступа стенокардии и до исходного уровня понижается медленно, в течение 14-16 дней, эпизодическое повышение ЛДГ можно отметить и в более поздние сроки.
Активность ЛДГ подвержена гормональному влиянию. Большие дозы тироксина снижали синтез фермента, при этом в большей мере отмечено ингибирование синтеза субъединицы М. Норадреналин и адреналин вызывают увеличение общей активности ЛДГ с преобладанием активности ЛДГ1, и ЛДГ2. Активность фермента в крови возрастает при действии анаболических стероидов и этанола, а также ряда медикаментозных препаратов — клофибрата, кофеина, сульфаниламидов и др.
Спектр изоферментов ЛДГ может меняться при неопластических процессах. В таких случаях его трудно интерпретировать, так как источником изоферментов ЛДГ служит не только неопластическая ткань, но и ткани, разрушаемые метастазами. Однако изоферментный спектр транссудатов при опухолевом поражении сходен с таковым сыворотки крови, тогда как в воспалительных экссудатах преобладает активность ЛДГ1 и ЛДГ2. Для ЛДГ, как и для других ферментов, при опухолевом процессе характерен синтез изоферментов, свойственных эмбриональным тканям. Недифференцированные эмбриональные ткани имеют спектр изоферментов ЛДГ, в котором преобладают ЛДГ2 и ЛДГ3, а также ЛДГ4. В злокачественных опухолях обнаружено три вида распределения изоферментов ЛДГ. Увеличение содержания ЛДГ4 и ЛДГ5 выявлено при опухолях предстательной железы, матки, молочных желез, желудка, толстой кишки, мочевого пузыря и некоторых типах опухолей мозга. У больных лейкозом, злокачественной лимфомой, нейробластомой, феохромоцитомой, а также при опухолях полости рта, раке бронхов и некоторых типах опухолей мозга увеличена активность ЛДГ2, ЛДГ3, ЛДГ4. Увеличение активности ЛДГ, отмечено в сыворотке крови больных с некоторыми типами опухолей мозга и разными типами опухолей половых органов.
Возможность повышения активности ЛДГ, при опухолевом процессе следует учитывать при диагностике инфаркта миокарда. Иногда при опухолях мозга, раке пишевода, нейробластоме отмечают необычную дополнительную полосу при ЭФ сыворотки крови и ткани опухоли. Определение спектра изоферментов ЛДГ в сыворотке крови при онкологических заболеваниях полезно не только для диагностики, но и для контроля эффективности лечения. Обнаружено, что нормализация спектра изоферментов ЛДГ коррелирует с успешностью ответа больного на лечение.
Наличие осложнений при инфаркте миокарда и сопутствующие заболевания могут изменить спектр ЛДГ и активность ЛДГ. Выявление спектра изоферментов, характерного для инфаркта миокарда, возможно при застое крови в печени и почках вследствие сердечной недостаточности, при ишемическом поражении некоторых органов из-за резкого снижения сердечного выброса. При эмболии легочной артерии, которую в ряде случаев приходится дифференцировать с инфарктом миокарда, увеличение в крови активности ЛДГ2 и ЛДГ3 может быть объяснено выходом ферментов из тромбоцитов, патологией печени, вызванной венозной гипертензией, анемией коркового слоя надпочечников и почек. Поскольку эти нарушения не всегда удается различить, изменение спектра изоферментов ЛДГ интерпретировать непросто.
В сыворотке крови тяжелобольных (как правило, в терминальном состоянии) методом ЭФ на ацетате целлюлозы выявляется дополнительная полоса, более близкая к катоду, чем ЛДГ5, названная ЛДГ6. Во всех наблюдениях в тканях печени, скелетных мышцах, почке, селезенке и надпочечниках также отмечено присутствие ЛДГ6; в ряде случаев появление этой фракции носило транзиторный характер, ЛДГ6 не обнаружена в тканях миокарда. Считают, что нет нозологической формы заболевания, для которой характерна ЛДГ6, но есть тяжелые клинические состояния, обусловливающие ее появление, к которым следует отнести выраженный ацидоз, гипотонию и сепсис.
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе