Проведение проб на скрытую кровь
Методы проведения проб на скрытую кровь Амидопириновая проба
• Приготовление раствора. Смешивают равные количества 5% спиртового раствора амидопирина, 30% уксусной кислоты и 3% раствора перекиси водорода (по 2-3 мл).
• Техника проведения. На стерильную вату наносят полученную смесь и протирают поршень шприца, цилиндр с наружной стороны, иглы, канюлю внутри. Затем заливают реактивы в цилиндр шприца, пропускают их через шприц на вату, проверяя цилиндр. Надевают иглу и делают то же самое, проверяя иглу. При наличии крови на вате появляется сине-зеленое окрашивание. Оно может появиться и при реакции на тройной раствор, хлорамин, лекарственные вещества.
Азопирамовая проба
• Техника проведения. Готовят 1,0-1,5% раствор солянокислого анилина в 95% растворе спирта этилового. Его хранят в холодильнике до 2 месяцев, вне холодильника - не более месяца. Перед постановкой пробы смешивают равные объемы азопирама и 3% раствора перекиси водорода.
• Техника проведения. Смесь использовать в течение 1-2 ч. Не проверять горячие инструменты, не держать раствор возле нагревательных приборов и на ярком свету. При попадании реактива на кровь в течение 1 мин появляется фиолетовое окрашивание.
Инструменты, после операции у больных с анаэробной инфекцией, дезинфицируют в 6% растворе перекиси водорода в течение 60 мин, а затем они проходят стандартную предстерилизационную подготовку, как и другие инструменты.
Укладка и подготовка к стерилизации
Инструменты стерилизуют воздушным (в сухожаровых шкафах), паровым (автоклавирование) и химическим методами. Для стерилизации в сухожаровых стерилизаторах инструменты помещают в металлические коробки (при снятых крышках, крышки стерилизуют рядом) или в упаковку из бумаги мешочной непропитанной (закладывают уже высушенные инструменты), или выкладывают их на специальные решетки стерилизатора и производят просушку инструментов при температуре - 80-85 °С, при открытой дверце стерилизатора, до полного испарения влаги с инструментов (рис. 4-2, рис. 4-3). Для стерилизации паром под давлением инструменты кладут в металлические биксы (выстланные двухслойной хлопчатобумажной простынкой (рис. 4-4, рис. 4-5) или двойные полотняные мешки (изготовленные из бязи).

Рис. 4-2. Общий вид сухожарового стерилизатора

Рис. 4-3. Общий вид сухожарового стерилизатора с хирургическими инструментами на решетках стерилизатора (с целью просушки)

Рис. 4-4. Общий вид загруженного металлического бикса

Рис. 4-5. Общий вид загруженного биксами парового стерилизатора
Перед химическим методом стерилизации хирургические инструменты, после предстерилизационной обработки, выкладывают на чистые простыни и производят просушку при комнатной температуре до полного испарения влаги с поверхностей инструментов.
Стерилизация хирургических инструментов
Инструментарии для медицинских манипуляций по риску имеют следующие различия.
• Критические - проникают в стерильные ткани или сосуды: имплантаты, скальпели, иглы, другие хирургические инструменты и т.д. Стерилизация - спороцидные химические вещества, длительный контакт.
• Полукритические - соприкасаются со слизистыми оболочками (за исключением стоматологических инструментов): гибкие эндоскопы, ларингоскопы, эндотрахеальные трубки, а также другие аналогичные инструменты. Дезинфекция высокого уровня - спороцидные химические вещества, кратковременный контакт.
Термометры, ванны для гидротерапии. Дезинфекция среднего уровня - больничные дезинфицирующие средства с указанием в маркировке о наличии туберкулоцидной активности.
• Некритические - (соприкасаются с неповрежденной кожей): стетоскопы, настольные приборы, подкладные судна и др. Дезинфекция низкого уровня - больничные дезинфицирующие средства без указания в маркировке о наличии туберкулоцидной активности.
Стерилизация хирургических инструментов осуществляется несколькими методами: воздушным (сухожаровые шкафы), паровым (автоклавирование) и химическим.
Воздушный - производится в воздушных стерилизаторах, которые находятся в стерилизационной комнате операционного блока или перевязочных хирургических отделений (рис. 4-6, рис. 4-7), по двум режимам:
• при 180 °С (+2 °С или -10 °С) в течение 60 мин;
• при 160 °С (+2 °С или -10 °С) в течение 150 мин.

Рис. 4-6. Общий вид воздушного стерилизатора снаружи

Рис. 4-7. Общий вид воздушного стерилизатора внутри
Оба режима рекомендуются для изделий из металла, стекла и силиконовой резины.
Паровой - производится в паровых стерилизаторах (рис. 4-8, рис. 4-9), которые располагаются в специальном помещении - автоклавной, по «основному» режиму стерилизации:
• при 132 °С (±2 °С) под давлением 2 атм. (0,2 МПа) в течение 20 мин.
Данный режим стерилизации рекомендуется для изделий коррозийно-стойкого металла, стекла, изделий из текстильных материалов.
Химический - проводится при полном погружении в раствор в закрытых емкостях из пластмассы или покрытых эмалью на время стерилизационной выдержки, после чего изделие должно быть промыто стерильной водой.

Рис. 4-8. Общий вид парового стерилизатора снаружи

Рис. 4-9. Общий вид парового стерилизатора внутри
АЛГОРИТМ ПОСТАНОВКИ ПРОБ НА СКРЫТУЮ КРОВЬ
И МОЮЩЕЕ СРЕДСТВО.
I. Подготовка к манипуляции:
1. Приготовьте реактив:
Азопирам,
Фенолфталеин.
2. Приготовьте пипетку, салфетку, лоток.
3. Возьмите 1% инструментов от общего количества для проведения проб.
II. Выполнение манипуляции:
1. Наберите реактив в пипетку, капните на поршень, в иглу.
2. Налейте реактив в цилиндр, продвиньте поршень.
3. При наличии скрытой крови или моющего средства цвет реактива изменится.
4. Окрашивание, наступившее позже, чем через минуту, не учитывайте. При положительной пробе окраска будет следующей:
азопирамовая - фиолетовая, быстро переходящая в розово-сиреневую.
При положительной пробе на скрытую кровь изделия обрабатываются с первого этапа до получения отрицательного результата.
Проба на наличие моющего средства - фенолфталеиновая.
Готовят 1%-ый раствор фенолфталеина. Наносят на вымытое изделие одну-две капли раствора. При наличии остаточных количеств моющего средства появится розовое окрашивание. Обработку изделия повторяют со II этапа до получения отрицательного результата.
III. Окончание манипуляции:
1. Уберите оснащение для проведения проб.
2. Продолжайте предстерилизационную очистку проверенного инструментария и шприцев.
ВНИМАНИЕ!Все дезсредства готовятся с соблюдением правил техники безопасности, в индивидуальных средствах защиты.
При приготовлении дезрастворов обращайте внимание на форму выпуска и единицу измерения дезсредства (порошкообразные – в граммах, твердые - в таблетках, жидкие (концентраты, растворы) – в миллилитрах).
ü Для приготовления растворов хлорамина возьмёте порошка: 1% р-р – 10 граммов, 3% р-р – 30 граммов, 5% р-р – 50 граммов и до литра дольёте необходимое количество воды.
ü При приготовлении дезрастворов из хлорсодержащих таблеток (Жавель, Нью-жавель, Жавелион, Пюржавель и т.д) 0,1% р-р -7 таблеток на 10 литров воды, 0,015% р-р – 1 таблетка на 10 литров воды.
ü Для приготовления растворов из концентрата ( Ника –экстра М, Бриллиант, Экобриз, Амексан, Аламинол. и т.д.) возьмёте: 1% р-р -100 мл. на10 литров воды.
В ЛПУ дезсредства меняются каждые 2 – 3 месяца. При приготовлении дезрастворов из не известных Вам средств, внимательно изучите инструкцию и воспользуйтесь таблицами приготовления растворов различной концентрации.
Режим дезинфекции различных объектов
Растворами средства «Ника - экстра М».
Дезинфицирующее средство с моющим эффектом.
| Режим обеззараживания | Концентрация р-ра (%) | К-во мл Ника-экстра на 10 л воды | Время обеззараживания (мин) | Способ обеззараживания |
| Поверхности в помещениях, поверхности приборов, аппаратов, жесткая мебель | Протирание, Орошение | |||
| Посуда без остатков пищи | Погружение | |||
| Белье, не загрязненное выделениями | Замачивание | |||
| Белье, загрязненное выделениями | Замачивание | |||
| Предметы ухода за больными | Протирание двукратное или погружение | |||
| Уборочный инвентарь | Протирание двукратное или погружение | |||
| Санитарно-техническое оборудование | Протирание 2х кратное через 15 мин |
Режим дезинфекции различных объектов
Растворами средства «Бриллиант»
(применяется и для предстерилизационной очистки инструментария)
| Объекты обеззараживания | Концентрация р-ра (%) | Кол-во мл «Бриллианта» на 10 л воды | Время обеззараживания (мин) | Способ обеззараживания |
| Изделия медназначения из металлов, стекла, пластмасс, резин | Погружение | |||
| Предметы ухода за больными из стекла, пластмасс, резин | Погружение или двукратное протирание с интервалом 15 мин | |||
| Поверхности в помещениях, жесткая мебель, поверхности приборов, аппаратов | Протирание | |||
| Санитарно-техническое оборудование | Двукратное протирание или орошение с интервалом 15 мин | |||
| Уборочный инвентарь | Протирание, замачивание | |||
| Эндоскопы | Погружение |
Режим дезинфекции различных объектов
Растворами средств Нью-жавель, Жавелион, Пюр-жавель,
И подобными хлорсодержащими
| Объекты обеззараживания | Концентрация рабочего раствора (%) | Колич-во таблеток на 10 л воды | Время обеззараживания (мин). | Способ обеззараживания |
| Соматические, хирургические, процедурные кабинеты, лаборатория | 0,015 | Протирание и орошение | ||
| Поверхности в помещениях, жесткая мебель | 0,015 | Протирание | ||
| Санитарно-техническое оборудование | 0,06 | Протирание | ||
| Посуда без остатков пищи | 0,015 | Погружение | ||
| Посуда с остатками пищи | 0,1 | Погружение | ||
| Белье не загрязненное | 0,015 | Замачивание | ||
| Белье, загрязненное | 0,1 | |||
| Предметы ухода за больным (из стекла, пластмасс, резины) | 0,06 | Погружение | ||
| Изделия мед. назначения из коррозийных металлов пластмасс, резины, стекла | 0,06 | Погружение | ||
| Уборочный инвентарь (ветошь) | 0,1 | Замачивание | ||
| Резиновые коврики | 0,1 | Погружение | ||
| Генеральная уборка | 0,1 |
Срок годности рабочих растворов 3 суток
Дезинфекция может производиться с добавлением моющего средства - 0,5%
Режим дезинфекции различных объектов
Растворами средства «Жавель-Клейд»
| Объекты обеззараживания | Концентрация р-ра (%) | Кол-во таблеток на 10 л воды | Время обеззараживания (мин). | Способ обеззараживания |
| Изделия медназначения из коррозионно-стойких металлов, стекла, пластмасс, резин | 0,1 | Погружение | ||
| Предметы ухода за больными из стекла, пластмасс, резин | 0,1 | Погружение или протирание | ||
| Посуда без остатков пищи | 0,015 | Погружение | ||
| Белье, загрязненное выделениями | 0,2 | Замачивание | ||
| Белье, загрязненное кровью | 0,2 | Замачивание | ||
| Белье, не загрязненное выделениями | 0,015 | Замачивание | ||
| Поверхности в помещениях, жесткая мебель поверхности приборов, аппаратов | 0,015 | Протирание или орошение | ||
| Санитарно-техни-ческое оборудование | 0,06 | Двухкратное протирание через 15 мин | ||
| Уборочный инвентарь | 0,3 | Протирание двухкратное, замачивание |
ОБРАБОТКА РУК
Впервые обработка рук для профилактики раневой инфекции была применена английским хирургом Джозефом Листером (J. Lister) в 1867 году. Обработка рук хирурга осуществлялась путём дезинфекции их раствором карболовой кислоты (фенола). Помимо этого, Листер использовал раствор карболовой кислоты для орошения инструментария, перевязочного материала и для распыления в воздухе над операционным полем.
Метод сэра Джозефа Листера (1827-1912) стал триумфом медицины 19-го века. В 21-м столетии обработка рук — этот простой метод профилактики инфекций (в первую очередь кишечных) — к сожалению, зачастую игнорируется как населением, так и некоторыми медицинскими работниками.
Между тем, правильная и своевременная обработка рук является залогом безопасности медицинского персонала и пациентов.
Обработка рук делится на три уровня:
- Бытовой уровень (механическая обработка рук)
- Гигиенический уровень (обработка рук с применением кожных антисептиков)
- Хирургический уровень (особая последовательность манипуляций при обработке рук с последующим одеванием стерильных перчаток)
Механическая обработка рук
Цель бытового уровня обработки рук — механическое удаление с кожи большей части транзиторной микрофлоры (антисептики не применяются).
Подобная обработка рук проводится:
- после посещения туалета;
- перед едой или перед работой с продуктами питания;
- перед и после физического контакта с пациентом;
- при любом загрязнении рук.
Необходимое оснащение:
- Жидкое дозированное нейтральное мыло или индивидуальное одноразовое мыло в кусочках. Желательно, чтобы мыло не имело резкого запаха. Открытое жидкое или брусковое многоразовое неиндивидуальное мыло быстро инфицируется микробами.
- Салфетки размером 15х15 см одноразовые, чистые для промокания рук. Использование полотенца (даже индивидуального) не желательно, т. к. оно не успевает просохнуть и, кроме того, легко обсеменяется микробами.
Правила обработки рук:
Снимаются с рук все украшения, часы, поскольку они затрудняют удаление микроорганизмов. Руки намыливаются, затем ополаскиваются тёплой проточной водой и всё повторяется сначала. Считается, что при первом намыливании и ополаскивании тёплой водой микробы смываются с кожи рук. Под воздействием тёплой воды и самомассажа поры кожи открываются, поэтому при повторном намыливании и ополаскивании смываются микробы из раскрывшихся пор.
Тёплая вода способствует более эффективному воздействию антисептика или мыла, в то время как горячая вода удаляет с поверхности рук защитный жировой слой. В связи с этим следует избегать употребления слишком горячей воды для мытья рук.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Пробы на скрытую кровь
14 .2
Для ее проведения используют три реактива: 5 % спиртовой раствор амидопирина, 3 % раствор перекиси водорода и 3 % раствор уксусной кислоты.
Тремя разными пипетками (промаркированными для каждого реактива) берут 2—3 мл каждого реактива и смешивают в небольшой емкости. Затем чистой пипеткой 1—2 капли смеси реактивов наносятся на исследуемый инструмент, иглу, шприц и т. д.
При наличии кровяных загрязнений появляется сине-зеленое окрашивание, в связи с чем необходима повторная обработка инструментов.
Бензидиновую пробу ставят в двух модификациях:
1) с гидрохлоридом бензидина: 0,5—1 % раствор гидрохлорида бензидина, приготовленного на дистиллированной воде, смешивают с равным количеством 3 % раствора перекиси водорода;
2) с сульфатом бензидина. В раствор, состоящий из 5 мл 50 % уксусной кислоты и растворенного в ней сульфата бензидина (0,025 г) , добавляют 5 мл 3 % раствора перекиси водорода.
Техника постановки пробы та же, что и амидопириновой, т. е. пипеткой наносят раствор на рабочие части инструментов. Окрашивание раствора в зеленый или желтый цвет является признаком наличия на инструментах скрытой крови.
Амидопириновая проба: правила проведения и оценки результата :
Амидопириновая проба – один из методов контроля предстерилизационной очистки медицинских инструментов. После применения моющих растворов на медицинских инструментах не должно оставаться следов белка, жира, крови и других загрязнений. Определить это невооруженным глазом невозможно: на помощь приходят химические реакции. Амидопириновая проба позволяет с точностью определить наличие скрытой крови. В статье рассмотрим правила и порядок ее проведения.
Реагенты
Раствор для амидопириновой пробы может изготавливаться непосредственно перед применением или же заранее. Поместив смесь во флакон с притертой пробкой в холодильник, ее можно хранить на протяжение одного месяца. Это достаточно удобно: не нужно каждый раз тратить время на приготовление раствора.
Для проведения амидопириновой пробы необходимы следующие вещества:
- раствор перекиси водорода 3%;
- раствор уксусной кислоты 30%;
- спиртовой раствор амидопирина 5%.
Перед использованием следует проверить срок годности каждого из реагентов. Дополнительно для проведения реакции понадобятся: мензурка, лоток с сухими инструментами, приготовленными для пробы, лоток с ватными тампонами и пипетки. Все используемые емкости должны быть стерильны.
Метод приготовления и использования
Амидопириновая проба довольно легко проводится: не требуется никаких особых навыков, только четкое следование инструкции. Приготовив все реактивы, емкости и приспособления, следует приступить к процедуре. Для этого используется следующий алгоритм:
- В равных количествах смешать реагенты: уксусную кислоту (р-р 30%), перекись водорода (р-р 3%), амидопирин (спиртовой р-р 5%). При этом каждое из веществ набирать отдельной промаркированной для этих целей пипеткой. Например, пипетка для раствора перекиси водорода должна быть отмечена как «Для Н2О2».
- Раствор перемешать. Получается бесцветная жидкость. Взяв отдельную пипетку («Для реактива»), набрать смесь и нанести на сухие предметы, которые прошли предстерилизационную очистку. Раствор капать равномерно по всей площади исследуемого инструмента, в том числе на корпус, во внутреннюю полость, в просвет иглы и т. д.
- Держать предмет над стерильной салфеткой или ватой, внимательно наблюдать за тем, какого цвета раствор стекает с инструмента.
- Для проверки очистки многоразовых шприцев раствор набирают в него и медленно по капле выдавливают на чистую салфетку, наблюдая за изменением оттенка.
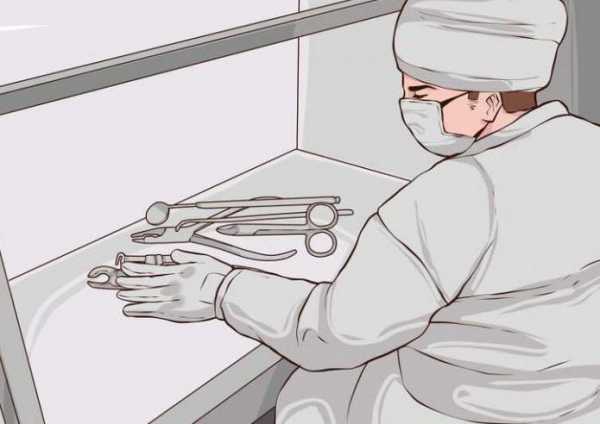
На данном этапе важно соблюсти правила стерильности всех используемых для приготовления и нанесения раствора инструментов. Результаты пробы не должны быть искажены, потому как для соблюдения правил асептики необходима, в частности, амидопириновая проба. Инфекции, которые могут содержаться в остатках крови, нередко становятся серьезной угрозой для жизни и здоровья населения.
Завершение пробы
После нанесения реагента на инструменты в течение минуты необходимо оценить результат. Если за 60 секунд произошло окрашивание, проба считается положительной. Изменение цвета в промежуток времени после 1 минуты не засчитывается. Положительная амидопириновая проба определяется в том случае, если раствор окрасился в фиолетовый (сине-зеленый) цвет. Отрицательная – если оттенок раствора не изменился после нанесения его на инструментарий.

После получения результатов в случае обнаружения остатков крови (положительная проба) всю партию инструментов снова подвергают предстерилизационной очистке. Если цвет жидкости не изменился, то проверяемый инструмент опускают в мыльный раствор. Затем всю партию направляют на стерилизацию установленным методом.
Амидопириновая проба действие оказывает подобно индикатору, она чувствительна к компонентам крови. К проведению предстерилизационной очистки выдвигается ряд требований. На инструментах не должно оставаться следов жира, крови, мыльного раствора и других посторонних веществ. Проверить качество очистки помогают различные пробы. Амидопириновая - одна из них.
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе