Иммунный статус это
Иммунный статус - это... Что такое Иммунный статус?
Имму́нный ста́тус — это комплексный показатель состояния иммунной системы, это количественная и качественная характеристика состояния функциональной активности органов иммунной системы и некоторых неспецифических механизмов противомикробной защиты.
Методы оценки
Клинико-лабораторный этап
- Сбор и оценка иммунологического анамнеза (частота инфекционных заболеваний, характер их течения, выраженность температурной реакции, наличие очагов хронической инфекции, реакции на вакцинации или введение лекарственных средств);
- Оценка результатов общего клинического анализа крови (содержание гранулоцитов, моноцитов, лимфоцитов);
- Выявление с помощью бактериологических, вирусологических и серологических исследований бактерионосительства и вирусоносительства.
Лабораторно-иммунологический этап
На лабораторно-иммунологическом этапе исследования иммунного статуса применяются тесты ориентировочного и аналитического уровней.
Ориентировочный уровень
На этом уровне выявляются грубые нарушения деятельности иммунной системы. Они включают в себя определение:
Для определения количественного отношения между различными группами лимфоцитов используются меченые моноклональные флюоресцирующие сыворотки к специфическим поверхностным антигенным маркерам, обозначаемым символами CD (claster differentiation).
Таких антигенных маркеров известно несколько десятков, но отдельные из них характерны для того или иного типа клеток:
- рецептор CD3 — рецептор всех Т-лимфоцитов;
- рецепторы CD19, 20, 21, 72 — рецептор В-лимфоцитов;
- рецептор CD4 — рецептор Т-хелперов;
- рецептор CD8 — рецептор Т-киллеров;
- рецептор CD16 — рецептор NK-клеток (натуральных киллеров).
Для оценки фагоцитарной активности нейтрофилов крови определяют количество фагоцитирующих клеток и фагоцитарный показатель, то есть среднее количество микробных клеток, поглощенных одним лейкоцитом.
Концентрацию (уровень) иммуноглобулинов разных классов в сыворотке крови определяют в реакции преципитации в геле с антиглобулиновыми сыворотками. На сегодняшний день считается, что такая методика имеет погрешность в измерении до 15 %.
Аналитический уровень
На этом уровне проводится более глубокий анализ состояния иммунной системы. На этом уровне осуществляется определение отдельных субклассов иммуноглобулинов и В-лимфоцитов, регуляторных и эффекторных клеток. Также на этом этапе можно определить концентрации отдельных цитокинов — главных регуляторных молекул, определяющих тип иммунного ответа.
Примечания
Иммунный статус человека: два типа иммунитета, иммунный статус взрослого и ребенка, описание, иммунограмма
Понятие иммунной системы включает в себя множество  различных составляющих. Это клетки, органы, процессы, которые должны слаженно взаимодействовать. Как и все остальные вещи, иммунные показатели поддаются оцениванию по количеству и качеству. Результаты этих количественно-качественных измерений и составляют иммунный статус человека.
различных составляющих. Это клетки, органы, процессы, которые должны слаженно взаимодействовать. Как и все остальные вещи, иммунные показатели поддаются оцениванию по количеству и качеству. Результаты этих количественно-качественных измерений и составляют иммунный статус человека.
Если возникают болезни, это значит, что иммунной системе произошел сбой. Для того, чтобы выявить, где именно возникли проблемы, и решить быстро и с наименьшими потерями, необходимо устанавливать иммунный статус. Делается это с помощью специального исследования – иммунограммы. Без нее любое лечение будет напоминать поиски в темноте. Выделяют два типа иммунитета: клеточный и гуморальный. Каждый процесс запускается в своем, особом случае. Гуморальный иммунитет – это защита от вирусов и бактерий, а клеточный – это действие против грибка, рака, паразитов. Поэтому состояние этих видов иммунитета чрезвычайно важно для установления иммунного статуса. Как уже было сказано, иммунитет – это совокупность многих клеток и процессов, поэтому лишь их правильное и эффективное взаимодействие может обеспечить нормальный иммунный статус.
Гуморальный иммунитет – это тот, кто защищает нас от вирусов и бактерий. Проникновение вражеских микроорганизмов в кровь человека запускает защитные механизмы. Из плазматических клеток начинают образовываться антитела, которые и уничтожают незваного гостя. Также антитела запускают другие защитные реакции в организме и помогают поддерживать иммунный статус человека на нужном уровне. Клеточный иммунитет необходим для защиты от других напастей – онкологических заболеваний, грибковых и паразитарных инфекций. Реакции этого вида защиты происходят уже в других клетках – клетках лимфоидной системы. Т-клетки отвечают за ликвидацию чужеродных клеток.
Деление на клеточный и гуморальный виды иммунитета является достаточно условным, поскольку многие клетки принимают участие и в тех, и в других процессах. Этот факт еще раз доказывает, что иммунный статус человека зависит от того, насколько эффективно будут взаимодействовать между собой клетки иммунной системы.Исследований, определяющих иммунный статус, сегодня достаточно много – это и анализы крови, и исследования щитовидной железы методом биопсии, и многие другие. Следует помнить, что такие анализы как биопсия могут назначаться лишь тогда, когда есть риск злокачественных опухолей.
Иммунный статус ребенка
 Основным фактором, определяющим иммунный статус ребенка, является его наследственность. Чем болели родители, как протекала беременность, находился ли ребенок на грудном вскармливании – ответы на все эти вопросы имеют огромное значение для лечения. Определяя иммунный статус ребенка и его родителей, не стоит забывать о том, что все ошибки иммунитета находят свое отражение в коде ДНК, поэтому еще во время зачатия через гены мы передаем будущему ребенку некоторые патологии. Можно ли это исправить? Есть ли способ защититься от заболеваний самому и улучшить иммунный статус ребенка на уровне ДНК? Не так давно на все эти вопросы ответ был отрицательный, но сегодня все изменилось в лучшую сторону.
Основным фактором, определяющим иммунный статус ребенка, является его наследственность. Чем болели родители, как протекала беременность, находился ли ребенок на грудном вскармливании – ответы на все эти вопросы имеют огромное значение для лечения. Определяя иммунный статус ребенка и его родителей, не стоит забывать о том, что все ошибки иммунитета находят свое отражение в коде ДНК, поэтому еще во время зачатия через гены мы передаем будущему ребенку некоторые патологии. Можно ли это исправить? Есть ли способ защититься от заболеваний самому и улучшить иммунный статус ребенка на уровне ДНК? Не так давно на все эти вопросы ответ был отрицательный, но сегодня все изменилось в лучшую сторону.
На сегодняшний день медицинская наука располагает препаратом, который обладает уникальными качествами. Это разработка американской компании 4Life, которая направлена на укрепление главного бастиона нашего организма – иммунной системы. В основе его работы лежит принцип передачи иммунной информации от матери к ребенку. Это те данные, без которых ни одна иммунная клетка не сможет правильно функционировать. Эта информация, в которой описаны все действия иммунной системы – распознавание вражеских микроорганизмов, их уничтожение, выведение из организма продуктов распада. Откуда же берется эта информация? В природе у всех млекопитающих среди иммунных клеток имеются особые пептидные клетки, которые отвечают за накопление и транспортировку иммунной памяти. Клетки эти названы трансфер факторами или факторами переноса. В организме они обучают иммунитет корректной работе на благо здоровья. На этом принципе и основано действие препарата Трансфер фактор, курс лечения которым можно сравнить со сверхинтенсивным курсом повышения квалификации для иммунных клеток. После этого они сами начинают «понимать» как, на кого, когда и где нужно реагировать. Это воздействие на самом высоком, информационном уровне, которое не воздействует напрямую ни на один орган или систему организма. Этот принцип «невмешательства» делает Трансфер фактор очень безопасным и подходящим для приема с другими лекарственными препаратами.
Министерство Здравоохранения и Социального развития России одобряет и рекомендует данный иммуномодулятор абсолютно всем, кто нуждается в улучшении своего иммунного статуса. Он подходит для профилактики заболеваний, а так же в комплексном лечении самых разных болезней, а также во время восстановления и реабилитации. Трансфер фактор прошел все клинические испытания, и сегодня доподлинно известно, что его могут принимать все люди, включая тех, кому бывает трудно подобрать эффективное и в то же время безопасное средство в силу их особенностей. Речь идет о беременных женщинах, маленьких детях, включая новорожденных, пожилых людях. Любому человеку в независимости от возраста, пола и заболевания можно без опасений принимать Трансфер фактор. Улучшение иммунного статуса произойдет в рекордно короткие сроки без побочных эффектов и противопоказаний.
КЛИНИЧЕСКАЯ ИММУНОЛОГИЯ: ИММУННЫЙ СТАТУС МАКРООРГАНИЗМА. ОЦЕНКА ИММУНОГО СТАТУСА
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кафедра «Микробиологии, эпидемиологии и инфекционных болезней»
Дисциплина: Медицинская микробиология
Лекция 15
Тема лекции: КЛИНИЧЕСКАЯ ИММУНОЛОГИЯ: ИММУННЫЙ СТАТУС МАКРООРГАНИЗМА. ОЦЕНКА ИММУНОГО СТАТУСА.
Задачи:
1. Изучить возрастные особенности иммунитета.
2. Рассмотреть методики оценки иммунного статуса человека
3. Познакомить с основными факторами, от которых зависит состояние иммунного статуса человека.
План:
| [1] 1. Возрастные особенности иммунитета [1.1] 1.1. Внутриутробный период [1.2] 1.2. Иммунная система новорожденных, детей и подростков [1.3] 1.3. Иммунные факторы грудного женского молока [1.4] 1.4. Иммунная система при старении [2] 2. Иммунный статус человека. [3] 3. Иммунологическое обследование человека [4] 4. Иммунодефицитные состояния. |
Вопросы для повторения:
- Какие особенности иммунитета характерны для периода внутриутробного развития ребенка?
- Назовите иммунные факторы грудного молока.
- Что такое иммунный статус человека?
- Какие методы используются для определения иммунного статуса человека?
Литература для подготовки:
Воробьёв А.А., Быков А.С., Пашков Е.П., Рыбакова A.M. Микробиология (Учебник).- М: Медицина, 1998.
Медицинская микробиология (Справочник) под ред. В.И.Покровского, Д.К.Поздеева. - М: ГОЭТАР, «Медицина», 1999.
Микробиология с вирусологией и иммунологией / Под ред.Л.Б.Борисова, А.М.Смирновой. – М., 1994
Микробиология и иммунология / Под ред.А.А.Воробьева.- М., 1999
Руководство к лабораторным занятиям по микробиологии / Под ред. Л.Б.Борисова.- М., 1984.
Вирусология. В 3-х тт./ Под ред.Б.Филсца, Д.Найпа.- М, 1989.
Месровяну Л., Пунеску Э. Физиология бактерий.- Бухарест: Изд-во Академии наук РПРД960.
Вирусные, хламидийные и микоплазменные заболевания. В.И.Козлова и др.- М.: «Авиценна», 1995.
Лектор Митрофанова Н.Н.
1. Возрастные особенности иммунитета
В онтогенезе иммунной системы человека различают несколько периодов (табл.1).
Таблица 1
Основные периоды онтогенеза иммунной системы
| Период | Характеристика | Сроки |
| I | Закладка первичных органов и начальная дифференциация клеток иммунной системы | 6 нед. - 9 мес. (эмбрион-плод) |
| II | Совершенствование и формирование зрелой иммунной системы | С момента рождения до 16-18 лет |
| III | Зрелость, максимальная функциональная активность иммунной системы | От 16-18 до 55-60 лет |
| IV | Старение, снижение функции иммунной системы | После 55-60 лет |
У детей и женщин возникают критические состояния, которые связаны либо с первичными морфо-функциональными изменениями в иммунной системе, либо с перестройкой эндокринной и других систем организма.
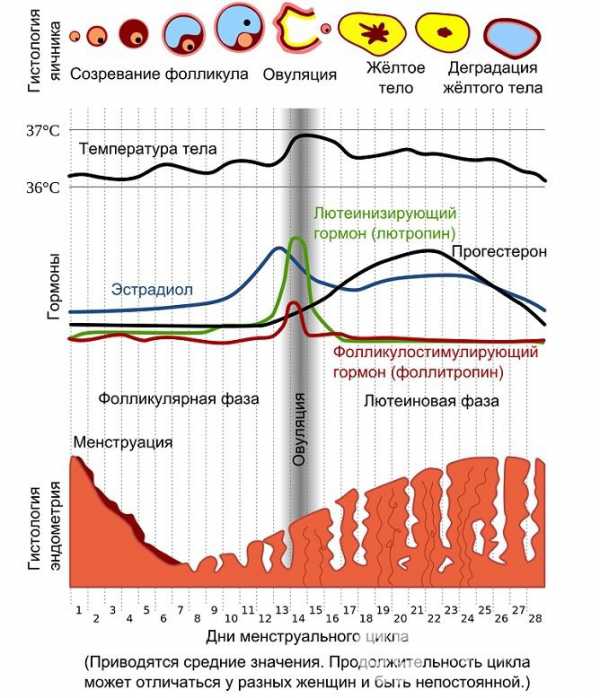
Критические моменты проявляются у женщин во время специфических физиологических состояний — беременность, роды, вскармливание, менопауза.
1.1. Внутриутробный период
С 6-8 недели развития плода начинается закладка и дифференцировка основных органов и клеток иммунной системы. Иммунный аппарат эмбриона и плода чувствителен к повреждающим воздействиям внешней среды. В результате после рождения могут возникать врожденные иммунопатологии (иммунодефицит, аллергия, аутоиммунитет).
В иммунной системе женщины в период беременности происходят существенные физиологические изменения. Имплантация оплодотворенной яйцеклетки в матке (0-15 сут.) и развитие эмбриона (16-75 сут.) недостаточно объяснена с иммунологических позиций, т.к. в их составе присутствуют чужеродные антигены (антигены отца, эмбриональные антигены). Но полного уничтожения сперматозоидов или блокирования имплантации не наблюдается. Этому дают несколько объяснений.
1. Факторы местной защиты слизистых женских половых органов (секреторные Ig А, лизоцим и другие ферменты) умеренно реагируют на мужские половые клетки.
2. Факторы системной иммунореактивности — сывороточные антитела и Т-киллеры — малоэффективны из-за относительной изолированности женских половых путей от общего кровотока.
3. В семенной жидкости мужчин содержатся вещества, ингибирующие иммунные реакции.
И в дальнейшем иммунная система беременной женщины проявляет терпимость к чужеродным антигенам в составе развивающегося плода. Толерантность в этот период обусловлена следующим обстоятельствами:
1. Трофобласт, как плацентарный барьер, изолирует кровоток плода от кровотока матери.
2. Плацента и плод синтезируют вещества, подавляющие реакции отторжения.
3. В организме беременной женщины происходит перестройка цитокиновой регуляции иммунных процессов и запускается избирательная супрессия реакции против чужеродных антигенов плода.
4. Плацента ограждает плод от проникновения В- и Т-лимфоцитов матери на ранних этапах развития эмбриона.
При этом материнские антитела класса IgG свободно проникают через плаценту. Антитела всех других классов такой способностью не обладают.
Особенно активный трасплацентарный транспорт материнских иммуноглобулинов происходит в конце срока беременности. Поэтому в крови доношенных новорожденных очень высокий уровень IgG.
У недоношенных новорожденных этот показатель ниже.
С 10-й недели начинается синтез IgM, с 12-й — IgG, с 30-й — IgA, но концентрация их невелика. Таким образом, к моменту рождения здорового ребенка основную массу антител в его организме составляют материнские IgG.
Вместе с тем еще на внутриутробной стадии развития организма иммунная система реагирует на чужеродные антигены — бактериальные, вирусные и другие — усиленным синтезом преимущественно IgM-антител. Этот феномен имеет важное практическое значение: повышенный уровень IgM в пуповинной крови новорожденного — индикатор внутриутробной антигенной стимуляции, чаще всего результат перенесенной внутриутробной инфекции.
Онтогенез неспецифических факторов резистентности характеризуется ранними сроками их становления в opганизме плода. Начало синтеза некоторых фракций комплемента (С3, С4, С5), интерферона, лизоцима относится к 8-9 неделям беременности. В эти же сроки формируются фагоцитирующие клетки. Но функциональная активность гуморальных и клеточных факторов неспецифической реактивности даже к моменту рождения очень низка. Это связано с несовершенным метаболизмом клеток, которые отвечают за синтез эффекторов данных реакций.
1.2. Иммунная система новорожденных, детей и подростков
Второй период развития иммунной системы (после рождения) характеризуется дальнейшим ее совершенствованием под воздействием факторов внешней и внутренней среды организма. Особое значение для окончательного созревания иммунной системы имеет антигенная стимуляция со стороны микрофлоры и других экзоантигенов.
В процессе развития детей и подростков происходит адаптация иммунной системы к изменяющимся условиям внешней сред и координация иммунологических механизмов с нейроэндокринной регуляцией функций организ ма. Патология иммунитета отражается на работе других органов и систем, а иммунная система реагирует на патологию других систем организма. Она особенно чувствительна к метаболическим нарушениям, которые нарушают работу иммунокомпетентных клеток и продукцию цитокинов.
В иммунной системе детей закономерно происходят критические морфофункциональные сдвиги. Эти этапы в онтогенезе иммунной системы совпадают с переходными периодами общего развития детского организма.
Первый иммунный кризис по времени совпадает с периодом новорожденности, когда организм впервые встречается с огромным количеством чужеродных антигенов. Лимфоидная ткань, клетки, ответственные за механизмы неспецифической реактивности, получают значительный стимул для развития уже в первые часы. Разнообразная микрофлора колонизирует желудочно-кишечный тракт, дыхательные пути, кожу. Если быстро формируется нормальная микрофлора толстого кишечника (с преобладанием бифидобактерий и других анаэробов), то развитие иммунной системы происходит правильно.
В периферических лимфоузлах новорожденного происходит возрастание концентрации плазматических клеток и лимфоцитов, уве личение их массы и функциональной активности.
У детей, рожденных при помощи операции кесарева сечения отмечается отставание в развитии лимфоидной системы. Заселение биотопов организма микрофлорой происходит медленнее, состав микрофлоры отличается от приобретенной при нормальных родах.
На гнотобионтах - животных, выращенных в безмикробных условиях, показано, что их лимфоидный аппарат развит недостаточно из-за отсутствия антигенной стимуляции.
После рождения впервые активно включаются механизмы иммунного реагирования Т- и В-систем. В реакциях преобладает супрессорный компонент.
Количество Т- и В-клеток у новорожденных чаще всего соответствует их содержанию у взрослых.
Главное отличие — функциональная неполноценность регуляторных и исполнительных клеток из-за несовершенства системы цитокиновой регуляции иммунной системы у детей раннего возраста.
Иммунная регуляция осуществляется противовоспалительными цитокинами — ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12, фактором некроза опухоли (ФНО), альфа- и гамма-интерферонами и др. и цитокинами (ИЛ-2, ИЛ-5, ИЛ-7). Другие участвуют на этапе более ранней регуляции миеломоноцитопоэза и лимфопоэза (ИЛ-3, колониестимулирующие факторы). Некоторые цитокины могут осуществлять противоположные эффекты.
Для новорожденных характерен слабый иммунный ответ из-за не- зрелости Т- и В-лимфоцитов, а также в связи с функциональной слабостью фагоцитоза Недостаточно развиты естественные киллеры (ЕК-клетки). Этим, в частности, объясняется низкий уровень гамма-интерферона.
В силу несостоятельности иммунной системы ребенка раннего возраста основные защитные функции выполняют пассивно приобретенные сывороточные и секреторные антитела. Сывороточные антитела в основном представлены материнским IgG. При инфицировании им мунная система новорожденного способна к первичному гумораль ному иммунному ответу с преимущественным синтезом IgM, иммунологическая память еще не функционирует.
Секреторные иммуноглобулины, в основном в виде SIgA, корорые поступают с материнским молоком и осуществляют функцию местного иммунитета в желудочно-кишечном тракте.
Для новорожденных характерна низкая резистентность но отношению к различным бактериям, особенно к условно-патоген ной, гноеродной (слабый фагоцитоз), грамотрицательной (низкая ак тивность системы комплемента и антител) микрофлоре. Отмечается тенденция генерализации гнойно-воспалительных инфекций с переходом в сепсис.
Второй критический период в иммунном статусе ребенка прихо дится на возраст 3-6 мес. Он характеризуется постепенным ослабле нием пассивного гуморального иммунитета из-за уменьшения концен трации материнских иммуноглобулинов. Полное исчезновение материнских антител происходит в возрасте 18 мес.
В это время могут проявляться скрытые до сих пор признаки врожденных иммунодефицитов, нередко развивается ранняя иммунопатология в виде пищевой аллергии.
Из-за отсутствия местного иммунитета слизистых и слабого Т-клеточного иммунного ответа дети остаются высокочувствительными ко многим вирусам, особенно поражающим дыхательные пути.
На вакцинацию организм ребенка 1-го года жизни отвечает в основном продукцией IgM-антител, без формирования иммунологичес кой памяти. Чтобы получить нормальный вторичный иммунный ответ с IgG-антителами и стойкой иммунологической памятью требу ется 2-3 ревакцинации против столбняка, дифтерии, коклюша, полиомиелита.
К концу 1-го года жизни ряд функций иммунной системы нормализуется. Концентрация лимфоцитов в крови достигает максимума, хелперная функция доминирует над супрессорной, начинается более активный синтез IgG. Но способность к полноценному синтезу антител класса IgG появляется только к 4-6 годам. Местный иммунитет слизистых дыхательных путей и пищеварительного тракта окончательно формируется только к 7-8 годам жизни.
Можно дополнительно выделелить критические зоны в возрасте двух лет и 4-6-го годов жизни ребенка. В двухлетнем возрасте собственный иммунитет еще не совершенен, а факторы пассивного иммунитета уже отсутствуют. В это время могут проявиться врожденные дефекты иммунного статуса, а также иные варианты иммунопатологии — аутоиммунный диатез, иммунокомплексные болезни. Часто наблюдаются повторные вирусно-бактериальные инфекции органов дыхания и кишечного тракта.
С первой недели жизни до 4-6 лет формула крови характеризуется абсолютным и относительным лимфоцитозом (физиологический лимфоцитоз). Только к 6 годам у всех детей определяется «взрослый» тип формулы крови. Перестройка гемопоэза у ряда детей может сопровождаться учащением иммунопатологических состояний.
Таким образом, в возрасте 2 и 4-6 лет есть риск развития заболевания преимущественно у детей с врожденной патологией какого-либо звена иммунитета.
Третий иммунный кризис в жизни всех детей связан с гормональной перестройкой организма подростков. У девочек этот этап начинается с 12-13 лет, у мальчиков — с 14-15 лет. В иммунной системе при этом происходят следующие изменения:
- уменьшается масса лимфоидных органов, что связано с пубертатным скачком роста и веса детей;
- подавляется функция Т-системы (клеточный иммунитет)
3. стимулируется функция В-системы (гуморальный иммунитет)
Сдвиги в функции иммунитета обусловлены повышенной секрецией половых гормонов. При этом отмечается половое различие в характере этих сдвигов. У юношей андрогенная стимуляция вызывает увеличение абсолютного числа В-лимфоцитов (CD 19+). У девушек усиление гуморального pвена иммунитета связано с повышением количества и активизацией Тх2.
В антиинфекционной защите организма функции распределяются следующим образом:
- клеточное звено иммунного ответа преимущественно защищает от внут риклеточных паразитических агентов — вирусов, некоторых бакте рий, грибков и простейших;
- гуморальное звено иммунного ответа гарантирует эффективную защиту от внеклеточных паразитов — бактерий и токсинов.
Происходит увеличение количества хронических заболеваний лимфопролиферативной и аутоиммунной природы, при этом активизируются вирусные инфекции и присоединяются новые. Иммунная система становится более чувствительной к действию внешних факторов. Заканчивается формирование иммун ного статуса. У большинства подростков аллергические заболевания протекают легче, чем раньше.
В течение нескольких лет происходит постепенное выравнивание всех систем иммунорегуляции с выходом на «взрослый» фенотип иммунного статуса. Суще ственных различий в иммунной системе женщин и мужчин не отме чается.
1.3. Иммунные факторы грудного женского молока
Грудное женское молоко является идеальной пищей для детей раннего возраста. В нем есть все компоненты, необходимые для организма развивающегося ребенка — белки, аминокислоты, жиры, углеводы, комплекс витаминов, минеральные вещества, гормоны, разнообразные факторы иммунной защиты и неспецифической резистентности.
Только естественное вскармливание материнским молоком обеспечивает максимально возможную для этого возраста резистентность к возбудителям инфекционных болезней и аллергенам. По сравнению с детьми, находящимися на грудном молочном вскармливании, дети, переведённые на искусственное вскармливание, страдают от инфекций в 4 раза чаще, а от кишечных инфекций в 10 раз чаще.
Природа действия грудного молока кормящей женщины заключается в сумме разнообразных иммунных факторов прямого и опосредованного действия.
Иммуноглобулины женского молока. Они представлены классами G, М и А, однако доминирующим является секреторный IgA (SIg A).
SIgA синтезируется В-лимфоцитами в лимфоидных тканях молочной железы женщины и поступает в молоко. Незадолго до конца беременности в молочную железу мигрируют иммунокомпетентные В-клетки из лимфоидных образований кишечника, дыхательных путей и другой локализации. В лимфоидной ткани молочной железы они размножаются и начинают синтезировать SIgA антитела той же специфичности, что и раньше — против возбудителей острых инфекций кишечного, респираторного тракта, мочеполовых путей.
Процесс переселения В-клеток, продуцирующих SIgА , стимулируется и контролируется гормонами и цитокинами. Уровень этих иммуноглобулинов в крови кормящей женщины возрастает в 5 раз.
Динамика концентрации SIgA в грудном молоке в первую неделю после родов связана со сроками созревания молока. Отечественная школа педиатров определяет следующие временные параметры: для молозива — после родов, затем наступает фаза переходного молока – до 6-7 дня, а с начала 2-й недели— зрелого молока.
Молозиво по составу почти идентично тканям новорожденного и поэтому легко усваивается. Это густая, желтоватая жидкость с очень высокой концентрацией белка, аминокислот, липидов и других компонентов. По мере созревания их процентное содержание снижается.
При раннем прикладывании ребенка к груди он сразу получает порции молока с большим содержанием секреторных иммуноглобулинов класса А, лизоцима, лактоферрина, лактопероксидазы, бифидогенных факторов и других веществ, стимулирующих колонизацию кишечника защитной микрофлорой.
Изменение содержания IgA в грудном молоке в целом соответствует указанным выше срокам его созревания. В молозиве отмечен максимальный уровень SIgA— 12-16 мг/мл, со 2-З дня, уровень быстро снижается и к концу первой — началу второй недели стабилизируется на цифре 0,6-1 мг/мл. Такая концентрация SIgA удерживается в зрелом молоке на протяжении 8-9 мес. При неоднок ратном вскармливании в организм ребенка ежедневно поступает 600-1000 мг SIgA. Секреторный иммуноглобулин стабилен при низком уров не рН кишечника и не подвергается ферментативному расщеплению кишечными протеазами.
SIgA локализуется в муциновом слое слизистых оболочек желудочно-кишечного такта. Защитная роль SlgA заключается в экранировании эпителия пищеварительного тракта от чужеродных антигенов . Эта функция реализуется путем специфического связывания секреторными антителами бактерий, вирусов, токсинов и других аллоантигенов. В результате предотвращается адгезия и колонизация бактерий, проникновение в клетки и кровоток вирусов и некоторых инвазивных микробов.
Секреторные антитела класса IgA — главный фактор местного иммунитета пищеварительного тракта против разнообразных бактерий, вирусов и токсинов.
Усилению барьерной функции слизистой кишечника ребенка способствуют и другие гуморальные факторы грудного молока — лизоцим, лактоферрин (он связывает железо, уменьшая его потребление патогенными бактериями), комплемент, пропердин, лактопероксидаза.
От уровня барьерной функции слизистой желудочно-кишечного тракта в значительной мере зависит риск возникновения пищевых аллергических реакций. Если барьер слаб, то в кровь начинают всасываться цельные белки и недостаточно расщепленные пептиды, что провоцирует аллергические расстройства у детей.
В грудном молоке содержатся сывороточные иммуноглобулины классов М, G; А (их уровень существенно ниже, чем уровень SIgA), макрофаги, ЕК-клетки, JB- и Т-лимфоциты, иммуноцитокины (ннтерлейкины, интерферон и др.). Роль этих факторов еще мало изучена.
Вскармливание грудным молоком активирует процесс становления иммунного статуса ребенка, из крови быстрее элиминируются малодифференцированные формы клеток, созревание лимфоцитов протекает более энергично.
Уникальный состав иммунных факторов женского молока, нестоек к термическому воздействию. Даже мягкая пастеризация грудного молока (63°С в течение 30 мин.) инактивирует иммуноглобулины, комплемент, лизоцим, другие ферменты, разрушает клетки.
Поэтому использование пастеризованного донорского женского молока, как и вскармливание различными искусственными смесями, частично позволяет решить задачи питания, но не предуп реждает развития дисбактериоза кишечника и острых кишечных инфекций у детей 1-го года жизни.
1.4. Иммунная система при старении
С возрастом у большинства лиц после 55-60 лет наблюдается постепенное угнетение иммунитета. Скорость этого процесса имеет индивидуальный характер.
Количество Т- и В-клеток при этом не снижается, но изменяется их функциональная активность. У лиц старческого возраста (после 80 лет) особенно страдают функции Т-системы иммунитета, в частности, способность распознавания аллоантигенов макрофагами и лимфоцитами, угнетена активность хелперных Т-клеток (как Тх2, так и Txl), извращена супрессорная функция иммунной системы. Возникает дисбаланс в системе цитокиновой регуляции иммунных реакций .
В связи с расбалансировкой системы физиологической иммунорегуляции при старении возрастает частота злокачественных образований и аутоиммунных нарушений.
Из-за снижения активности метаболических процессов в фагоцитах и других клетках, ответственных за функцию неспецифической реактивности, у пожилых лиц учащаются хронические и вялотекущие бактериальные, вирусные и грибковые инфекции.
Таким образом, типичные болезни старческого возраста связаны с подавлением иммунореактивности вследствие глубоких изменений в популяционной структуре Т-клеток и их функций, а также из-за снижения активности клеток, участвующих в реализации неспецифических клеточных и гуморальных реакций.
2. Иммунный статус человека.
Иммунный статус (иммунный профиль, иммунореактивность) – это структурное и функциональное состояние иммунной системы индивидуума, определяемое комплексом клинических и лабораторных иммунологических показателей.
Иммунный статус характеризует способность иммунной системы к иммунному ответу на определенный антиген в данный момент времени.
Иммунный статус человека подвержен возрастным и суточным колебаниям в зависимости от биоритма.
Иммунная система филогенетически относится к наиболее молодым образованиям и очень лабильна к внешним воздействиям.
На иммунный статус оказывают влияние следующие факторы:
1. климато-геграфические
2. социальные
3. экологические
4. «медицинские»
3. Иммунологическое обследование человека
Иммунологическое обследование человека сводится к оцен ке состояния иммунной системы, выявлению чужеродных или собственных антигенов, обнаружению признаков клеточных и гуморальных специфических иммунных реакций.
Оценка иммунного статуса
Оценка иммунного статуса организма начинается с ориентировочного клинического (первого) этапа, на котором врач собирает и оценивает иммунологический анамнез: частоту инфекционных заболеваний, характер их течения, выраженность температурной реакции, наличие очагов хронической инфекции, признаков аллергизации. Далеe оцениваются результаты клинического анализа крови: содер жание гранулоцитов, моноцитов, лимфоцитов. С помощью бактерио логических, вирусологических и серологических исследований выяв ляется бактерио- или вирусоносительство.
На втором этапе в иммунологической лаборатории проводится исследование крови с использованием иммунологических тестов 1-го и 2-го уровней.
Тесты 1-го уровня позволяют выявить грубые нарушения со сто роны иммунной системы путем определения в крови процентного содержания и абсолютного количества Т- и В-лимфоцитов, уровня иммуноглобулинов крови, оценки показателей неспецифической защиты организма.
Для выявления и подсчета Т- и В-лимфоцитов наиболее точными являются методы, состоящие в выявлении поверхностных маркеров антигенов системы CD.
К этим антигенам биопромышленность готовит стандартные моноклональные антитела и наборы реактивов, позволяющие в иммунолюминесцентных и цитотоксических тестах (см. далее) выявить Т- и В-лимфоциты, их субпопуляции, другие клетки иммунной системы. Так, маркером Т-лимфоцитов служит антиген CD3, В-лимфоцитов – CD22, хелперных Т-лимфоцитов — CD4, цитотоксических лимфоцитов — CD8, естественных киллеров — CD 16, CD56.
Т- и В лимфоциты выявляют также по их способности фиксировать на своей поверхности эритроциты барана или мыши, образуя видимые под микроскопом структуры, именуемые розетками . В-лимфоциты, обладающие рецепторами для иммуноглобулина G и комплемента могут быть выявлены также по способности формировать розетки с эритроцитами, нагруженными этими белками. Содержание в крови здорового взрослого человека Т-клеток — 40-70%, В-лимфоцитов — 10-30% общего числа лимфоцитов. Некоторые лимфоциты (около 5%) не имеют маркеров Т- или В-клеток. Это нулевые лимфоциты, утратившие рецепторы. Их число возрастает при некоторых заболеваниях.
Кроме того, к тестам 1-го уровня относится определение концентрации сывороточных иммуноглобулинов IgM, IgG и IgА. Для этого используются антисыворотки к тяжелым цепям иммунглобулинов разных классов, реакция преципитации (тест иммунедиффузии — см. 19.2) или нефелометрия и турбидометрия, выявляющие взаимодействие иммуноглобулина с антителами по светорассеянию или мутности. Уровень сывороточных иммуноглобулинов функциональное состояние В-системы иммунитета.
Для оценки факторов неспецифической защиты определяют фагоцитарную активность лейкоцитов крови. О фагоцитарной активности судят по способности клеток к фагоцитозу нейтральных частиц латекса, эритроцитов или микробных клеток. При этом вычисляют процент фагоцитирующих клеток (фагоцитарное число) и среднее число частиц поглощенных одним фагоцитом (фагоцитарный индекс).
Тесты 2-го уровня позволяют провести более тщательный анализ для уточнения характера дефекта, выявленного на предыдущем этапе с помощью ориентировочных тестов. К ним относится определение субпопуляций Т-лимфоцитов (CD4+ и CD8+), их соотношений, оценка их функциональной активности, супрессорного потенциала, анализ цитокинов и их рецепторов. Функциональная активность лимфоцитов может быть оценена по количеству бластных форм, нарастаю щих после активации клеток.
Потенциальную способность лимфоцитов к активации оценивают после стимуляции митогенами, фитогемагглкгашом и др., культивируемых вне организма клеток. Количество бластных форм может быть определено при микроскопии. Более точен и чувствителен радиометрический метод, оценивающий интенсивность включения радиоактивных предшественников (тимидина) в ДНК культивируемых клеток. Для оценки иммунной защиты слизистых используется определение секреторных иммуноглобулинов IgA.
Уровень активности фагоцитов оценивают по их способности к ферментативной обработке поглощенных клеток. Наиболее распространен так называемый НСТ-тест, основанный на выявлении способности клеток восстанавливать бесцветный реактив нитросиний тетразоль в краситель, окрашивающий активную клетку в синий цвет.
4. Иммунодефицитные состояния.
Иммунодефициты возникают в ре зультате выпадения или недостаточности функ ции одного или нескольких элементов иммунной системы. Причинами заболеваний, обусловлен ных специфической иммунной недостаточно стью, служат нарушения функций Т- или В-лимфоцитов — основы приобретенного иммунитета. Неспецифические иммунодефицита связаны с нарушениями в таких элементах иммунной сис темы, как комплемент и фагоциты, действующих при иммунном ответе неспецифично. Первич ные иммунодефицитные состояния обусловлены внутренними дефектами клеток иммунной сис темы и большей частью генетически детермини рованы.
Вторичные иммунодефициты возникают в течение жизни человека под воздействием различных неблагоприятных факторов внешней среды.
При иммунодефицитном состоянии наблюда ется повышенная чувствительность к инфекци ям. Наиболее часто возникающие у таких боль ных инфекции можно разделить на две катего рии. При нарушениях, связанных с иммуноглобулинами, компонентами комплемента и фаго цитарной активностью, резко возрастает воспри имчивость к повторным инфекциям, вызывае мым бактериями, которые обладают капсулой, — Haemophilus influenzae, Streptococcus pneumoniae и Staphylococcus aureus. Эти бактерии называют пиогенными, или гноеродными, поскольку они вы зывают гнойное воспаление. В случаях наруше ний в системе клеточного иммунитета, т. е. функ циях Т-клеток, повышается чувствительность к микроорганизмам, широко распространенным во внешней среде и в норме безвредным — у здо ровых людей к ним быстро развивается резистентность, но у больных с недостаточностью Т-клеточной функции они способны вызывать генерализованные и даже летальные инфекции. Это так называемые оппортунистические инфек ции; их возбудителями могут быть различные ми кроорганизмы, от дрожжей до обычных вирусов, таких как вирус ветряной оспы.
Первичная иммунологическая недостаточность.
1. При нарушениях иммунного ответа повыша ется чувствительность организма к пиогенным (гноеродным) бактериям. Подобные нарушения могут возникнуть вследствие недостаточности функции В-клеток, например, при сце пленной с Х-хромосомой агаммаглобулинемии. В других случаях причина состоит в том, что В-клетки не получают соответствующих сигна лов от Т-клеток. С этим связано возникновение таких расстройств, как синдром lgM-гипергаммаглобулинемии, общий вариабельный иммуно дефицит и транзиторная гипогаммаглобулинемия детского возраста.
2. При недостаточности клеточного иммуните та организм подвержен оппортунистическим ин фекциям. Такой тип иммунодефицита обуслов лен нарушением функций Т-клеток, как это име ет место при тяжелом комбинированном имму нодефиците (ТКИД), недостаточности молекул МНС класса II, атаксии-телеангиэктазии, син дромах Вискотта-Олдрича и Ди Джорджи.
3. Наследственная патология системы компле мента обнаруживается при ряде клинических синдромов. Наиболее часто ее дефект состоит в недостаточности ингибитора С1, клинически проявляющейся как ангионевротический отек.
4.При наследственной недостаточности тер минальных компонентов комплемента (С5, С6, С7 и С8) и белков альтернативного пути актива ции комплемента (фактора Н, фактора I и пропердина) повышена чувствитель ность к инфекциям, вызываемым двумя видами Neisseria - N. gonorrhoeae и N. meningitidis.
5.Нарушения механизма восстановления мо лекулярного кислорода в фагоцитах, а имен но сборки молекулы NADP-H-оксидазы и обра зования активных метаболитов кислорода, обла дающих бактерицидными свойствами, служат причиной развития хронического гранулематоза. Длительное присутствие бактериальных продуктов в фагоцитах ведет к образованию ли бо абсцессов, либо гранулем, в зависимости от вида возбудителя.
6.Недостаточность адгезии лейкоцитов ассо циирована с персистирующим лейкоцитозом, поскольку лейкоциты крови, несущие дефектные молекулы интегринов, не способны проникать через сосудистый эндотелий в ткани.
Вторичная иммунологическая недостаточность.
Вторичные иммунодефицитные состояния могут возникать под воздействием нескольких факторов:
1. Иммуномодулирующие лекарственные пре параты могут сильно подавлять иммунные функции.Стероиды влияют на миграцию клеток, индуци руют лейкоцитопению и ингибируют синтез цитокинов. Циклофосфамид, азатиоприн и микофенолат-мофетил действуют непосредственно на ДНК или ее синтез.
2. Недостаточность питания ведет к нарушению иммунных реакций. Белково-калорическая недостаточность ока зывает выраженное негативное влияние на лимфоидную ткань и клеточный иммунитет.
Недостаток в пище отдельных микроэле ментов, таких как цинк, селен, медь или железо, а также витаминов А, В6 и фолата приводит к ослаблению функции иммунной системы.
Правильные диета и питание - факторы, поз воляющие снизить заболеваемость и смерт ность от инфекций.
3. ВИЧ – инфекция. Возбудителем СПИДа является вирус иммуноде фицита человека (ВИЧ) - РНК-содержащий ретровирус, который связывается с CD4. В результате происходит значительное снижение числа Т-клеток CD4+, что ве дет к резкому нарушению клеточного иммуните та и к гибели от оппортунистических инфекций.
Клиническое течение ВИЧ-инфекции
Для лечения ВИЧ-инфекции применяется комбинированная терапия с применением ин гибиторов обратной транскриптазы и протеаз, которая дает определенный эффект, однако это дорогостоящий способ лечения. Эффективной вакцины против СПИДа пока не разработано
PAGE 15
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе