 [Фетальный гемоглобин это]
[Фетальный гемоглобин это]
Понятие фетального гемоглобина, его основная функция для организма человека
Фетальный гемоглобин – это плодный подвид гемоглобина человека. В медицинском мире он обозначается аббревиатурой hbf. Важность этого элемента для человека невозможно переоценить. Хотя в большом количестве он присутствует в нашем организме сравнительно недолго, это соединение задействовано практически во всех жизненно важных процессах. Именно поэтому для диагностирования некоторых заболеваний у пациента проверяют его уровень.
Расшифровка понятия фетальный гемоглобин
Фетальным гемоглобином называется соединение гемоглобинового белка, который способствует правильному насыщению нашего организма кислородом. Это вещество образуется в эритроцитах эмбриона, поэтому часто его определяют как плодный гемоглобин.
Гемоглобин f характеризуется конкретной схемой развития в теле:
- Возникает у эмбриона на 9-10 неделе беременности.
- К первому триместру считается главным видом гемоглобина у будущего ребенка.
- Сохраняет приоритетность у новорожденного.
- Резко снижается с 25 дня рождения малыша.
- За временной промежуток с 25 по 105 день жизни грудничка гемоглобин f снижается к норме, допустимой для взрослого человека.
Ребенок в утробе матери
Важность фетального гемоглобина для новорожденного
Для данного белкового соединения характерно высокое химическое сродство с кислородом, поэтому оно эффективно работает при «извлечении» кислорода из гемоглобина беременной женщины и передаче к ребенку через плаценту. После рождения малыша это сродство уже не требуется, поскольку hbf гемоглобин хуже делится кислородом с тканями. В итоге это может стать решающим фактором при сердечной или легочной гипоксемии. Во избежание подобных патологий, фетальный гемоглобин начинает заменяться более функциональным гемоглобином-А еще до появления ребенка на свет.
Резкий скачок парциального давления кислорода в артериальной крови (раО2) с 25-32 мм ртутного столба у плода до 87-98 мм у новорожденного провоцирует недостаточный синтез эритроцитов в первые 6-9 недель жизни малыша. Данное негативное влияние на костномозговое кроветворение нередко вызывает физиологическую анемию. В зону риска попадают недоношенные дети, поскольку у них после рождения быстро увеличивается масса тела и литраж крови.
В конечном счете уменьшение количества гемоглобина снижает парциальное давление кислорода на ткани, что провоцирует увеличение уровня эритрпоэтина и продуцирование эритроцитов.
Польза эмбрионального гемоглобина
Это белковое соединение важно не только для плода и новорожденного, но и для специалистов при проведении диагностики различных недугов. Чаще всего он применяется в таких структурных анализах:
- Для проверки степени созревания ребенка при недоношенности.
- Для подтверждения/опровержения гемолитической анемии у грудничков. При такой патологии проводятся переливания крови, об их эффективности тоже судят по количеству этого соединения.
- Для обнаружения лейкоза, для которого характерен повышенный уровень фетального гемоглобина.
- Для выявления предрасположенности к гипоксии и гипоксемии. Если патология присутствует, уровень этого белкового соединения значительно выше нормы.
Гипоксия
Нередки случаи, когда при проблемах с кислородным насыщением организма гемоглобин-А замещается белком типа f, поскольку первый при таких условиях не может стать надежным источником кислорода для органов.
Отличия между белковыми соединениями А и F
Главное, что разделяет эти два типа белка – способность насыщать тело кислородом. Белок типа F выполняет данное задание лучше белка типа А. Обусловлено это несколькими факторами:
- Различиями полипептидной цепи в структуре.
- Необходимостью развивающегося плода получать кислород из внутриутробной водной среды, где его количество значительно ниже, чем в воздушной, в которую попадает малыш после рождения.
- В несколько раз меньшим литражом крови, которой надо перенести кислород по всем органам и системам организма.
К недостаткам белка типа F относят:
- Не способен выдержать перемену температурного режима.
- Сложно и длительно адаптируется к кислотности новой окружающей среды.
У ребенка, имеющего предрасположенность к легочным патологиям, усиленная отдача гемоглобином f кислорода организму может спровоцировать развитие гипоксии.
Диагностирование заболеваний по результату анализа на белок F
Информация о количестве фетального и гликированного (а1с) белка, которое может содержать наше тело, помогает при диагностике многих болезней и патологий. К примеру, при беременности количество этих соединений показывает врачу стадию созревания будущего малыша.
Если у рожденного малыша диагностировали гемолитическую анемию, инструкция предполагает использование данных анализа на количество фетального гемоглобина.
Кровь донора
По количеству присутствующего в организме фетального гемоглобина специалисты могут определить лейкемию у пациента. Если общий анализ и биохимия крови показали превышение нормы, это расценивается как признак возврата организма к эмбриональной стадии образования крови и появлению большого количества незрелых сформировавшихся клеток.
Еще завышенные показатели данного белкового соединения свидетельствуют о наличие в организме острого дефицита кислорода.
Фетальный гемоглобин или гемоглобин F — что это
Содержание
Важность такого белка, как фетальный гемоглобин, который иначе называется гемоглобин-F, недооценить практически невозможно. Несмотря на то что в человеческом организме он занимает достаточно большой процент от общего объема гемоглобина совсем недолго, он успевает способствовать выполнению многих важных функций. Поэтому при диагностировании некоторых заболеваний обязательно проверяют его уровень.
Фетальный гемоглобин
Фетальный гемоглобин – одна из форм гемоглобинового белка, необходимого для полноценного насыщения организма кислородом. Также его обозначают как гемоглобин-F или попросту HbF – какой бы из этих вариантов не попался, речь будет идти об одном и том же веществе.
Этот тип белка возникает в эритроцитах еще формирующегося ребенка, и потому порой его называют плодный гемоглобин.
Общий цикл его развития в организме выглядит следующим образом:
- Образуется у плода на 9 неделе беременности.
- К 3 месяцу беременности является основным типом гемоглобина в эритроцитах будущего ребенка.
- По-прежнему остается приоритетным непосредственно после рождения.
- Уровень гемоглобина-F в крови резко понижается к 20 дню жизни ребенка.
- В период с 20 до 100 дня снижается еще больше до уровня, который считается нормальным в организме взрослого человека.
Фетальный гемоглобин в крови взрослого человека в целом составляет около 1% от общего количества различных гемоглобиновых белков, среди которых основным является гемоглобин-A. Именно он, приходя на смену фетальному, становится основным источником кислорода.
Отличия фетального гемоглобина от гемоглобина А
Основное и самое важное отличие между двумя этими типами гемоглобиновых белков в способности проводить кислород и насыщать им организм.
Гемоглобин-F справляется с этой задачей значительно лучше привычного гемоглобина, и на это есть важные причины:
- необходимость для формирующегося плода получать кислород из водной среды, где его содержится значительно меньше, чем в той среде, которая окружает уже родившегося ребенка;
- значительно меньшие, чем у взрослого человека, объемы крови в теле, которая переносит кислород по его органам.
Поэтому логично, что белок, предназначенный для насыщения тела кислородом, у новорожденных и только формирующихся детей, лучше «захватывает» частицы нужного вещества и больше их сохраняет для передачи внутренним органам.
Тем не менее, гемоглобин-F по сравнению с более привычным типом гемоглобина обладает и некоторыми недостатками, делающими его менее устойчивым к воздействию внешней среды.
Это:
- сложности с перенесением им изменений температур;
- сложности с перенесением им изменений уровня кислотности окружающей среды.
Кроме того, при рождении ребенка, предрасположенного к легочным заболеваниям, чрезмерная «открытость» его организма кислороду может вызывать гипоксию и провоцировать развитие проблемы.
Именно эти недостатки в итоге и становятся объяснением тому, почему на смену достаточно эффективно действующему фетальному гемоглобину приходит гемоглобин-A.
Этот тип белка демонстрирует значительно более высокую способность справляться с изменениями, происходящими вокруг организма.
Польза гемоглобина F-типа
Фетальный гемоглобин имеет непосредственную пользу не только для самого формирующегося ребенка, но и для его родителей, а также врачей, проводящих диагностику возможных заболеваний.
Он используется в следующих анализах:
- На выяснение степени сформированности плода (именно уровень этого белка в организме и служит указателем на недоношенность или полноценное развитие ребенка).
- На выявление синдрома гемолитической анемии у новорожденных детей. В этом случае уровень гемоглобина-F важен также для последующих медицинских действий по переливанию крови.
- На выявление комплекса лейкозных заболеваний, при которых уровень гемоглобина этого типа значительно повышается по сравнению с обычным.
- На выявление склонности к проблемам с кислородоснабжением – то есть, таким болезням, как гипоксия и гипоксемия. В этом случае уровень фетального гемоглобина тоже будет необычно высок.
Порой, особенно при развитии в организме болезней, провоцирующих проблемы с насыщением кислородом, этот тип белка может выполнять компенсаторную функцию и замещать значительную часть гемоглобина-A, который в этом случае не способен полноценно обеспечивать органы.
Основные свойства фетального гемоглобина
Фетальный гемоглобин является плодовое разновидность гемоглобина человека. В медицине этот тип гемоглобина имеет обозначение HbF.
Строение фетального гемоглобина
Соединение типа F представляет собой белок, который по своей структуре является белковым соединением — гетеротетрамером, состоящий из двух -цепей и двух -цепей. Эта белковая разновидность присутствует в организме взрослого человека в небольшом количестве.
При нормальном состоянии организма в нем содержится до 1% от общего объема.
При проведении анализа этот тип белка определяется у 7% эритроцитов. У плода, что развивается фетальный гемоглобин является преобладающим в организме.
Гемоглобина F присущее повышенное сродство к кислороду, что позволяет при небольшом объеме крови, имеющейся в организме плода, выполнять функцию кислородоснабжения организма более эффективно. Этот вид белкового соединения имеет невысокую стойкость к разрушению и невысокую стабильность при изменении pH и температуры. В течение последнего триместра беременности и в первые несколько недель после появления на свет у ребенка происходит плавная замена этого белкового соединения на белок, который присущ организму взрослого человека. Этот процесс проходит параллельно с увеличением объема крови в организме новорожденного. Белковое соединение в организме взрослого человека является менее активным по отношению к кислороду, однако оно имеет высокую устойчивость к денатурированные под действием перепадов pH и температуры. Процесс замещения осуществляется, потому что в организме ребенка происходит снижение уровня продуцирования-цепей белкового соединения. Одновременно со снижением синтеза -цепей увеличивается синтез -цепей в эритроцитах.
Повышенное сродство к кислороду у белка типа F обеспечивается особенностями его первичной структуры. Дело в том, что в -цепи место лизина-143 занимает серин-143, который вносит отрицательный заряд. Эта особенность ведет к тому, что молекула HbF имеет более низкий положительный заряд, который способствует повышению активности белка относительно кислорода.
Вернуться к змистуСинтез в организме человека
Белковая структура F начинает образовываться с 12-14 недели развития плода, на этом этапе происходит замещение эмбрионального белкового соединения на белок типа F. Первичная структура HbF отличается от HbА в 39 позициях. Особые свойства белка F обусловливают возникновение устойчивости к воздействию на белковую структуру щелочной среды. Эта особенность HbF легла в основу методики определения типа гемоглобина в организме человека. Кроме этого фетальный гемоглобин имеет способность трансформироваться в метгемоглобин, который имеет специфический спектром поглощения в ультрафиолете.
В момент появления новорожденного на свет на долю HbF приходится до 85% от общего количества белкового соединения. Замедление продуцирования этого типа белкового соединения происходит в течение первого года жизни, при этом количественный показатель белка становится таким же, как у ребенка третьего года развития. В этот период количество HbF приближается к 1-1,5%. После рождения повышенное сродство к кислороду оказывается вредным для организма, так как при наличии легочного или сердечного заболевания оно может грозить гипоксией. Именно это обстоятельство обусловливает активацию процесса изменения белковой комбинации HbF на комбинацию, характерную для взрослого человека HbА.
Вернуться к змистуМетодика диагностирования с использованием показателя гемоглобина F
Определение в организме количества белковой комбинации HbF имеет огромное значение при проведении диагностики целого ряда болезней и патологических состояний. Например, за наличием и количеством этого соединения судят о степени созревания и степени недоношенности ребенка.
Определение уровня HbF играет очень важную роль при осуществлении медицинских мероприятий в случае выявления гемолитическая анемия новорожденного ребенка, которые касаются проведения заменных переливаний крови. Заменное переливание проводится с помощью донорской крови, которая практически не имеет в своем составе HbF-гемоглобина. Это обстоятельство позволяет судить о полноте проведенного заменного переливания, именно количественный показатель HbF помогает определить полноту переливания у новорожденного.
С помощью определения количественного показателя белкового соединения проводится диагностирование анемии в случае обнаружения в организме гемотрансфузий двух типов:
- фето-материнской;
- фето-фетальной.
При рождении ребенка с анемией у матери наблюдается повышение количественного показателя этого типа гемоглобина. В такой ситуации наблюдается развитие фето-материнской гемотрансфузии, которая характеризуется проникновением красных кровяных телец кровеносной системы плода через плаценту в кровеносную систему матери. В случае близнецов возможно развитие анемии у одного из родившихся детей. В такой ситуации определение количественного показателя HbF позволяет подтвердить или опровергнуть наличие фето-фетальной гемотрансфузии. При данном типе нарушения один из близнецов имеет повышенный показатель HbF, а второй — понижен.
Определение количественного показателя гемоглобина HbF является важнейшим признаком при диагностировании различных типов лейкозов. Повышение этого значения может свидетельствовать о возвращении организма к эмбрионального типа осуществления кроветворения, что проявляется в появлении молодых и не полностью созревших клеток крови.
Содержание этого типа белка повышается при гипоксии и гипоксемии — нарушениях кислородоснабжения. Процесс развивается как компенсаторный, что способствует синтеза HbF, у которого повышено сродство к кислороду.
ПОИСК
При рождении ребенка в его крови до 70—90% гемоглобина находится в форме фетального гемоглобина. [c.439]
Глобин принадлежит к группе гистонов, так как он растворяется в разбавленных кислотах (изоэлектрическая точка 7,5). Примерно одну пятую часть молекулы белка составляют основные аминокислоты, среди которых преобладает лизин. В большинстае гистонов преобладает аргинин. Аминокислотный состав гемоглобина лошади приведен в табл. 42 (стр. 657). Содержание серы (щистива) в глобинах колеблется IB гемоглобине лошади— 0,39%. в гемоглобине кошки — 0,62%, в гемоглобине курицы — 0,86%. Гемоглобин здорового взрослого человека так же, как и гемоглобин лошади, не содержит изолейцина фетальный гемоглобин (HbF) содержит примерно восемь остатков этой аминокислоты. Гемоглобин S, который находится в крови больных серповидной анемией (болезнь, характеризующаяся массовым распадом эритроцитов), является продуктом врожденного нарушения нормального метаболизма. Гемоглобин S значительно менее растворим, чем гемоглобин А, его изоэлектрическая точка лежит заметно выше (на [c.671]
При рождении ребенка в его крови до 70—90% гемоглобина находится в форме фетального гемоглобина (HbF). У эмбриона человека на самых ранних стадиях развития (между 7-й и 12-й неделями жизни) был обнаружен третий тип гемоглобина — примитивный гемоглобин (НЬР), отличающийся по ряду свойств как от фетального гемоглобина (HbF), так и от НЬА — взрослого человека. [c.474]
Благодаря работам ряда авторов (В. А. Энгельгардт, 1959 Neel, 1942 Ingram, 1956) стало известным, что наряду с нормальными типами гемоглобина — НЬА (гемоглобин взрослых) и HbF (фетальный гемоглобин) — существуют самые разнообразные патологические виды гемоглобина, которых в настоящее время насчитывается около 20. Основной причиной развития гемоглобино-зов являются изменения физико-химических свойств, молекулярной структуры гемоглобина, что сопровождается усиленным гемолизом. В число наиболее распространен- [c.232]
На стр. 62 уже упоминалось о том, что гемоглобин плода HbF (фетальный гемоглобин) несколько отличается по ряду свойств (способность связывать кислород при различном парциальном давлении, растворимость и устойчивость в щелочной среде и т. д.) от гемоглобина взрослых. [c.439]
Свойства индивидуальных гемоглобинов неразрывно связаны с их четвертичной, равно как и вторичной и третичной, структурами. Наиболее распространенные гемоглобины имеют следующую тетра-мерную структуру НЬА (нормальный гемоглобин взрослого человека)—а Р НЬР (фетальный гемоглобин)—агУг НЬ8 (гемоглобин при серповидноклеточной анемии)—НЬАг (минорный гемоглобин взрослого человека)—а б . Четвертичная структура наделяет гемоглобин дополнительными важными особенностями (отсутствующими у миоглобина), которые способствуют выполнению гемоглобином его уникальной биологической функции и обеспечивают возможность строгой регуляции его свойств. Гемоглобин обладает аллостерическими свойствами (от треч. аллос—другой, стерос— место, пространство), и на его примере можно лучше понять свойства других аллостерических белков. [c.56]
Обратите внимание на более высокое сродство к Oj (меньшую величину Pio) крови плода, содержащей фетальный гемоглобин (/), который должен извлекать кислород из водной среды—материнской крови. Гемоглобин взрослого животного, обладающий низким сродством к Oi, извлекает кислород из богатой Ог среды —воздуха. [c.369]
Делеции в -глобиновом кластере генов и наследственная персистенция фетального гемоглобина. В отличие от а-талассемии Р-талассемия обычно обусловлена не делениями генов. Однако из этого правила есть много исключений. Более трети случаев Р-талассемии у индийцев оказывается связанной с делецией длиной 619 п. п., которая начинается во втором интроне и заканчивается за З -концом некодирующей области гена НЬр (рис. 4.54, табл. 4.18). Различные редкие делеции в этом гене описаны у негров США, известен один случай среди датчан. Обнаружено также несколько других, более крупных делеций в у-8-р-локусе. Их локализация и протяженность показаны на рис. 4.54. Методами цитогенетики эти делеции обнаружить не удается они слишком малы для микроскопического изучения. [c.91]
Сродство гемоглобинов к Oj характеризуется величиной Pjo—значением Р , при котором наблюдается полунасыщение гемоглобина кислородом. Значение Ру) у разных организмов существенно различается, но во всех случаях оно превышает значение Р в периферических тканях рассматриваемого организма. Это хорошо иллюстрирует фетальный гемоглобин человека (HBF). Для НЬА 50 = 26 мм. рт. ст., а для HBF Р50 = 20 мм рт. ст. Благодаря этой разнице гемоглобин F отбирает кислород у НЬА, находящегося в плацентарной крови. Однако после рождения ребенка HBF утрачивает свою функцию обладая более высоким сродством к О2, он высвобождает меньшее его количество в тканях. [c.56]
Фетальный гемоглобин 1/1008 Фехраль 2/261, 262 4/802 Фианит 2/222, 223 5/766 Фибриды 1/623 3/436 5/235 Фибриллы 1/620-622 2/1061 3/177, [c.735]
В дополнение к основному гемоглобину HbAj в крови взрослого человека доказано существование мигрирующего с меньшей скоростью при электрофорезе гемоглобина НЪЛ также состоящего из 4 субъединиц двух а-цепей и двух б-цепей. На долю НЬА, приходится около 2,5% от всего гемоглобина. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух а-цепей и двух Y-цепей. Фетальный гемоглобин отличается от HbAj не только составом аминокислот, но и физико-химическими свойствами спектральным показателем, электрофоретической подвижностью, устойчивостью к щелочной денатурации и др. Кровь новорожденного содержит до 80% HbF, но к концу 1-го года жизни он почти целиком заменяется на НЬА (все же в крови взрослого человека открывается до 1,5% HbF от общего количества гемоглобина). Последовательность аминокислот в у- и б-цепях гемоглобинов окончательно не расшифрована. [c.81]
Однако н в пределах одного вида гемоглобин состоит из нескольких компонент. Даже у одного индивидуума обычно существует ряд гемоглобинов. У человека кроме главной нормальной 0 мтоненты, НЬ А, имеется еще фетальный гемоглобин, НЬ F, и так называемая меньшая компонента, НЬ Аг. Помимо трех нормальных гемоглобином встречаются также аномальные, которых в настоящее время насчитывается несколько десятков. [c.126]
В крови всех здоровых людей находится также в небольшом количестве фетальный гемоглобин НЬ F. Этот гемоглобин составляет основную часть гемоглобина зародыша, откуда и происходит его название (fetus — зародыш, эмбрион), однако уже у новорождонного значительная часть его заменяется гемоглобином А, а через несколько месяцев после рождения НЬ F составляет уже совсем небольшую часть от общего содержания гемоглобина (0,3—0,4%). [c.131]
Приведенные выше аномальные гемоглобины являются модификациями НЬ А, так как их молекулы содержат видоизмененные а- или р- цепи. Однако нарушения в синтезе а-цепи вызывают появление модификаций и других нормальных компонент гемоглобина человека, т. е. появления аномальных гемоглобинов F и Аг. Действительно, известны аномальный гемоглобин Аг, так называемый гемоглобин Russ (НЬ Russ), содержащий видоизмененную а-цепь (а 0г), и аномальный фетальный гемоглобин с модифицированной а-цепью (аф). [c.132]
Полиморфизм белков в онтогенезе — существование гомологичных белков в разные отрезки жизненного цикла организма. У плода имеется гемоглобин Р (фетальный гемоглобин, 0 2 имеет большое сродство к кислороду). После рождения он заменяется на гемоглобин А, (а2Р2>. [c.34]
В эритроцитах плода преобладает фетальный гемоглобин — НЬР. Он состоит из двух а-цепей и двух у-цепей у-цепи отли- [c.434]
Наследственные болезни с простым моногенным наследованием служат превосходными примерами успешного применения концепции моноказуальной болезни. Используя в качестве примеров мутации гемоглобиновых генов, можно показать, как генетический анализ, основанный на менделевской парадигме, не только позво-.лил идентифицировать причины болезни, но и подготовил почву для выяснения механизмов, вследствие которых конкретные мутации вызывают нарушение функции, т.е. болезнь (разд. 4.3). Заслуживает внимания тот факт, что тяжесть моногенной болезни определяется взаимодействием с другими генами (и, возможно, со средой). Хорошо исследованным примером может служить серповидноклеточная анемия. Высокий уровень фетального гемоглобина НЬР способствует более мягким клиническим проявлениям этого заболевания, и. [c.293]
Делеции. Установлено, что гены, детерминирующие синтез глобиновых цепей, могут делетироваться. Делеции генов НЬа приводят к а-талассемии, делеция генов НЬ8 и НЬр вызывает наследственное персистиро-вание фетального гемоглобина или НЬ8 3-талассемию (см. ниже). [c.84]
Гетероклеточная наследственная персистенция фетального гемоглобина [222]. Груп- [c.92]
Генетический механизм. Мы уже говорили, что остаточная лактазная активность присутствует и у взрослых, неспособных усваивать лактозу. До сих пор неизвестно, есть ли отличия в структуре лактазы у лиц с нарушением всасывания и у всасывате-лей . Переключение с высокой на низкую активность несколько напоминает переход от продуцирования у-цепи гемоглобина к продуцированию -цепи, сопровождающийся переходом от образования HbF к образованию НЬА сохранение лактазной активности у взрослых можно сравнить с сохранением фетального гемоглобина (разд. 4.3). [c.42]
До настоящего времени предложено несколько методов пептидного картирования. С-концевой пептид у-цепи фетального гемоглобина идентифицировали, сравнивая электрофореграммы триптических гидролизатов после повторного разделения (pH 6,5) в направлении, перпендикулярном первому, до и после удаления С-копцевых остатков Arg или Lys при помощи карбоксипептидазы В прямо на листе бумаги [63]. Теоретически после обработки карбоксипептидазой на диагонали должен быть только С-концевой пептид. Однако в случае у-цепи гемоглобина человека па диагонали оказались 3 пятна, а именно свободный Lys, дипептид Val-Lys (так как дипептиды очень медленно расщепляются карбоксипептидазой [46]) и ожидае- [c.484]
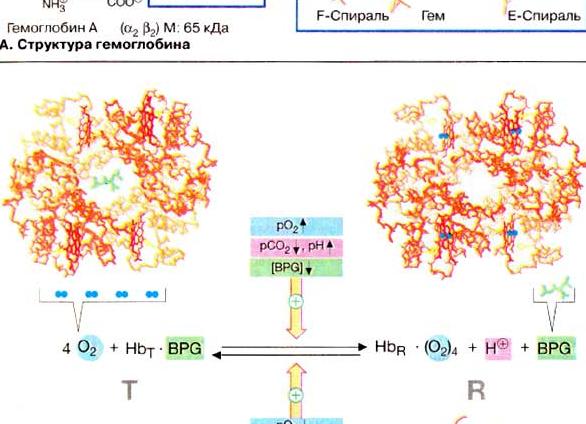
С фетальным гемоглобином ДФГ связывается менее прочно, чем с гемоглобином взрослого человека, поскольку в его Р-цепи в положении Н21 находится не His, а Ser, который не может участвовать в фор-мировэнии солевых мостиков, удерживающих ДФГ в центральной полости. -Поэтому ДФГ в меньшей степени способствуют стабилизации Т-формы фетального гемоглобина и последний обладает более высоким сродством к кислороду по сравнению с гемоглобином взрослого человека. [c.60]