 [Энтерококки что это]
[Энтерококки что это]
Энтерококки: о бактерии, нормальное и патологическое существование
Энтерококки — это бактерии, относящиеся к нормальной микрофлоре кишечника человека. Обитают в желудочно-кишечном тракте, органах мочеполовой системы, иногда обнаруживаются в полости рта. Выполняют важные функции: участвуют в пищеварении, способствуют усилению иммунной защиты и другое. Но под воздействием определённых факторов вызывают заболевания.
Особенности бактерии
Основной особенностью энтерококков является то, что они относятся к условно-патогенным микроорганизмам. Их выявлено около 20 видов:
- pallens;
- Е. gilvus;
- Е. faecalis;
- Е. faecium;
- Е. avium;
- Е. casseliflavus;
- Е. durans;
- Е. gallinarum;
- Е. malodoratus;
- Е. raffinosus
- Е. mundtii и др.
Некоторые из них являются частью микрофлоры, обязательным компонентом пищевых продуктов. Они способствуют молочнокислому брожению. Их используют в пищевой промышленности для изготовления твёрдых сыров и творога.
В организме человека в основном обитают энтерококки вида:
Эти штаммы энтерококков, вместе с другими аэробными кокками, составляют 25% всей пристеночной микрофлоры тонкой кишки и 5–6% микрофлоры толстой кишки.
Они необходимы, так как:
- участвуют в синтезе витаминов;
- расщепляют сложные углеводы;
- не дают размножаться другим патогенным микроорганизмам;
- усиливают иммунитет.
Энтерококки входят в состав пробиотиков – лекарственных препаратов, нормализующих микрофлору кишечника:
Для изготовления медикаментов и продуктов питания используют наименее патогенные штаммы энтерококков.
В то же время, именно те штаммы, которые обитают в кишечнике (энтерококки фекалис и фэциум) являются наиболее патогенными для человека. При интенсивном росте колоний возникают гнойно-воспалительные заболевания. Они являются основной причиной развития госпитальных инфекций. При этом лечение их затруднено: энтерококки устойчивы к воздействию желудочного и кишечного сока, проявляют резистентность к большинству антибиотиков. Уменьшается их количество при снижении кислотности желудочного сока.
Если в окружающей среде, особенно на пищевых продуктах, накапливаются эти виды энтерококков, то возрастает риск экзогенного инфицирования. Поэтому работники пищевой промышленности проходят особую медицинскую комиссию. При выявлении повышенного содержания энтерококков они не допускаются к работе.
Имеются ли у вас заболевания кишечника? — Пройти онлайн тест!
Чем опасны энтерококки?
Хотя энтерококки являются представителями нормальной микрофлоры, они обладают долей патогенности. При интенсивном размножении энтерококков, они становятся причиной эндогенной инфекции. С током крови, лимфы они попадают в другие органы, вызывая:
- инфекции мочеполовой системы (цистит, простатит);
- интраабдоминальные инфекции;
- инфекции дыхательных путей;
- остеомиелит;
- эндокардит;
- септический артрит.
При попадании энтерококков в брюшную полость возникает спонтанный бактериальный перитонит, который может окончиться летальным исходом.
Энтерококки, кроме того, что синтезируют витамины и способствуют пищеварению, выделяют токсины – эндогенные нейротрансимиттеры (аммиак, меркаптан). Тем самым становятся основной причиной развития пищевой токсикоинфекции. Болезнь стремительно развивается и приводит к тяжёлым осложнениям:
- инфекционно-токсический шок;
- тромбоз сосудов;
- эндокардит;
- пиелоцистит.
От воздействия токсинов страдает печень: она не успевает нейтрализовать вредные вещества, вырабатываемые бактериями. Возникает цирроз. Затем метаболиты попадают в кровоток и вызывают картину печёночной энцефалопатии.
Если сами энтерококки проникают в кровеносные сосуды, возникает тяжёлое и очень опасное состояние – сепсис.
Чрезмерный колониальный рост бактерий приводит к нарушению баланса нормальной микрофлоры кишечника. Развивается дисбактериоз.
Энтерококки являются возбудителями заболеваний мочеполовой системы. Чаще всего вызывают:
Нередко воспаление мочевого пузыря становится причиной развития пиелонефрита.
Загрузка …
Факторы риска
Болезни, вызываемые энтерококками, возникают при влиянии двух основных факторов:
- снижение иммунной защиты организма;
- попадание патогенных штаммов с пищей.
Наличие энтерококков в питьевой воде, пищевых продуктах – основной критерий фекального заражения.
Как и где обнаруживают энтерококки?
Исследование на содержание энтерококков проводят при инфекционных заболеваниях, дисбактериозе кишечника. В большинстве клинических лабораторий используют:
Для анализов берут кал, мазки, мочу в зависимости от заболевания. Проводят посев на разные питательные среды. Так как энтерококки схожи со стрептококками (до середины 80-х годов они не дифференцировались), используют такие свойства энтерококков:
- инертность к солям жёлчных кислот;
- способность расти в присутствии 6,5% соляной кислоты;
- способность обесцвечивать молоко с лакмусом или метиленовым синим (признак молочнокислого брожения).
Исследование кала
В основном такие исследования проводят при дисбактериозе кишечника или же для проведения дифференциальной диагностики при различных воспалительных процессах в желудочно-кишечном тракте.
Для анализа в стерильную ёмкость набирают материал. Его отбирают из разных мест в каловых массах, обязательно проводят забор слизистых, гнойных или кровавых включений (если они есть). Бактериологическое исследование необходимо начинать не позднее чем через 1 час после забора материала.
В норме в кале энтерококков должно быть:
- дети до 1 года – 105–107 колониеобразующих единиц/г (КОЕ/г);
- от 1 года до 60 лет – 105–108 КОЕ/г;
- старше 60 лет – 106–107 КОЕ/г.
При исследовании обязательно обращают внимание на процентное соотношение энтерококков по сравнению с другими представителями нормальной микрофлоры. В норме должны преобладать бифидо- и лактобактерии.
Исследование мочи
Мочу исследуют на содержание энтерококков при воспалительных заболеваниях мочеполовой системы. В норме она стерильная. Бактерии попадают в мочу с дистальных отделов мочеиспускательного канала. Так как в моче содержатся углеводы, соли, мочевина, урина является великолепной питательной средой, в которой бактерии интенсивно размножаются.
Для правильной диагностики необходимо не допустить попадания бактерий, колонизирующих наружные половые органы, в мочу. Для этого:
- Перед забором мочи необходимо помыть наружные половые органы с мылом.
- Собрать мочу в стерильную ёмкость.
- Для анализа необходимо 3–5 мл средней порции утренней мочи.
- Бактериологическое исследование начинают как можно скорее.
Если в урине выявлено не более 104 бактерий, исследование следует повторить через некоторое время.
Для дифференциации возбудителя болезни проводят бактериологическое исследование.
Исследование мазков
Энтерококки обитают не только в кишечнике. Они являются представителями нормальной микрофлоры влагалища, наружных половых органов. При невенерических инфекционных заболеваниях у женщин исследуют мазки с влагалища, шейки матки, матки, вульвы, мочеиспускательного канала.
Так как во внешней среде большинство возбудителей болезни погибает, исследования необходимо проводить сразу же после забора материала или использовать консервирующие жидкости.
Симптомы
Клиническая картина инфицирования зависит от того, какой орган поражён патогенными штаммами энтерококков.
Общие
Протекает болезнь как любое инфекционное заболевание, проявляясь:
- повышением температуры тела;
- тошнотой;
- головокружением;
- слабостью.
Специфические
- При поражении дыхательной системы – кашель, насморк, боль в горле, груди.
- При инфицировании мочеполовой системы – болезненное мочеиспускание, частые ложные позывы, боль внизу живота.
- При дисбактериозе характерен понос, метеоризм.
- При пищевых токсикоинфекциях сопровождаются рвотой.
Особенно опасен эндогенный сепсис. Болезнь протекает с кратковременными подъёмами температуры тела, ознобом. Если он молниеносный, то быстро развивается септический шок. Смерть наступает в течение 1–2 дней.
Длиться болезненное состояние может месяцами. Изредка пациент жалуется на субфебрильную температуру тела, головокружение. Температура повышается беспричинно (нет кашля, болей, насморка). А в конечном итоге могут возникать тяжёлые осложнения вплоть до летального исхода.
Чтобы не допустить прогрессирования болезни необходимо обратиться к врачу. Он назначит соответствующее обследование и подберёт оптимальную тактику лечения.
Лечение
Так как энтерококки постоянно обитают в кишечнике, а для лечения любых инфекционных болезней используют антибиотики, то эти микроорганизмы приобрели устойчивость к этим видам препаратов. Они плохо поддаются лечению цефалоспоринами, оксолиновой кислотой, фторхинолонами, левомицетином.
При энтерококковом поражении проводят терапию:
- ампициллином с гентамицином;
- мезлоциллином с амикацином.
Для лечения предпочтительней использовать пробиотики, содержащие лакто- и бифидобактерии, непатогенные штаммы энтерококков, кишечной палочки:
- Линекс;
- Лактиале;
- Бифиформ;
- Биофлор;
- Лактофильтрум и др.
Болезни, вызываемые энтерококками, плохо поддаются лечению. Всё осложняется тем, что эти микроорганизмы – постоянные обитатели кишечника. Они являются частью нормальной микрофлоры, выполняющей ряд важных функций. Поэтому развитие болезни лучше предупредить.
Профилактика
Не существует специфических методов профилактики энтерококковой инфекции. Не созданы вакцины. Но предупредить болезнь можно. Для этого надо:
- Придерживаться элементарных правил гигиены.
- Правильно питаться. Росту непатогенной микрофлоры способствует пища, богатая балластными веществами, молочнокислые продукты.
- Повышать иммунитет. Эндогенные инфекции вызывают патологии при сниженной защитной реакции организма. А повышают иммунитет закаливанием, употреблением витаминов и минералов. Есть также лекарственные препараты, усиливающие иммунную защиту.
И самое главное, никогда не заниматься самолечением, особенно с использованием антибиотиков, которые угнетают нормальную микрофлору и способствуют развитию патогенных штаммов микроорганизмов. При появлении симптомов инфекционного заболевания надо обращаться к врачу, который подберёт схему лечения в зависимости от патологии и вызвавшего её возбудителя.
Бактерии энтерококки — что это такое
Когда человек слышит об энтерококках, что это такое — это самое первое, о чем он хочет узнать. Эти бактерии можно встретить у здоровых людей и тех, кто принимает наркотические средства.
Что такое энтерококки
У человека в кишечнике живут фекальный энтерококк и энтерококк фэциум. Эти обе разновидности имеются в составе нормальной микрофлоры желудочно-кишечного тракта. Только в том случае они имеют большое значение в функционировании слизистой кишечника, если нет условий для того, чтобы они переродились в инфекцию.
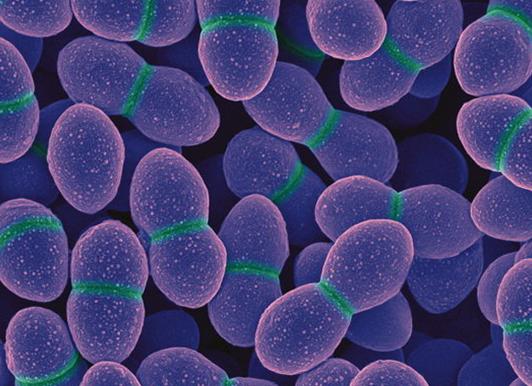
Еnterococcus faecalis — это бактерии овальной формы. В мазках они выравниваются в цепочку либо держатся в скоплении. Температура человеческого тела для них является оптимальной для энергичного размножения. Энтерококк фекальный не в состоянии образовывать споры и капсулы. На него не действует губительно очень маленькое количество кислорода.
Отмечается, что в 90% случаев эти организмы устойчивы при колонизации бактерий другого вида. У женщин они встречаются намного чаще, потому что наряду со снижением гормонального фона уменьшается и иммунитет. Если в моче присутствует фекальный энтерококк, это свидетельствует о воспалительных процессах в мочевыводящих путях. В таких ситуациях требуется незамедлительное врачебное вмешательство. Дело в том, что превышение допустимой нормы этого условно-патогенного микроорганизма ведет к серьезным воспалительным болезням, менингиту, пищевым отравлениям и дисбактериозу.
Электронная микрофотография Enterococcus faecalis
Еnterococcus faecalis весьма устойчив к всевозможным антисептическим средствам и не боится высоких температур. Заразиться ими можно через повреждения на слизистой и коже.
Причины возникновения энтерококка
Эти микроорганизмы способны нанести вред здоровью человека. Энтерококк отличается устойчивостью к большому количеству препаратов и способен переносить антибактериальную терапию. В то время когда полезные бактерии погибают, на их место приходит этот вид микроорганизмов. Энтерококк начинает паразитировать на этом участке. Длительный прием антибиотиков также является причиной их появления.
Энтерококки, присутствующие в моче, в 18% всех случаев поражают систему ее выделения. В ослабленном организме их размножение протекает усилено, особенно при беременности, во время которой у женщины отмечается застой мочи. Такая почва считается благоприятной для размножения бактерий. Причины, по которым в организме человека появляются энтерококки, разные. Они начинают активно размножаться при:
- Несоблюдении правил интимной гигиены;
- Частой смене половых партнеров;
- Нарушении микрофлоры кишечника;
- Ушибах и ранении;
- Употреблении анестетиков, обладающих наркотическим действием;
- Старении. В это время наблюдается ослабление организма, который уже не в состоянии сопротивляться различным видам бактерий.
Основные признаки болезней, вызванных энтерококками
При разрастании колонии энтерококков у больного наблюдается:
- возникновение болевых ощущений при мочеиспускании и внизу живота;
- частые позывы к мочеиспусканию;
- наличие в моче разных примесей;
- отсутствие оргазма;
- снижение полового влечения.
Снижение полового влечения
Человек начинает чувствовать себя слабым, изможденным, быстро устает. У мужчин наблюдается нарушение эрекции, из мочевого канала выделяется бело-зеленая слизь, становится другим цвет мочи. Если будет обнаружен хотя бы один из этих симптомов, необходимо без промедлений обратиться за врачебной помощью. Энтерококк может стать причиной возникновения и развития скрытой инфекцией мочеполовой системы. У женщин появляются обильные, плохо пахнущие выделения слизистой консистенции или творожной густоты. Мучают боли в паху, внизу живота и спине. В случае, когда инфекция проходит без каких-либо признаков, увеличенное количество enterococcus faecalis в мазке у мужчин выявляется во время медицинского осмотра или диагностики цистита и венерических болезней. Обнаруживают его при сдаче анализов в моче, мазке и экскрементах.
Если энтерококк фекалис обнаружен в моче и при этом он поражает мочеполовую систему, то нужна немедленная терапия. Игнорирование лечения приводит к тому, что инфекция перейдет в хроническую форму с повторяющимися проявлениями. Этот условно-патогенный микроорганизм может привести к тому, что обостряются и развиваются заболевания сосудов и сердца.
Предотвратить излишнее увеличение количества этих бактерий поможет прием бактериофагов. Они в состоянии стабилизировать микрофлору кишечника. Необходимо воздержаться от употребления антибиотиков, которые побуждают их к размножению.
Схема лечения предполагает назначение:
- витаминных и поливитаминных комплексов;
- антибактериальных препаратов;
- местных лекарств.
В качестве местных лекарственных средств используются:
- вагинальные таблетки;
- гели и мази;
- антисептические свечи и капсулы.
Не забыть про витамин С
В дополнение к этому лечению могут быть назначены физиотерапевтические процедуры. Большинство заболеваний, вызванных энтерококками, развивается при ослабленной иммунной системе, которая должна защищать организм. Для того чтобы укрепить и активизировать ее функции, назначаются иммуностимуляторы. Нужно заметить, что натуральный иммуностимулятор — это витамин С или аскорбиновая кислота. Ею богата смородина, лимон, шиповник, облепиха.
Врач назначает дополнительно принимать витаминно-минеральные комплексы. Они помогают лечить инфекционные заболевания тем, что:
- активизируют и укрепляют иммунитет;
- приводят в норму работу всех важных процессов;
- восстанавливают баланс микрофлоры в кишечнике.
Признаки недуга отрицательно сказываются на общем состоянии организма. Однако раннее обнаружение и адекватное лечение поможет справиться с этой проблемой.
На основе анализов кала и мочи врач обязан четко сформировать правила, по которым предстоит лечить пациента. Неправильное назначение лекарственных препаратов приведет к серьезным осложнениям и тяжким последствиям.
Enterococcus faecium: что это такое и как его лечить
Организм человека населяет огромное количество бактерий. Особенно много их в кишечнике и других пищеварительных органах. Эти микроорганизмы, существуя в пределах нормы, обеспечивают осуществление жизненно важных процессов.
Но когда численность популяции выходит за установленные границы, либо в организм извне попадают измененные разновидности бактерий, развиваются болезни, которые иногда очень сложно правильно диагностировать и успешно вылечить. Это касается и энтерококков.
Характеристика энтерококков
Enterococcus faecium являются молочнокислыми бактериями
Enterococcus faecium – молочнокислые бактерии, относящиеся к роду энтерококков. Они населяют пищеварительный тракт человека и ряда млекопитающих, являясь незаменимой культурой, участвующей в процессах обработки пищи.
Более ранняя классификация относила данный вид к стрептококкам групп D и E. Молочнокислые бактерии появляются в кишечнике человека в первые недели его жизни.
Ученые отмечают, что в случаях грудного вскармливания младенцев этот процесс происходит намного интенсивнее по сравнению с организмами малышей, которых кормили искусственными смесями.
Энтерококки не способны образовывать споры и капсулы. Эти грамположительные бактерии являются факультативными анаэробами.
Их жизненный цикл основан на бескислородном существовании, но благодаря энергии брожения, которую используют микроорганизмы, они выживают и при незначительном доступе кислорода. Энтерококки отличаются высокой устойчивостью к факторам внешней среды:
- температура;
- влажность;
- воздействие агрессивных веществ;
- химический состав среды и др.
Они приспособились выживать под воздействием дезинфицирующих средств и при высоких температурах. Так, бактерии могут в течение получаса выдерживать температуру 60°С, находясь на предметах в комнате и оставаясь при этом жизнеспособными.
Кроме функций, необходимых для обеспечения жизнедеятельности организма человека, энтерококки нашли применение в пищевой промышленности.
Различные штаммы используются в основном при производстве копченых мясных продуктов и сыров (Чеддер, Фета, колбасы холодного и твердого копчения).
Норма энтерококков в организме
Enterococcus faecium есть у каждого здорового человека
Enterococcus faecium – один из видов бактерий, представителей которого наиболее часто можно встретить в пробах биологического материала абсолютно здорового человека.
Читайте: Энциклопедия здоровья: симптомы увеличения селезенки
Норма энтерококков в организме составляет 107-108 жизнеспособных бактерий на 1 г взятого на пробу материала.
Функции энтерококков как полезных бактерий, принимающих участие в жизнедеятельности человеческого тела, достаточно широки:
- гидролиз сахаров;
- элиминация (устранение) патогенных микробов;
- синтез витаминов;
- деконъюгация (расщепление) желчных кислот;
- поддержание иммунитета.
Благодаря своим полезным свойствам, энтерококки нашли применение не только в пищевой промышленности, но и в производстве одной из групп медицинских препаратов – так называемых пробиотиков. Назначение этих средств – восстановление нормальной микрофлоры кишечника.
Заболевания, которые способны вызвать энтерококки
Несмотря на всю пользу enterococcus faecium для человека, они носят условно-патогенный характер. Они вызывают заболевания при резком снижении иммунитета либо при попадании в организм извне.
Наиболее распространены следующие болезни, вызываемые энтерококками:
- инфекции мочеполовой системы (пиелонефрит, цистит, уретрит);
- септический артрит;
- бактериемия;
- инфекции дыхательных путей (коклюш, бронхит, пневмония);
- остеомиелит;
- эндофтальмит;
- интраабдоминальные инфекции (заражение органов брюшной полости);
- инфекции кожи и мягких тканей (фурункулы, лимфангиты, рожистые воспаления, карбункулы);
- эндокардит.
Повышенное содержание энтерококков находят в биологических пробах пациентов, перенесших длительную госпитализацию в связи со стационарным лечением или перенесенной операцией.
Причины заражения энтерококком:
- вертикальная инфекция (от матери новорожденному младенцу вместе с грудным молоком);
- повреждения кожных покровов (царапины, ушибы, порезы);
- нарушение состава нормальной микрофлоры кишечника;
- сбои в метаболических процессах;
- длительная госпитализация;
- несоблюдение правил гигиены.
Заражение энтерококками во взрослом возрасте означает нарушение иммунитета. В этих случаях в первую очередь надо повышать собственную защитную систему человека, параллельно устраняя симптомы заражения.
Симптомы заражения
Enterococcus faecium: бакпосев
Энтерококковые инфекции затрагивают различные системы органов. В зависимости от вида вызываемого заболевания могут отличаться и симптомы заражения.
Однако существует ряд признаков, по которым можно заподозрить инфекцию:
- повышение температуры;
- быстрая утомляемость;
- слабость;
- состояние депрессии;
- выделения из мочеполовых органов;
- боли при дефекации;
- диспепсические расстройства;
- отличный от нормы цвет мочи.
Кожные инфекции дополнительно могут выражаться высыпаниями, нарывами и гнойными образованиями, сопровождаться зудом, покраснением кожи.
При дыхательных инфекциях может начаться кашель, возникает заложенность носа. Септический артрит сопровождается болями в суставах, сокращением их подвижности и воспалительными процессами в пораженной области.
При эндофтальмите (воспалении глазного яблока) ухудшается зрение, возникает слезотечение, светобоязнь. Заболевание сопровождается резкими болями в области глаза.
Эндокардит (воспаление эндокарда – внутренних стенок сердечной мышцы) характеризуется лихорадочным состоянием, изменением цвета кожных покровов, в слизистых оболочках лопаются мелкие кровеносные сосуды, утолщаются концевые фаланги пальцев на руках и ногах.
При этом также могут увеличиваться внутренние органы, в сердце возникают шумы. Но эти признаки визуально нелегко определить.
При остеомиелите (гнойном поражении тканей костного мозга и прилегающего эпителия) наблюдается гиперемия кожи в пораженных очагах, сильный болевой синдром, отечность. Местная форма инфекция проявляется слабее, чем септико-пиемическая.
При бактериемии (наличии в пробах биологического материала пациента бактерий) характеризуется общими симптомами заражения энтерококком.
Диагностика
Лечение должен назначать врач!
Для определения энтерококковой инфекции врач вначале осматривает пациента и изучает состав жалоб.
Здесь важно указать, были ли контакты с инфицированными людьми, какую пищу в последнее время принимал больной, не проводилось ли лечение других заболеваний и проч.
Далее пациент отправляется на лабораторные исследования. Основным методом установления заражения энтерококком является бак-посев. Бактерии растут на простых питательных средах:
- кровяной и триптиказо-соевый агар;
- азидодекстрозный бульон;
- стрептококковый селективный агар;
- М-агар и др.
В среде Диф-3 на основе теллурита калия вырастают колонии черного цвета, так как энтерококки способны восстанавливать теллур.
В кровяном агаре штаммы приобретают белый или кремовый цвет. Края клеток ровные и гладкие. Тип гемолиза (разрушения эритроцитов) при этом может различаться.
Большинство энтерококковых штаммов являются гомоферментативными, в своей деятельности они не образуют газов. Они преобразуют ряд углеводов (в том числе глюкозу) с конечным выделением молочной кислоты.
Отдельные штаммы обладают способностью разжижения желатина. Энтерококки в биологическом материале также можно установить по их выраженной редуцирующей способности – они разлагают нитриты до нитратов, обесцвечивают индикаторы метиленовый синий и лакмус в молочной среде.
После сдачи лабораторных анализов и установления в пробах энтерококков пациента могут отправить на дополнительные диагностические процедуры – рентгенографию, УЗИ внутренних систем и органов, компьютерную томографию. Эти исследования проводятся с целью уточнения диагноза, определения степени и характера изменения структуры и функционирования внутренних органов пациента.
Лечение
Препараты для восстановления микрофлоры
Лечение энтерококковых инфекций должно включать комплекс мероприятий, направленных на устранение симптомов и причин заболевания, а также предупреждение отрицательных последствий заражения.
Схема терапии включает применение:
- антибиотиков;
- иммунностимулирующих препаратов;
- лекарственных средств для устранения симптоматики;
- физиопроцедур;
- препаратов, нормализующих микрофлору кишечника.
Сложностью лечения энтерококковых инфекций является их высокая резистентность ко многим видам антибиотиков (ванкомицин, беталактам, аминогликозиды, цефалоспорины, эритромицин). В настоящее время против данного рода бактерий используются препараты:
- Рокситромицин;
- Рифаксимин;
- Линезолид.
В лечении грудных младенцев используются бактериофаги (Интести-бактериофаг и др.). Антибактериальная терапия носит не только системный характер, но и местный. Мази и гели с антибиотиком применяются в очагах поражения.
Укрепление иммунной системы проводят путем назначения витаминных комплексов и иммунностимулирующих препаратов (Иммунал, ИРС-19 и др.). Также повышению иммунитета способствует нормализация кишечной микрофлоры, чему способствует прием лакто- и бифидобактерий в составе пробиотиков (Линекс, Бифидумбактерин, Лактофильтрум).
Болевой синдром устраняют с помощью альфа-адреноблокаторов, миорелаксантов и анальгетиков. Enterococcus faecium входят в состав нормальной микрофлоры кишечника. Но при определенных условиях они становятся опасными для человеческого организма.
В этом случае развиваются заболевания, провоцируемые бактериями. Основным методом диагностики являются лабораторные анализы проб биологического материала пациента. Для обеспечения эффективности лечения нужно подобрать фармакологические препараты, к которым энтерококки не будут резистентны.
Что представляют собой энтерококки, подскажет видеосюжет:
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.
Расскажите друзьям! Расскажите об этой статье своим друзьям в любимой социальной сети с помощью социальных кнопок. Спасибо!
Поделиться
Твит
Телеграм
Класс
Вотсап
Симбиотические энтерококки и проблемы энтерококковой оппортунистической инфекции
Комментарии
В.М. Бондаренко, А.Н. Суворов
Рецензенты: А.Ф. Мороз, доктор биологических наук, профессор, Заслуженный деятель науки РФ В.Г. Лиходед, академик Российской академии медико-технических наук, доктор медицинских наук, профессор
Введение
Энтерококки, входящие в состав нормальной микрофлоры пищеварительного тракта человека, играют важную роль в обеспечении колонизационной резистентности слизистых. В то же время они являются представителями группы условно-патогенных бактерий, способных вызывать аутоинфекцию, а при накоплении в окружающей среде – приводить к экзогенному инфицированию. В последние годы изучение энтерококков как биологических объектов и оценка их роли в физиологии и патологии человека чаще всего рассматриваются сквозь призму участия энтерококков в возникновении инфекционных заболеваний, количество которых постоянно нарастает. Однако односторонняя оценка микроорганизмов зачастую не позволяет объективно оценить их значение, так как многие из них являются составной частью нормальной микрофлоры и обязательными компонентами привычных пищевых продуктов. Обнаружение у больного энтерококков часто ставит неразрешимые вопросы перед клиницистами в плане определения врачебной тактики. Возник вопрос о безопасности применения в медицинской практике препаратов-пробиотиков, содержащих жизнеспособные симбиотические энтерококки. В данной книге мы постарались рассмотреть проблему энтерококков с разных точек зрения и объяснить причины, определяющие их способность вызывать развитие инфекционного процесса, т.е. возможность проявления патогенных свойств энтерококками различных штаммов одного и того же вида.
Общая характеристика бактерий рода Enterococcus
Энтерококки, ранее относимые к стрептококкам группы D, — многочисленная группа бактерий рода Enterococcus, включающая виды Е. faecalis, Е. faecium, Е. avium, Е. casseliflavus, Е. durans, Е. gallinarum, Е. raffinosus, Е. irae, Е. malodoratus и Е. mundtii. В клиническом материале от человека встречаются Е. faecalis, Е. faecium, Е. gilvus и E. pallens. Энтерококки содержат групповой антиген, который реагирует с антисывороткой стрептококков серогруппы D по Лэнсфилду. Энтерококки других видов, как правило, не обнаруживаются в клиническом материале от людей.
У новорожденных энтерококки выявляются уже с первых дней жизни, и в последующем на первом году, у детей, находящихся на грудном вскармливании, их уровень колеблется от 106 до 107 КОЕ/г. У детей с искусственным вскармливанием их уровень может достигать 108–109 КОЕ/г. Популяционный уровень энтерококков в кишечнике здорового человека остается стабильным, достигая 107–108 КОЕ/г фекалий. Энтерококкам отводится существенная роль в стимуляции местного гуморального и клеточного иммунитета, что способствует поддержанию колонизационной резистентности [4]. Количество в кишечнике энтерококков в норме не должно превышать общее количество кишечных палочек. Различные виды энтерококков, обнаруженные у теплокровных, указанные в атласе Koneman E.W. и др. [50], представлены в таблице 1.
Таблица 1. Основные представители рода Enterococcus, выделяемые от человека, животных и птиц [50]
| E. faecalis | Наиболее частый изолят клинических проб из кишечника человека, обнаруживается также в кишечнике домашней птицы, крупного рогатого скота, свиней, собак, лошадей, овец и коз |
| E. faecium | Выявляется в клинических пробах от людей; более резистентен к антимикробным средствам, чем Е. faecalis; также выявляется в кишечнике разных видов животных |
| E. avium | Выделяют из кишечника птиц, собак, человека, штаммы могут иметь групповые D- и G-антигены по Лэнсфилду, образуют h3S |
| E. durans | Редкий клинический изолят: обнаруживают главным образом в молоке и других молочных продуктах |
| E. casseliflavus | Выявляют в растениях, почве и редко – в фекалиях цыплят; первоначально классифицировали как подвид Е. faecium; продуцирует желтый пигмент, подвижен; может выделяться при инфекциях у человека |
| E. gallinarum | Изолируют из фекалий цыплят; один из двух подвижных видов Enterococcus; также был изолирован при инфекциях людей, подвергавшихся гемодиализу |
| E. raffinosus | Первоначально рассматривался как Е. avium (вместе с Е. solitarius и Е. pseudoavium); назван за свою способность продуцировать кислоту из раффинозы; выделяют при инфекциях человека, включая культуры из крови, мочи и абсцессов |
| E. dispar | Первоначально считали биохимическим вариантом Е. hirae, но анализ сиквенса 16S РНК показал, что он является новым видом; обнаруживают в пробах от человека (в фекалиях, синовиальной жидкости) |
| E. flavescens | Новый, образующий желтый пигмент подвижный вид; изолирован из проб от человека (крови, абсцессов и гнойного отделяемого больных остеомиелитом) |
Морфологические и физиологические свойства. В мазках, приготовленных из бульонной культуры, энтерококки — грамположительные кокки, единичные, парные, в виде небольших скоплений или цепочек. При выращивании на плотной питательной среде в большей степени выражен полиморфизм, проявляющийся как в форме клеток (круглые или вытянутые, иногда в виде коккобактерий), так и в размерах (карликовые и гигантские формы, различные размеры клеток в одной паре или цепочке). Спор и капсул не образуют. Встречаются подвижные варианты, несущие от одного до четырех жгутиков. Энтерококки являются факультативными анаэробами, оптимальная температура культивирования которых составляет 35–37°С. Энтерококки осуществляют метаболизм бродильного типа, ферментируют разнообразные углеводы с образованием в основном молочной кислоты, но не газа, снижая рН до 4,2–4,6. В некоторых случаях восстанавливают нитрат, обычно лактозопозитивные.
Бактерии большинства штаммов энтерококков растут в бульоне, содержащем 6,5% раствор NaCl, при температурах от 10 до 45°С. Каталазоотрицательные, гидролизуют эскулин в присутствии 40% раствора желчи. Некоторые виды энтерококков гидролизуют пирролидонил-β-нафтиламид, за исключением Е. сесоrит, Е. columbae и Е. saccharolyticus. Все штаммы продуцируют фермент лейцинаминопептидазу. Энтерококки хорошо растут на триптиказо-соевом агаре или на агаре, приготовленном на сердечно-мозговом настое, с добавлением к ним 5% крови барана. Некоторые штаммы Е. faecalis проявляют β-гемолитические свойства на агаре, содержащем кровь кролика, лошади или человека, но оказываются негемолитическими на агаровой среде с кровью барана. Часть культур Е. durans являются β-гемолитическими независимо от типа используемой крови.
Для выделения и выращивания энтерококков существует ряд селективных сред: основа кровяного агара с азидом, азидодекстрозный бульон, KF-стрептококковый агар, М-агар для энтерококков, стрептококковый селективный агар и др. На кровяном агаре колонии энтерококков мелкие, кремовые или белые, гладкие с ровным краем, различающиеся по типу гемолиза. Почти все штаммы – гомоферментативные, газа не образуют, конечный продукт ферментации глюкозы и некоторых других углеводов — молочная кислота. Отдельные виды энтерококков разжижают желатин. У энтерококков резко выражены редуцирующие свойства: они обесцвечивают лакмус и метиленовый синий в молоке, редуцируют нитраты в нитриты.
Устойчивость к факторам внешней среды. Энтерококки высокорезистентны к различным факторам внешней среды и дезинфицирующим средствам, могут длительное время сохранять жизнеспособность на предметах домашнего обихода, в течение нескольких месяцев — на обычных агаровых косяках, выдерживают нагревание до 60°С в течение 30 минут.
Энтерококки как причина оппортунистической инфекции
Хорошо известно, что увеличение числа лиц с иммунодефицитными состояниями ведет к нарастанию случаев инфекционных процессов, вызываемых условно-патогенными микроорганизмами, в том числе и энтерококками [5]. В последние десятилетия возросла роль двух видов энтерококков – E. faecalis и E. faeсium – как нозокомиальных патогенов в различных клиниках [26, 33, 62, 73]. Принимая во внимание увеличение числа лиц с иммунодефицитными состояниями, нельзя исключить возможное увеличение спектра видов энтерококков, причастных к патологии у человека.
Недавно была проведена оценка значения энтерококков как возбудителей послеоперационных инфекционных осложнений после операций аортокоронарного шунтирования, реконструктивных операций на сердце и трансплантации почек. Энтерококки изолировали из крови, операционного материала (клапанов сердца), мочи, отделяемого трахеи, ран, плевральной жидкости, внутрисосудистых катетеров. Было изолировано 465 штаммов энтерококков, которые встречались при воспалительных процессах у пациентов отделений трансплантации почек – в 39,8% случаев, затем по показателю высеваемости следовали пациенты реанимационного отделения – 34,6%, сердечно-сосудистой хирургии – 20,4% и материал из операционного блока – 4,2%. Наибольший пул этих микробов изолирован из мочи – в 47,7% и из трахеи – в 24,3%. Энтерококковые бактериемии регистрировались в 9,7%, имея значительный удельный вес среди грампозитивной микрофлоры – 38,5% всех изолятов. Из крови пациентов различных отделений выделено 45 штаммов (E. faecalis – 0,7%, E. faecium – 14,6%).Отмечена высокая степень резистентности энтерококков к антибиотикам [6].
По данным Murray B.E., в 1990 году 80–90% выделенных у человека энтерококков приходилось на долю E. faecalis и 5–10% – на E. faecium [59]. Энтерококки, изолированные при бактериемиях, составили 38,5% от грампозитивной микрофлоры и 9,7% – от всех изолятов энтерококков. По этиологической значимости энтерококки заняли второе место после коагулазоотрицательных стафилококков. Свыше 60% тяжелых энтерококковых инфекций зарегистрированы в отделениях интенсивной терапии [73]. Энтерококки изолированы из крови преимущественно пациентов реанимационного отделения. Другие авторы также указывают на значительную частоту энтерококковых бактериемий: 7–10%, 15,3% [8, 9]. Наряду с другими микробами энтерококки являются возбудителями инфекционных поражений клапанов сердца [28].
Значительное число штаммов энтерококков (n = 113) выделено из отделяемого трахеи пациентов с искусственной вентиляцией легких (ИВЛ), что составило 24,3% от всего пула энтерококков. Эти микроорганизмы выделены только в 1,7% случаев инфекций дыхательных путей [9]. Раневая инфекция, вызванная энтерококками, составила 3%. Наибольший пул энтерококков изолирован из мочи – 222 штамма, что составило 47,7%. Одним из основных возбудителей инфекций мочевыводящих путей является E. faecalis, занимающий второе место после кишечной палочки [1]. Особенно опасны инфекции мочевыводящих путей, вызванные энтерококками, для больных с пересаженной почкой. У E. faecalis описан цитотоксин, вызывающий лизис эритроцитов, нейтрофилов. Штаммы, продуцирующие цитотоксин, проявляют высокую резистентность к химиотерапевтическим препаратам [27]. Обнаружено также, что E. faecalis обладает высокой протеолитической активностью в отношении ряда белков – гидролизирует желатин, казеин, коллаген, гемоглобин и другие белки. Бактерии способны длительно персистировать в мочеполовой системе [1]. Наиболее распространенные заболевания, вызванные энтерококками, представлены в таблице 2.
Таблица 2. Заболевания человека, вызываемые энтерококками
| Эндокардит |
| Инфекции кожи и мягких тканей |
| Инфекции мочеполовой системы |
| Остеомиелит |
| Септический артрит |
| Бактериемии |
| Инфекции дыхательных путей |
| Интраабдоминальные инфекции |
| Эндофтальмит |
Энтерококки были названы внутрибольничным патогеном 90-х годов минувшего века [59]. Усиление их роли как нозокомиального патогена в значительной степени обуславливается множественной резистентностью к антибиотикам. Описана устойчивость энтерококков к беталактамным антибиотикам, низким дозам аминогликозидов. В последние годы стала расти их устойчивость к ванкомицину [8, 9, 22, 33, 44]. Факторами риска для распространения ванкомицинустойчивых штаммов являются использование ванкомицина для профилактики, частое применение его для терапии инфекционных осложнений, использование цефалоспоринов III поколения, длительные сроки госпитализации и тяжелое течение заболевания [33].
Роль энтерококков как экзогенного источника инфекции определяется тем, что они длительно сохраняют жизнеспособность на объектах внешней среды, даже в присутствии антисептических растворов. Одной из основных причин распространения энтерококков в стационарах является присущая им природная резистентность к некоторым часто применяемым антибиотикам, в частности к аминогликозидам и цефалоспоринам III поколения, вследствие их селективного давления при назначении больным [8, 9, 22, 33, 73]. Широко распространена резистентность к хлорамфениколу, эритромицину, тетрациклину и клиндамицину. Чувствительные к ванкомицину до 80-х годов прошлого столетия энтерококки к настоящему времени все чаще замещаются ванкомицинрезистентными штаммами. За последние 20 лет заболеваемость, вызванная данными штаммами энтерококков в детских стационарах, возросла более чем в 20 раз [8]. Энтерококки были высокоустойчивы к цефалоспоринам I и II поколений, фторхинолонам, амногликозидам, а также к оксолиновой кислоте. Среди клинических изолятов 70% и более штаммов E. faecalis были чувствительны к ванкомицину, амоксициллину/клавулановой кислоте, имипенему, нитрофурантоину; 51–70% штаммов E. faecium были чувствительны к ванкомицину, нитрофурантоину и нитроксолину [8].
Интенсивные исследования последних лет позволили установить, что данные бактерии синтезируют существенное количество веществ, так называемых факторов вирулентности, способствующих развитию инфекционного процесса. К таким факторам можно отнести поверхностные белки, участвующие в процессе адгезии и инвазии, экскретируемые белки и токсины, обеспечивающие повреждение тканей хозяина, белки, обуславливающие устойчивость к антибиотикам, а также факторы, индуцирующие воспаление (табл. 3).
При этом нельзя не отметить, что многие из так называемых факторов патогенности энтерококков являются необходимыми компонентами их функционирования, обеспечивающими их существование в свойственной им экосистеме, и не связаны напрямую с повреждением тканей хозяина или подавлением системы иммунитета. Так, адгезины жизненно необходимы для нормальной колонизации в желудочно-кишечном тракте, а гидролаза желчных кислот повышает их шансы выжить в двенадцатиперстной кишке. Детальный молекулярно-генетический анализ вирулентных штаммов энтерококков показал, что большинство генов вирулентности локализовано достаточно компактно на геноме данных штаммов. В настоящее время достаточно хорошо установлено, что участки генома с генами вирулентности являются мобильными элементами и могут передаваться от одного штамма другому. Данные генетические элементы, называемые «островами» патогенности, могут содержать различный набор генов вирулентности, включая гены устойчивости к антибиотикам [3, 58]. Большинство исследователей полагает, что именно данные гены наиболее важны для развития энтерококкового инфекционного процесса [70]. На «островах» патогенности обнаруживают комплекс генов цитолизинов cyl, ген адгезина esp, ген поверхностно экспрессируемой сериновой протеиназы spr, гидролазы желчных bhs, гены устойчивости к ванкомицину и ряд других. Однако достоверной связи между каким-либо из факторов в геноме и развитием инфекции показать до сих пор не удалось.
Таблица 3. Факторы патогенности энтерококков
| Адгезия и колонизация | КапсулаАдгезин ЕspАдгезин AsaФактор агрегацииАдгезин EfaA
Рецептор коллагена |
cpsasa1, 373espaggefaA
ase |
Bentley et al., 2006Hancock et al., 2002Nallapareddy et al., 2000Bensing, Dunny, 1993
Creti et al., 2004 |
| Пенетрация, колонизация, повреждение тканей | ЖелатиназаСериноваяпротеиназаFsr-регуляторГиалуронидаза
Цитолизин |
gelEsprfsr
сyl |
Qin et al., 2000Tacao et al., 1997Gilmore, 1990Nakayama et al., 2006
Danny et al., 1978 |
| Устойчивость к антибиотикам и микробицидным факторам организма и ингибиция других бактерий | Устойчивость к антибиотикам.Фактор устойчивости к желчным кислотам | tetM, vanA, B, CeryA, Bbsh
glsB |
Roberts et al., 2005Evers et al., 1993Manson et al., 2003Oh et al., 1998Begley et al., 2005Dashkevicz et al., 1989Nannini et al., 2005
Giard et al., 2002 |
| Гемолиз, токсигенность, бактериоциногенность | ГемолизиныЦитолизиныи бактериоцины
Феромоны |
hlycylA, B, M
cpd, cob, ссf |
Ike, Clewell, 199 2Gilmore et al., 1994Nakayama et al., 2006
Dunny et al., 1979 |
Есть ли польза от энтерококков?
Все сказанное выше указывает на существенную роль энтерококков в развитии инфекционных процессов и может определять отношение клиницистов к данным бактериям. Самым простым решением было бы элиминировать энтерококки из нашей экосистемы. Однако простые решения не всегда возможны. Дело в том, что энтерококки различных видов являются естественными обитателями нашего организма, они одними из первых колонизируют организм новорожденных, а система врожденного иммунитета не распознает их как врагов. Более того, практически все птицы и млекопитающие в норме колонизированы энтерококками (табл. 4). В соответствии с существующими стандартами в норме в толстом кишечнике должно обитать от 107 до 108 жизнеспособных клеток энтерококков на грамм [10]. Наиболее частыми представителями энтерококков, колонизирующих человеческий организм, являются энтерококки двух видов – E. faecium и E. faecalis. Благодаря уникальной даже для бактерий жизнеспособности (устойчивость к низким значениям рН, к желчным кислотам, к широкому диапазону температур) энтерококки обитают практически во всех отделах кишечника, часто обнаруживаются во влагалище и желудке [50]. Энтерококки как естественные обитатели кишечника принимают самое активное участие в происходящих там метаболических процессах, синтезе витаминов, гидролизе сахаров, в частности лактозы, деконъюгировании желчных кислот, элиминации патогенных бактерий. Количественное содержание энтерококков в кишечнике находится в строгом соответствии с уровнем содержания других индигенных бактерий, в частности кишечных палочек, лактобацилл и бифидобактерий [4]. Энтерококки являются эффективными иммуностимуляторами, способными поддерживать адекватный для нормальной работы системы врожденного иммунитета уровень цитокинов широкого спектра.
Таблица 4. Частота обнаружения энтерококков у млекопитающих и птиц [49]
| E. faecalis | ++ | (+) | + | ++ |
| E. faecium | ++ | ++ | + | ++ |
| E. durans/hirae | (+) | – | (+) | (+) |
| E. gallinarum | (+) | – | (+) | – |
| E. casseliflavus | (+) | – | + | – |
| E. cecorum/columbae | – | + | – | + |
Будучи столь широко распространенными в природе и обладая важной способностью гидролизовать ряд сахаров, включая лактозу (энтерококки, как лактококки, лактобациллы и целый ряд других бактерий, относятся к молочнокислым микроорганизмам), энтерококки широко и с давних пор используются в производстве пищевых продуктов. Так, энтерококки необходимы в сыроварении (табл. 5), применяются для приготовления целого ряда мясных продуктов, ферментированных продуктов на основе сои и зерновых. Основной причиной, объясняющей столь широкое применение энтерококков в пищевой промышленности, помимо их высокой устойчивости к воздействию кислот, солей и высокой температуры является их способность эффективно подавлять болезнетворные бактерии в самих пищевых продуктах. Незначительное содержание энтерококков в колбасах, сырах и мясном фарше не позволяет размножаться в пищевых продуктах таким микроорганизмам, как стафилококки, листерии и кишечные палочки. Основная причина антагонистической активности энтерококков – их способность продуцировать короткие пептиды – энтероцины. Данные пептиды, которые чаще всего относятся к педиоциноподобным бактериоцинам второго класса [48], способны при контакте с бактерией вызывать повреждение клеточной стенки с последующей гибелью клетки. По-видимому, механизм повреждающего действия энтероцинов сходен с таковым, детально изученным у таких лантибиотиков, как низин и мерзацидин [74]. В настоящее время подробно изучены структура и механизм действия лактицина, синтезируемого, как и лантибиотик низин, бактериальными клетками Lactococcus lactis. Недавно обнаруженный у лактококков новый лактицин 3147 состоит из двух пептидов – LtnA1 и LtnA2, синергическое действие которых обуславливает антибиотическую активность в наномолярной концентрации. Полагают трехступенчатую модель механизма повреждающего действия лактоцина 3147:
- пептид LtnA1 взаимодействует с липидом II мембраны клетки-мишени,
- затем иммобилизованный на липиде II компонент лактоцина LtnA1 взаимодействует с компонентом LtnA2, образуя двукомпонентный комплекс,
- далее С-терминальный конец двукомпонентного комплекса транслоцирует в мембрану с формированием поры, через которую из пораженной клетки выходит наружу содержимое ее цитоплазмы [74].
Следует отметить, что энтероцины широко распространены среди штаммов энтерококков, список которых приведен в таблице 6.
Таблица 5. Штаммы энтерококков, применяемые в пищевой промышленности [36]
| E. faecalis B114 | Сыр «камамбер» | Sulzer, Busse, 1991 |
| E. faecium 7C5 | Сыр Taleggio | Giraffa et al., 1995 |
| E. faecalis INIA 4 | Сыр Manchego | Joosten et al., 1995 |
| E. faecalis INIA 4 | Сыр Hispano | Garde et al., 199 7 |
| E. faecalis INIA 4 | Сыр Manchego | Nunez et al., 1997 |
| E. faecalis INIA 4 | Сыр Hispano | Oumer et al., 2001 |
| E. faecium CCM 4231 | Сыр Saint-Paulin | Laukova et al., 2001 |
| E. faecium CCM 4231 | Испанская колбаса холодного копчения | Callewaert et al., 2000 |
| E. faecium RZS C13 | Испанская колбаса холодного копчения | Callewaert et al., 2000 |
| E. faecium CTC49 2 | Колбаса твердого копчения | Aymerich et al., 2000 |
| E. faecium CTC49 2 | Копченая свинина | Aymerich et al., 2002 |
| E. faecalis TAB 28 | Творог | Rodriguez et al., 2001 |
| E. faecium RZS C5 | Сыр Cheddar | Foulquie Moreno et al., 2003 |
| E. faecium DPC 1146 | Сыр Cheddar | Foulquie Moreno et al., 2003 |
| E. faecium FAIR-E 198 | Сыр «фета» | Sarantinopoulos et al., 2002 |
| E. casseliflavus IM 416K1 | Итальянская колбаса (Cacciatore) | Sabia et al., 2003 |
Таблица 6. Некоторые энтероцины, выделенные из энтерококков
| Enterocin 226 NWC | Сыр Mozzarella | Villani et al., 1993 |
| Enterocin 4 | Молочная промышленность | Rodriguez et al., 1997 |
| Enterocin CCM 4231 | Корм для скота | Laukova et al., 1998 |
| Enterocin CCM 4231 | Соевое молоко | Laukova, Czikkova, 199 |
| Enterocin CCM 4231 | Сосиски Hornad salami | Laukova et al., 199 |
| Enterocin CCM 4231 | Брынза | Laukova, Czikkova, 2001 |
| Enterocin CRL 35 | Козий сыр | Farias et al., 199 |
| Enterocin CRL 35 | Мясные продукты | Vignolo et al., 2000 |
| Enterocin CTC 49 2 | Мясные продукты | Aymerich et al., 2000 |
| Enterocin CTC 49 2 | Свинина копченая | Aymerich et al., 2002 |
| Энтероцины А и В | Закваска «Авена» | Суворов и др., 2003 |
Энтерококки в составе препаратов и продуктов – пробиотиков
Полезные для человека свойства энтерококков (высокая антагонистическая активность в отношении патогенной микрофлоры, участие в формировании и поддержании иммунитета, участие в нормальном пищеварении, противовоспалительные свойства, витаминообразование) определили их частое использование в медицине в качестве пробиотиков. Под пробиотиками в настоящее время понимают препараты или пищевые продукты, содержащие живые бактерии, которые после попадания в человеческий организм оказывают благотворное воздействие, в первую очередь за счет восстановления нормального микробиоценоза кишечника [4, 7, 29, 37].
Таким образом, пробиотики, содержащие жизнеспособные энтерококки, могут входить в состав пищевых продуктов или фармакологических препаратов. Бактерии, входящие в состав пробиотиков, должны быть способными сохранять жизнеспособность при прохождении желудочно-кишечного тракта, должны подавлять развитие патогенных бактерий, положительно влиять на собственную микрофлору человеческого организма и быть безопасными для человека [68]. Наиболее часто в качестве пробиотиков используют молочнокислые бактерии Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus plantarum, Enterococcus faecium, Enterococcus faecalis, Streptococcus thermophilus, Lactococcus lactis, Leuconostoc mesenteroides, Propionibacterium freudenreichii, Pediococcus acidilactici, Sporolactobacillus inulinus, Escherichia coli, Saccharomyces cerevisiae или Saccharomyces boulardii 37, 42]. Благодаря широкому распространению в природе энтерококки на основе штаммов E. faecium и E. faecalis применяют не только для человека, но и для животных. Так, в 2004 году девять различных штаммов E. faecium были утверждены European Commission (EC) для применения на животных.
Одним из наиболее хорошо исследованных штаммов является E. faecium SF68, который входит в состав ряда фармакологических препаратов. Данный штамм проявил эффективность в клинических исследованиях при лечении диареи, вызванной приемом антибиотиков [74], а также диареи у детей [19]. E. faecium SF68 в клинических исследованиях, проведенных в Бельгии, продемонстрировал эффективность при острой диарее у взрослых [24]. Прием данного пробиотика позволял сокращать продолжительность острой диареи на один – три дня. E. faecium SF68 эффективен и при лечении животных. Так, включение данного штамма в состав корма для собак существенно улучшало как гуморальный, так и клеточный иммунитет [21]. Кисломолочный продукт, содержащий E. faecium SF68 (GAIO, MD Foods, Aarhus, Denmark), в течение длительного времени продается в Дании, причем его исследования показали гипохолестеринемический эффект [13]. В аналогичных исследованиях, проведенных в России с пробиотиком, содержащим штамм E. faecium L3, на больных с хроническими гепатитами, было также показано существенное улучшение целого ряда биохимических параметров, включая уровень холестерина крови и билирубина [12]. Пробиотический продукт, приготовленный на основе соевого молока, содержащий штамм E. faecium CRL 183 в сочетании с Lactobacillus jugurti, также существенно снижал уровень холестерина. Использование другого штамма – E. faecium PR88 (E. faecium Fargo 688® from Quest International, Naarden, Netherlands) продемонстрировало положительное влияние энтерококков у больных с синдромом раздраженной толстой кишки [14]. Данный штамм был добавлен в состав закваски для приготовления пробиотического сыра «чэддер».
Длительный прием (56 недель) пробиотика на основе штамма E. faecium М-74 добровольцами пожилого возраста с патологиями сердца существенно улучшал показатели функционирования сердечно-сосудистой системы, а также иммунологические параметры, характеризующие степень развития атеросклероза [43]. Накоплен существенный опыт длительного клинического применения пробиотика Линекс® (фирма Lek, Словения). Одна капсула Линекс содержит живые лиофилизированные бактерии: не менее 1,2×107 Bifidobacterium infantis var. liberorum, Lactobacillus acidophilus и Enterococcus faecium. Входящие в состав пробиотика энтерококки, бифидобактерии и лактобациллы поддерживают и регулируют физиологическое равновесие кишечной микрофлоры и обеспечивают ее физиологические функции (антимикробную, витаминообразующую, пищеварительную) во всех отделах кишечника. Показания: лечение дисбактериозов различной этиологии. Линекс может быть назначен одновременно с антибиотиками и химиотерапевтическими препаратами. Дозы и применение: грудные дети и дети до 2-х лет – по 1 капсуле три раза в день; дети от 2-х до 12 лет – по 1 или 2 капсулы три раза в день; взрослые – по 2 капсулы три раза в день. Длительность лечения зависит от причины развития дисбактериоза и индивидуальных особенностей [2]. Обычный курс применения Линекса – 2–4 недели.
Позитивный эффект пробиотика Симбиофлор (Германия), содержащего энтерококки, подтвержден на огромном клиническом материале (более 2000 пациентов). Препарат был эффективным при таких заболеваниях, как хронический тонзиллит, хронический синусит, хронический бронхит, синдром раздраженного кишечника, острый энтерит (Руш К., Руш Ф. Микробиологическая терапия. – М.: Арнебия, 2003).
Штамм E. faecium Walthers ECOFLOR (Walthers Health Care, Den Haag, Netherlands) проявлял эффективность при диарее, активно подавлял листерии за счет продукции энтероцинов и снижал уровень холестерина крови у пациентов. Исследования данного штамма показали также его противоопухолевый эффект. Интересно, что российский штамм E. faecium L3 также оказался мощным продуцентом энтероцинов А и В, подавляющих как грамположительные, так и грамотрицательные патогенные бактерии [76]. Высокая антагонистическая активность данных энтероцинов позволила существенно ускорить эрадикацию патогенных штаммов H. pylori из желудка и двенадцатиперстной кишки [72]. Благотворный эффект приема данного штамма в составе пробиотиков был также продемонстрирован при лечении онкологических больных [11].
Естественным вопросом, беспокоящим клиницистов, которые назначают пробиотики на основе энтерококков, является опасение, что пробиотический энтерококк после приема будет колонизировать желудочно-кишечный тракт интенсивнее, чем естественные обитатели, и в какой-то момент приобретет устойчивость к антибиотикам (в первую очередь – к ванкомицину) либо набор генов вирулентности. Данное опасение, имеющее под собой логическое основание, при ближайшем рассмотрении представляется фантастическим по целому ряду причин.
Во-первых, молочнокислые энтерококки, входящие в состав пробиотиков, не адаптированы к длительной персистенции в человеческом организме, являясь в своей основе производственными штаммами, исходно селекционированными для создания пищевых продуктов. Так, пробиотический штамм L3 в условиях эксперимента уже через две недели после окончания приема полностью элиминируется из организма [75]. Данное наблюдение указывает на низкую вероятность колонизации пробиотиками такого рода даже в случае передачи им генов лекарственной устойчивости.
Во-вторых, учитывая естественную концентрацию энтерококков в кишечнике человека – 107–108 на грамм кишечного содержимого, нетрудно подсчитать, что для введения сколько-нибудь значимого количества пробиотиков, сравнимого с количеством собственных энтерококков, нужно в сотни раз увеличивать дозы приема. Так, предлагаемая дозировка пробиотика Линекс составляет 0,1–0,2% от естественного количества энтерококков.
В-третьих, исследования штаммов энтерококков, используемых в качестве пробиотиков, выявили их низкий уровень генетической компетентности по сравнению с индигенными штаммами, что также снижает риск приобретения новых генетических маркеров [49]. И что особенно важно, штаммы энтерококков, используемые в клинике, наиболее тщательно отбираются в плане их безопасности, начиная с экспериментов на лабораторных животных и заканчивая наблюдениями за больными. Исследования молочнокислого продукта, содержащего E. faecium SF68, в плане возможной передачи данному штамму устойчивости к ванкомицину, проведенное на добровольцах, не выявили ни одного случая приобретения данного признака штаммом пробиотика [54]. В настоящее время наиболее достоверным критерием, позволяющим охарактеризовать энтерококки в плане их потенциальной патогенности, является наличие у энтерококкового штамма набора генов патогенности (см. табл. 3). Большинство генов патогенности (например, комплекс генов цитолизинов) обнаруживается только у бактериальных клеток Enterococcus faecalis, причем последние располагаются на геноме в пределах «островов» патогенности [3]. У штаммов E. faecium частота обнаружения генов патогенности существенно ниже – наиболее часто удается обнаружить либо гены, кодирующие синтез факторов адгезии, либо гены устойчивости к антибиотикам [58]. Обнаружена закономерная связь между наличием в штаммах энтерококков тех или иных генов патогенности и характером течения патологического процесса [30]. При этом штаммы энтерококков – представители нормальной микрофлоры практически никогда не содержали генов цитолизинов при достаточно высоком содержании факторов адгезии [30]. Энтерококки же, выделенные из пищевых продуктов или штаммов пробиотиков, оказались практически свободными от генов факторов патогенности, за исключением наличия гена gelЕ [32]. В аналогичном исследовании коллекции патогенных штаммов энтерококков по сравнению с пробиотическим штаммом L3 было показано, что данный штамм также не содержит генов патогенности, выбранных для исследования [51]. В недавно проведенном исследовании клинических штаммов энтерококков (собственные данные авторов), выделенных от больных, принимавших пробиотик Линекс, было установлено, что ни один из этих штаммов не имел генетических характеристик, свойственных штамму E. faecium, входящему в состав препарата Линекс, а бактерии пробиотического штамма не содержали известных генов патогенности, детектируемых с помощью ПЦР (табл. 7).
Таблица 7. Анализ клинических штаммов энтерококков на предмет наличия генов патогенности
| Праймеры | ||||||||||||||||
| E. faecalis | + | – | – | – | – | – | – | – | + | – | + | + | + | + | – | – |
| E. faecium | + | + | – | – | + | + | + | – | + | + | + | + | + | – | +/–* | – |
| gelE | + | +/*– | – | – | – | – | +/–* | – | – | – | + | + | + | + | – | – |
| еsp | + | + | – | – | – | – | – | – | + | – | +/–* | +/–* | – | – | – | – |
| sprE | + | – | – | – | – | – | – | – | – | – | + | – | + | – | – | – |
| fsrB | – | – | – | – | – | – | – | – | – | – | + | – | + | – | – | – |
| аsa1 | + | – | – | – | – | – | – | – | – | – | + | +/–* | + | + | – | – |
| cylA | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – |
| cyIM | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – |
| efaA | + | – | – | – | – | – | – | – | – | – | + | – | + | – | – | – |
* Размер ампликона отличен от ожидаемого, штамм № 5 соответствует штамму E. faecium, входящему в состав препарата Линекс, штамм № 6 соответствует другому штамму SF68, использованному в качестве контроля.
Как уже отмечалось, энтерококки с давних времен применяются для производства и сохранения пищевых продуктов – за счет их способности ферментировать лактозу и угнетать развитие патогенных бактерий. В настоящее время российские исследователи пытаются выделить пробиотические и пищевые энтерококки в новый вид микроорганизмов – Enterococcus lactis [23].
Послесловие
Приведенные нами данные литературы указывают на неоднозначную роль энтерококков в жизни человека. Энтерококки широко распространены в природе. Они являются представителями резидентной нормальной микрофлоры человека и животных, встречаются в пищевых продуктах, воде, растениях, у животных, птиц и насекомых. У людей, как и у животных, они обитают в кишечнике, женском генитальном тракте, реже в уретре мужчин, могут колонизировать слизистые оболочки полости рта и кожу, особенно в условиях стационаров.
Некоторые штаммы данных микроорганизмов, приобретя ряд признаков патогенности, могут вызывать серьезные инфекционные заболевания, а другие штаммы служат необходимым компонентом нормального микробиоценоза. Ключевым критерием для отдифференцировки энтерококков, полезных для человека, от энтерококков патогенных является наличие или отсутствие у штамма энтерококков набора генов патогенности.
Важное значение имеет определение у клинических изолятов Е. faecalis и Е. faecium генов, контролирующих синтез известных факторов патогенности: Esp, Asa1 и EfaA – поверхностные белки, участвующие в процессе адгезии и инвазии; CylA и CylM – цитолизины; GelE – желатиназа; SprE – сериновая протеиназа и FsrB – феромон. Некоторые штаммы Е. faecalis обладают гиалуронидазной активностью. Энтерококковый цитолизин поражает эритроциты и некоторые эукариотические типы клеток, в то время как бактериальный феромон является низкомолекулярным пептидом, способствующим конъюгативной передаче плазмидной ДНК от штамма к штамму. Существует предположение, что этот феромон может действовать как хемоаттрактант для нейтрофилов, способствуя усилению воспалительного ответа на инфекцию. Более того, у клинических штаммов E. faеcalis обнаружена плазмида, кодирующая синтез поверхностного белка, сообщающего способность энтерококкам к интернализации клетками кишечного эпителия, культивируемыми in vitro [63].
Следует указать, что энтерококки редко являются причиной инфицирования у здоровых лиц. Только при значительном снижении резистентности макроорганизма, и особенно при травмах кишечника или мочеполового тракта в результате инструментальных исследований, они могут проникать в стерильные в нормальных условиях органы и ткани организма хозяина, вызывая оппортунистические инфекции мочевыводящих путей, бактериемию, сепсис, подострый септический эндокардит, инфекции желчных путей или абсцессы в брюшной полости.
Лабораторная диагностика. Для выделения энтерококков применяют стандартные методы получения проб крови, мочи, отделяемого ран и других видов клинического материала, используя при необходимости стерильные ватные тампоны. Для доставки материала в лабораторию возможно использование любой транспортной среды или сухого тампона. Посев проб должен быть осуществлен как можно скорее после их получения, предпочтительнее в течение одного часа. Лабораторную диагностику энтерококковых инфекций осуществляют с использованием бактериологического метода исследования, предусматривающего посев патологического материала на питательные среды с последующим выделением чистых культур, подозрительных на энтерококки. Используют энтерококк-агар производства ГНЦ ПМ (Оболенск) или производства ФГУП «Аллерген» (Ставрополь), Enterococcus Agar или HiCrome UTI Agar (М1353) фирмы HiMedia (Индия). Следует отметить, что на чашках с хромогенным агаром HiCrome UTI возможно дифференцировать одновременно колонии Enterococcus faecalis (голубовато-зеленого цвета), Escherichia coli (пурпурного цвета), Staphylococcus aureus (бесцветные колонии) и Klebsiella pneumoniae (мукоидные колонии голубого цвета). Для последующей видовой идентификации колонии, типичные для энтерококков, отвивают на азидовый агар. Выделенные штаммы дифференцируют с гемолитическими и зеленящими стрептококками. Идентификацию проводят с помощью физиолого-биохимических тестов.
Первый день: посев поступившего на исследование клинического материала производят принятыми при диагностике стрептококковых инфекций методами с использованием питательных сред.
Второй день:
- просматривают первичные посевы на чашках с кровяным агаром. Энтерококки образуют мелкие кремовые или белые, круглые, с ровными краями глянцевые колонии с α-, β-гемолизом или негемолитические;
- из колоний с признаками, характерными для энтерококков, бактериологической петлей берут небольшое количество материала и готовят мазки для окраски по Граму. При микроскопическом исследовании энтерококки представляют собой грамположительные полиморфные кокки, располагающиеся короткими цепочками или небольшими скоплениями, что определяет необходимость дифференцировать их с гемолитическими и зеленящими стрептококками;
- колонии, характерные для энтерококков, высевают и в бульон для получения чистой культуры, необходимой нейшей идентификации.
Идентификация видовой принадлежности энтерококков
Первый день: суточную бульонную культуру энтерококка
- на желчно-щелочной агар (ЖЩА);
- в молоко с 0,1% раствором метиленового синего.
Второй и третий дни:
- если на ЖЩА есть рост в виде круглых, блестящих, синеватого цвета, слегка выпуклых колоний, которые случаев появляются на третьи сутки инкубирования при 37°С, исследуемая культура подозрительна на
- в пробирках с молоком энтерококки редуцируют вследствие чего уже через 16–20 часов после посева в термостате цвет среды изменяется с голубого на Способность микробных культур к росту на ЖЩА 0,1% раствором метиленового синего в молоке указывает ность исследуемой культуры к энтерококкам. Идентификация принадлежности энтерококков и определение спектра к антибактериальным препаратам и действию лечебного могут быть необходимы для назначения больному адекватной иногда и в эпидемиологических целях. Известно, что проявляют более выраженную резистентность к пенициллину циллину, чем культуры Е. faecalis. Резистентность к наиболее часто определяется у Е. faecium. Идентификацию рококков осуществляют с помощью биохимических тестов. Более 80% энтерококков реагируют с антисывороткой по Лэнсфилду.
Молекулярно-генетическая идентификация ДНК
Используются праймеры к трем группам генов:
- для видовой идентификации – позволяющие дифференцировать штаммы E. faecium и Е. faecalis;
- гены поверхностных белков-адгезинов (esp, asa1, efaA);
- гены, кодирующие синтез цитолизинов (cylA, cylM), желатиназы (gelE), сериновой протеиназы (sprE) и феромона (fsrB).
Праймеры, рекомендуемые для выявления генов, ассоциированных с патогенностью изолятов Еnterococcus faecalis и Еnterococcus faecium, приведены в таблице 8.
Выбор данных праймеров обусловлен принятыми в современной научной литературе стандартными подходами, позволяющими отличить патогенные штаммы энтерококков от апатогенных.
Таблица 8. Праймеры, используемые для выявления генов, ассоциированных с патогенностью энтерококков
| gelE | gelE 1 | ACCCCGTATCATTGGTTT | 419 |
| gelE 2 | ACGCATTGCTTTTCCATC | ||
| esp | esp 1 | TTGCTAATGCTAGTCCACGACC | 93 |
| esp 2 | GCGTCAACACTTGCATTGCCGAA | ||
| sprE | sprE 1 | GCGTCAATCGGAAGAATCAT | 233 |
| sprE 2 | CGGGGAAAAAGCTACATCAA | ||
| fsrВ | fsrB 1 | TTTATTGGTATGCGCCACAA | 316 |
| fsrB 2 | TCATCAGACCTTGGATGACG | ||
| asa1 | asa1 1 | CCAGCCAACTATGGCGGAATC | 529 |
| asa1 2 | CCTGTCGCAAGATCGACTGTA | ||
| cylA F | t56 | ACTCGGGGATTGATAGGC | 688 |
| R | GCTGCTAAAGCTGCGCTT | ||
| E. faecalis | F t54 | TCAAGTACAGTTAGTCTTTATTAG | 941 |
| R | ACGATTCAAAGCTAACTGAATCAGT | ||
| E. faecium | F t54 | TTGAGGCAGACCAGATTGACG | 658 |
| R | TATGACAGCGACTCCGATTCC | ||
| cylM | F | GATTGGAATGTGGGAATCCTAA | 825 |
| R | ACTTCCGGCAACCTTTAGTGTA | ||
| efaA | F | CGTTAGCTGCTTGCGGGAATC | 735 |
| R | CCATACTACGTTTATCGACAC |
Лечение и профилактика. Многочисленные исследования свидетельствуют о свойственной энтерококкам резистентности к широкому спектру антибактериальных препаратов. Чувствительность к действию антибиотиков двух наиболее часто выделяемых при инфекциях человека видов — Е. faecalis и Е. faecium — различна. Известно, что около 90% штаммов Е. faecalis и около 50% штаммов Е. faecium чувствительны к ампициллину. При резистентности энтерококков к ампициллину необходимо использовать ванкомицин. Неосложненные инфекции мочевыводящих путей лечат ампициллином, тетрациклином или хинолонами. При системных инфекциях энтерококковой природы, опасных для жизни, целесообразно использовать антибиотики, действующие на клеточную стенку, такие как пенициллин, ампициллин или ванкомицин, в сочетании с аминогликозидами (гентамицином или стрептомицином) или хлорамфениколом. Однако выбор наиболее эффективной комбинации антибиотиков для лечения системных энтерококковых инфекций возможен только после предварительного определения in vitro антибиотикорезистентности выделяемых в каждом конкретном случае культур энтерококков. Интенсивная терапия антибиотиками, не эффективными в отношении энтерококков, может способствовать возникновению генерализованных энтерококковых инфекций, уничтожая нормальную микрофлору, конкурирующую с энтерококками, с одной стороны, и оказывая иммуносупрессивное действие — с другой. Учитывая рост в последние годы внутригоспитальных инфекций, вызываемых полирезистентными энтерококками, появляющимися в результате селекции в связи с широким использованием антибиотиков в стационарах, важнейшим фактором предупреждения нозокомиальных энтерококковых инфекций следует признать четко обоснованное применение антибиотиков.
Пробиотические препараты. Энтерококки и кишечные палочки явились основой первых препаратов-пробиотиков, производство которых было налажено в Европе в середине 20-х годов прошлого столетия. Следует отметить, что при заселении кишечника колиподобной микрофлорой и энтерококком наблюдается образование колоний только на поверхности слизистой оболочки, выявляемых гистологически (Savage et al., 1968). В настоящее время существует довольно большая группа пробиотических препаратов, включающих симбиотические штаммы энтерококков и оказывающих благотворное воздействие на человеческий организм.
Особенно ценными свойствами этерококков являются:
- высокая антагонистическая активность в отношении патогенной микрофлоры,
- участие в формировании и поддержании иммунитета,
- участие в нормальном пищеварении,
- противовоспалительные свойства,
- витаминообразование,
- восстановление нормального микробиоценоза кишечника [4, 7, 29, 37, 76].
Ярким представителем энтерококксодержащих средств, представленных на российском рынке, является препарат Линекс, высокая пробиотическая эффективность которого подтверждена длительным опытом клинического применения как в нашей стране, так и за рубежом.
Литература
- Билимова С.И. Характеристика факторов персистенции энтерококков. Журн. микробиол. 2000, 4: 104, 105.
- Бондаренко В.М. Поликомпонентные пробиотики: механизм действия и терапевтический эффект при дисбиозах кишечника. Фарматека. 2005, 20 (115): 46–54.
- Бондаренко В.М. «Острова» патогенности бактерий. Журн. микробиол. 2001, 4: 67–74.
- Бондаренко В.М., Мацулевич Т.В. Дисбактериоз кишечника как клинико-лабораторный синдром: современное состояние проблемы. ГЭОТАР-Медиа. М., 2007, 304 с.
- Бондаренко В.М., Петровская В.Г. Ранние этапы развития инфекционного процесса и двойственная роль нормальной микрофлоры. Вестн. РАМН. 1997 , 3: 7–10.
- Габриэлян И.Н., Горская Е.М., Спирина Т.С., Преображенская Т.Б. Энтерококки как возбудители инфекционных послеоперационных осложнений. Журн. микробиол. 2007, 4: 50–53.
- Грачева Н.М., Бондаренко В.М. Пробиотические препараты в терапии и профилактике дисбактериоза кишечника. Инфекц. болезни. 2004, 2 (2): 53 –58.
- Зубов Л.А., Богданов Ю.М. Современные проблемы антибиотикорезистентности в педиатрической клинике. Антибиотики и химиотерапия. 1998 , 38 (6): 43 –49.
- Сидоренко С.В. Клиническое значение антибиотикорезистентности грамположительных микроорганизмов. Инфекции и антимикробная терапия. 2003, 5 (2): 3–15.
- Отраслевой стандарт «Протокол ведения больных. Дисбактериоз кишечника» (ОСТ 91500.11.0004–2003, утвержден Приказом Министерства здравоохранения РФ № 231 от 09.06.2003 г.).
- Смирнова И.И., Филатова Е., Суворов А.Н., Былинская Е.Н. Опыт применения лечебно-профилактического драже «Ламинолакт медовый» при лучевом лечении больных раком тела матки. Вопросы онкологии. 2000, 6 (46): 748 –75 0.
- Тимофеева Е.И., Радченко В.Г., Суворов А.Н. Использование биопродукта «Ламинолакт» в комплексной терапии хронических гепатитов. Terra Medika Nova. 199 , 2: 19–35.
- Agerbaek М., Gerdes L.U., Richelsen B. Hypocholesteroleamic effect of a new fermented milk product in healthy middle-aged men. Eur. J. Clin. Nutr. 1995 , 49: 34 6–35 2.
- Allen W.D., Linggood M.A., Porter P. Enterococcus organisms and their use as probiotics in alleviating irritable bowel syndrome symptoms. European Patent 05087 01 (B1), 199 6.
- Aymerich T., Garriga M., Ylla J., Vallier J., Monfort J.M., Hugas M. Application of enterocins as biopreservatives against Listeria innocua in meat products. Journal of Food Protection 2000, 63: 721–726.
- Aymerich M.T., Garriga M., Costa S. et al. Prevention of ropiness in cooked pork by bacteriocinogenic cultures. Int. Dairy J. 2002, 12: 239 –246.
- Balla E., Dicks L.M., du Toit M. et al. Characterization and cloning of the genes encoding enterocin 1071A and enterocin 1071B, two antimicrobial peptides produced by Enterococcus faecalis BFE1071. Appl. Envir. Microbiol. 2000, 66: 1298 –1304.
- Begley M., Gahan C.G., Hill C. The interaction between bacteria and bile. FEMS Microbiol. Rev. 2005, 29: 625–651.
- Bellomo G., Mangiagle A., Nicastro L., Frigerio G. A controlled double-blind study of SF68 strain as a new biological preparation for the treatment of diarrhoea in pediatrics. Curr. Ther. Res. 198 0, 28: 927–93 6.
- Bensing B.A., Dunny G.M. Cloning and molecular analysis of genes affecting expression of binding substance, the recipient-encoded receptor(s) mediating mating aggregate formation in Enterococcus faecalis. J Bacteriol. 1993 , 175: 74 21–74 29.
- Benyacoub J., Czarnecki-Maulden G.L., Cavadini C. et al. Supplementation of food with Enterococcus faecium (SF68) stimulates immune functions in young dogs. J. Nutr. 2003, 133 : 1158 –1162.
- Boyce J.M., Mermel L., Zevos M.J. et al. Controlling vancomycin-resistant enterococci. Infect. Control. Hosp. Epidmiol. 1995 , 16: 634 –637.
- Botina S.G., Sukhodolets V.V. Speciation in bacteria: comparison of the 16S rRNA gene for closely related Enterococcus species. Russian J. Genetics. 2005, 42: 325–33 2.
- Buydens P., Debeuckelaere S. Efficacy of SF 68 in the treatment of acute diarrhea. A placebo-controlled trial. Scand. J. Gastroenterol. 199 6, 31: 887 –89 1. 25. Callewaert M.H., De Vuyst L. Competitiveness and bacteriocin production of enterococci in the production of Spanish-style dry fermented sausages. Int. J. Food Microbiol. 2000, 57 : 33 –42.
- Chenoweth C., Schaberg C. The epidemiology of enterococci. Eur. J. Clin. Microbiol. 199 0, 9: 80–89.
- Coburn P.S., Gilmore M.S. The Enterococcus faecalis cytolysin: a novel toxin active against eukaryotic and prokaryotic cells. Cell Microbiol. 2003, 5 (10): 661–669.
- Coque T.M., Patterson J.E., Steckelberg J.M. et al. Incidence of hemolysin, gelatinase-andeagregation substance among enterococci isolated from patients with endocarditis and other infections and from feces of hospitalized and community-based persons. J. Infect. Dis. 1995 , 171 (5): 1223–1229.
- Collins M.D., Gibson G.R. Probiotics, prebiotics, and synbiotics: approaches for modulating the microbial ecology of the gut. Am. J. Clin. Nutr. 199 , 69: 1052–1057.
- Creti R., Imperi M., Bertuccini L. et al. Survey for virulence among Enterococcus faecalis isolated from different sources. J. Med. Microbiol. 2004, 53 : 13–20.
- Dunny G.M., Craig R.A., Carron R.L., Clewell D.B. Plasmid transfer in Streptococcus faecalis: production of multiple sex pheromones by recipients. Plasmid. 1979 , 2: 454 –465.
- Eaton T.J., Gasson M.J. Molecular screening of Enterococcus virulence determinants and potential for genetic exchange between food and medical isolates. Appl. Environ. Microbiol. 2001, 67: 1628–1635.
- Edmond M.B. Multidrug-resistant enterococci and the threat of vancomycinresistant Staphylococcus aureus. In: Wenzel R.P. (ed.), Prevention and Control of Nosocomial Infections. 1997. P. 339 –335.
- Evers S., Sahm D.F., Courvalin P. The vanB gene of vancomycin-resistant Enterococcus faecalis V583 is structurally related to genes encoding D-Ala ligases and glycopeptide-resistance proteins VanA and VanC. Gene. 1993 , 124: 143 , 144.
- Farias M.T., de Ruiz Holgado A., Sesma F. Bacteriocin production by lactic acid bacteria isolated from regional cheeses: inhibition of foodborne pathogens. J. Food Protection. 1994 , 57 : 1013–1015.
- Foulquie Moreno M.R., Rea M., Cogan T., De Vuyst L. Applicability of a bacteriocin-producing Enterococcus faecium as a co-culture in Cheddar cheese manufacture. Int. J. Food Microbiol. 2003, 81: 73 –84.
- Fuller R. Probiotics in man and animals. J. Appl. Bacteriol. 1989 , 66: 365–378.
- Giard J.C., Verneuil N., Auffray Y., Hartke A. Characterization of genes homologous to the general stress-inducible gene gls24 in Enterococcus faecalis and Lactococcus lactis. FEMS Microbiol. Lett. 2002, 206: 235 –239.
- Gilmore M.S., Segarra R.A., Booth M.C., Bogie C.P., Hall L.R. et al. Genetic structure of the Enterococcus faecalis plasmid pAD1-encoded cytolytic toxin system and its relationship to lantibiotic determinants. J. Bacteriol. 1994 , 176: 735 –734.
- Giraffa G. Enterococci from foods. FEMS Microbiol. Rev. 2002, 26: 163–171.
- Hancock L.E., Gilmore M.S. The capsular polysaccharide of Enterococcus faecalis and its relationship to other polysaccharides in the cell wall. Proc. Natl. Acad. Sci. USA. 2002, 99 : 1574 –1579.
- Havenaar R., Huis in›t, Veld J.H. Probiotics, general view. In: Wood J.B.J. еd., Lactic Acid Bacteria in Health and Disease. Elsevier, London. 199 2. P. 151–170.
- Hlivak P., Janova E., Odrazka J. et al. Long-term (56 week) oral administration of probiotic E. faecium M-74 decreses the expression of sICAM-1 and monocyte CD49 in humans. Bratisl. Lek. Listy. 2005, 106 (4–5): 175 –181.
- Huycke M.M., Sahm D.F., Gilmore M.S. Multiple-drug resistant еnterococci: the nature of the problem and an agenda for the future. Emerg. Infect. Dis. 1998, 4: 239–249.
- Ike Y., Clewell D.B. Evidence that the hemolysin/bacteriocin phenotype of Enterococcus faecalis subsp. zymogenes can be determined by plasmids in different incompatibility groups as well as by the chromosome. J. Bacteriol. 199 2, 174 : 8172–8177.
- Isolauri E., Kirjavainen P.V., Salminen S. Probiotics: a role in the treatment of intestinal infection and inflammation? Gut. 2002, 50 (Suppl. 3): 54 –59.
- Kayaoglu G., Orstavik D. Virulence factors of Enterococcus faecalis: relationship to endodontic disease. Crit. Rev. Oral Biol. Med. 2004, 15: 308–320.
- Klaenhammer T.R. Genetics of bacteriocins produced by lactic acid bacteria. FEMS Microbiol. Rev. 1993 , 12: 39 –85.
- Klein G. Taxonomy, ecology and antibiotic resistance of enterococci from food and the gastro-intestinal tract. Int. J. Food Microbiol. 2003, 88 : 123–131.
- Koneman E.W. et al. Color atlas and textbook of diagnostic microbiology. 1997.
- Kolodjieva V., Yafaev R., Yermolenko E., Suvorov A. Incidence of virulence determinants in enterococcal strains of probiotic and clinical origin. New Insights Into and Old Enemy. 2006, 367–37 0.
- Laukova A., Czikkova S. Antagonistic effect of enterocin CCM 4231 from Enterococcus faecium on «bryndza», a traditional Slovak dairy product from sheep milk. Microbiol. Res. 2001, 156: 31–34.
- Laukova A., Vlaemynick G., Czikkova S. Effect of enterocin CCM 4231 on Listeria monocytogenes in Saint-Paulin cheese. Folia Microbiol. 2001, 46: 157 –160.
- Lund B., Edlund C., Barkholt L. et al. Impact on human intestinal microflora of an Enterococcus faecium probiotic and vancomycin. Scand. J. Infect. Dis. 2000, 32: 627–632.
- Maekawa S., Yoshioka M., Kumamoto Y. Proposal of a new scheme for the serological typing of Enterococcus faecalis strains. Microbiol. Immunol. 199 2, 36: 671–681.
- Manson J.M, Keis S., Smith J.M., Cook G.M. A clonal lineage of VanA-type Enterococcus faecalis predominates in vancomycin-resistant еnterococci isolated in New Zealand. Antimicrob. Agents Chemother. 2003, 47 : 204–210.
- Mathur S., Singh R. Antibiotic resistance in food lactic acid bacteria – a review. Int. J. Food Microbiol. 2005, 105: 281–295.
- McBride S., Fischetti V., LeBlanc D. et al. Genetic diversity among Enterococcus faecalis. PLoS ONE. 2007, 2: 58 2–58 6.
- Murray B.E. The life and times of the Enterococcus. Clin. Microbiol. 199 0, 3: 46–65.
- Nallapareddy S.R., Duh R.W., Singh K.V., Murray B.E. Molecular typing of selected Enterococcus faecalis isolates: pilot study using multilocus sequence typing and pulsed-field gel electrophoresis. J. Clin. Microbiol. 2002, 40: 868–87 6.
- Nallapareddy S.R., Qin X., Weinstock G.M. et al. Enterococcus faecalis adhesin, ace, mediates attachment to extracellular matrix proteins collagen type IV and laminin as well as collagen type I. Infect. Immun. 2000, 68: 5218–5224.
- Noskin G.A., Stozor V., Cooper I., Peterson L.R. Recovery of vancomycinresistant enterococci on fingerprints and environmental surfaces. Infect. Control. Hosp. Epidemiol. 1995 , 16: 57 –58 1.
- Olmsted S.B., Dunny G.M., Erlansen S.L., Wells C.L. A plasmid encoded surface protein on Enterococcus faecalis augments its internalization by cultured intestinal epithelial cells. J. Infect. Dis. 1994 , 170: 1549 –155 6.
- Patterson J.E., Sweeney A.H., Simms M. et al. An analysis of 110 serious enterococcal infections: epidemiology, antibiotic susceptibility, and outcome. Medicine. 1995 , 56: 191–200.
- Qin X., Singh K.V., Weinstock G.M., Murray B.E. Effects of Enterococcus faecalis fsr genes on production of gelatinase and a serine protease and virulence. Infect. Immun. 2000, 68: 2579 –258 6.
- Rodriguez J.M., Martinez M.I., Horn N., Dodd H.M. Heterologous production of bacteriocins by lactic acid bacteria. Int. J. Food Microbiol. 2003, 80: 101–116.
- Sabia C., de Niederhausern S., Messi P. et al. Bacteriocin-producing Enterococcus casseliflavus IM 416K1, a natural antagonist for control of Listeria monocytogenes in Italian sausages («cacciatore»). Int. J. Food Microbiol. 2003, 87 : 173 –179.
- Salminen S., Isolauri E., Salminen E. Clinical uses of probiotics for stabilising gut mucosal barrier: successful strains and future challenges. Antonie van Leeuwenhoek. 199 6, 70: 347 –358.
- Sarantinopoulos P., Kalantzopoulos G., Tsakalidou E. Citrate metabolism by Enterococcus faecalis FAIR-E 229. Appl. Envir. Microbiol. 2001, 67: 548 2–5487.
- Shankar N., Baghdayan A.S., Gilmore M.S. Modulation of virulence within a pathogenicity island in vancomycin-resistant Enterococcus faecalis. Nature. 2002, 417: 74 6–75 0.
- Sharpe M.E. Serological types of Streptococcus faecalis and its varieties and their cell wall type antigen. J. Gen. Microbiol. 1964, 36: 151–160.
- Simanenkov V., Suvorov A., Bovaeva D., Solovieva O. Effect of the therapy of patients with H.pylori related gastritis is correlated with organization of cag pathogenicity island. European congress of clinical microbiology and infection diseases. 2004, Prague. P. 179.
- Spera R.V., Farber B.F. Multiply-resistant Enterococcus faecium: the nosocomial pathogen of the 199 0. JAMA. 199 2, 268: 2563–2564.
- Wiedemann I., Bottiger T., Bonelli R. et al. The mode of action of the lantibiotic lacticin 3147 – a complex mechanism involving specific interaction of two peptides and the cell wall precursor lipid II. Mol. microbiol. 2006, 61 (2): 285 –296.
- Wunderlich P.F., Braun L., Fumagalli I. et al. Double-blind report on the efficacy of lactic acid-producing Enterococcus SF68 in the prevention of antibioticassociated diarrhoea and in the treatment of acute diarrhea. J. Int. Med. Res. 1989 , 17: 33 –338.
- Yermolenko E., Chernish A., Aleshina G. et al. Antagonistic activity of Enterococcus faecium L3 against different groups of pathogenic streptococci. New Insights Into and Old Enemy. 2006. P. 363–366.
Комментарии (видны только специалистам, верифицированным редакцией МЕДИ РУ) Если Вы медицинский специалист, войдите или зарегистрируйтесь