 [Белок гемоглобин выполняет функцию]
[Белок гемоглобин выполняет функцию]
Гемоглобин –главный белок цитозоля эритроцитов
Одну треть клеточной массы эритроцитов составляет гемоглобин. Он же придает и красный цвет эритроциту и крови и выполняет следующие функции
-
Транспорт кислорода по крови
-
Участие в транспорте диоксида углерода
-
Участие в создании буферной системы, поддерживающей концентрацию ионов водорода во внеклеточном пространстве.
Содержание гемоглобина в одном эритроците можно рассчитать, зная общее содержание гемоглобина и количество эритроцитов При концентрации гемоглобина в 160 г/л крови, которая содержит 5000 млрд эритроцитов содержание Hb в одном эритроците 32 пиког ( в норме 27-54).
-
При отклонении значений ниже указанных говорят о гипохромной анемии ( недостаток железа)
-
При отклонении значений выше указанных говорят о гиперхромной анемии (недостаток В12)
-
При уменьшении концентрации Hb и числа эритроцитов и нормальном содержании Hb в одном эритроците говорят о нормохромной анемии.
У нормального взрослого массой 70 кг и объемом крови в 5 л при условии среднего содержания Гб 160 г/л (16 г% или 9.9.ммоль/л ) общее количество Hb составит 800 г. Ежедневно при этом 6.25 г или около 1% распадается и синтезируется вновь.
Таласемии – болезни, вызываемые нарушениями синтеза цепей глобина.
Врожденные нарушения синтеза одной из двух глобиновых цепей получили название талассемий. Гомозиготные формы (Thalassaemia major) приводят в отличие от более благоприятных, гетерозиготных форм (Thalassaemia minor) всегда к смерти в детском возрасте, так как молекулярные изменения при них таковы , что полноценное снабжение кислородом тканей становится невозможным.
- талассемии. Делеции генов, кодирующих глобиновые цепи являются наиболее частой причиной этих заболеваний. В геноме человека имеется 4 гена a цепей (соответственно по две на каждой хромосоме 16),и это объясняет более мягкое течение этих талассемий, потому, что гомозиготные формы – талассемии, которые ведут к водянке плода (Morbus haemolyticus neonatorum) и к внутриматочной смерти, связаны с делециями всех четырех генов, кодирующих -глобиновые цепи.
Вследствие нарушения биосинтеза a цепей уменьшается не только синтез HbA1 но и HbA2, и HbF. У эмбриона избыток цепей, возникающий из-за ограниченного синтеза цепей ведет к сборке тетрамера -цепей- Hb4 ( Hb Барт) . Так как после рождения - цепи замещаются цепями, последние, не находя цепи для образования нормального гемоглобина, собираются в тетрамеры цепей Hb4 (HbH). Hb Барт и HB-H не обладают эффектом Бора, их кривые насыщения кислородом — гиперболы (отсутствие кооперативного эффекта), обладают низкой стабильностью, имеют склонность к образованию агрегатов, вследствие чего нормальная продолжительность жизни эритроцитов сокращается и заболевание проявляется в форме умеренной гипохромной гемолитической анемии.
талассемии в отличие от талассемий начинают проявляться только после рождения, когда произойдет замена -цепей цепями. Возникающий относительный избыток -цепей у взрослого человека сопровождается сохранением синтеза и цепей поэтому у гетерозиготных форм повышено содержание HBA2, (a2) до 4-6 % ( в норме 2-3 %) и HBF (22) до 0,5-6 % (в норме отсутствует), однако тетрамеров -цепей обычно не образуется .
Неустойчивость эритроцитов больных талассемиями, частично обусловлена тем, что свободные и цепи сильнее подвержены аутоокислению чем в составе тетрамеров нормального гемоглобина, а это приводит к увеличению образования большего количества супероксидных анионов, что может перекрыть мощность дисмутазной системы и привести к пероксидному повреждению липидов и SH-групп белков эритроцитарных мембран.
При гомозиготных формах -талассемий содержание HBF в эритроцитах может достигать от 50 до 100 % и это объясняет летальные исходы этого заболевания, так как HBF приспособлен для транспорта кислорода в условиях кровообращения плода, а не у взрослых.
Точечные мутации в экзонных областях генов глобина ведут к образованию гемоглобинов с измененной функцией
Варианты аминокислотной последовательности цепей глобина наблюдаются примерно у каждого шестисотого человека. В какой мере замены аминокислот сказываются на структуре и функции гемоглобина зависит от типа замещения аминокислот(например, замена аминокислоты с гидрофобными свойствами гидрофильной аминокислотой), или расположения заменяемой аминокислоты в структуре белка (на поверхности или внутри молекулы). Аномалии гемоглобина наследуются аутосомально рецессивным путем. Гетерозиготные носители, которые имеют половину нормальных и половину патологических гемоглобинов обычно имеют достаточное количество нормального гемоглобина для снабжения кислородом ткани, в то время как у гомозиготных носителей наблюдаются тяжелые анемии и во многих случаях наступает смерть. Аномальные гемоглобины обозначаются большими буквами алфавита или по клинической картине, местности или имени пациентов, с которыми связано первое описание(см табл 14-17). Мутации обычно описываются либо указанием на место в ДНК (например. ГАГ— ГТГ) или в белке(6 ГЛУ — >
ВАЛl или ГЛУ6ВАЛ), что означает замену остатка глутаминовой кислоты в положении 6 цепи валиловым остатком.
Табл 14-20. Генетически обусловленные нарушения последовательности аминокислот гемоглобина (известно около 300 вариантов)
|
Гемоглобин |
Нарушение |
Замещение |
|
Hb S |
Образование серповидных клеток |
6 ГЛУВАЛ |
|
Hb M Iwate |
Метгемоглобинобразование |
87 ГИСТИР |
|
Hb M Boston |
58 ГИСТИР |
|
|
Hb M Hyde Park |
92 ГИСТИР |
|
|
Hb M Saskatoon |
63 ГИСТИР |
|
|
Hb M Milwauki I |
67 ВАЛГЛУ |
|
|
Hb H Hammersmith |
Отщепление гема |
42 ФЕН СЕР |
У гомозиготных форм серповидноклеточной болезни наблюдают в периферический и следовательно с низким содержанием кислорода крови появление серповидно клеточных эритроцитов, который склонны к гемолизу. С конца сороковых годов ХХ столетия известно, что пациенты с серповидноклеточной болезнью имеют гемоглобин с измененной электрофоретической подвижностью. Молекулярная причина дефекта, тем не менее, выяснилась после доказательства, что различие связано с заменой аминокислоты в цепи: пептиды трипсинового гидролизата гемоглобина после разделения электрофорезом и хроматографией давали характерные пятна, названные исследователями «отпечатками пальцев (fingerprints)». При сравнении передвижения трипсиновых пептидов нормального гемоглобина с пептидами полученными из гемоглобина больного серповидноклеточной анемией оказалось , что один пептидный фрагмент отличался своей подвижностью. Исследование этого фрагмента, октапептида -цепи показало, что он, в отличие от пептида HbА, имел остаток валина вместо глутаминовой кислоты.
Эта замена гидрофильной аминокислоты гидрофобной и послужила основой измененной электрофоретической подвижности HbS. После выяснения первичной структуры гемоглобина к началу 60ых годов было твердо установлено, что дефект в положении 6 - цепи HBS (a2b26ГЛУ ВАЛ) лежит в области, которая находится на поверхности молекулы гемоглобина. Это замещение вызвано заменой пуринового основания в кодоне (ГАГ), на кодон для валина (ГТГ). Присоединение кислорода в серповидноклеточном гемоглобине не нарушается, однако эритроциты, содержащие этот гемоглобин обладали особой наклонностью принимать форму серпа в периферической крови. Причина образования серповидных клеток связана с агрегацией молекул HbS. Преимущество отбора гетерозиготного носителя основывается на том, что в эритроцитах с HbS малярийные плазмодии не выживают.
Сложные белки. Гемоглобин. Миоглобин
3.4.1. Среди хромопротеинов различают гемопротеины (содержат в качестве простетической группы порфириновые производные) и флавопротеины (содержат производные рибофлавина — витамина B2). Хромопротеины участвуют в осуществлении многих жизненно важных функций, таких как тканевое дыхание, перенос кислорода, окислительно-восстановительные реакции, светоощущение, фотосинтез в растительных клетках и другие процессы.
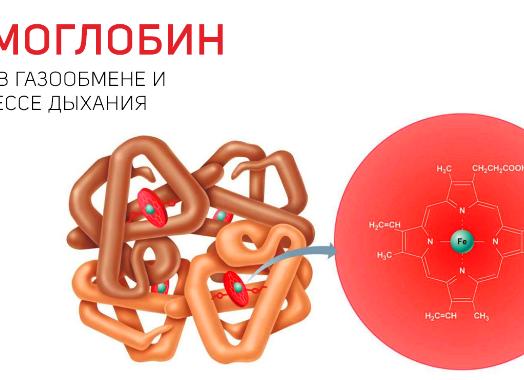
3.4.2. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем.
По своему химическому строению гем представляет собой протопорфирин IX, связанный с двухвалентным железом. Протопорфирин IX — органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН—. Заместителями в пиррольных кольцах являются: четыре метильные группы СН3—, две винильные группы СН2=СН— и два остатка пропионовой кислоты — СН2—СН2—СООН. Гем соединяется с белковой частью следующим образом. Неполярные группы . протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов.
Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет).
3.4.3. Сравните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков.
Миоглобин — хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода.
Гемоглобин (Hb) — хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы — полипептидные цепи (обозначаемые α1, α2, β1 и β2, каждая из которых связана с гемом.
Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией.
R- и Т-конформации молекулы гемоглобина находятся в состоянии динамического равновесия:
Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O2, являются: 1) кислород; 2) концентрация Н+ (рН среды); 3) углекислота (СO2) ; 4) 2,3-дифосфоглицерат (ДФГ) . Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O2, имеющая S-образную форму (рисунок 3.1).
Повышение содержания СO2, Н+, ДФГ на фоне низкого парциального давления O2 в тканях способствует взаимодействию этих факторов с гемоглобином и переходу R-конформации в Т-конформацию. Это приводит к смещению равновесия в уравнении (1) вправо. Выделившийся O2 поступает в ткани.
Рисунок 3.1. Кривые насыщения миоглобина (1) и гемоглобина (2) кислородом.
Белок гемоглобин выполняет функцию
Гемоглобин — молекула, состоящая из белка глобина (2а- и 2β-цепи) и 4 пигментных групп (гем), которые способны обратимо связывать молекулярный кислород. В 1 эритроците содержится в среднем 400 млн молекул гемоглобина.
Оглавление:
Гемоглобин, связанный с кислородом, именуется оксигелюглобином (придает крови ярко-алый цвет). Процесс его связывания с кислородом называется оксигенацией, а его отдача оке и гемоглобином — дезоксигенацией. Не связанный с кислородом гемоглобин называется дезоксигелюглобином. Гемоглобин способен связываться с углекислым газом (карбамингемоглобин), с оксидом углерода (карбоксигемоглобин). Кроме того, NO, взаимодействуя с этим протеидом, образует различные NO- формы: метгемоглобин, нитрозилгемоглобин (HbFe 2+ NO) и S-нитрозогемоглобин (SNO-Hb), которые играют роль своеобразного аллостерического регулятора функциональной активности гемоглобина.
Норма и функции гемоглобина
Количество гемоглобина у мужчин —г/л, у женщин —г/л. Перенос кислорода и углекислого газа — функция гемоглобина. Гемоглобин — сложное химическое соединение, состоящее из белка-глобина и четырех молекул гема.
Рис. Норма гемоглобина у мужчин и женщин
Основные функции эритроцитов обусловлены наличием в их составе особого белка хромопротеида — гемоглобина. Молекулярная масса гемоглобина человека равна. Гемоглобин — это дыхательный фермент, который находится в эритроцитах, а не в плазме, потому что:
- обеспечивает уменьшение вязкости крови (растворение такого же количества гемоглобина в плазме повысило бы вязкость крови в несколько раз и затруднило бы работу сердца и кровообращение);
- уменьшает онкотическое давление плазмы, предотвращая обезвоживание тканей;
- предупреждает потерю организмом гемоглобина вследствие его фильтрации в клубочках почек и выделения с мочой.
Основное назначение гемоглобина — транспорт кислорода и углекислого газа. Кроме того, гемоглобин обладает буферными свойствами, а также способностью связывать токсические вещества.
Рис. Взаимодействие гемоглобина с кислородом. k — константа скорости реакции
Гемоглобин состоит из белковой части (глобин) и небелковой железосодержащей части (гем). На одну молекулу глобина приходится четыре молекулы гема. Железо, которое входит в состав гема, способно присоединять и отдавать кислород. При этом валентность железа не изменяется, т.е. оно остается двухвалентным. Железо входит в состав всех дыхательных ферментов.
В крови здорового человека содержание гемоглобина составляетг/л (г/л для женщин,г/л для мужчин).
В норме гемоглобин содержится в виде трех физиологических соединений: восстановленного, оксигемоглобина и карбоксигемоглобина. Гемоглобин, присоединивший кислород, превращается в оксигемоглобин — НbО2,. Это соединение ярко-алого цвета, от которого зависит цвет артериальной крови. Один грамм гемоглобина способен присоединить 1,34 мл кислорода.
Оксигемоглобин, отдавший кислород, называют восстановленным гемоглобином (Нb). Он находится в венозной крови, которая имеет темно-вишневый цвет. Кроме того, в венозной крови содержится соединение гемоглобина с углекислым газом — карбогемоглобин (НbСO2), который транспортирует углекислый газ из тканей к легким.
Гемоглобин обладает способностью образовывать и патологические соединения. Одним из них является карбоксигемоглобин — соединение гемоглобина с угарным газом (НbСО). Сродство железа гемоглобина к угарному газу превышает сродство к кислороду, поэтому даже 0,1% угарного газа в воздухе ведет к превращению 80% гемоглобина в карбоксигемоглобин, который не способен присоединять кислород, что является опасным для жизни. Слабое отравление угарным газом — обратимый процесс. При дыхании свежим воздухом угарный газ отщепляется. Вдыхание чистого кислорода увеличивает скорость расщепления НbСО в 20 раз.
Таблица. Характеристика гемоглобинов
Метгемоглобин (MetHb) — тоже патологическое соединение, является окисленным гемоглобином, в котором под влиянием сильных окислителей (феррацианид, перманганат калия, пероксид водорода, анилин и др.) железо гема из двухвалентного превращается в трехвалентное. При накоплении в крови в большом количестве метгемоглобина транспорт кислорода тканями нарушается и может наступить смерть.
В скелетных мышцах и миокарде находится мышечный гемоглобин, называемый миоглобином. Его небелковая часть аналогична гемоглобину крови, а белковая часть — глобин — обладает меньшей молекулярной массой. Миоглобин человека связывает 14% общего количества кислорода в организме. Это его свойство играет важную роль в снабжении работающих мышц. При сокращении мышц их кровеносные капилляры сдавливаются и кровоток уменьшается либо прекращается. Однако благодаря наличию кислорода, связанного с миоглобином, в течение некоторого времени снабжение мышечных волокон кислородом сохраняется.
Гемоглобин: функции и норма гемоглобина у мужчин и женщин
Источник: https://www.grandars.ru/college/medicina/gemoglobin.html
Если гемоглобин понижен: признаки и эффективные способы нормализации
Кровь – источник жизни человека, а ее заболевания приводят к поражениям функций всего организма. Однако функции крови очень сложны, поэтому даже незначительное изменение формулы этого вещества могут вызвать значительные изменения в функционировании всех систем.
Особенно важен уровень гемоглобина, из-за снижения которого страдают практически все органы человеческого тела. Если гемоглобин понижен, это может указывать на множество различных причин, в том числе и на железодефицитную анемию.
Основные функции гемоглобина
Роль гемоглобина в организме человека
Состав крови при его относительной стабильности постоянно меняется, так как организм живет, работает, а иногда и болеет. На состояние крови влияет общее самочувствие человека, его питание, окружающая среда, состав воздуха и многое другое.
Гемоглобин – это один из сложных белков крови, содержащий в себе железо. Он выполняет очень важную для жизни человека функцию – переносит кислород по всему организму и выводит из него отработанный продукт – углекислый газ. Именно благодаря гемоглобину и содержащемуся в нем железу красные кровяные тельца эритроциты получили свою окраску, сделав нашу кровь всех оттенков алого и багрового цвета.
О хорошем крепком здоровье свидетельствует нормальный уровень гемоглобина в крови.
Если же количество гемоглобина снижено, это может указывать на наличие разнообразных проблем со здоровьем человека. Для определения уровня гемоглобина проводят специальный анализ.
Более всего снижению гемоглобина подвержены маленькие дети и женщины в силу физиологических причин, у мужчин это состояние встречается намного реже. Считается, что низкий гемоглобин встречается у третьей части всего населения земного шара, так что это проблема глобальная.
Диагностика уровня гемоглобина: норма
Анализ: подготовка и процедура
Показатели гемоглобина можно определить при общем анализе крови. Забор пробы производится чаще всего из пальца, однако может использоваться и кровь из вены.
Особых требований к подготовке к анализу не существует, но лучше всего в непосредственные часы перед сдачей крови не есть и не заниматься спортом, другими физическими нагрузками. На картину крови может повлиять и излишнее эмоциональное волнение, а также прием некоторых медикаментов.
В целом процедура эта практически безболезненная для пациента и достаточно быстрая и простая для персонала.
Показатели гемоглобина колеблются не только под влиянием различных болезней, даже нормальный уровень сильно отличается в разные периоды жизни, а также у мужчин и женщин.
Норма гемоглобина в г/л:
- Новорожденный в первые 3 дня :5
- Первая неделя :
- 2 недели:
- Месяц:
- 2 месяца:
- 3 месяца – полгода:
- Полгода – год:
- 1 – 2 года:
- 3 – 6 лет:
- 7 – 12 лет:
- 13 – 15 лет:
- 16 – 18 лет:
- Женщины:
- Мужчины:
- Беременные первый триместр:
- Беременные второй триместр:
- Беременные третий триместр:
Особенно важно следить за уровнем гемоглобина беременным женщинам, а еще лучше позаботиться об этом задолго до наступления зачатия. Этим женщина обеспечит себя от многочисленных неприятностей и волнений во время беременности, а своего ребенка спасет от множества болезней и врожденных дефектов.
По предписанию врача беременным с риском развития анемии рекомендуется профилактически в течение всего срока вынашивания ребенка и времени кормления грудью принимать специальные витамины с повышенным содержанием железа и фолиевой кислоты.
Причины понижения
Низкий уровень гемоглобина в крови
Если гемоглобин понижен, то чаще всего это указывает на наличие железодефицитной анемии в разных ее стадиях. Однако это далеко не единственная причина низких показателей.
Их могут вызвать следующие болезни и состояния:
- Беременность.
- Большая кровопотеря во время менструаций, родов, выкидыша, аборта, перенесенных хирургических операций.
- Переливание крови.
- Заболевания крови с разрушением эритроцитов.
- Онкологические заболевания.
- Острые и хронические воспалительные процессы.
- Ряд аутоиммунных заболеваний, например, системная красная волчанка.
- Хронический гастрит.
- Дисбактериоз.
- Нехватка витамина В12, железа и фолиевой кислоты.
- Вегетарианство и веганство.
- Суровые диеты с ограничением выбора продуктов, голодание.
- Несбалансированная диета.
- Гиподинамия с отсутствием достаточного притока кислорода (плохая вентиляция помещения).
- Постоянная сдача крови (чаще 4 раз в год).
Симптоматика
Признаки пониженного гемоглобина в крови
Так как уровень гемоглобина напрямую связан с кислородным обменом в организме, симптомы низких показателей очень напоминают кислородное голодание:
- Сонливость.
- Общая и мышечная слабость.
- Апатия.
- Быстрая утомляемость.
- Головокружение.
- Звон в ушах.
- Головные боли.
- Низкое артериальное давление.
- Обмороки и кратковременные потери сознания, темнота в глазах.
- Учащенное сердцебиение.
- Одышка.
- Искаженное восприятие вкусов и запахов.
- Возможное появление зуда и раздражения кожи.
- Сухость и бледность кожных покровов.
- Холодная кожа и конечности.
- Повышенная ломкость ногтей.
- Выпадение и ломкость волос, «сечение» кончиков.
- Нарушение работы кишечника, изменение цвета кала (бледный, бесцветный, желтоватый).
- Увеличение селезенки.
Все эти симптомы не обязательно встречаются все сразу, большинство из них – это проявление крайней степени анемии.
Однако наличие 2-3 симптомов это весомый повод посетить медицинскую лабораторию и сдать простой анализ крови, чтобы убедиться в отсутствии железодефицитной анемии или других опасных состояний.
У ребенка эти симптомы могут быть дополнены недостаточными прибавками в весе, капризностью, нарушениями сна, медленным ростом, склонностью к простудам и другим заболеваниям.
Медикаментозное лечение
Нормализация уровня гемоглобина медикаментозными препаратами
Если гемоглобин понижен на значительные показатели, врач скорее всего назначит прием специальных лекарственных средств. Экстренные меры необходимы при анемии, вызванной большой потерей крови при авариях, травмах, операциях и при маточных кровотечениях разной природы.
В этих случаях приходится прибегать к переливанию крови, так как речь уже идет не просто о падении уровня гемоглобина, но и об общем уменьшении объема циркулирующей крови, что может вызвать кому и смерть.
В ряде случаев для подъема уровня гемоглобина достаточно изменения схемы питания и назначения специальных витаминных комплексов, в других может потребоваться прием препаратов железа, витамина В12 и других витаминов из группы В, а также фолиевой кислоты.
Однако вред от чрезмерной дозы железа может быть также очень велик, поэтому лекарства такого типа выбираются и назначаются только лечащим врачом по жизненным показаниям.
При этом учитывается возраст пациента, состояние его здоровья и наличие других возможных заболеваний. Самостоятельный прием таких лекарств может принести больше вреда, чем пользы.
При лечении анемии опытный врач учитывает, что падение уровня гемоглобина – это не заболевание, а его последствие, поэтому просто пытаться поднять его недостаточно, необходимо бороться с основным заболеванием.
Народное лечение и диета
Правильное питание при низком гемоглобине
Народная медицина знает много методов лечения, если гемоглобин понижен. В основном они связаны с приемом различных лекарственных трав, а также различных ягод. Одним из самых популярных составов является отвар шиповника, очень богатый витаминами, и мед с орехами. Эти вкусные лекарства с удовольствием едят дети, так что проблем с лечением не возникает.
Следующее средство не настолько приятное, но очень эффективное. С его помощью можно значительно улучшить формулу крови, а также «подстегнуть» иммунитет, остановить падение зрения, помочь набрать вес и оздоровить организм в целом.
Для этого средства потребуется:
- Несколько листьев алоэ возрастом не менее года, а еще лучше трехлетние.
- Мед высокого качества.
- Орехи. Можно использовать только грецкие, но лучше применить смесь – грецкие орехи, фундук, миндаль, фисташки, кешью и любые другие по вкусу, кроме арахиса – он считается канцерогенным продуктом.
- Сухофрукты, в основном это курага, инжир, финики, изюм и чернослив.
- Кагор.
- Листья алоэ тщательно промывают, просушивают, заворачивают в чистую полотняную ткань и помещают на нижнюю полку холодильника на 2 недели. За это время в листьях вырабатывается необходимое количество биологически активных веществ.
- Готовые листья и остальные компоненты измельчают через мясорубку или при помощи блендера, добавляют мед и несколько ложек кагора до получения однородной густой пастоподобной консистенции. Оставляют состав на сутки настояться.
- Средство употребляют дважды в день по столовой ложке утром и вечером до еды.
Кроме использования народных средств, очень важно правильно сбалансировано питаться. Диета должна быть достаточно калорийной, но не слишком однообразной с преобладанием жирной и мучной пищи, это не пойдет на пользу больному.
Полезное видео — Анемия.
При анемиях необходимо употреблять следующие продукты:
- Печень, желательно в слегка обжаренном виде.
- Субпродукты (почки, легкое, сердце) в небольших количествах.
- Красное мясо, лучше говядину, в виде ростбифа или отбивных.
- Красная рыба.
- Морепродукты.
- Икра (красная, черная, мойвы, минтая – любая доступная).
- Шпинат и другие зеленные овощи.
- Фрукты – яблоки, цитрусовые, гранаты, хурма, бананы и другие. Особенно полезны гранаты и красные яблоки.
- Соки фруктовые и овощные, а также смешанные. Детям и взрослым понравится сок или пюре из моркови и яблок, а также смеси на базе яблочного сока с добавлением тыквенного, морковного, свекольного и сельдерейного сока.
- Птица и дичь.
- Яйца, лучше всего перепелиные, а также желток куриного яйца.
- Кисломолочные продукты.
- Красное вино – натуральное, не крепленое, сухое, не более 150 мл в день, если нет противопоказаний (болезни, детский возраст, беременность и кормление грудью).
Вся пища должна быть свежей, хорошего качества, питание не должно быть чрезмерным, но разнообразным. Правильное питание при анемиях не означает набор лишнего веса, это только может усугубить проблему.
Возможные последствия
Осложнения при неправильном лечении
Падение уровня гемоглобина ухудшает снабжение тканей всего организма кислородом, что ведет к нарушению функционирования как отдельных органов, так и систем в целом.
Хроническая нехватка кислорода вызывает нарушения работы центральной нервной системы, которые управляют всеми функциями. Это вызывает цепную реакцию, постепенно приводя к проблемам со здоровьем, а также вызывая снижение иммунитета. При этом сама анемия может «маскироваться» сопутствующими заболеваниями, а человек даже не подозревает о настоящих причинах своей слабости и болезненности.
Когда же выявляется анемия, заболевание обычно уже находится в запущенной стадии и лечить его будет достаточно долго и трудно.
Именно поэтому регулярное проведение анализа крови поможет контролировать гемоглобин и защитит от появления крайне неприятных последствий.
Профилактика
В случае, если гемоглобин понижен, потребуется прибегнуть к экстренному лечению, однако это состояние можно предотвратить.
Для этого необходимо выполнять несложные рекомендации по профилактике, непосредственно связанные со здоровым образом жизни:
- Правильное сбалансированное питание с употреблением достаточного количества красного мяса, печени и других субпродуктов, овощей, фруктов, ягод, орехов и злаков.
- Подвижный, активный образ жизни с регулярным пребыванием на свежем воздухе. Известно, что нахождение в горах в четыре раза увеличивает количество кислорода в крови, а прогулки в лесу повышают его уровень вдвое.
- Проветривание помещения, особенно перед сном.
- Контроль потери крови во время менструаций. Если она явно превышает норму, необходимо нанести визит гинекологу для уточнения причин.
- Регулярное проведение анализа крови для определения уровня гемоглобина.
Внимательное отношение к своему здоровью может предотвратить развитие многочисленных серьезных и опасных заболеваний.
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.
Комментарии
А мне на третьем триместре беременности при гемоглобине 110 повышали его, хотя тут норма указана. И по опыту скажу, что только лекарства помогали нормализовать, народные средства вообще никакого эффекта не давали.
Добавить комментарий Отменить ответ
В продолжение статьи
Мы в соц. сетях
Комментарии
- Марина – 25.09.2017
- ГРАНТ – 25.09.2017
- Татьяна – 25.09.2017
- Илона – 24.09.2017
- Лара – 22.09.2017
- Татьяна – 22.09.2017
Темы вопросов
Анализы
УЗИ / МРТ
Новые вопросы и ответы
Copyright © 2017 · diagnozlab.com | Все права защищены. г. Москва, ул. Трофимова, д. 33 | Контакты | Карта сайта
Содержание данной страницы исключительно ознакомительного и информационного характера и не может и не являет собой публичную оферту, которая определяется ст. №437 ГК РФ. Предоставленная информация существует с ознакомительной целью и не заменяет обследование и консультацию у врача. Имеются противопоказания и возможны побочные эффекты, проконсультируйтесь с профильным специалистом
Источник: https://diagnozlab.com/analysis/clinical-tests/blood/esli-gemoglobin-ponizhen.html
Какую роль в организме играет гемоглобин и что значит, если он повышен или понижен?
Цифры напротив символа Hb, или гемоглобина, в бланке с результатами общего анализа крови могут раскрыть врачу причины низкого давления, головокружения, судорог ног пациента, а также оповестить о надвигающихся серьезных угрозах. Своевременное выявление отклонений и приведение концентрации гемоглобина в норму позволит избежать серьезных проблем со здоровьем. Речь идет о снижении рисков инфарктов и инсультов у людей в возрасте, патологий развития детей, ухудшения состояния матери и плода во время беременности.
Что такое гемоглобин и каковы его функции
Гемоглобин (Hb) — сложный железосодержащий белок, содержащийся в эритроцитах (красных кровяных тельцах) крови и частично присутствующий в свободном виде в плазме. Именно он осуществляет перенос кислорода от легких к клеткам и углекислого газа — в обратном направлении. Если говорить образно, то эритроцит — это своеобразное грузовое судно, курсирующее по кровяному руслу, а молекулы гемоглобина — контейнеры, в которых транспортируется кислород и углекислый газ. В норме один эритроцит вмещает порядка 400 млн молекул гемоглобина.
Участие в газообмене — важнейшая, но не единственная функция «кровяных шаров» (от греч. haima — «кровь» + лат. globus — «шар»). Благодаря своим уникальным химическим свойствам гемоглобин является ключевым элементом буферной системы крови, поддерживающим кислотно-щелочной баланс в организме. Hb связывает и выводит на клеточном уровне кислые соединения (препятствует ацидозу — закислению тканей и крови). А в легких, куда он поступает в форме карбгемоглобина (HbCO2), за счет синтеза углекислоты предотвращает противоположный процесс — защелачивание крови, или алкалоз [1] .
Производная Hb — метгемоглобин (HbOH) — обладает еще одним полезным свойством: прочно связывать синильную кислоту и другие токсичные вещества. Таким образом, железосодержащий белок принимает удар на себя и снижает степень отравления организма [2] .
Итак, гемоглобин крайне важный элемент жизнедеятельности и патологическое уменьшение его концентрации (анемия или малокровие) может спровоцировать в лучшем случае ломкость ногтей и волос, сухость и шелушение кожи, мышечные судороги, тошноту и рвоту, головокружение. Острая же форма анемии вызывает кислородное голодание клеток, приводящее к обморокам, галлюцинациям и фатальным последствиям — гипоксии мозга, атрофии нервных клеток, параличу дыхательной системы.
Как должно быть в норме
Уровень гемоглобина в нашей крови может несколько увеличиваться и уменьшаться по естественным причинам. Обновление гемоглобина связано с жизненным циклом эритроцита, к которому он прикреплен. Так, примерно каждые 120 дней часть молекул гемоглобина вместе с эритроцитами отправляется в печень — на расщепление и после вновь синтезируется, присоединяясь к свободному эритроциту [3] .
Количество гемоглобина зависит от возраста и пола, меняется в процессе вынашивания и рождения ребенка [4] .
На гемоглобин также оказывают влияние специфические условия труда или проживания (например, повышенные показатели бывают у пилотов и жителей гористой местности), приверженность вегетарианству и донорство (эти факторы, напротив, снижают гемоглобин) [5] .
Согласно рекомендациям ВОЗ [6] , нормой гемоглобина считается:
- для детей от полугода до 5 лет — 110 г/л и выше;
- для детей 5–11 лет — 115 г/л и больше;
- для детей 12–14 лет, а также девушек и женщин (15 лет и старше) — 120 г/л и выше;
- для мужчин (15 лет и старше) — 130–160 г/л.
Беременным женщинам, обеспечивающим минералами (в том числе железом) себя и малыша, важно следить, чтобы уровень гемоглобина не падал ниже 110 г/л. Отметим, что, по данным ВОЗ, железодефицитная анемия (ЖДА) диагностируется у 38,2% беременных на планете [7] . Дефицит молекул гемоглобина может возникнуть после 20-й недели «интересного положения»: из-за увеличения объема циркулирующей крови, растущих потребностей плода, уменьшения поступления и всасывания железа вследствие токсикоза и расстройств ЖКТ. В это время женщину может мучить слабость, головокружение, одышка даже при непродолжительной ходьбе, судороги нижних конечностей. Опасное следствие острых форм ЖДА — преждевременные роды, задержки в развитии плода.
Кстати, необычные вкусовые запросы беременных (вплоть до анекдотичных, таких как салат из жареной клубники и селедки) порой тоже связаны с потребностью в железе для синтеза гемоглобина. Роды, сопровождающиеся потерей крови, ведут к дополнительному понижению гемоглобина. В целом от зачатия до появления ребенка на свет организм женщины утрачивает порядка 700 мг железа, еще 200 мг — за период лактации [8] . На восстановление запасов требуется не менее трех лет.
Виды анализов на гемоглобин
Подсчет числа молекул гемоглобина производится при общем анализе крови. Помимо количества белка (строка Hb), в бланке анализа могут указать MCH/MCHC, что соответствует среднему содержанию/концентрации гемоглобина в эритроците. Это уточнение позволяет подсчитать полезный железопротеин и исключить из расчета аномальные, нестабильные формы гемоглобина, не способные переносить кислород.
Для измерения гемоглобина во внелабораторных условиях — в машинах скорой помощи или при проведении профилактических выездных осмотров — применяются специальные гемоглобинометры. Это портативные приборы, в которые помещается кровь с реагентом для фотометрического автоматического определения количества гемоглобина.
Для массового тестирования на анемию в странах третьего мира ВОЗ разработала малозатратный колорометрический метод исследования. При колориметрии каплю крови наносят на специальную хроматографическую бумагу и сопоставляют ее со шкалой цветов, соответствующих разным показателям гемоглобина с шагом 20 г/л [9] .
Уровень гликированного гемоглобина определяется и при биохимическом анализе венозной крови. Цель исследования в данном случае — определение глюкозы в крови, которая образует прочное соединение с гемоглобином и лишает его возможности транспортировать кислород. Показатель важен для диагностики сахарного диабета и оценки эффективности его лечения.
Чем опасен повышенный гемоглобин в крови
Высокий гемоглобин может быть вызван объективной нехваткой кислорода, стимулирующей организм на увеличенное производство этого белка крови. Подобная патология часто фиксируется у экипажей воздушных судов и часто летающих пассажиров, жителей высокогорья, альпинистов, горнолыжников. В силу большей потребности в кислороде повышенный уровень гемоглобина свойственен профессиональным спортсменам, преимущественно лыжникам, легкоатлетам, борцам, тяжелоатлетам. Это физиологический механизм компенсации, не вызывающий никаких медицинских опасений (кавказское долголетие — яркий тому пример).
Повысить гемоглобин может и пагубная привычка: во время курения человек вдыхает меньше кислорода, чем требуется, и организм реагирует на это выработкой дополнительного гемоглобина.
К сожалению, повышенный гемоглобин может указывать и на патологии системы кроветворения: эритроцитоз, рак крови, обезвоживание организма, порок сердца и легочно-сердечную недостаточность, а также на непроходимость кишечника [10] .
Увеличенное количество гликированного гемоглобина отмечается при сахарном диабете: часть молекул Hb «перетягивает» на себя глюкозу, и для нормального дыхания требуются добавочные кислородные «контейнеры» [11] .
Повышенный свободный гемоглобин в плазме фиксируется и при ожоговых поражениях вследствие разрушения эритроцитов с высвобождением из них гемоглобина [12] .
Опасность высокого гемоглобина (+20 г/л от нормы и более) заключается в сгущении и увеличении вязкости крови, приводящему к образованию тромбов. Тромбы, в свою очередь, могут вызвать инсульт, инфаркт, кровотечение в ЖКТ или венозный тромбоз [13] .
Гемоглобин ниже нормы: что это значит и к чему приводит
Железо — один из самых распространенных и легко добываемых химических элементов на Земле. При этом, как ни парадоксально, от дефицита железа в организме страдает больше людей, чем от какого-либо другого нарушения здоровья [14] . В группе риска население из низких социальных слоев, не получающее достаточного количества железа из продуктов питания, женщины репродуктивного возраста и дети, то есть люди, у которых «приход» элемента меньше «расхода».
Причиной низкого уровня гемоглобина (минус 20 г/л от нормы и более) зачастую являются скудное или несбалансированное питание — недостаточное поступление железа и меди, витаминов A, С и группы B или употребление железосодержащей пищи совместно с цинком, магнием, хромом или кальцием, которые не позволяют Fe усваиваться [15] .
Низкие показатели могут наблюдаться у вегетарианцев, т.к. негемовое железо из растительной пищи усваивается намного хуже, чем гемовое, источником которого служат продукты животного происхождения [16] .
Смежная причина — наличие кишечных паразитов, которые перехватывают поступающие микроэлементы и витамины. Усвоению железа могут также мешать проблемы с желудочно-кишечным трактом.
Заметное снижение уровня гемоглобина сопровождает кровопотери, вызванные ранениями, оперативным вмешательством, менструацией, кровотечениями, возникающими во время родов и абортов, а также при донации крови и ее компонентов.
На уровень гемоглобина влияют и скрытые кровопотери при патологии ЖКТ (язвы желудка и ДКП), варикозе, миомах и кистах органов женской половой системы, кровоточивость десен.
Причины снижения гемоглобина, возникающие во время беременности и лактации, а также осложнения, к которым они могут привести, мы рассмотрели выше. Длительный железодефицит у мужчин, детей и небеременных женщин имеют сходную симптоматику: ухудшение состояния кожи, ногтей и волос, головокружение, обмороки, онемение рук и ног, беспричинная слабость.
Кислородное голодание вследствие недостатка гемоглобина может привести к ухудшению памяти, замедлению нервных реакций, в запущенной форме — к атрофии клеток мозга и других органов и систем организма.
Усиленное кровообращение (более частый прогон гемоглобина от легких к тканям и обратно) чревато проблемами с сердцем и сосудами: кардиомиопатией и развитием сердечной недостаточности.
Низкий гемоглобин негативно отражается на буферной функции: это значит, что закисление крови подрывает иммунную защиту организма, снижает сопротивляемость простудным и инфекционным заболеваниям.
Наиболее уязвимы перед анемией дети и подростки. Острый дефицит жизненно важного минерала может сказаться на их умственном и физическом развитии [17] .
Гемоглобин — незаменимый участник жизнедеятельности, на который возложены важнейшие функции: перенос кислорода и углекислого газа, сохранение кислотно-щелочного баланса, противостояние ядам. Еще одна функция — сигнальная — помогает по отклонению уровня гемоглобина от нормы выявить риски развития патологий и принять контрмеры. Таким образом, контроль и оперативная коррекция уровня гемоглобина — не прихоть врачей, а действенный способ сохранить здоровье.
Copyright, технология и дизайн принадлежат ООО «Правда.Ру».
Материалы сайта предназначены для лиц старше 18 лет (18+).
Использование материалов сайта (распространение, воспроизведение, передача, перевод, переработка и др.) допускается только с письменного разрешения редакции. Мнения и взгляды авторов не всегда совпадают с точкой зрения редакции.
Источник: https://www.pravda.ru/navigator/za-chto-otvechaet-gemoglobin.html
роль гемоглобина в крови
я просто нажал «найти ответ в интернете»
Зачем же нужен гемоглобин? Ведь кислород может просто растворяться в плазме крови и разноситься ею к органам. Дело в том, что насыщение крови кислородом ограничивается законами диффузии: поступление кислорода в плазму крови прекращается, когда сравнивается его концентрация в альвеолярном воздухе и в кровеносных капиллярах. В связанном же виде (в виде оксигемоглобина) кровь может перенести гораздо больше кислорода: так как кислород связывается с гемоглобином, концентрация свободного кислорода в крови уменьшается, и в кровь может поступить новая порция кислорода из альвеолярного воздуха.
Именно поэтому недостаток гемоглобина в крови вызывает анемию (кислородную недостаточность).
Главная функция гемоглобина состоит в транспорте дыхательных газов. В капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало, здесь необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких. Монооксид углерода (CO) связывается с гемоглобином крови прочнее, чем кислород, образуя метгемоглобин (metHb, от мета… и гемоглобин, иначе гемиглобин или ферригемоглобин) . Таким образом, блокируется процессы транспортировки кислорода.
Источник: https://otvet.mail.ru/question/
Виды и функции гемоглобина
Функции гемоглобина (Hb) связаны с транспортировкой кислорода к тканям и органам. В крови людей и животных содержится гемоглобин (Hb). Соединение гемоглобина с кислородом к тканям доставляют эритроциты.
Основные задачи
Железосодержащий белок выполняет свою задачу в 3 этапа:
- 1 этап: к нему присоединяются молекулы кислорода;
- 2 этап: основная функция гемоглобина. Молекула гемоглобина, вступая в реакцию с кислородом, преобразуется в синглетный кислород, способный взаимодействовать с клетками организма;
- 3 этап: поступление синглетного кислорода к тканям. Hb соединяется с кислородом (при условии избытка последнего в капиллярах легких). Эритроциты с помощью циркулирующей крови доставляют соединения гемоглобина и кислорода к органам и тканям, которые испытывают недостаток кислорода. На этом этапе молекулы кислорода высвобождаются из связи с белком.
В организме здорового человека присутствует гемоглобин а, который имеет белковую и небелковую структуру. Hb связывает небольшое количество CO2 (диоксид углерода), освобождая его в легких. CO (монооксид углерода) обеспечивает более прочную связь с Hb по сравнению с кислородом.
В результате этого соединения образуется HbCO (карбоксигемоглобин). В результате некоторых процессов ионы железа в гемме могут окисляться до степени +3, образуя метгемоглобин. Эти варианты провоцируют блокировку транспортировки кислорода в организме.
Монооксид углерода можно частично вытеснить из геммы с помощью повышения парциального давления кислорода в легких.
Мутационные процессы
Гемоглобин С, в отличие от нормальной четвертичной структуры гемоглобина, обладает молекулярным строением и физико-химическими свойствами. Его наличие в организме приводит к гемоглобинопатии. Если структура гемоглобина нарушена, тогда рекомендуется исследовать кровь (талассемия, серповидно-клеточная анемия и т.п.). Определить количество Hb в крови можно с помощью следующих методик:
- количество связываемого им кислорода;
- содержащееся в нем железо (Fe);
- окраска раствора благодаря гематину или Hb (колориметрический способ).
В первом случае количество белка определяют, встряхивая кровь с воздухом. Благодаря этому образуется оксигемоглобин. Затем его превращают в метгемоглобин с помощью добавления красной кровяной соли. В процессе высвобождается рыхло связанный с белком кислород. Его количество определяют с помощью аппарата Баркрофта или Ван Слайка.
Один из наиболее простых колориметрических способов – метод Сали. У пациента берут 20 куб. мм крови с помощью микропипетки. Взятую жидкость разводят децинормальной HCl в градуированной пробирке до деления 10. Hb распадается на гемм и глобин. Гемм, вступая в реакцию с кислородом, превращается в гематин, и раствор окрашивается светло-коричневый цвет.
Полученный цвет сравнивают со стандартом (раствор в запаянных пробирках аналогичного диаметра). В состав добавляют дистиллированную воду до соответствия цвета пробы стандарту. Чем больше дистиллированной воды необходимо добавить, тем выше концентрация Hb. На пробирках расположены деления, которые в зависимости от объема жидкости, показывают процентное содержание гемоглобина относительно нормы. Метод Сали предполагает, что 100 % Hb содержится 17, 3 г/ 100 мл крови. У большинства здоровых пациентов этот показатель не превышает 80 – 90 % (14 – 16 г/ 100 мл крови).
Причины определения количества Hb
Определение концентрация гемоглобина помогает при постановке диагнозов и выявлении патологий. Анализ на общий гемоглобин назначают при подозрении на малокровие, а для диагностики сахарного диабета необходим биохимический анализ крови с определением концентрации гликозированного Hb.
Для мужского организма норма –г/ 1 л крови. У женщин и детей показатель не должен превышатьг/ 1 л крови. Объем гликозированного Hb в организме достигает 4-6 %.
Строение гемоглобина тесно связано с его функциями.
Поэтому превышение его концентрации в крови свидетельствует о наличии патологий, провоцирующих эритроцитоз (увеличение количества красных кровяных телец). В этом случае формула и структура гемоглобина не изменяются.
Медики выделяют следующие патологии:
- абсолютные (возникают при физиологических изменениях, провоцирующих увеличение концентрации эритроцитов);
- относительные (временные, возникают из-за обезвоживания или уменьшения объемов плазмы);
- истинные (возникают при эритремии или болезнях кроветворения и сопровождаются повышением давления, покраснениями кожи, закупоркой сосудов и увеличением селезенки).
Причины повышения уровня Hb связаны с развитием заболеваний сердечно-сосудистой системы, гипоксией, ожирением, проживанием в высокогорной местности, курением, возникновением неактивного гемоглобина, чрезмерными физическими нагрузками, стрессами, обезвоживанием, увеличением количества кортикостероидов и андрогенов в организме; ожогами, отравлениями медикаментами и угарным газом.
Самостоятельно нельзя понижать Hb. В случае самостоятельного повышения гемоглобина требуется определение причин, с учетом знания всех основных и второстепенных функций гемоглобина, постановка диагноза и грамотное лечение.
Пониженный уровень Hb
Уменьшение концентрации гемоглобина (анемия) возникает по следующим причинам:
- уменьшение количества эритроцитов при малокровии;
- потеря большого количества крови;
- дефицит железа, витамина С, фолиевой кислоты или витамина В12;
- нарушение развития красных кровяных телец;
- отравление печени и нарушение ее функционирования;
- вегетарианство или неправильный рацион;
- острые и хронические инфекционные заболевания;
- алкоголизм;
- коллагеноз;
- наследственность;
- употребление чая или кофе в больших объемах.
Анемия может возникать после операций или во время беременности. У будущих мам концентрация железосодержащего белка снижается до 110 г/1 л крови из-за повышенной потребности организма женщины и плода в микроэлементах. Чтобы выяснить, сколько гемоглобина находится в организме беременной, рекомендуется сдать анализ крови.
Со сниженным Hb рекомендуется принимать витамины группы В, препараты с высоким содержанием железа. При этом потребуется откорректировать рацион. Анемию диагностируют, основываясь на показателях Hb, потому что уровень эритроцитов при легкой форме не успеет снизиться.
Медики выделяют 6 групп анемии:
- железодефицитная – наиболее распространенная, так как организм не способен самостоятельно вырабатывать железо и получает его извне. Пациент может не догадываться о заболевании до тех пор, пока не сдаст анализ на Er, Hb, ЦП;
- острая постгеморрагическая – возникает из-за обильной потери крови в результате оперативного вмешательства, ранений или внутренних кровотечений;
- Аддисона-Бирмера (фолиеводефицитная);
- сидероахрестическая – возникает на фоне сбоя в синтезе, утилизации порфирина и избыточного накопления железа в организме. Возникает из-за наследственной или приобретенной патологии, включая прием противотуберкулезных препаратов;
- угнетение пролиферации эритроидного ростка;
- гемолитическая – возникает из-за ускорения распада эритроцитов.
Симптоматика анемии
Медики выделяют общие и специфические симптомы рассматриваемого недуга. Последние зависят от того, что спровоцировало развитие анемии. Общие симптомы:
- потрескавшиеся губы, заеды в уголках рта, болезненный язык;
- сухая, бледная (иногда желтоватая) кожа;
- длительное заживление царапин;
- тусклые, секущиеся волосы;
- ломкие ногти;
- помутнения в глазах;
- снижение внимания;
- повышенная утомляемость;
- плохая переносимость душных помещений;
- мышечная слабость;
- депрессивные состояния;
- сонливость;
- ослабление иммунитета;
- частые позывы к мочеиспусканию;
- головокружения;
- слюнотечение по ночам;
- головные боли;
- приступы учащения сердцебиения;
- обмороки;
- одышка;
- увеличение размеров селезенки или печени (не всегда).
Клинические проявления усиливаются по мере развития анемии. Биохимия позволяет понять реакции, протекающие в организме. Строение и функции Hb могут меняться под воздействием патологических процессов. Дефицит железосодержащего белка нельзя путать с гипоксемией (понижение давления кислорода в крови). Патологии костного мозга, почек, большая потеря крови провоцируют снижение концентрации Hb, а легочный фиброз и врожденные патологии сердца вызывают повышение его уровня.
Вредные соединения
Hb может вступать в реакцию с угарным газом, образуя HHbCO. Это соединение снижает физиологические способности красного кровяного пигмента. Пребывание в помещении, заполненном угарным газом, опасно для жизни человека. Для соединения 80 % гемоглобина с СО достаточно вдыхать 0, 1 % с кислородом. Курильщики наносят своему здоровью непоправимый вред, ведь в их организме содержание HHbCO превышено в 3-10 раз.
Не меньшую опасность представляет замена Fe2+ на Fe3+ (двухвалентного железа на трехвалентное). Это приводит к образованию метгемоглобина, замедляющего доставку кислорода к органам. Отравление химикатами может спровоцировать метгемоглобинемию, которая может носить наследственный характер.
Hb токсичен при проникновении крови из эритроцитов в плазму. Токсичность провоцирует:
- превышение концентрации продуктов распада в организме;
- гипоксию тканей.
В организме человека есть специальные механизмы, которые запускаются для связывания и обезвреживания токсичного вещества. Нормальный уровень Hb у мужчин и женщин немного отличается в силу особенностей организма.
Во время менструаций и беременности уровень гемоглобина немного снижается из-за разжижения крови. Среднее значение нормы для женщин:г/л (во время беременности снижается до 110 г/л). Среднее значение нормы для мужчин:г/л. Цветовые показатели указывают на насыщение крови:
При необходимости медики могут определить содержание Hb в 1 эритроците (нормальное значение 27 – 31 пг). Дополнительно, при помощи гематологического анализатора, определяют средний объем красных кровяных телец, гематокрит, показатель гетерогенности эритроцитов, среднее количество Hb в эритроцитах.
Причины изменения уровня Hb
Количество гемоглобина в организме может меняться из-за смены рациона, времени года (понижается осенью), образа жизни (физическая активность способствует повышению), рельефа местности, климата. Чистый воздух и курение практически одинаково влияют на уровень Hb – повышают его.
Прежде чем пытаться повысить уровень Hb, необходимо определить катализаторы такого состояния. Для этого потребуется пройти комплекс обследований, включая фиброгастродуоденоскопию. Среди растительной пищи много продуктов богатых железом, но они лучше усваиваются в сочетании с белками:
Особенности диеты при анемии:
- Гречка – лучший гарнир. Второе место у овсяных хлопьев и пшенной каши.
- Аскорбиновая кислота помогает всасыванию железа. Поэтому в рацион включают цитрусовые.
- Крепкий чай после еды заменяют какао на воде, настоем шиповника или черным шоколадом.
- Продукты с высоким содержанием кальция мешают усвоению железа.
- Немного сухого красного вина.
- Гематоген.
Включение в рацион продуктов, богатых железом, помогает справиться с легкой формой анемии. При ярко выраженной форме придется принимать железосодержащие препараты, которые может назначить только врач, основываясь на результатах анализов и особенностях организма пациента.
- Гемоглобин
- Глюкоза (сахар)
- Группа крови
- Лейкоциты
- Тромбоциты
- Эритроциты
Копирование материалов сайта возможно без предварительного согласования в случае установки активной индексируемой ссылки на наш сайт.
Источник: https://osostavekrovi.ru/sostav/gemoglobin/funkcii-gemoglobina.html
Гемоглобины—структурно-родственные белки, находящиеся в эритроцитах позвоночных. Они выполняют две важные биологические функции:
1) переносят из легких к периферическим тканям;
2) переносят и протоны от периферических тканей к дыхательным органам для последующего выведения из организма. Сравнительная биохимия гемоглобинов чрезвычайно интересна сама по себе, однако мы здесь сосредоточим внимание только на гемоглобинах человека.
Первичная структура гемоглобина А
В отличие от миоглобина, который не имеет четвертичной структуры, гемоглобины представляют собой тетрамерные белки, молекулы которых образованы различными типами полипептидных цепей (они обозначаются , и т. д.). В состав молекулы входят по две цепи двух разных типов. Длина
а- и -цепей примерно одинакова — a-цепь содержит 141 остаток, а Р-цепь—146; однако а- и ( -полипептиды гемоглобина А (НЬА) кодируются разными генами и имеют разную первичную структуру. В то же время первичная структура и -цепей гемоглобина человека в значительной степени консервативна.
Вторичная и третичная структура гемоглобина А
Несмотря на различия в длине цепи и аминокислотной последовательности миоглобина и р-полипептида , они имеют почти идентичную вторичную и третичную структуру. Это поразительное сходство, которое распространяется на расположение гема и восьми спиральных участков, частично обусловлено тем, что в эквивалентных положениях первичной структуры миоглобина и Р-субъединицы находятся хотя и различающиеся, но сходные по своим свойствам аминокислоты. а-Полипептид также весьма сходен с миоглобином, хотя в нем содержится семь, а не восемь спиралей. Как и в миоглобине, гидрофобные остатки у него размещаются внутри структуры, а гидрофильные (опять-таки за исключением двух остатков гистидина) — на поверхности; это в одинаковой мере свойственно и и Р-субъединицам.
Четвертичная структура гемоглобина А
Свойства индивидуальных гемоглобинов неразрывно связаны с их четвертичной, равно как и вторичной и третичной, структурами. Наиболее распространенные гемоглобины имеют следующую тетрамерную структуру: (нормальный гемоглобин взрослого человека) — (фетальный гемоглобин) — (гемоглобин при серповидноклеточной (минорный гемоглобин взрослого человека) — . Четвертичная структура наделяет гемоглобин дополнительными важными особенностями (отсутствующими у миоглобина), которые способствуют выполнению гемоглобином его уникальной биологической функции и обеспечивают возможность строгой регуляции его свойств. Гемоглобин обладает аллостерическими свойствами (от треч. аллос — другой, стерос — место, пространство), и на его примере можно лучше понять свойства других аллостерических белков.
Кинетика оксигенирования гемоглобина
Гемоглобин связывает четыре молекулы кислорода на тетрамер (по одной на гем в каждой субъединице); особенно важным отличием его от миоглобина является характерная кривая насыщения кислородом, которая имеет сигмоидную форму (рис. 6.8). Таким образом, способность гемоглобина связывать зависит от того, содержатся ли в данном тетрамере другие молекулы 02.
Рис. 6.8. Кривые связывания кислорода гемоглобином и миоглобином. Парциальное давление кислорода в артериальной крови составляет около 100 мм рт. ст., в венозной крови около 40 мм рт. ст., в капиллярах кровеносных сосудов активной мышцы— около 20 мм рт. ст.; минимальное давление, необходимое для функционирования ферментов цитохромной системы, равно мм рт. ст. Из рисунка видно, что ассоциация цепей с образованием теграмерной структуры приводит к существенному повышению эффективности снабжения тканей кислородом по сравнению с мономерными белками. (Изолированные цепи гемоглобина обладают примерно таким же сродством к кислороду, что и миоглобин, и характеризуются аналогичной гиперболической кривой насыщения.) (Из работы Stanbury J. В., Wyngaardcn J.B., Fredrickson D. S. (editors): The Metabolic Basis of Inherited Diseases. 4th ed. McGraw-Hill, 1978, с изменениями.)
Если да, то последующие молекулы 02 присоединяются легче. Следовательно, для гемоглобина характерна кинетика кооперативного связывания, благодаря которой он связывает максимальное количество 02 в легких и отдает максимальное количество 02 при тех PQ, которые имеют место в периферических тканях. Сравните, например, какие количества кислорода связываются гемоглобином и миоглобином в легких, при мм рт. ст., и какие в тканях, при мм рт. ст. (рис. 6.8).
Сродство гемоглобинов к характеризуется величиной —значением при котором наблюдается полунасыщение гемоглобина кислородом. Значение у разных организмов существенно различается, но во всех случаях оно превышает значение в периферических тканях рассматриваемого организма. Это хорошо иллюстрирует фетальный гемоглобин человека (HBF). Для мм. рт. ст., а для мм рт. ст. Благодаря этой разнице гемоглобин F отбирает кислород у , находящегося в плацентарной крови. Однако после рождения ребенка HBF утрачивает свою функцию; обладая более высоким сродством к 02, он высвобождает меньшее его количество в тканях.
Оксигенирование сопровождается значительными конформационными изменениями в гемоглобине
Связывание О, сопровождается разрывом солевых связей, образованных концевыми карбоксильными группами субъединиц (рис. 6.9). Это облегчает связывание следующих молекул , поскольку при этом требуется разрыв меньшего числа солевых связей. Указанные изменения заметно влияют на вторичную, третичную и особенно четвертичную структуру гемоглобина. При этом одна -пара субъединиц поворачивается относительно другой -пары, что приводит к компактизации тетрамера и повышению сродства гемов к (рис. 6.10 и 6.11)
Четвертичная структура частично оксигенированного гемоглобина описывается как Т-состояние (от англ. taut — напряжение); полностью оксигенированному гемоглобину отвечает R-состояние (relaxed — релаксированное) (рис. 6.12). Термины Т-состояния используют для характеристики четвертичной структуры аллостерических ферментов; меньшим сродством к субстрату обладает Т-состояние.
Конформационные изменения в окружении гемогруппы
Оксигенирование гемоглобина, как и миоглобина, сопровождается структурными изменениями в окружении гемогруппы. При оксигенировании атом железа, который в дезоксигемоглобине выступал на 0,06 нм из плоскости гемового кольца, втягивается в эту плоскость (рис. 6.13). Вслед за атомом железа ближе к гему перемещается и проксимальный гистидин а также связанные с ним соседние остатки.
Рис. 6.9. Солевые связи между субъединицами в дезоксигемоглобине. При оксигенировании эти нековалентные связи, обусловленные электростатическими взаимодействиями, разрушаются. (Из книги Stryer L.: Biochemistry, 2nd ed.. Freeman, 1981, с изменениями.)
Транспорт двуокиси углерода
Гемоглобин не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт от тканей к легким. Гемоглобин связывает сразу после высвобождения кислорода; примерно присутствующего в крови, переносится молекулами гемоглобина. Находящаяся в эритроцитах карбоангидраза катализирует превращение поступающего из тканей в угольную кислоту (рис. 6.14). Угольная кислота быстро диссоциирует на бикарбонат-ион и протон, причем равновесие сдвинуто в сторону диссоциации. Для
Рис. 6.10. Переход гемоглобина из Т- в -форму сопровождается поворотом одной пары жестко связанных субъединиц на 15 относительно другой такой же пары Ось вращения эксцентрична, т. е. одновременно происходит сдвиг димера ближе к оси тетрамера. На этом рисунке показан поворот и смещение затененной -пары относительно незатененной -пары (последняя считается неподвижной)
Рис. 6.11. Изменения, происходящие в области -контакта при оксигенировании. Контакт как бы «перескакивает» с одного зубца на другой, с заменой одной водородной связи на другую. Остальные связи образованы неполярными остатками. (Из работы Perutz М. F.: Molecular pathology of human hemoglobin. Stereochemical interpretation of abnormal oxygen affinities. Nature 1971:232:408, с любезного разрешения.)
Рис. 6.12. Вероятность перехода из Т-формы в R-форму повышается по мере последовательного оксигенирования каждой из четырех гемогрупп. В представленной здесь модели солевые мостики (прямые линии), связывающие субъединицы в Т-форме. разрушаются по мере присоединения кислорода, и даже те солевые мостики, которые остаются неразрушенными, постепенно ослабляются (волнистые линии). Переход из Т- в R-состояние не связан однозначно с присоединением определенного числа молекул кислорода, однако при связывании каждой новой молекулы кислорода вероятность этого перехода повышается. На переход между двумя состояниями оказывают влияние протоны, двуокись углерода, хлорид и ДФГ. Чем выше их концентрация, тем большее число молекул кислорода должно связаться, чтобы оказался возможным переход. Полностью оксигенированные молекулы в Т-состоянии и полностью дезоксигенированные в R-состоянии не показаны — они слишком неустойчивы, чтобы присутствовать в заметном количестве. (Из работы Perutz М. F.: Hemoglobin structure and respiratory transport. Sci. Am. [Dec.] 1978:239:92, с изменениями.)
Рис. 6.13. При оксигенировании диаметр координационной сферы атома железа становится меньше, и он втягивается в плоскость гема. Вместе с атомом железа смещается гистидин F8. (Из книги Stryer L: Biochemistry, 2nd ed.. Freeman, 1981, с некоторыми изменениями.)
Рис. 6.14. Образование угольной кислоты в ходе реакции, катализируемой карбоангидразой эритроцитов, и ее диссоциация на бикарбонат-ион и протон.
предотвращения опасного повышения кислотности крови должна существовать буферная система, способная поглощать избыток протонов. Гемоглобин связывает два протона на каждые четыре освободившиеся молекулы кислорода и определяет буферную емкость крови (рис. 6.15). В легких идет обратный процесс: присоединение кислорода к дезоксигемогло-бину сопровождается высвобождением протонов, которые связываются с бикарбонат-ионами, переводя их в угольную кислоту. Далее эффективно действующая карбоангидраза катализирует превращение угольной кислоты в углекислый газ, выдыхаемый из легких. Таким образом, связывание кислорода тесно сопряжено с выдыханием . Это обратимое явление известно как эффект Бора. Эффект Бора является свойством тетрамерного гемоглобина и определяется гем-гемовым взаимодействием, лежащим в основе кооперативных эффектов. У миоглобина эффект Бора не обнаруживается.
Рис. 6.15. Эффект Бора. Двуокись углерода, образовавшаяся в периферических тканях, реагирует с водой, образуя угольную кислоту, которая диссоциирует на бикарбонат-ион и протон. Дезоксигенированный гемоглобин выполняет роль буфера — он связывает протоны и поставляет их в легкие. В легких связывание гемоглобином кислорода сопровождается высвобождением протонов из гемоглобина. Протоны соединяются с бикарбонат-ионом, образуя угольную кислоту, которая при участии карбоангидразы превращается в двуокись углерода и воду. Двуокись углерода (углекислый газ) удаляется из легких с выдыхаемым воздухом.
Молекулярная основа эффекта Бора
Протоны, ответственные за эффект Бора, высвобождаются в результате разрушения солевых мостиков, которым сопровождается связывание кислорода с Т-структурой; они отсоединяются от атомов азота остатков гистидина (146) в ( -цепях. Эти протоны сдвигают равновесие в сторону образования угольной кислоты, которая расщепляется карбоангидразой с образованием СО; (рис. 6.15).
Наоборот, при высвобождении кислорода вновь формируется Т-структура с присущими ей солевыми мостиками, при образовании которых происходит присоединение протонов к остаткам гистидина в Р-цепях. Таким образом, в периферических тканях протоны благоприятствуют образованию солевых мостиков путем протонирования (по атому азота) концевых остатков гистидина в ( -субъединицах. Образование солевых мостиков форсирует освобождение кислорода из оксигенированной R-формы гемоглобина. Итак, повышение концентрации протонов способствует освобождению кислорода, а повышение концентрации кислорода стимулирует высвобождение протонов. Первый из этих эффектов проявляется в сдвиге кривой диссоциации кислорода вправо при повышении концентрации ионов водорода (протонов).
Регуляция 2,3-бисфосфоглицератом
Недостаток кислорода в периферических тканях приводит к накоплению 2,3-бисфосфоглицерата (ди-фосфоглицерата, ДФГ) (рис. 6.16). Это соединение образуется из 1,3-бисфосфоглицерата. промежуточного продукта гликолиза. Тетрамер гемоглобина связывает одну молекулу ДФГ, которая размещается в центральной полости, выстланной остатками всех четырех субъединиц. Объем этой полости достаточен для размещения ДФГ только в том случае, когда молекула гемоглобина находится в Т-форме и образуется достаточно широкий просвет между Н-
Рис. 6.16. Структура 2,3-бисфосфоглицерага.
спиралями -цепей. Связывание ДФГ осуществляется путем образования солевых мостиков между атомами кислорода ДФГ и группами, принадлежащими обеим -цепям: концевыми аминогруппами остатков аминогруппами остатков и боковыми группами остатков . Таким образом, ДФГ стабилизирует дезоксигениро-ванную Т-форму гемоглобина, образуя поперечные связи между -цепями—дополнительные солевые мостики, которые должны быть разрушены при переходе гемоглобина из Т- в R-форму.
С фетальным гемоглобином ДФГ связывается менее прочно, чем с гемоглобином взрослого человека, поскольку в его -цепи в положении находится не который не может участвовать в формировании солевых мостиков, удерживающих ДФГ в центральной полости. -Поэтому ДФГ в меньшей степени способствуют стабилизации Т-формы фетального гемоглобина и последний обладает более высоким сродством к кислороду по сравнению с гемоглобином взрослого человека.
Пусковым механизмом перехода между R- и Т-формами гемоглобина служит перемещение атома железа в плоскость порфиринового кольца или от нее. Источником свободной энергии для этих процессов (около 3000 кал/моль) служат стерические и электростатические факторы. Таким образом, совсем небольшое смещение атома относительно порфиринового кольца вызывает значительные изменения конформации гемоглобина и решающим образом воздействует на его ответную реакцию на сигнал, поступающий из внешней среды.
Рис. 6.17. Механизм связывания ДФГ с дезоксигемоглобином человека. ДФГ взаимодействует с тремя положительно заряженными группами в каждой из -цепей. (Из работы Amone A.: X-ray diffraction study of bonding of 2,3-diphosphoglycerate to human deoxyhemoglobin. Nature 1972:237:146, с разрешения.)
Мутантные гемоглобины человека
Мутации генов, кодирующих а- и -цепи, могут существенным образом сказываться на их биологической функции. Известно несколько сот мутантных гемоглобинов человека (в большинстве случаев функционально активных), и о некоторых из них, отличающихся сильным изменением биологических функций, речь пойдет ниже. Патологическое состояние, при котором мутация вызывает изменение биологической функции темоглобина, называют гемоглобинопатией.
В семействе гемоглобинов М остатки проксимального или дистального гистидина в а- или Р-субъединицах заменены на остатки тирозина. Атом железа в составе гема находится в этом случае в -состоянии, что обусловлено образованием прочного ионного комплекса с фенолятным анионом тирозина. Результатом такой аномалии является метгемоглобинемия, поскольку ферри-гем не способен связывать . В -цепи гемоглобина М -равновесие сдвинуто в сторону образования Т-формы. Сродство к кислороду низкое, эффект Бора отсутствует. В -цепях гемоглобинов М может происходить переход между R- и Т-состояниями и, следовательно, наблюдается эффект Бора.
Мутации, приводящие к преимущественному образованию -формы (в качестве примера можно привести гемоглобин Чезапик), отличаются тем, что соответствующие гемоглобины обладают повышенным сродством к кислороду. Подобные гемоглобины не способны поставлять достаточное количество кислорода периферическим тканям. Возникает тканевая гипоксия, ведущая к развитию полицитемии (повышению концентрации эритроцитов).
Гемоглобин при серповидноклеточнон анемии
В гемоглобине S остаток замещен на Остаток (Glu или Val) располагается на поверхности молекулы гемоглобина и контактирует с водой, и замещение полярного остатка на неполярный приводит к появлению на поверхности Р-субъединицы «липкого участка». Этот липкий участок присутствует как в оксигенированном, так и в дезоксигенированном гемоглобине S (в гемоглобине А он отсутствует). На поверхности дезоксигенированного гемоглобина существует комплементарный участок, способный прочно связываться с липким участком Р-субъединицы, тогда как в оксигенированном гемоглобине этот участок маскируется другими группами (рис. 6.18). Когда гемоглобин S переходит в дезоксигенированное состояние, его липкий участок связывается с комплементарным участком на другой молекуле дезоксигенированного гемоглобина. Происходит полимеризация дезоксигемоглобина S и его осаждение в виде длинных волокон. Волокна
Рис. 6.18. Схема, поясняющая взаимодействие липкого участка гемоглобина S (черный треугольник) с рецептором липкого участка (светлый треугольник) дезоксигемоглобина А и дезоксигемоглобина S. Наличие комплементарных участков на поверхности молекулы дезоксигемоглобина S способствует его полимеризации с образованием волокнистых структур. В присутствии дезоксигемоглобина А процесс полимеризации останавливается, поскольку на поверхности этой молекулы липкого участка нет. (Из книги Stryer L.: Biochemistry, 2nd ed., Freeman, 1981, с некоторыми изменениями.)
дезоксигемоглобина S механически деформируют эритроцит, придавая ему серповидную форму, что приводит к лизису клеток и множеству вторичных клинических проявлений. Таким образом, если бы можно было поддерживать гемоглобин S в оксигенированном состоянии или по крайней мере свести к минимуму концентрацию дезоксигенированного гемоглобина S, то нам удалось бы предотвратить полимеризацию дезоксигенированного гемоглобина S и образование «серповидных» клеток. Ясно, что полимеризации подвержена Т-форма гемоглобина S. Интересно отметить (хотя в практическом плане это мало существенно), что ферри-ион метгемоглобина А остается в плоскости порфиринового кольца и тем самым стабилизирует R-форму гемоглобина. То же относится и к гемоглобину при серповидноклеточной анемии: гемоглобин S в ферри-состоянии (метге-моглобин S) не подвержен полимеризации, поскольку он стабилизирован в R-форме.
В дезоксигемоглобине А тоже имеется рецепторный участок, способный взаимодействовать с липким участком оксигенированного или дезоксигенированного гемоглобина S (рис. 6.18), но присоединения «липкого» гемоглобина S к дезоксигемоглобину А недостаточно для образования полимера, поскольку сам дезоксигемоглобин А липкого участка не содержит и не может связать следующую молекулу гемоглобина. Следовательно, связывание дезоксигемоглобина А с R- или Т-формой гемоглобина S прерывает полимеризацию.
В результате полимеризации дезоксигемоглобина S образуются спиральные фибриллярные структуры. При этом каждая молекула гемоглобина контактирует с четырьмя соседними молекулами (рис. 6.19). Образование подобных трубчатых волокон ответственно за механические нарушения в содержащем
Рис. 6.19. Предполагаемая спиральная структура волокна из агрегированных молекул дезоксигемоглобина S. (Из работы Maugh Т. II: A new understanding of sickle cell emerges. Science 1981:211:265, с разрешения.)
Рис. 6.20. Электронные микрофотографии нормального (А) и серповидного (Б) эритроцитов. Изменения в молекуле р-глобина, приводящие к такому изменению формы клетки, вызваны мутацией единственного основания в ДНК (А вместо Т), в результате чего в цепи Р-глобина происходит замена глутамата на валин (гл. 36).
их эритроците: он приобретает серповидную форму (рис. 6.20), становится подверженным лизису в момент прохождения им щелей в синусоидах селезенки.
Талассемии
Другая важная группа нарушений, связанных с аномалиями гемоглобина — талассемии. Для них характерна пониженная скорость синтеза а-цепей гемоглобина (а-талассемия) или P-цепей (Р-талассемия). Это приводит к анемии, которая может принимать очень тяжелую форму. В последние годы достигнут ощутимый прогресс в выяснении молекулярных механизмов, ответственных за развитие талассемии (см. гл. 36).
ЛИТЕРАТУРА
Dean J.. Schechter А. N. Sickle-cell anemia: Molecular and cellular basis of therapeutic approaches. (3 parts). N. Engl. J. Med.. 1978. 299. 752, 804, 863.
Kloti I. М.. Haney D.N., King L.C. Rational approaches to chemotherapy: Antisickling agents. Science, 1981, 213, 724.
Perutz M. F. Hemoglogin structure and respiratory transport, Sci. Am. (Dec.). 1978, 239, 92.
Perutz M. F. The regulation of oxygen-affinity of hemoglobin: Influence of structure of globin on heme iron, Annu. Rev. Biochem.. 1979, 48. 327.
Stamatoyarmopoulos G. The molecular basis of hemoglobin disease, Annu. Rev. Genet., 1972, 6, 47.
Winslow R.M., Anderson W.F. The hemoglobinopathies. Page 1666. In: The Metabolic Basis of Inherited Disease, 5th ed., Stanbury J. B. et al. (eds.), McGraw-Hill, 1983.
Раздел I. Структура и функции белков и ферментов
Раздел II. Биоэнергетика и метаболизм углеводов и липидов
Раздел III. Метаболизм белков и аминокислот
Копирование информации со страницы разрешается только с указанием ссылки на данный сайт
Источник: https://edu.sernam.ru/book_b_chem1.php?id=38
Какую функцию выполняет белок гемоглобин
Многие годы пытаетесь вылечить ГИПЕРТОНИЮ?
Глава Института лечения: «Вы будете поражены, насколько просто можно вылечить гипертонию принимая каждый день…
Читать далее »
Наверняка каждый человек задавался вопросом: «Почему кровь красная?» Чтобы получить ответ, нужно рассмотреть, из чего она состоит.
Состав
Кровь – это быстро обновляющаяся соединительная ткань, которая циркулирует по всему организму и переносит газы и вещества, необходимые для обмена веществ. Она состоит из жидкой части, которая называется плазмой, и форменных элементов – кровяных клеток. В норме плазма составляет около 55% от общего объема, клетки – около 45%.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для лечения ГИПЕРТОНИИ наши читатели успешно используют Норматен. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию. Подробнее здесь…
Плазма
Эта бледно-желтая жидкость выполняет очень важные функции. Благодаря плазме, клетки, находящиеся в ней во взвешенном состоянии, могут перемещаться. На 90% она состоит из воды, остальные 10% – это органические и неорганические компоненты. В плазме содержатся микроэлементы, витамины, промежуточные элементы обмена веществ.
Клети
Существует три вида форменных элементов:
- лейкоциты – белые тельца, выполняющие защитную функцию, оберегающие организм от внутренних болезней и чужеродных агентов, проникающих извне;
- тромбоциты – мелкие бесцветные пластинки, отвечающие за свертывание;
- эритроциты – те самые клетки, которые делают кровь красной.
Эти клетки, которые называются красными кровяными тельцами, составляют большую часть форменных элементов – более 90%. Основная их функция – перенос кислорода из легких к периферическим тканям и углекислого газа от тканей в легкие для дальнейшего выведения его из организма. Эритроциты непрерывно производятся в костном мозге. Срок их жизни составляет около четырех месяцев, после чего они разрушаются в селезенке и печени.
Цвет крови бывает разным в зависимости от того, течет она от сердца или к сердцу. Кровь, поступившая из легких и затем по артериям направляющаяся к органам, насыщена кислородом и имеет ярко-алый цвет. Дело в том, что гемоглобин в легких связывает молекулы кислорода и превращается в оксигемоглобин, который имеет светло-красную окраску. Поступая в органы, оксигемоглобин высвобождает O₂, превращается вновь в гемоглобин. В периферических тканях он связывает углекислый газ, принимает форму карбогемоглобина и темнеет. Поэтому кровь, текущая по венам от тканей к сердцу и легким, темная, с синеватым оттенком.
Незрелый эритроцит содержит мало гемоглобина, поэтому сначала он синий, затем становится серым, и лишь созрев, приобретает красный цвет.
Гемоглобин
Это сложный белок, в состав которого входит пигментная группа. Эритроцит на одну треть состоит из гемоглобина, который и делает клетку красной.
Гемоглобин состоит из белка – глобина, и небелкового пигмента – гема, содержащего ион двухвалентного железа. Каждая молекула гемоглобина включает четыре гема, которые составляют 4% от всей массы молекулы, в то время как на долю глобина приходится 96% массы. Главная роль в активности гемоглобина принадлежит иону железа. Чтобы осуществить транспортировку кислорода, гем обратимо связывается с молекулой O₂. Двухвалентное окисное железо и придает крови красный цвет.
Кровь человека и других позвоночных животных имеет красный цвет, благодаря находящемуся в ней железосодержащему белку гемоглобину. Но есть на Земле живые существа, кровь которых содержит другие виды белка, поэтому и окраска у нее иная. У скорпионов, пауков, спрутов, речных раков она голубая, поскольку в ней находится белок гемоцианин, включающий медь, которая и отвечает за оттенок. У морских червей белок крови содержит закисное железо, поэтому она зеленого цвета.