Онкомаркер при раке молочной железы
Лабораторные маркеры рака молочной железы
Исследование концентрации двух основных онкомаркеров молочной железы – СА 15-3 и ракового эмбрионального антигена (РЭА), которое используется для прогноза, раннего выявления рецидива и метастазов опухоли и контроля лечения заболевания.
Синонимы русские
Анализы крови при раке молочной железы, онкомаркеры рака молочной железы.
Синонимы английские
Carcino embryonic antigen, CEA, CD66e, CEACAM5, Soluble form of MUC-1 protein, CA 15-3.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 24 часов до исследования.
Общая информация об исследовании
Для диагностики и контроля лечения многих онкологических заболеваний используют онкомаркеры. Это, как правило, белки, концентрация которых в крови повышается при наличии опухолевой ткани.
РЭА на сегодняшний день в основном используется при диагностике и мониторинге рака молочной железы, а также некоторых других злокачественных заболеваний. Также хорошо изученным онкомаркером, концентрацию которого исследуют при раке молочной железы, является гликопротеин CA 15-3.
РЭА – это крупный гликопротеин, по структуре напоминающий иммуноглобулины. Вероятно, РЭА обеспечивает межклеточные взаимодействия, однако его физиологическая роль не до конца ясна. Показано, что он играет определенную роль в стимуляции опухолевого роста, инвазии и метастазировании. Концентрация РЭА повышена при раке молочной железы, но также и при многих других злокачественных заболеваниях, в том числе при раке толстой кишки, поджелудочной железы, яичников, головы и шеи, мочевого пузыря, почек и предстательной железы. Более того, уровень РЭА может быть повышен и при доброкачественных заболеваниях, таких как эндометриоз, болезни печени, хроническая обструктивная болезнь легких, а также и у 5 % здоровых людей. С другой стороны, у пациентов с раком молочной железы может наблюдаться нормальное значение РЭА. Так как исследование РЭА обладает недостаточной чувствительностью и специфичностью в отношении рака молочной железы, в особенности его ранних стадий, этот онкомаркер не используют для первичной диагностики рака молочной железы.
СА 15-3 считается более специфичным для рака молочной железы онкомаркером. СА 15-3 – это растворимый фрагмент трасмембранного белка MUC-1, необходимого для защиты, смазывания и увлажнения поверхности эпителиальных слоев. Кроме того, MUC-1 является онкогеном. Повышение СА 15-3 наблюдается в 10-15 % случаев рака молочной железы Iстадии, 20 % - II стадии, 40 % - III стадии и 75 % - IV стадии. Таким образом, как и в случае с РЭА, СА 15-3 не подходит для ранней диагностики рака молочной железы. С другой стороны, оба онкомаркера могут быть рекомендованы для оценки прогноза заболевания, раннего выявления метастазов и контроля лечения рака молочной железы.
В настоящее время для оценки прогноза рака груди используются критерии, основанные на анализе биоптата молочной железы (наличие эстрогеновых рецепторов, наличие регионарных и отдаленных метастазов, экспрессия HER-2). В этой связи онкомаркеры – это перспективный метод оценки прогноза заболевания, так как они не требуют биопсии органа и могут быть исследованы в крови. Показано, что высокая концентрация РЭА, и в особенности СА 15-3, до операции является неблагоприятным прогностическим фактором, связанным с меньшей выживаемостью и более частыми рецидивами рака.
Это имеет особое значение при назначении адъювантной терапии. Традиционно при решении вопроса о назначении адъювантной терапии принимают во внимание такие характеристики опухоли, как размер и степень злокачественности, и в меньшей степени ориентируются на онкомаркеры. Это представление, однако, поменялось за последнее время. Считается, что уровень СА 15-3 может быть использован в качестве критерия отбора пациентов для адъювантной терапии наравне с другими, традиционными критериями, особенно у пациентов без метастазов в региональные лимфатические узлы.
Концентрацию онкомаркеров исследуют для контроля лечения и раннего выявления рецидива или метастазов заболевания. Прежде нарастающий уровень онкомаркеров у пациентов, лечившихся от рака груди, при отсутствии клинических и инструментальных признаков рецидива (в первую очередь, данных КТ) рассматривался как ложноположительный результат. Повышение уровня онкомаркеров не считалось признаком рецидива, и тактика лечения этих пациентов не менялась. С разработкой новых методов диагностики (прежде всего - ПЭТ-КТ с использованием фтордезоксиглюкозы) стало понятно, что значительная часть пациентов с нарастающим уровнем онкомаркеров в действительности имеет микрометастазы в грудную стенку, интрамаммарные лимфоузлы, легкие, печень и кости, которые ранее обычные методы диагностики (КТ) не регистрировали. Уровень онкомаркеров повышается задолго (2-9 месяцев) до того, как появляются клинические или радиологические признаки рецидива. Таким образом, онкомаркеры могут помочь в отборе пациентов, которые нуждаются в более точных методах радиологической диагностики. Следует отметить, что онкомаркеры более чувствительны в отношении отдаленных метастазов, чем регионарного распространения опухоли или рецидива.
Более того, в нескольких клинических исследованиях было показано, что назначение химиотерапии пациентам с нарастающим уровнем онкомаркеров без каких-либо клинических и радиологических признаков рецидива и (или) метастазов улучшало прогноз заболевания. Лечебная тактика, несмотря на ее эффективность, по-прежнему является экспериментальной.
Исследование онкомаркеров имеет прогностическое значение не только при первичной диагностике рака груди, но и при диагностике рецидива и метастазирования рака. Например, показано, что продолжительность жизни пациентов при уровне СА 15-3 менее 30 Ед/мл на момент рецидива больше, чем при более высокой концентрации этого онкомаркера. Также показано, что прогноз заболевания лучше, если повышение концентрации СА 15-3 произошло более чем через 30 дней после лечения.
Еще одним показанием к исследованию онкомаркеров является оценка ответа на терапию на поздних стадиях рака молочной железы, когда стандартные критерии оценки UICC не могут быть применены (например, при наличии плеврального выпота, асцита, литических очагов в кости – это 10-20 % пациентов с раком груди на поздних стадиях). Согласно рекомендациям Европейской группы по изучению онкомаркеров, у таких пациентов для оценки ответа на терапию могут применяться периодические контрольные исследования уровня СА 15-3 и РЭА. В одном из исследований было показано, что у 66 % пациентов с хорошим ответом на химиотерапию наблюдалось снижение СА 15-3, у 73 % со стабильным течением заболевания не было никаких изменений СА 15-3 и у 80 % пациентов с прогрессированием заболевания отмечалось повышение концентрации этого онкомаркера.
Следует помнить о том, что после начала химиотерапии могут наблюдаться парадоксальные изменения уровня онкомаркеров. Так, значительное повышение СА 15-3 может достигать 230 % нормы и продолжаться в течение нескольких месяцев. У большинства пациентов с таким парадоксальным пиком СА 15-3 в итоге наблюдается регрессия заболевания или его стабильное течение. По этой причине результат исследования онкомаркеров после химиотерапии рекомендуется повторить через 1-2 месяца. Существуют и другие причины транзиторного повышения онкомаркеров.
Для чего используется исследование?
- Для оценки прогноза рака молочной железы;
- для раннего выявления рецидива опухоли и метастазов;
- для контроля лечения рака молочной железы, особенно когда стандартные критерии оценки UICC не могут быть применимы (например, при наличии плеврального выпота, асцита, литических очагов в кости).
Когда назначается исследование?
- При подготовке к мастэктомии;
- при принятии решения об адъювантной терапии;
- при наблюдении пациентки после операции;
- при оценке ответа на химиотерапию и гормональную терапию.
Что означают результаты?
Референсные значения
Отдельно для каждого анализа, входящего в комплекс:
| Причины повышения | Причины понижения | |
| Раковый эмбриональный антиген (РЭА) |
|
|
| СА 15-3 |
|
|
Что может влиять на результат?
- Наличие сопутствующих заболеваний;
- прогрессирование болезни и появление метастазов;
- начало химиотерапии.
Важные замечания
- Анализ не предназначен для скрининга рака молочной железы;
- нормальные значения онкомаркеров не позволяют полностью исключить рак молочной железы;
- результаты исследования оценивают с учетом дополнительных анамнестических, инструментальных и лабораторных данных.
Также рекомендуется
[12-015] Гистологическое исследование биоптатов органов и тканей (за исключением печени, почек, предстательной железы, лимфатических узлов)
[12-027] Иммуногистохимическое исследование клинического материала (с использованием 1 антитела)
[18-001] Ген рака молочной железы 1 (BRCA1). Выявление мутации 185delAG (нарушение структуры белка)
[18-002] Ген рака молочной железы 1 (BRCA1). Выявление мутации 4153delA (нарушение структуры белка)
[18-003] Ген рака молочной железы 1 (BRCA1). Выявление мутации 5382insC (нарушение структуры белка)
[18-005] Ген рака молочной железы 2 (BRCA2). Выявление мутации 6174delT (нарушение структуры белка)
[18-079] Ген рака молочной железы 1 (BRCA1). Выявление мутации 3819delGTAAA (Нарушение структуры белка)
[18-080] Ген рака молочной железы 1 (BRCA1). Выявление мутации 3875delGTCT (Нарушение структуры белка)
[18-081] Ген рака молочной железы 1 (BRCA1). Выявление мутации T300G (Нарушение функции белка)
[18-082] Ген рака молочной железы 1 (BRCA1). Выявление мутации 2080delA (Нарушение структуры белка)
Кто назначает исследование?
Онколог, врач общей практики, терапевт.
Литература
- Molina R, Barak V, van Dalen A, Duffy MJ, Einarsson R, Gion M, Goike H, Lamerz R, Nap M, Sölétormos G, Stieber P. Tumor markers in breast cancer- European Group on Tumor Markers recommendations. Tumour Biol. 2005 Nov-Dec;26(6):281-93.
- Duffy MJ. Serum tumor markers in breast cancer: are they of clinical value? Clin Chem. 2006 Mar;52(3):345-51. Epub 2006 Jan 12. Review.
- Chernecky C. C. Laboratory Tests and Diagnostic Procedures / С.С. Chernecky, В.J. Berger; 5th ed. - Saunder Elsevier, 2008.
Онкомаркеры при раке молочной железы: виды, нормы концентрации и особенности исследования
Главная > Другие болезни > Рак груди > Симптомы и диагностика > Онкомаркеры при раке молочной железы: виды, нормы концентрации и особенности исследования
Рак молочной железы является страшным диагнозом для многих женщин: большинство сразу вспоминает о потерявших волосы пациентках и довольно высокой смертности.
При этом мало кто помнит о том, что на первых стадиях процент излечившихся больных достигает 95-98%.
Это связано с тем, что рак не имеет особых признаков и часто протекает бессимптомно. Это приводит к тому, что женщина обращается к врачу только на 3-4 стадии.
Оглавление:
- Важность своевременной диагностики
- Виды
- Проведение исследования и норма концентрации
Важность своевременной диагностики
 Чем раньше будет обнаружен рак, тем проще его можно вылечить и тем благоприятнее прогнозы.
Чем раньше будет обнаружен рак, тем проще его можно вылечить и тем благоприятнее прогнозы.
Сложность заключается лишь в том, что на 1-2 стадиях рака молочной железы женщина ощущает лишь небольшую боль, при тщательном ощупывании может отметить небольшое уплотнение. Также быстро обнаружить рак можно при регулярном посещении маммолога.
Используя МРТ или УЗИ, врач сможет обнаружить подозрительные уплотнения и взять пробу тканей для более тщательного изучения. Также диагностировать рак в самом начале можно при помощи онкомаркеров.
Это специфические молекулы, которые организм производит при возникновении рака или других опухолей. Они помогают бороться с образованием и являются своеобразным «сигналом» для маммолога о наличии какой-либо проблемы.
Имейте ввиду: онкомаркеры не всегда являются симптомом именно рака: их появление может быть вызвано нарушением работы желудка, почек или печени или воспалением.
Также важно помнить, что для получения наиболее правильной информации необходимо сдать несколько анализов. Единичная сдача не сможет полностью отразить картину происходящего. После обнаружения критической нормы врачом могут быть прописаны дополнительные процедуры.
Виды
 Существует несколько видов онкомаркеров, при обнаружении которых можно говорить о возможности появления рака груди:
Существует несколько видов онкомаркеров, при обнаружении которых можно говорить о возможности появления рака груди:
- СА 15-3: является наиболее важным и достоверным, так как появляется только при раке молочной железы. Пациентка сдает кровь на анализ, который проводит маммолог в течение нескольких дней. При раннем обнаружении заболевания вероятность полного излечения составляет более 90%. Немаловажную роль СА 15-3 играет и при определении метастаз и рецидивов.
- СА 27-29: имеет то же значение, что и СА 15-3.
- СА 125: появляется при возникновении опухоли в районе половых органов, может появляться при раке груди. Обычно проявляется при беременности или во время менструального цикла.
- СА 19-9: возникает при наличии опухолей в желудке, желчном пузыре, толстой и прямой кишках, молочных железах. В зависимости от концентрации врач определяет вид опухоли и ее месторасположение.
- Раково-эмбриональный антиген (РЭА): его можно встретить при раке печени, яичников, почек и груди. Его уровень может повыситься из-за курения, язвы желудка или каких-либо нарушений в работе пищеварения. Обычно его наличие проверяют вместе с онкомаркером СА 15-№.
- ИАП-1 (Ингибитор активатора плазминогена) и УАП (Урокиназа активатора плазминогена): эти вещества наблюдаются практически при всех агрессивных формах рака и зачастую применяются для определения необходимости химиотерапии. Их проведение требует специфических условия хранения тканей для исследования.
Процент содержания онкомаркера пропорционально состоянию рака: чем больше опухоль, тем больше СА 15-3. При повышении концентрации стоит говорить о стабильном росте рака, при уменьшении – о его уничтожении. Это помогает правильно подобрать терапию и оценить ее результат.
Важно знать: при разрушении опухоли и во время беременности концентрация онкомаркера может повышаться.
Небольшие превышения нормы могут свидетельствовать о наличие воспалений в организме, но должны быть обязательно проверены дополнительно.
Проведение исследования и норма концентрации
Онкомаркеры находятся в крови пациента, а потому ему необходимо сдать ее для анализа.
Это делается в первой половине дня у маммолога. За 8-14 часов до приема необходимо отказаться от еды, также придется забыть о лекарствах на 1-2 недели, так как это может повлиять на качество крови.
Результат будет готов через несколько дней. Для каждого онкомаркера существует своя норма: например, для СА 15-3 она составляет 22 единицы на мл крови, для СА 27-29 – до 40 единиц, уровень РЭА – до 5 единиц.
При превышении нормы врач может порекомендовать дополнительное обследование для обнаружения рака молочной железы. При обнаружении рака груди на ранних стадиях вероятность полного и безопасного излечения существенно повышается.
При этом помощь в обнаружении оказывает сам организм: производя специальные онкомаркеры, он старается побороть болезнь самостоятельно. Их обнаружение будет свидетельствовать о неполадках в организме и поспособствует более глубокому изучению состояния пациента.
Что такое онкомаркеры, и каким образом они помогают выявить злокачественную опухоль, смотрите в следующем видео:
Онкомаркер рака молочной железы (СА 15-3)
24 Мая в 10:34 936
Раковый антиген СА 15-3 — гликопротеиновый эпитоп муцина (молекулярная масса 300 кДа), представитель класса онкофетальных маркеров. Плод накапливает СА 15-3 в гепатоцитах, а также в клетках эпителия бронхов.Организм взрослого человека характеризует экспрессия данного антигена эпителием протоков молочной железы.
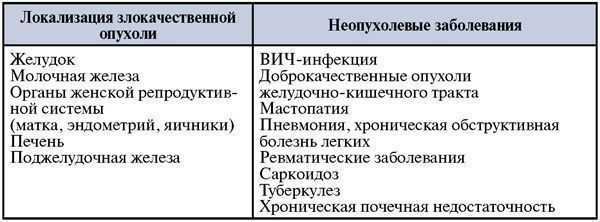
Впервые соединение удалось выделить Куфэ в 1983 году. Биологический период полужизни маркера составляет 7 дней. Физиологическая концентрация СА 15-3 в сыворотке крови здоровых женщин < 37 Ед/мл. В качестве патологического рассматривают показатель > 37 Ед/мл. Заболевания, при которых комплекс диагностируемых клинико-биохимических нарушений включает повышение концентрации СА 15-3, представлены в ниже (Табл.2).Таблица 2. Основные заболевания, сопровождающиеся повышением уровня СА 15-3.
Применительно к диагностике рака молочной железы (РМЖ), за антигеном СА 15-3 традиционно сохраняется роль маркера выбора, значение которого предопределяет стадия болезни.
В условиях распространенного опухолевого процесса, повышенный уровень данного антигена регистрируется в 85% случаев, тогда как на фоне I-II стадии РМЖ, подобные изменения отмечены лишь у 15% больных. Достаточно низкая (15-20%) чувствительность теста делает неэффективным его использование в целях ранней диагностики рака молочной железы и, соответственно, в программах скрининга при указанной патологии. Вместе с тем, повышенные, особенно сверхвысокие уровни СА 15-3, выявляемые до проведения оперативного вмешательства, обоснованно расцениваются как прогностически неблагоприятный признак. Известно, что указанные концентрации антигена, как правило, ассоциируются с наличием отдаленных метастазов первичной опухоли. Кроме того, специальные наблюдения свидетельствуют, что повышение уровня СА 15-3 обнаруживается в среднем за 2,7 месяца до появления клинических признаков рецидива РМЖ. Коэффициент корреляции между уровнем СА 15-3 и массой опухоли молочной железы составляет 75%. Подробная закономерность аргументирует правомерность осуществления мониторинга эффективности проводимого лечения РМЖ, путем динамического контроля концентрации данного антигена в сыворотке крови.Показания к проведению количественного определения СА 15-3:
• Оценка эффективности проводимого лечения РМЖ. • Мониторинг послеоперационной активности опухолевого процесса с целью раннего (доклинического) выявления рецидива РМЖ.Методы количественного определения СА 15-3:
• Иммуноферментный; • Радиоиммунологический; • Хемилюминесцентный; • Электрохемилюминесцентный; • Молекулярно-генетический. Перспективным должно явиться применение лабораторной панели, которая интегрирует то или иное сочетание рационально (с максимальным учетом специфики клинической ситуации) подобранных маркеров рака молочной железы.Муциноподобный раковый антиген (МСА) — гликопротеид с молекулярной массой 350-500 кДа, принадлежит к семейству MUC-1. Референсное значение уровня МСА = 11 Ед/мл, стадиеспецифический маркер рака молочной железы.
Чувствительность теста 60,8%. При распространенном раке молочной железы, уровень МСА повышается в 80% случаев. Показано, что рост концентрации МСА, как и СА 15-3, особенно характерен для РМЖ с наличием метастазов в кости скелета. Повышение уровня опухолевых маркеров МСА и СА-125, диагностированное у больного РМЖ одновременно, квалифицируется как неблагоприятный прогностический фактор на любой стадии опухолевого роста. Неспецифический подъем уровня МСА может регистрироваться при беременности, мастопатии, а также (как проявление) неопухолевых заболеваний печени.Тканевой полипептидный специфический антиген (TPS) — фрагмент цитокератина 18 — цитоплазматического белка с молекулярной массой 45 кДа.
Цитокератины (кератины) — белки типичные для эпителиальных клеток. В зависимости от изоэлектрической точки и молекулярного веса, им присвоены порядковые номера от 1 до 27. Экспрессия данных белков находится в тесной связи с морфологическим типом эпителия. Биологический период полужизни TPS 7 дней. Референсное значение уровня = 80 Ед/л. Специфичность теста — 95%, чувствительность — 18-31%. Данный антиген считается одним из показателей агрессивности РМЖ. Так при условии выраженности последней, даже сравнительно малого размера опухоль, способна обусловить существенное повышение сывороточного уровня TPS.В этой связи рекомендуется применение данного теста сочетать с определением одного из муцинов (СА 15-3 или МСА), уровень которых более адекватно отражает распространенность опухолевого процесса.
Маммологическое цитологическое исследование (ЦИ) представляет собой объективное изучение структуры клеточных элементов в цитологическом препарате, с целью диагностики наличия и характера опухолевых и/или неопухолевых поражений молочной железы.Как правило, материалом для проведения ЦИ являются следующие субстраты:
• диагностические пунктаты (опухолевидных образований молочной железы, уплотнений в области рубца после хирургических манипуляций на ней, региональных лимфатических узлов); • отпечатки и соскобы, полученные с эрозированной поверхности соска молочной железы; • отпечатки с поверхности разрезов и клеточного материала, полученного при эксфолиативной биопсии. Общепринятым критерием достоверности ЦИ являются результаты сопоставления его данных и данных планового гистологического исследования. Последнее при этом следует расценивать в качестве основополагающих. Выраженная пролиферация клеточных элементов представляет собой типичный источник гипердиагностических ошибок в условиях имеющихся подозрений на РМЖ. Характерны в этом плане морфологические изменения протоков и долек молочной железы, которые сопутствуют ее фиброаденоме и пролиферирующему аденозу.Дополнительные затруднения в постановке на основе ЦИ, адекватного (исключающего наличие опухолевой болезни) диагноза, могут в данном случае быть обусловлены укрупнением клеточных ядер.
Не вызывает сомнения тот факт, что носительство мутаций определенных генов сопряжено с увеличением риска РМЖ. Вместе с тем, прогностическая значимость ряда геномных нарушений, нуждается при данной патологии в уточнении (группа генов-кандидатов). Соответствующие представления обобщены в Табл. 3.Таблица 3. Гены и гены-кандидаты, связанные с РМЖ.
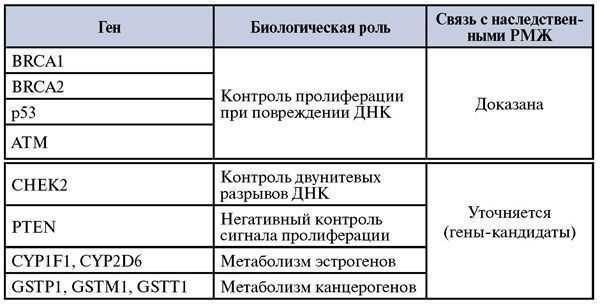
Последние могут реализоваться не только через эстрогеновые, но и тирозинкиназные рецепторы к эпидермальному фактору роста (EGFR), семейство которых представлено четырьмя рецепторами: EGFR (HER1, ErbB1), HER2 (ErbB2, HER-2/neu), HER3 (ErbB3) и HER4 (ErbB4).
Данные рецепторы участвуют в реализации сигнальных путей, через которые запускаются механизмы клеточного роста и пролиферации. Ключевыми представителями семейства рецепторов к эпидермальному EGFR при РМЖ являются EGFR (HER1/ErbB1) и HER2 (ErbB2). Гиперэкспрессия рецептора EGFR/HER1 встречается в 27-30% случаев РМЖ, а гиперэкспрессия рецептора HER2 характерна для 20-25% данных больных и ассоциируется с агрессивным фенотипом опухоли. Взаимодействие эстрогеновых рецепторов с рецепторами EGFR (HER1) и особенно, HER2 (ErbB2) — так называемый crossta LK, считаются причиной развития резистентности клеток опухоли к эндокринной терапии, а также являются важным фактором предикации исхода рака молочной железы. Согласно имеющимся предклиническим данным, экспрессия сосудистого эндотелиального фактора роста — VEGF, ассоциирована с гиперэкспрессией HER2 (подчеркнем, что эстроген является потенциальным модулятором неоангиогенеза и повышает экспрессию VEGF в клетках). Пациентов с опухолями, характеризующимися экспрессией каждого из данных рецепторов, отличает более негативный прогноз, чем на фоне повышения экспрессии любого из них в отдельности. Одним из первых тестов, которые удалось внедрить в практику клинической лабораторной онкодиагностики, явилось определение рецепторов стероидных гормонов. Указанные аналиты представляют собой белки, специфически, а также избирательно связывающие соответствующие биологически активные соединения после их проникновения через мембрану клетки.В настоящее время разработан ряд методов анализа рецепторов стероидных гормонов:
• иммуногистохимический; • иммуноферментный; • иммуноцитохимический; • радиолигандный.Наиболее важное преимущество иммуногистохимии (ИГХ) и иммуноцитохимии (ИЦХ) анализов определяется возможностью установить с их помощью принадлежность рецепторов именно к опухолевой клетке.
Экспрессия рецепторов эстрогена и прогестерона зависит от типа РМЖ и характеризуется в этой связи следующими уровнями (данные ВОЗ):
• инвазивный дольковый — 60-70% (прогестерон) и 70-95% (эстрогены); • инвазивный криброзный и муцинозный — 100% (эстрогены); • инвазивный протоковый — 70-80% (прогестерон и эстрогены).Проспективные исследования доказывают, что к факторам риска РМЖ у женщин в постменопаузе относят повышение концентрации половых стероидных гормонов (свободного эстрадиола, тестостерона, эстрона, дэгидроэпиандростерона (ДЭА) и ДЭА-сульфата, андростендиона) и снижение сексстероидсвязывающего глобулина, часто ассоциирующимся с избыточной массой тела (абдоминальным ожирением) и гиперинсулинемией.
Влияние эстрогенов на клеточную пролиферацию в тканях молочной железы может реализоваться опосредованно — через факторы роста. Стимулируют пролиферацию и дифференцировку эпителиальных клеток молочной железы и тормозят апоптоз протоонкогены и следующие пептидные факторы: эпидермальный фактор роста (ЭФР); инсулиноподобные факторы роста типов I и II (ИПФР-I и ИПФР-II); альфа-трансформирующий фактор роста (ТФР-альфа).
Сформулирована также теория генотоксического действия эстрогенов, согласно которой метаболиты эстрадиола проникают в клетку, минуя эстрогеновые рецепторы, связываются с ядерной ДНК и повреждают ее молекулу. В настоящее время изучено более 100 различных факторов прогноза РМЖ, которые позволяют оценивать биологическое поведение опухоли. Для оптимального решения таких важных вопросов, как прогноз клинического течения РМЖ, отбор групп пациентов с целью дифференцированного назначения адекватной гормоно- и химиотерапии, большое значение придают ряду маркеров, хорошо выявляемых с помощью иммуногистохимических методов. Современная программа комплексного лабораторного ИГХ исследования клеток РМЖ должна интегрировать в себе определение содержания и уровня экспрессии рецепторов стероидных гормонов (эстрогенов, прогестерона, андрогенов), онкобелка HER2 и антигена Ki67. Среди указанных тестов, определение рецепторов андрогенов, не всегда находит применение на практике. Между тем, они обнаруживаются в 47% случаев рака молочной железы. Рецепторы андрогенов выявляются в 69% опухолей, которые имеют рецепторы эстрогенов и прогестерона, а также в 11% опухолей, не содержащих указанные рецепторы. Почти 1/3 опухолей (32% случаев) лишены при РМЖ всего комплекса рецепторов стероидных гормонов.Фенотипы РМЖ, характеризующиеся отсутствием рецепторов эстрогенов, обладают более злокачественным течением. Среди соответствующей группы пациентов достоверно чаще диагностируются метастазы первичной опухоли в региональные лимфатические узлы.
Пролиферативная активность клеточных элементов опухоли является одним из основных проявлений биологического поведения опухоли. Считается, что для адекватной оценки данного параметра требуется использовать ИГХ реакцию с антигеном Ki67. Активная экспрессия антигена Ki67, сочетается с повышенным продуцированием онкобелка HER2 и с одновременно низкой экспрессией клетками РМЖ рецепторов прогестерона. Последний, в связи с выраженным метастическим потенциалом опухоли, приходится распространить и на ситуацию максимальной экспрессии онкобелка HER2. Соответствующий эффект с одинаковой частотой обнаруживается в различных горомально-рецепторных фенотипах РМЖ. Прогностическую роль HER2-позитивного статуса при РМЖ, убедительно подтверждают также данные выживаемости (общей и безрецидивной) группы больных с подобными опухолями. Значения ее характеризующие существенно уступают полученным на фоне HER2 негативного статуса РМЖ (Табл. 4).Таблица 4. Выживаемость больных раком молочной железы, в зависимости от HER2 статуса опухоли.
Выявление HER2-позитивного РМЖ (гиперэкспрессия онкобелка = 3+) с использованием ИГХ реакции или по амплификации гена HER2 методом FISH, имеет определенные недостатки как методологического, так и технологического плана. В частности, показано, что первичный HER2 статус РМЖ, не всегда соответствует статусу его метастазов. Подобный эффект объясняют гетерогенностью опухоли. Кроме того, диагностическую эффективность определения HER2 статуса снижают технологическая вариабельность используемого метода и нередко возникающее разночтение между ИГХ исследованием и FISH анализом. Требуется также учитывать наступающее из-за длительного архивирования срезов, снижение количества антигена. В данной связи сейчас предложен новый сывороточный биомаркер РМЖ — внеклеточный фрагмент домена HER2 (HER2 ECD). Тестирование HER2 ECD ставится серийно, выполняют в режиме реального времени, мониторирует результаты лечения РМЖ, позволяет предсказывать рецидив опухоли, а также способствует оперативной выработке необходимых решений. Повышение HER2 ECD может быть использовано для идентификации пациенток, отличающихся плохим прогнозом развития рака молочной железы. Последние годы разрабатываются подходы к практическому использованию теории опухолевого ангиогенеза в онкоморфологии, а именно определяется степень развития кровеносных сосудов в опухоли, что, в свою очередь часто позволяет предсказать риск развития рецидива и метастазов РМЖ, а также исход заболевания. Основное внимание уделяется исследованию количества сосудов в РМЖ. Для этого используется ИГХ выявление их с помощью антител против антигенов VII фактора свертывания крови (фактор Виллебранда), СД31, СД34. На гистологических препаратах, окрашенных с помощью указанных антител, подсчитывают плотность сосудов в опухоли и другие параметры. Кроме того, проводят иммуноморфологические исследования по выявлению ангиогенного сосудистого фактора роста. Большое значение придают исследованиям, связанным с определением взаимоотношения раковых клеток между собой и с окружающей стромой. Для этого изучают адгезивные свойства клеток с помощью антител против адгезивных молекул, к которым относятся кадгерины, катенины и протеогликан СД44. Кадгерины — кальцийзависимые белки, осуществляющие связь между клетками. При этом выделяют кадгерины эпителиальные (Е-кадгерины), нервные (N) и плацентарные (P). Внутриклеточно кадгерины взаимодействуют с несколькими белками — катенинами. Среди последних различают альфа-, бета-, гамма-варианты и белок p120. Взаимодействие кадгеринов и катенинов во многом определяет структуру и функции клеток: полярность, дифференцировку, рост, гибель. Снижение уровня Е-кадгерина в клетках РМЖ сопровождается снижением дифференцировки, нарастанием инвазивного роста и увеличением метастатического потенциала, что свидетельствует о неблагоприятном прогнозе. Высокая концентрация Р-кадгеринов в РМЖ резко ухудшает течение заболевания. Считают, что Р-кадгерины являются более информативными маркерами клинического исхода рака молочной железы, чем изменения в экспрессии Е-кадгерина или катенинов. Другой аспект этой проблемы — выработка опухолевыми клетками протеолитических ферментов (протеаз), которые приводят к дегенерации клеточного матрикса, что лежит в основе инвазивного роста опухоли и ее метастазирования. Среди таких протеаз наиболее изучены металлопротеиназы и катепсин D. Повышенный уровень этих ферментов отмечен в клетках опухоли, что является одним из критериев ее агрессивности, определяемой стадией заболевания, количеством гормональных рецепторов и гистологическим типом РМЖ. Анализируя изложенную выше информацию, важно констатировать наличие достаточно большого количества ИГХ маркеров биологического поведения злокачественной опухоли молочной железы. Вместе с тем, остается актуальной дальнейшая разработка стандартизации всех этапов проведения соответствующих исследований. Разумеется, не могут явиться в этом плане исключением, критерии количественной оценки результатов каждой из применяемых в данном случае реакций. Правильное формулирование окончательного диагноза является компетенцией гистолога. При этом необходимо руководствоваться действующим вариантом Международной гистологической классификации опухолей и опухолеподобных процессов молочной железы (ВОЗ, 2003).
Протокол гистологического исследования РМЖ должен отразить следующие данные: гистологический тип, степень дифференцировки, размеры опухоли, наличие фокусов рака in situ в окружающей ткани, количество исследованных лимфатических узлов, в том числе пораженных метастазами, рецепторный статус опухоли.
В рамках эпидемиологического подхода к изучению рака молочной железы, все случаи данной патологии могут быть классифицированы следующим образом: • спорадический РМЖ, при котором факт заболевания не удается достоверно подтвердить для обеих родителей (около 68% всех случаев РМЖ); • семейный РМЖ, представляющий собой скопление (исключительно случайное) больных РМЖ внутри одной семьи, как результат воздействия единых для нее и одновременно экзогенных факторов риска канцерогенеза (около 23% всех случаев рака молочной железы); • наследственный РМЖ, ассоциирующийся с носительством кровными родственницами (особенно 1-й степени родства) мутаций определенных генов (около 9% всех случаев РМЖ). Доказана значимость в рассматриваемом аспекте близости родства с пациентом, особенно 1-й его степени (мать, дочь, родная сестра), тогда как 2-я степень родства (двоюродная сестра, бабушка, внучка, тетя, племянница), играет здесь ощутимо меньшую роль. Классический (аутосомно-доминантный) механизм передачи наследственного РМЖ, предполагает, что образование одиночного мутантного аллеля, достаточно для инициации и/или промоции опухоли. Этапным достижением в изучении проблемы наследственных форм рака молочной железы и яичников, принято считать открытие генов BRCA (Breast cancer associated gene) — BRCA1 и BRCA2. В 1994 году был выделен ген BRCA1, который картирован на длинном плече 17-й хромосомы (17q21), затем — в 1996 году удалось клонировать ген BRCA2. Последний размещен на 13-й хромосоме (13q12). На протяжении дальнейших исследований была получена информация относительно биологической функции, а также структуры рассматриваемых генов. При этом доказано, что конкретные герминальные мутации генов BRCA1 и BRCA2 способны детерминировать предрасположенность к РМЖ (также, впрочем, как и раку яичников). В настоящее время идентифицировано более 800 вариантов таких мутаций (главным образом, делеций и инсерций). С геном BRCA1, согласно оценкам большинства авторов, корректно связывать около 20% случаев наследственного РМЖ.Носительство женщинами мутаций данного гена сопряжено с наличием следующих рисков:
• вероятность рака молочной железы = 75%, возраст < 50 лет; • вероятность РМЖ = 85%-90% к 70 годам; • вероятность второго новообразования — рака яичников (синдром рака молочной железы и яичников — breast-ovarian cancer syndrome) = 29%, возраст < 50 лет или 44% к 70 годам; • 4-х кратное увеличение риска рака толстой кишки.Патогенетическое значение мутаций BRCA1 у мужчин характеризуют следующие результаты наблюдений:
• редкое развитие РМЖ (что, разумеется, не исключает возможность передачи соответствующей мутации по отцовской линии); • 3-х кратное увеличение риска рака предстательной железы.В целом РМЖ, обусловленный мутациями BRCA1 характеризуют следующие особенности:
• низкая степень дифференцировки; • частое отсутствие рецепторов эстрогена и прогестерона; • гиперэкспрессия гена р53 и циклина Е. С геном BRCA2 связано около 70% случаев наследственного РМЖ.Носительство женщинами мутации данного гена у женщин сопряжено с наличием следующих рисков:
• вероятность РМЖ = 40-70%; • вероятность рака яичников = 10-35%; • 4-х кратное увеличение риска карциномы эндометрия; • 3-х кратное увеличение риска рака поджелудочной железы; • 2-х кратное увеличение риска рака желудка. Мужчины-носители мутаций BRCA2 имеют 20% риск заболеть раком молочной железы, что практически в 200 раз выше, чем в общей их популяции. При этом заболевание диагностируется в более молодом возрасте и отличается высокой летальностью.В целом РМЖ, обусловленный мутациями BRCA2 характеризуют следующие особенности:
• более высокая (чем в случае BRCA1) степень дифференцировки; • частое наличие рецепторов эстрогена и прогестерона. Необходимо подчеркнуть специально, что прогноз у носительниц мутаций BRCA2 более благоприятный, чем в случае нарушения нормального функционирования BRCA1 и при спорадическом РМЖ. Пик заболеваемости РМЖ у носителей BRCA1 совпадает с возрастом 35-39 лет, а для носителей BRCA2 сдвигается на более поздний период (43-54 года).Представляется целесообразным проведение медико-генетического консультирования больных РМЖ с косвенными признаками наследственного заболевания:
• возраст обнаружения опухоли < 45 лет; • наличие РМЖ и/или РЯ у кровных родственников 1-2 степени родства;• диагностирование первично-множественных опухолей (билатериальный рак молочной железы (БРМЖ) и РЯ).
Указанным группам больных показано медико-генетическое обследование и последующий молекулярный анализ с целью выявления носи-тельства повторяющихся «founders-мутаций в генах BRCA1 (5382 ins C) и BRCA2 (6172 del T). Благодаря успехам генетики в исследовании проблемы рака молочной железы, выделен ряд клинических синдромов, включающих как один из компонентов, диагностирование данной опухоли (Табл.5).Таблица 5. Синдромы, сопряженные с наследственным раком молочной железы.
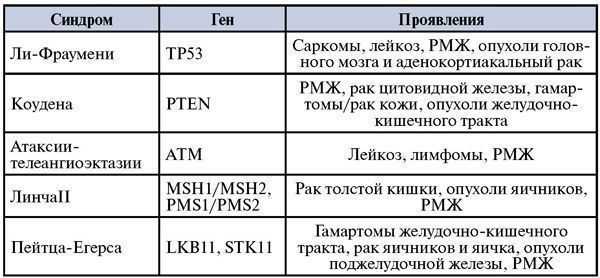
Использование молекулярных маркеров при раке молочной железы позволяет проводить:
• диагностику заболевания; • оценку степени распространенности неопластического процесса; • мониторинг эффективности лечения; • клинический прогноз; • оценку резистентности к химиотерапии.Исследована частота различных молекулярных повреждений, характерных для рака молочной железы. Данные повреждения могут быть систематизированы с учетом разрушаемых при этом клеточных процессов. Ниже (Табл. 6-9) приведена частота, с которой возникают молекулярные повреждения, сгруппированные согласно цитофизиологическому принципу.
Таблица 6. Молекулярные признаки рака молочной железы. Изменения рецепторов пролиферации дифференцировки.
Таблица 7. Молекулярные признаки рака молочной железы. Регуляторы клеточного цикла.
Таблица 8. Молекулярные признаки рака молочной железы. Регуляторы апоптоза.
Таблица 9. Молекулярные признаки рака молочной железы. Молекулы адгезии и протеазы.
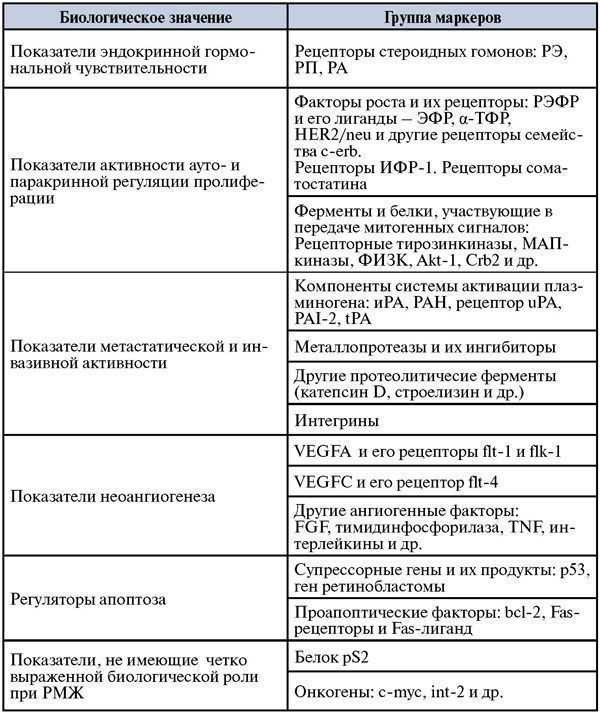
В отличие от классических опухолевых маркеров, определяемых в сыворотке крови, клеточные или тканевые маркеры типируются непосредственно в опухолевой ткани. Большинство из них характеризуют определенные биологические особенности опухоли, специфику ее поведения и регуляции, например гормональную чувствительность или склонность к инвазии и метастазированию. Основное значение таких маркеров заключается в том, что они характеризуют биологические особенности каждой конкретной опухоли и помогают при прогнозировании и индивидуализации лекарственного лечения заболевания.
Таблица 10. Основные группы тканевых/клеточных прогностических маркеров при раке молочной железы.
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе