 [Цпэ биохимия это расшифровка]
[Цпэ биохимия это расшифровка]
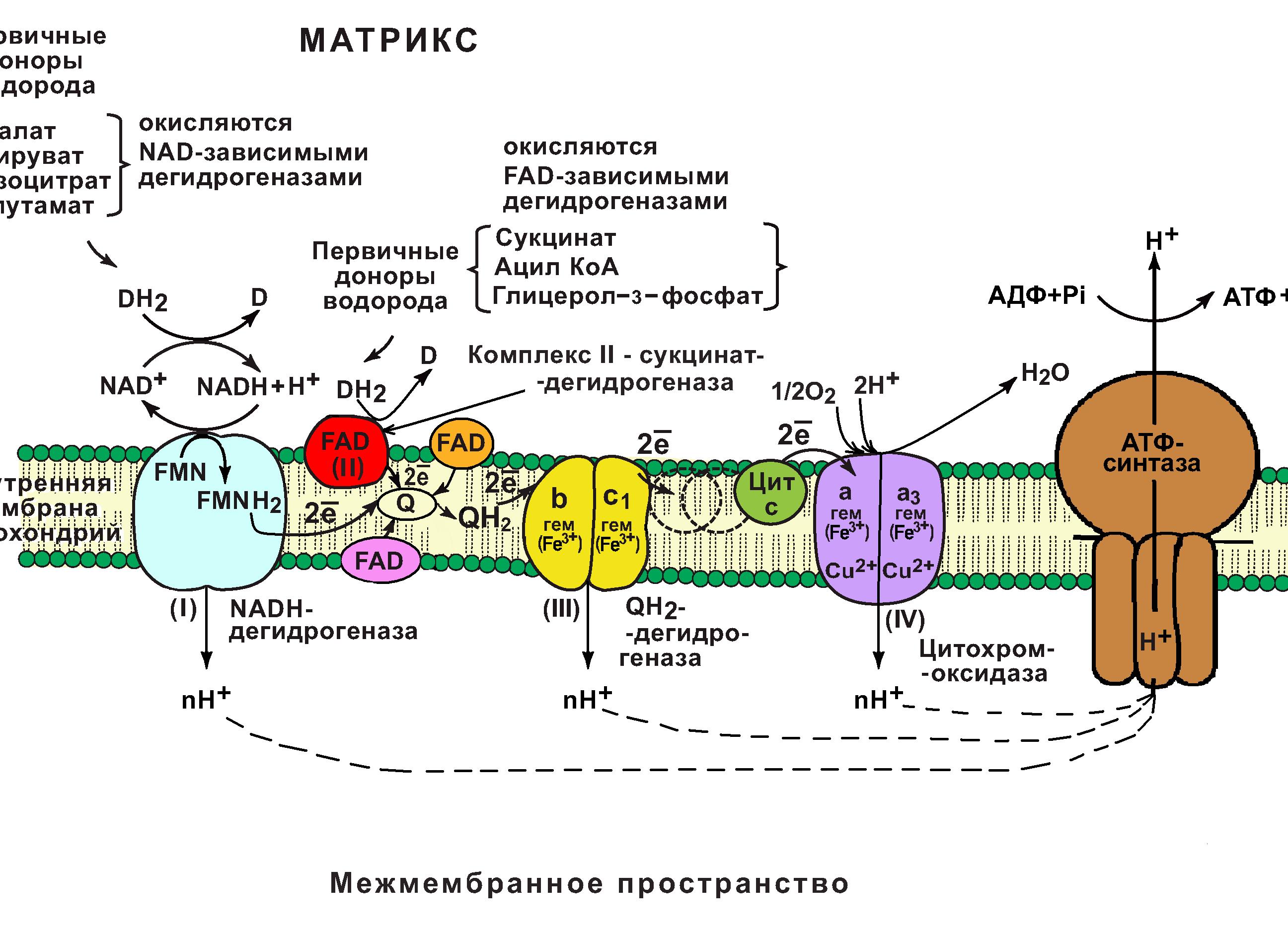
Цепь переноса электронов (цпэ).
Цепь переноса электронов (дыхательная цепь) – это сложная система переносчиков, при участии которой происходит процесс последовательного переноса электронов от NADH и FADh3 на O2.
Дыхательной цепи предшествует отнятие атомов водорода от окисляемых субстратов (реакции дегидрирования).
Эти реакции относятся к окислительно-восстановительным.
Их катализируют ферменты оксидоредуктазы (подкласс: дегидрогеназы).
Бóльшая часть окислительно-восстановительных реакций в клетке происходит в матриксе митохондрий.
Реакции дегидрирования происходят в ходе специфических и общего пути катаболизма.
Выделяют 2 типа дегидрогеназ, катализирующие реакции дегидрирования, предшествующие ЦПЭ:
-
NAD+ – зависимые дегидрогеназы (предшественник: витамин PP);
! Субстратов NAD+ – зависимых дегидрогеназ большинство.
Примеры: малат, изоцитрат, -кетоглутарат, глутаминовая кислота и др.
Кофермент NAD+ не образует прочной постоянной связи с ферментом.
Он соединяется с АЦ фермента уже в ходе реакции и после её завершения уже в восстановленной форме отсоединяется.
-
FAD – зависимые дегидрогеназы (предшественник: витамин B2)
Кофермент FAD прочно связан с активным центром фермента как в окисленной, так и в восстановленной форме.
Включаясь в реакцию, он принимает 2H+ и 2 и
переходит в восстановленную форму.
Субстраты FAD-зависимых дегидрогеназ: сукцинат, ацил-KoA, глицерол-3-фосфат (-глицерофосфат).
Структурная организация цепи переноса электронов (цпэ).
В основе функционирования ЦПЭ лежит работа 5 основных компонентов, обеспечивающих перенос электронов от NADH и FADh3 на O2.
В их число входит 3 сложных ферментных комплексов, а также 2 низкомолекулярных переносчика.
Компоненты цпэ:
-
NADH-дегидрогеназа (комплекс I);
-
сукцинатдегидрогеназа (комплекс II);
-
низкомолекулярный переносчик: убихинон (кофермент Q);
-
Убихинолдегидрогеназа (QН2-дегидрогеназа) (комплекс III);
-
низкомолекулярный переносчик (цитохром с);
-
цитохромоксидаза (комплекс IV)
Все компоненты ЦПЭ располагаются во внутренней мембране митохондрий в порядке возрастания окислительно-восстановительных потенциалов (редокс-потенциалов).
Самый низкий редокс-потенциал у NADH (-0,32В), а самый высокий редокс-потенциал у кислорода (+0,82В).
Это обеспечивает последовательное перемещение электронов от NADH (или FADh3) на O2, при котором происходит выделение энергии на каждом этапе ЦПЭ.
ЦПЭ обеспечивает взаимосвязь (сопряжение) процессов окисления и фосфорилирования АДФ.
Основная роль в переносе электронов принадлежит 3 важнейшим ферментным комплексам (I, III, IV).
Это сложные олигомерные белки, расположенные во внутренней мембране митохондрий.
Они являются интегральными белками.
|
Компонент ЦПЭ |
Кофермент |
Донор ē |
Акцептор ē |
|
|
Окисл. форма |
Восст. форма |
|||
|
NADH-дегидрогеназа (I ферментный комплекс) |
FMN |
FMN∙h3 |
NADH + H+ |
Убихинон (Q) |
|
Убихинон |
NADH-дегидрогеназа (I комплекс) |
Qh3-дегидрогеназа (цит. b и c1) (III комплекс) |
||
|
Окисл. форма: Q |
Восст. форма: Qh3 |
|||
|
Qh3-дегидрогеназа (убихинолдегидрогеназа) III ферментный комплекс, включает цитохромы b и c1 |
Гем (Fe3+) |
Гем (Fe2+) |
Qh3 |
Цитохром c |
|
Qh3-дегидрогеназа |
Цитохромоксидаза (IV комплекс) |
|||
|
Цитохромоксидаза IV ферментный комплекс, включает цитохромы a и a3 |
Гем (Fe3+), Cu2+ |
Cu+ |
O2 |
|
|
Сукцинатдегидрогеназа (II ферментный комплекс) |
FAD |
FAD∙h3 |
Сукцинат |
8ЦПЭ
Цепь переноса электронов (ЦПЭ)
Имеется два пути синтеза АТФ в клетке: 1) окислительное фосфорилирование и 2) субстратное фосфорилирование.
Окислительное фосфорилирование является главным путем синтеза АТФ из АДФ. С помощью этого механизма в клетках миокарда и скелетных мышц синтезируется около 90% АТФ. Реакция энергетически сопряжена с переносом электронов с восстановленных коферментов на кислород и требует наличия неповрежденной митохондриальной мембраны. Альтернативный путь синтеза АТФ из АДФ – субстратное фосфорилирование. В этом случае происходит перенос фосфата с высокоэнергетических фосфатов клетки на АДФ с образованием АТФ. Это происходит в ходе креатинкиназной реакции:
а) Креатинфосфат + АДФ → креатин + АТФ
и в ходе 2-х реакций гликолиза: фосфоглицераткиназной и пируваткиназной
б) 1,3-дифосфоглицерат + АДФ → 3-фосфоглицерат + АТФ
в) фосфоенолпируват + АДФ → пируват + АТФ
В этом случае механизм сопряжения не нуждается в наличии кислорода и неповрежденной митохондриальной мембраны.
Дыхательная цепь
Окисление субстратов в процессе дыхания можно представить как перенос электронов и протонов от органических веществ на кислород:
Sh3+ ½O2S+h3O
Перенос электронов на кислород происходит при участии системы переносчиков, встроенных во внутреннюю мембрану митохондрий и образующих цепь переноса электронов (ЦПЭ) или дыхательную цепь. В состав ЦПЭ входят 4 ферментативных комплекса: НАДН-дегидрогеназа (I), сукцинатдегидрогеназа (II),Q·h3-дегидрогеназа, цитохромоксидаза (IV), а также 2 низкомолекулярных переносчика: гидрофобная молекула коферментаQи цитохром С – небольшой по размерам белок. Все компоненты ЦПЭ расположены в митохондриальной мембране в порядке возрастания редокс потенциала (окислительно-восстановительного потенциала); самый высокий редокс–потенциал у кислорода. Это обеспечивает последовательное перемещение электронов от НАДН на кислород, при этом происходит выделение энергии на каждом этапе ЦПЭ.
Рис. 1. Митохондриальная цепь переноса электронов.
Атомы водорода или электроны перемещаются по цепи от более электроотрицательных компонентов к более электроположительному кислороду. Изменение окислительно-восстановительного потенциала при переходе от системы НАД+/НАДН к системе О2/Н2О составляет 1,1 В.
Водород от первичных доноров вводится в дыхательную цепь с участием НАД-зависимых (цитрат, 2-оксоглутарат, малат, пируват, глутамат) или ФАД-зависимых дегидрогеназ (сукцинат, ацил-КоА, глицерол-3-фосфат). НАД-зависимые дегидрогеназы переносят водород на НАД+(с образованием НАДН·Н+), а ФАД-зависимые дегидрогеназы – на ФАД (с образованием ФАД·Н2). Далее с НАДН·Н+водород при участии НАДН-дегидрогеназы (Iкомплекса) передается на КоQс образованием КоQ·h3. НАДН-ДГ представляет собой ФМН-содержащий фермент. С ФАД·Н2водород при участии СДГ (IIкомплекс) также передается на КоQс образованием КоQ·h3. КоQили убихинон является компонентом митохондриальных липидов. Его содержание значительно превосходит содержание других компонентов дыхательной цепи, поэтому считается, что КоQявляется подвижным компонентом дыхательной цепи, который получает восстановительные эквиваленты от фиксированных флавопротеиновых комплексов и передает их на цитохромы. Цитохромы – это переносящие электроны белки, молекула которых содержит в качестве простетической группы гем. Цитохромы дыхательной цепи выстроены в порядке возрастания окислительно-восстановительного потенциала и обозначаются латинскими буквами:b,c1,c,aиa3. Терминальный цитохром а-а3, называемый также цитохромоксидазой, осуществляет перенос восстановительных эквивалентов на молекулярный кислород. Цитохромоксидаза содержит медь и имеет очень высокое сродство к кислороду, что позволяет дыхательной цепи функционировать с максимальной скоростью до тех пор, пока в ткани не будет практически исчерпан кислород:
О2+ 4e+ 4H+2 Н2О
Дополнительным компонентом, находящимся в дыхательной цепи, является железо-серный белок, FeS(негемовое железо). Полагают, что он участвует в окислительно-восстановительном процессе, протекающем по одноэлектронному механизму.
Для объяснения механизма сопряжения окисления и фосфорилирования было выдвинуто несколько гипотез, из которых экспериментальное подтверждение получила только хемиосмотическая теория, предложенная Питером Митчеллом в 1961 году. Согласно этой теории первичным процессом в окислительном фосфорилировании является транслокация протонов (Н+) на наружную сторону внутренней митохондриальной мембраны. При этом предполагается, что мембрана непроницаема для ионов вообще и особенно для протонов, которые накапливаются на наружной стороне мембраны, создавая по обе стороны мембраны разность электрохимических потенциалов (н+). Она складывается из химического потенциала (разность рН) и электрического потенциала. Разность электрохимических потенциалов обеспечивает действие локализованной в мембране АТФ-синтазы, которая в присутствии АДФ и Фн синтезирует АТФ.
Предполагается, что дыхательная цепь уложена в мембране в виде трех окислительно-восстановительных петель, каждая из которых состоит из переносчиков водорода и переносчиков электронов:
АТФ-синтаза по своей структуре похожа на гриб. При этом шляпка гриба, представляющая собой фосфорилирующие субъединицы (F1-субъединица), ответственные за образование АТФ, находятся на поверхности внутренней мембраны, обращенной в матрикс. А ножка гриба представляет собой канальную часть (Fo-субъединица) АТФ-синтазы, пронизывающей всю толщу внутренней мембраны. Электрохимический потенциал заставляет протоны двигаться с наружной поверхности внутрь, кF1-субъединице, обладающей каталитической активностью, т.е. способностью катализировать образование АТФ из АДФ и Фн (Н3РО4).
Коэффициент фосфорилирования
Оценка эффективности улавливания энергии интактными митохондриями показывает, что при окислении субстратов, идущем с участием НАД-зависимых дегидрогеназ и дыхательной цепи, происходит включение 3 молей неорганического фосфата в АДФ и образуется 3 моля АТФ на ½ моля потребленного кислорода. Отношение Р/О (коэффициент фосфорилирования) = 3. В то же время при окислении субстрата через флавопротеиновую дегидрогеназу образуется только 2 моля АТФ, т.е. Р/О = 2.
Дыхательный контроль
Образующийся АТФ при участии АДФ/АТФ-транслоказы транспортируется из матрикса на наружную сторону мембраны в обмен на АДФ и попадает в цитозоль. Поэтому именно АДФ определяет скорость дыхания митохондрий. Это обусловлено тем, что окисление и фосфорилирование жестко сопряжены, т.е. функционирование дыхательной цепи не может осуществляться, если оно не сопровождается фосфорилированием АДФ. Зависимость скорости дыхания митохондрий от концентрации АДФ называется дыхательным контролем. Этот механизм регуляции имеет очень важное значение, т.к. в результате его действия скорость синтеза АТФ определяется потребностью клетки в энергии: при увеличении расходования АТФ в клеточных процессах увеличивается концентрация АДФ, а это автоматически ведет к ускорению дыхания и фосфорилирования.
Разобщение окисления и фосфорилирования
Некоторые вещества способны разобщать окисление и фосфорилирование. К таким веществам в частности относится 2,4-динитрофенол. Это липофильное вещество легко диффундирует через митохондриальную мембрану как в ионизированной, так и в неионизированной форме и т.о. может переносить ионы водорода через мембрану в сторону их меньшей концентрации. Поэтому 2,4-динитрофенол уничтожает н+митохондриальной мембраны, а энергия рассеивается в форме теплоты. Потребление кислорода и окисление субстратов при этом продолжается, но синтез АТФ невозможен.
Ингибиторы тканевого дыхания
Ингибиторы окисления прерывают поток электронов на участках дыхательной цепи, блокируя одно из трех звеньев образования протонного потенциала, Первая группа препаратов блокирует поток электронов на участке между НАД и КоQ. К этим препаратам относятся барбитураты — амитал или барбамил (малые транквилизаторы), ротенон (инсектицид), пиерицидин (антибиотик).
Вторая группа ингибиторов окисления, к которым относится антимицин А (антибиотик) блокирует поток электронов на участке цит. b566-FeS-белок, т.е. на уровне второго звена сопряжения.
Третья группа ингибиторов окисления, к которым относятся цианиды, азиды, оксид углерода, сероводород блокируют цитохромоксидазу.
Ингибиторы фосфорилирования действуют на АТФ-синтазу, препятствуя использованию протонного потенциала для синтеза АТФ. К этим веществам относятся олигомицин и дициклокарбодиимид.
Энергетический обмен и теплопродукция
На всех этапах превращения энергии пищевых веществ в энергию АТФ, а также в процессе использования АТФ для совершения работы часть энергии рассеивается в форме теплоты:
НАДН·Н+н+АТФработа
Свободная энергия окисления НАДН в дыхательной цепи (НАДН·Н++ ½ О2НАД++ Н2О) равна 220 кДж/моль. На образование трех макроэргических связей (Р/О = 3) используется 150 кДж/моль. Т.о. на этом этапе используется несколько больше половины (68%) всей энергии; остальная часть рассеивается в форме теплоты.
При использовании АТФ для совершения работы значительная часть энергии также превращается в теплоту. Именно поэтому при напряженной физической работе, когда синтезируется и расходуется много АТФ, человеку становится жарко: теплоты образуется столько, что включаются специальные механизмы для удаления ее избытка из организма. Наоборот, при снижении температуры тела включается механизм дрожания для увеличения продукции теплоты.
В состоянии покоя, в лежачем или сидячем положении расходование энергии на внешнюю работу минимально и теплопродукция становится главным путем расхода энергии организмом. Такое состояние энергетического обмена называют основным обменом. Интенсивность основного обмена можно оценить количественно по величине теплопродукции или косвенно по количеству потребленного кислорода. Для взрослого человека она составляет 350 кДж/ч. В других состояниях энергетические траты складываются из энергии основного обмена и энергии, затрачиваемой на внешнюю работу.
Нарушения энергетического обмена
У клеток, находящихся в состоянии покоя, скорость дыхания определяется доступностью АДФ. При повышении скорости дыхания, вызванном, например, физической работой, факторами, лимитирующими скорость дыхания, становятся доступность кислорода или возможности самой дыхательной цепи при насыщающих количествах всех субстратов и компонентов. При голодании фактором, лимитирующим скорость дыхания, становится доступность субстратов – доноров водорода.
Наиболее частой причиной гипоэнергетических состояний в клинике является гипоксия. Причинами гипоксии могут быть нарушение кровообращения вследствие нарушения проходимости дыхательных путей, сердечной недостаточности, кровопотерь, при спазме или тромбозе сосудов, блокировании гемоглобина. Гипоксия мозга является наиболее частой непосредственной (последней) причиной смерти. Поэтому среди реанимационных мероприятий важное место занимают меры, направленные на восстановление снабжения органов кислородом.
Биохимия в таблицах, схемах и графиках — Стр 3
Кm – это такая концентрация субстрата, которая необходима для связывания половины имеющегося фермента и достижения половины максимальной скорости.
Км — КОНСТАНТА МИХАЭЛИСА. Она численно равна той концентрации субстрата, при которой скорость реакции составляет половину от максимального значения. Эта реакция описывается уравнениемМихаэлиса-Ментон:
Км и Vmax — это две кинетические константы, с помощью которых можно характеризовать эффективность работы фермента, в том числе и in
vivo.
ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ ОТ рН
|
1 .0 |
||||||
|
0 .5 |
1 |
2 |
3 |
|||
|
0 .0 |
4 |
6 |
8 |
1 0 |
1 2 |
|
|
0 |
p H
Зависимость активности ферментов (для удобства сравнения приведены активности, нормированные к единице) от рН. 1 — Пепсин,2
— рибонуклеаза и 3 — аргиназа.
21
ИНГИБИРОВАНИЕ ФЕРМЕНТОВ
Конкурентное ингибирование
|
E + S |
k1 |
k2 |
+ P |
||||
|
ES |
E |
||||||
|
k–1 |
|||||||
|
+ I |
EI |
||||||
Здесь I — ингибитор, EI — фермент-игибиторныйкомплекс.
Неконкурентное ингибирование
|
E + |
||||||||||
|
S |
||||||||||
|
ESI |
||||||||||
ОСНОВНЫЕ СПОСОБЫ РЕГУЛЯЦИИ АКТИВНОСТИ ФЕРМЕНТОВ
Способность к регуляции делает ферменты важными участниками и своеобразными организаторами клеточных процессов в организме
22
человека. Активность фермента может регулироваться путем взаимодействия с определенными веществами, изменяющими конформацию активного центра.
23
ПРИМЕНЕНИЕ ФЕРМЕНТОВ В МЕДИЦИНЕ
|
Основные |
Ферменты |
Примеры использования |
|
|
разделы |
|||
|
Лактатдегидрогеназа |
Инфаркт миокарда |
||
|
(изофермент ЛДГ-1) |
|||
|
Аспартатаминотрансфераза |
|||
|
(АСТ) |
|||
|
Диагностика |
Аланинаминотрансфераза |
Заболевание |
печени |
|
(АЛТ) |
(например, инфекционный |
||
|
гепатит), |
инфаркт |
||
|
миокарда |
|||
|
Креатинкиназа (КК) |
|||
|
Изофермент ММ – |
Прогрессирующая |
||
|
Мышечный тип, |
дистрофия |
||
|
изофермент МВ – |
|||
|
сердечный тип |
|||
|
α -Амилаза |
|||
|
поджелудочной железы |
|||
|
Пепсин |
Нарушение переваривания |
||
|
белков в желудке, |
|||
|
нарушение синтеза или |
|||
|
24 |
|
секреции пепсина |
||
|
Лечение |
Трипсин, химотрипсин |
Лечение гнойных ран |
|
Стрептокиназа, урокиназа |
Предотвращение |
|
|
тромбообразования при |
||
|
пересадке органов и |
||
|
других операциях |
||
|
Гиалуронидаза |
Рассасывание рубцов |
|
|
Нуклеазы (ДНКаза) |
Вирусный конъюнктивит, |
|
|
ринит, гнойный бронхит |
||
|
Использование |
Глюкозооксидаза |
Определение |
|
ферментов в |
концентрации глюкозы в |
|
|
качестве |
крови |
|
|
аналитических |
Холестеролоксидаза |
Определение холестерина |
|
реактивов |
в крови |
|
|
Липаза |
||
|
триацилглицеринов в |
||
|
Уреаза |
Определение мочевины в |
|
25
|
ЭНЕРГЕТИЧЕСКИЙ ОБМЕН |
||||||
|
ОБЩАЯ СХЕМА ОБМЕНА ВЕЩЕСТВ И ЭНЕРГИИ |
||||||
|
Пищевые вещества |
Распад струк- |
|||||
|
1) |
4) |
|||||
|
турно |
||||||
|
Метаболиты |
||||||
|
функцио- |
||||||
|
Катаболизм |
5) |
7) Анаболизм |
нальных |
|||
|
компонентов |
||||||
|
2) |
Энергия |
3) |
||||
|
6) |
||||||
|
Выделение |
||||||
|
Синтез |
||||||
|
конечных продуктов |
Функциональная |
|||||
|
структурно- |
||||||
|
обмена (СО2, Н2О, |
активность |
функциональных |
||||
|
мочевина) |
(активный |
|||||
|
транспорт веществ, |
клетки |
мышечная работа, теплопродукция и др.)
1 – Пищеварение; 2,4 – катаболизм; 3 – анаболизм; 5 – экзергонические реакции; 6,7 эндергонические реакции
Развитие жизни на Земле пошло по пути использования в качестве главного экзоэргонического процесса, обеспечивающего энергетические потребности живых организмов, практически универсального для всей живой природы химического превращения — гидролиза одной из пирофосфатных связей аденозин-5’-трифосфата.
26
ЦИКЛ АТФ – АДФ
|
СО2 |
АТФ |
||
|
энергии: |
|||
|
биосинтез молекул, |
|||
|
окисление |
сокращение мышц, |
||
|
углеводов, |
активный транспорт, |
||
|
жиров, белков |
продукция тепла |
||
|
О2 |
АДФ + Фі |
Окисление органических веществ в организме кислородом (воздуха) с образованием воды и углекислого газа называется тканевым дыханием.
Тканевое дыхание включает:
а) отнятие водорода от субстрата (дегидрирование)
б) многоэтапный процесс переноса электронов на кислород.
Синтез АТФ из АДФ и Н3РО4 за счет энергии, выделяющейся при тканевом дыхании, называется окислительным фосфорилированием.
СТРУКТУРА МИТОХОНДРИЙ
Ферменты, отщепляющие водород от субстрата (дегидрогеназы), находятся в основном в матриксе митохондрий. Перенос электронов на кислород происходит при участии системы переносчиков, встроенных во внутреннюю мембрану митохондрий и образующих цепь переноса электронов
(ЦПЭ).
В состав ЦПЭ входят 3 ферментных комплекса: ΝАDН-дегидрогеназа(I),QН2-дегидрогеназа(III), цитохромоксидаза (IV), а также низкомолекулярные переносчики: гидрофобная молекула кофермента Q и цитохромс – небольшой по размерам белок. Все компоненты ЦПЭ расположены в митохондриальной мембране в порядке возрастанияредокс-потенциала;самый высокийредокс-потенциалу кислорода. Это обеспечивает последовательное перемещение электронов от ΝАDН на
27
кислород, при котором происходит выделение энергии на каждом этапе ЦПЭ.
МИТОХОНДРИАЛЬНАЯ ЦЕПЬ ПЕРЕНОСА ЭЛЕКТРОНОВ
Первичные
доноры водорода: пируват, изоцитрат, α- кето-глутарат,малат, глутамат
ΝАD-зависимыедегидрогеназы (кофермент ΝАD+ )
|
ΝАDН- |
QН2- |
Цитохро |
||||
|
дегидрогена |
мокси- |
|||||
|
ΝАDН |
за |
Q |
Цито- |
даза |
||
|
(FMN, |
Цитохромы |
хром с |
1/2О2 |
|||
|
FеS — |
b,c , белки |
м a, a3 |
||||
|
белок) |
FeS |
|||||
|
2Н+О2- |
||||||
доноры водорода: сукцинат, ацилКоА, α- глицерофосфат
Н2О
FАD-зависимыедегидрогеназы (кофермент FАD)
I, III, IV – высокомолекулярные комплексы, расположенные во внутренней мембране митохондрий, комплекс II – сукцинатдегидрогеназа, в отличие от других FАD-зависимыхдегидрогеназ локализована во внутренней мембране митохондрий, но на рисунке не представлена.
Места действия ингибиторов ЦПЭ показаны жирными стрелками: 1 – ротенон, барбитураты; 2 – антимицин; 3 – цианиды, СО, Н2S.
28
СОПРЯЖЕНИЕ ДЫХАНИЯ И СИНТЕЗА АТФ (ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ)
Основные переносчики электронов организованы в 3 комплекса во внутренней мембране митохондрии. Эти комплексы, используя энергию электронов, обеспечивают перенос Н+ из матрикса в межмембранное пространство. В результате возникает протонный электрохимический потенциал ∆µ Н+. При достижении определенного значения электрохимического потенциала происходит активацияАТФ-синтазы,в ней открывается канал, через который протоны возвращаются в матрикс из межмембранного пространства, а энергия ∆µ Н+ используется для синтеза АТФ.
Каждый из 3 комплексов ЦПЭ обеспечивает необходимый протонный градиент для активации АТФ-синтазыи синтеза 1 молекулы АТФ. Количество молей АТФ, образованных при восстановлении 1 атома кислорода до Н2О дыхательной цепи (т.е. при прохождении 2 электронов по ЦПЭ), выражается коэффициентом фосфорилирования (Р/О). Если водород поступает в ЦПЭ через коферментΝАDН, то Р/О имеет максимальное значение, равное 3. Если водород поступает через коферментQ, то Р/О=2.
29
СПЕЦИФИЧЕСКИЙ И ОБЩИЙ ПУТЬ КАТАБОЛИЗМА
Общий путь катаболизма – основной источник доноров водорода для цепи переноса электронов.
ЦТК, ЦПЭ
СО2 Н2О
Начальные этапы катаболизма (специфические пути катаболизма) основных пищевых веществ (белков, жиров и углеводов) происходят при участии ферментов, специфичных для каждого класса веществ, и завершаются образованием 2 метаболитов – пировиноградной кислоты (ПВК) и уксусной кислоты в форме ацетил-КоА.
После образования ПВК дальнейший путь распада веществ до конечных продуктов СО2 ,Н2О происходит одинаково в общем пути катаболизма (ОПК).
Общий путь катаболизма включает.
1.Реакцию окислительного декарбоксилирования пирувата.
2.Цитратный цикл (цикл Кребса, или цикл трикарбоновых кислот — ЦТК).
30
Дыхательная цепь (ДЦ) (или Цепь Переноса Электронов ЦПЭ, или Электрон-Транспортная Цепь ЭТЦ)
ДЦ – это конвейер по переносу электронов и протонов от восстановленного субстрата к кислороду.
Компоненты ДЦ:
1. Пиридинзависимые ДГ (НАД-, НАДФ-зависимые)
Рабочая часть – витамин РР (никотинамид)
НАД + 2Н+ + 2е ↔ НАД·Н2
2. ФАД-зависимые ДГ (кофермент в ДЦ – ФМН, а акцептор электронов непосредственно от субстрата – ФАД. Рабочая часть – изоалоксазин.
[При восстановлении к атомам азота при двойных связях, отмеченных стрелками, присоединяется по атому водорода, а двойная связь перемещается на общую грань колец В и С.]
3. Убихинон (Ko Q). Обладает о/в-свойствами благодаря кето-енольной таутомерии.
4. Цитохромы. Относятся к гемопротеинам, содержат атомы железа, переход степени (2↔3) окисления которого и обеспечивает транспорт электронов (протоны ими не транспортируются !!! ).
В ДЦ цитохромы расположены в следующей последовательности: b — c1 — c — a — a3 .
Совокупность цитохромов b и c1 называют КоQH-дегидрогеназой, т.к. они отщепляют атом водорода от убихинона (KoQ).
Цитохромы а и а3 – цитохромоксидазой (т.к. способствуют переносу электронов на молекулярный кислород).
У нас самая большая информационная база в рунете, поэтому Вы всегда можете найти походите запросы
Искать ещё по теме…