 [Бгса инфекция что это]
[Бгса инфекция что это]
Бета-гемолитический стрептококк группы А (БГСА)
- Добавить статью
- Подписаться на раздел
Бета-гемолитический стрептококк группы А (БГСА) — грамположительные, факультативно-анаэробные, неподвижные микроорганизмы сферической или овальной формы; устойчивы во внешней среде, хорошо приспосабливаются к различным условиям макроорганизма (человека). В отличие от прочих бактерий стрептококк А имеет особые антигены, способные вызывать неадекватный иммунный ответ, сопровождающийся мощным выбросом цитокинов, особенно таких, как фактор некроза опухоли и гамма-интерферон. Эти цитокины оказывают мощное системное воздействие на организм человека, с чем и связано развитие многих постстрептококковых осложнений, в том числе с аутоиммунным компонентом патогенеза (например, ревматизм). Болезни, вызываемые БГСА, делят на первичные, вторичные и редкие формы. К первичным относят поражения ЛОР-органов: острый тонзиллит (ангина); острый фарингит; ОРЗ; отиты и др., а также скарлатину, рожу и поражения кожи. Среди вторичных форм выделяют: • заболевания с аутоиммунным механизмом развития: ревматизм и гломерулонефрит; • гнойные осложнения: перитонзиллярный и метатонзиллярный абсцессы. К редким формам относят очаговые поражения внутренних органов, сепсис и пр. Источник инфекции – больные и бессимптомные носители патогенных стрептококков. При этом наиболее заразны люди с микробным очагом в области верхних дыхательных путей (тонзиллит (ангина), фарингит, скарлатина). Следует отметить, что экономический ущерб от стрептококковых инфекций примерно в 10 раз выше, чем от вирусных гепатитов, и в основном связан с ангиной и другими ОРЗ стрептококковой этиологии, которых в России регистрируется 6 – 8 млн случаев ежегодно. А на ревматические болезни приходится до 15% всех хронических заболеваний! Суммарные годовые трудопотери от указанных недугов в России составляют 65 млн дней нетрудоспособности. В связи с высокой опасностью стрептококка А, в нашей стране принят целый комплекс мер по борьбе со стрептококковой инфекций. Ключевые требования утверждены санитарно-эпидемиологическими правилами СП 3.1.2.1203-03 «Профилактика стрептококковой (группы А) инфекции» и методическими указаниями МУ 3.1.1885-04 «Эпидемиологический надзор и профилактика стрептококковой (группы А) инфекции». Указанные документы обязательны для исполнения врачами всех специальностей и средними медицинскими работниками всех лечебо-профилактических учреждений. Главной целью является недопущение развития осложнений, что возможно только при обоснованном и как можно более раннем назначении антибиотика. Чтобы этого достичь необходимо неукоснительно исполнять два ключевых нормативных требования: • активно выявлять больных стрептококковыми инфекциями, в том числе при оказании медицинской помощи на дому; • проводить лабораторную диагностику стрептококка А у больных тонзиллитом (ангиной) и рядом других заболеваний. Однако крупномасштабное исследование показало, что в России диагностика БГСА практически никогда не проводится из-за несоответствия доступных методов лабораторной диагностики поставленным целям. До сих пор рутинным бактериологическим исследованием является посев. Его преимущества (практически стопроцентные чувствительность и специфичность) в случае с БГСА напрочь перечеркиваются длительностью ожидания результата (в среднем 4 – 5 дней, когда заключение лаборатории становится скорее справочной информацией). Поэтому по настоящее время решение о назначении антибиотика принимается врачами, как правило, на основании клинической картины острого тонзиллита (ангины) и/или фарингита. Но теперь доступно простое решение – экспресс-тест Streptatest позволяет определить стрептококк А у больного в течение 5 минут не только в кабинете врача поликлиники, но и в домашних условиях. Высокое качество, надежность, скорость и простота применения тест-системы Streptatest дополняются доступной ценой: стоимость тест-полоски Streptatest в несколько раз дешевле стоимости рутинного бактериологического исследования. В дополнение необходимо отметить, что Streptatest относится к экспресс-методам диагностики без выделения возбудителя, рекомендованным к применению для определения стрептококка А методическими указаниями МУ 3.1.1885-04.
|
Стрептококковая инфекция у детей и подростков — Практическая медицина — Практическая медицина. Журнал для практикующих врачей и специалистов
Традиционно стрептококковая инфекция в практике работы врача-педиатра связывается со скарлатиной. В настоящей лекции дан краткий обзор принципов диагностики и лечения больных с другими клинически манифестными формами этого инфекционного процесса.
Стрептококковая инфекция (СтИ) — полиморфная по своим клиническим проявлениям бактериальная инфекция, вызываемая стрептококками. СтИ формирует самый большой спектр нозологических форм известных инфекционных заболеваний.
Этиология. В зависимости от особенностей роста на средах, содержащих цельную кровь животного, принято выделять α, β и γ-стрептококки. Вырабатываемый микробами гемолизин образует различную по внешнему виду зону гемолиза на этих средах. α- (зеленящие, формирующие неполный гемолиз) и γ- (негемолизирующие) стрептококки сравнительно нечасто формируют тяжелые соматические заболевания и, как правило, являются микробами-спутниками, традиционно обитающими в полости рта и кишечнике. β-гемолитические стрептококки ответственны более, чем за 90% заболеваний стрептококковой этиологии у человека. Ребеккой Лансфилд все гемолитические стрептококки с помощью иммунного типирования были разделены на 13 антигенных групп, обозначаемых большими латинскими буквами от А до S. Несмотря на широкое участие этих микробов в развитии различных патологических процессов, определение «стрептококковая инфекция» традиционно применяется к заболеваниям, вызываемым преимущественно стрептококками групп А и В. В последние годы в связи с пересмотром терминологических понятий отдельные роды и виды стрептококков получили собственное наименование и заболевания, вызванные ими, описываются как самостоятельные нозологические формы. Так, вид Streptococcus pneumoniaе (α-гемолитический стрептококк, пневмококк) ответственен за развитие пневмококковой инфекции, а стрептококк группы D отнесенный к роду Enterococcus, формирует группу болезней, объединенных понятием энтерококковой инфекции.
Стрептококковая инфекция, вызываемая стрептоккоками группы А
Стрептокококковая инфекция вызванная β-гемолитическими стрептококками группы А (БГСА) — самая распространенная на сегодняшний день бактериальная инфекция человека. Кроме того, эти возбудители ответственны за развитие заболеваний, традиционно рассматриваемых как неинфекционные, к примеру, такие, как острая ревматическая лихорадка и гломерулонефрит. Врачи практически всех специальностей имеют дело с этой обширной группой инфекционных болезней. В отличие от широкого перечня вызываемых стрептококками болезней, зарегистрированных в МКБ-10, в нашей стране прямое указание на стрептококковую этиологию имеется лишь при скарлатине, ревматизме, ревматических болезнях сердца, в том числе пороках клапанов. Видовое название возбудителей — Streprococcus pyogenes (гноеродный стрептококк). На основании антигенных особенностей поверхностного М-протеина выделено более 80 типов стрептококков группы А (М-протеины ̶ адгезивный фактор вирулентности, блокирующий опсонизацию возбудителя компонентами системы комплемента и способствующий проявлению гноеродных свойств). Микроб выделяет в процессе своего роста и размножения несколько типов экзотоксинов (являющихся, в том числе, и суперантигенами), ферментов, что способствует формированию широкого спектра болезней. «Неперевариваемость» ферментными системами организма клеточной стенки микроба — факт, способствующий мощной активации не только гуморального, но и клеточного звена иммунитета. Формирующийся при этом каскад реакций, инициируемых провоспалительными интерлейкинами, способствует манифестации системного воспаления (шок, острая ревматическая лихорадка и т.п.). Типичный для группы гемолиз эритроцитов связан с воздействием на эритроциты стрептолизина-О, антитела к которому являются на сегодняшний день «золотым стандартом» диагностики инфекции. Стрептококк при росте на искусственных средах и, в том числе, и на неповрежденных открытых поверхностях человека достаточно быстро теряет свои патогенные свойства, что и объясняет сравнительно невысокую эпидемиологическую значимость носителей возбудителя.
1. Критерии диагностики:
А) Клинико-эпидемиологические:
— указание на возможное заражение (контакт с больным), при этом реализация данного механизма заражения может происходить разными путями: контактным, либо капельным (редко — пищевым); применительно к СтИ наибольшую опасность представляет больной в остром периоде заболевания, поскольку реконвалесцент достаточно быстро санируется от возбудителя.
Последовательное или одновременное проявление основных синдромов заболевания:
синдром интоксикации, который при стрептококковой инфекции всегда выражен ярко (за исключением поверхностных форм инфекций), с наличием всего симптомокомплекса астено-вегетативных изменений типичных для данного синдрома (слабость, вялость, головокружение, головная боль и т.п.). Крайним проявлением синдрома интоксикации можно считать синдром токсического шока.
формирование воспалительного процесса. Применительно к СтИ формирование этого клинико-лабораторного синдрома может трактоваться достаточно широко: от классических гнойно-некротических изменений в зоне внедрения возбудителя до общих, системных реакций со стороны соединительной ткани токсического и иммунопатологического характера. Лихорадка — обязательный симптом воспаления при СтИ. Классически кожные формы стрептококковой инфекции характеризуются выраженными местными изменениями с яркой гиперемией пораженного участка, имеющего, как правило, четкие границы. Эти изменения определяются, в настоящее время, как дерматит и целлюлит (поражение всех слоев кожи с вовлечением в процесс подкожных структур и лимфатического аппарата мягких тканей). Процесс может сопровождаться нагноением, появлением буллезных и геморрагических элементов на коже. Формирование воспалительных изменений в ротоглотке (тонзиллит или ангина и фарингит) проявляется яркой, также отграниченной гиперемией слизистых неба, часто наличием гнойных или фибринозных изменений миндалин. Развитие поверхностного или глубокого воспалительного процесса стрептококковой этиологии всегда сопровождается выраженной болевой реакцией и регионарным лимфаденитом. Поражение мягких тканей (некротический фасциит и миозит), наряду с вышеуказанным болевым синдромом и типичными кожными изменениями, характеризуется распространенными некрозами с грубыми расстройствами гемодинамики пораженного массива мягких тканей. Системная воспалительная реакция токсического или иммунопатологического характера классически проявляется полиорганной патологией.
Общепринятой классификации стрептококковой инфекции нет. В зависимости от зоны поражения и особенностей патогенеза заболевания можно выделить следующие клинические варианты и нозологические формы:
|
Формы |
Заболевания |
| Поверхностные | Ангина, фарингит, импетиго, рожа (характерны для инфекций, вызванных БГСА), вагинит и эндометрит (характерны для инфекций, вызванных БГСБ) |
| Глубокие (инвазивные) | Некротический фасциит, миозит, эндо- и перикардит (характерны для инфекций, вызванных БГСА), менингит, пневмония, перитонит, сепсис (характерны для инфекций, вызванных преимущественно БГСБ) |
| Токсинопосредованные | Скарлатина, синдром токсического шока (характерны для инфекций, вызванных БГСА) |
| Иммунопатологические | Острая ревматическая лихорадка*, постстрептококковый гломерулонефрит*, реактивный артрит*, васкулиты*, PANDAS-синдром, острый диссеминированный энцефаломиелит (характерны для инфекций, вызванных БГСА) |
* — указанные клинические варианты инфекционного процесса не описаны в настоящем издании, поскольку традиционно рассматриваются в специальной литературе по ревматологии.
В качестве общего замечания следует отметить, что существуют и иные варианты деления СтИ, в частности, на первичные, вторичные и редко встречающиеся клинические формы. При этом к первичным относят преимущественно кожные поражения, скарлатину и рожу; к вторичным — аутоиммунные (острая ревматическая лихорадка, нефрит и т.п.) и токсико-септические процессы; редко встречающиеся формы объединяют фасцииты перитониты, миозиты и т.п.
Отдельные клинические варианты поверхностных инфекций, вызванных БГСА
Формы поверхностного поражения кожи и слизистых.
Стрептококковый тонзиллофарингит (тонзиллит, ангина) — острое инфекционное заболевание, проявляющееся поражением лимфоидного аппарата и слизистой оболочки тканей глотки. Заболевание типично для детей дошкольного и школьного возраста, случаи болезни у детей первого года жизни — явление редкое. Характерно острое начало заболевания с повышения температуры тела до 37,5-39°С, и проявлений общей интоксикации. Типична выраженная боль в горле. При осмотре выявляется яркая отграниченная гиперемия слизистой нёбных дужек, язычка и задней стенки глотки. Миндалины гиперемированы, увеличены в размерах, часто с гнойными наложениями в лакунах (лакунарная ангина) желтовато-белого цвета, которые достаточно легко удаляются шпателем с поверхности. Реже развивается фолликулярная ангина с характерными нагноившимися фолликулами, просвечивающими сквозь слизистую миндалин. Достаточно редкий вариант — фибринозная ангина с белым фибриновым налетом на поверхности миндалины. Развитие такой формы связано с некрозом слизистой миндалины и выходом жидкой части крови на пораженную поверхность. Типично развитие регионарной реакции со стороны лимфоузлов шейной группы (применительно к ангине — тонзиллярных) с характерной болевой реакцией. Общая продолжительность заболевания — 7-10 дней. Использование антибиотиков обычно приводит к быстрой обратной динамике всех клинических симптомов. Развитие хронического воспалительного процесса ткани миндалин (хронический тонзиллит) с периодической манифестацией в виде ангин также связано со СтИ, что, фактически, и определяет тактику лечения этой группы пациентов. Поражение слизистых носоглотки достаточно часто предшествует развитию острой ревматической лихорадки.
Рожистое воспаление (рожа). Один из вариантов инфекционного поражения кожи и подкожной клетчатки (целлюлит) с достаточно типичной клинической картиной. Считается малоконтагиозной формой СтИ. В связи с особенностями строения кожи ребенка и патогенеза процесса, этот вариант инфекционного процесса достаточно редко регистрируется у детей. Принято выделять эритематозную, геморрагическую и буллезную формы рожи. С учетом хронического течения заболевания рожу делят на первичную, рецидивирующую и повторную. Для заболевания характерно острое начало, с повышения температуры до высоких цифр, озноба, тошноты, рвоты, сильной головной боли и т.п. Местный процесс характеризуется появлением четко очерченных, болезненных участков гиперемии, отеком пораженной области (эритематозная форма), возможным появлением крупных пузырей с серозным содержимым (буллезная форма), наличием геморрагических элементов и крови в содержимом булл (геморрагическая форма). Процесс чаще локализуется на коже ног, в околопупочной зоне, реже — на лице. В отличие от взрослых, рожистый процесс у детей протекает сравнительно благоприятно, генерализации процесса в форме сепсиса практически не регистрируется.
Импетиго (заразное, контагиозное импетиго). Еще один из классических вариантов стрептококкового поражения кожи. Процесс начинается с образования возвышающихся над кожей, склонных к периферическому росту фликтен — полостных элементов типа пузырей размером от 2 до 10 мм и более в диаметре. Высыпания дискретны или сливаются в группы, окружены ободком гиперемии. Содержимое фликтен вначале прозрачное, с течением времени мутнеет, элемент быстро ссыхается в светло-желтые корки, отпадающие через 5-7 дней и оставляющие зоны депигментации. В процесс обычно вовлекается гладкая кожа, реже — кожа волосистой части головы. Заболевание проявляется симптомами общей интоксикации, температурной реакцией (что типично для стрептококковых воспалительных процессов). Импетиго — в целом нетяжело протекающая болезнь является одним из самых заразных бактериальных процессов у детей, что требует обязательной изоляции заболевших. Вторая особенность кожного стрептококкового процесса — высокий риск развития гломерулонефрита. Именно т.н. «кожные» стрептококковые инфекции ассоциируются с инфекционно-аллергическим поражением почек, практически не вызывая ревматической лихорадки. Еще одной из особенностей развития импетиго и более тяжелого варианта инфекции — эктимы является нередкая ассоциация в этиологии процесса с золотистым стафилококком. Поэтому лечение больных требует использования т.н. «защищенных» β-лактамовых антибиотиков.
Формы с поражением подкожных тканей и внутренних органов (глубокие, инвазивные формы)
Инвазивное заболевание БГСГА обычно определяется как инфекция, ассоциированная с выделением БГСГА из стерильных зон (органов, тканей, полостей) организма ребенка и включает ряд связанных друг с другом клинических синдромов:
1. синдром стрептококкового токсического шока (ССТШ, токсинопосредованная форма болезни), с развитием сосудистой шоковой реакции и типичной для такого рода процессов полиорганной недостаточности.
2. некротический фасциит;
3. группа болезненных состояний не отвечающим критериям ССТШ или некротического фасциита; в нее могут быть включены бактериемия в т.ч. с метастатическими очагами СтИ (менингит, пневмония, сепсис, остеомиелит, эндокардит, септический артрит, миозит, и хирургические раневые инфекции). Эти тяжелые, в том числе и инвазивные формы СтИ, как правило, не связаны со стрептококковым поражением слизистых. Наряду с БГСА этиологической причиной формирования этой нозологии (в первую очередь первых трех) является β-гемолитический стрептококк группы В.
Некротический фасциит (стрептококковая гангрена, НФ) и стрептококковый миозит (СтМ).
НФ определяется как инфекция т.н. третьего уровня. Заболевание имеет подострое или стертое начало. В течение 2-3 дней к болевой реакции мягких тканей и лихорадке присоединяется уплотнение, отечность кожи, подкожно-жировой клетчатки, определяемые пальпаторно как «деревянные». Внешними признаками НФ являются разнообразные изменения кожной окраски в пораженной зоне: от бледной до буро-коричневой. При этом по площади они значительно меньше зоны поражения подкожных тканей. Их уплотнение настолько выражено, что не позволяет даже четко определить мышечные образования. В ходе операции фасция внешне выглядит грязно-серой или бурой с очагами некрозов. При обследовании раны выявляется значительное количество коричневого, иногда мутного с жировыми пятнами некротического деривата (гной формируется достаточно редко). Многолетние наблюдения показывают, что в основе развития некротического фасциита нередко лежит та или иная степень предварительного повреждения кожных покровов (в т.ч. и неинфекционного происхождения), часто на фоне тяжелых сопутствующих заболеваний, таких, к примеру, как диабет. Возможно развитие НФ после внутривенного введения различных раздражающих препаратов (к примеру, наркотических средств). Несмотря на очевидную этиологическую значимость БГСА в развитии этой нозологической формы, определенную роль в ее формировании играет и анаэробная флора (в т.ч. микробы рода Clostridiae). Летальность при НФ даже при современных методах лечения остается очень высокой (до 25%). Причиной столь высокого уровня смертности даже в условиях стационаров является сочетание фасциита с синдромом стрептококкового токсического шока и неконтролируемой артериальной гипотензией. Основой лечения НФ является экстренная хирургическая операция. Объем операции должен соответствовать размеру поражений. с максимально возможной некрэктомией. Антибактериальная терапия остается важнейшей составляющей лечения таких больных. Как и все БГСА, возбудители НФ высокочувствительны к пенициллину и макролидам (специальные замечания по антибактериальной терапии см. в разделе Лечение). Учитывая смешанную природу процесса целесообразно в таких случаях проводить комбинированную антибактериальную терапию.
СтМ — достаточно редкий вариант инфекции четвертого уровня, для которой характерна выраженная локальная боль, не соответствующая изменениям со стороны кожи, лихорадка. Кожные изменения в виде бурых полос и булл, типичные для НФ, из-за частого сочетания этих двух форм СтИ появляются позднее. Более того, локальный отек в виде уплотнения, классически описываемый при этой патологии также не является первым симптомом болезни, что необходимо учитывать при постановке диагноза. Чаще поражается четырехглавая и ягодичная мышцы, процесс обычно осложняется развитием ССТШ, который и приводит к достаточно быстрому летальному исходу. Принципы терапии в подобном случае соответствуют таковым при НФ.
Синдром стрептококкового токсического шока. С конца 80-х гг. появились сообщения о шоке и динамично развивающейся полиорганной недостаточности при инфекциях, вызванных стрептококками группы. Этот синдром напоминал классический вариант токсического шока при стафилококковой инфекции и получил название стрептококковый токсический шок (ССТШ, стрептококковый токсический шок-синдром). В 1993 году Центром по контролю заболеваемости США были сформулированы диагностические критерии стрептококкового токсического шока (таблица).
| I. Выявление стрептококков группы А |
|
a) из стерильных в норме частей тела (кровь, ликвор, плевральный или перитонеальный секрет, биоптат) |
|
b) из нестерильных жидкостей организма или его частей (глотка, слюна, влагалище, отделяемое из раны) |
|
II. Клинические признаки |
|
a) гипотензия: систолическое давление (177 mmol/l или удвоение ранее имевшегося значения гемокоагуляционные нарушения : тромбоциты удвоенной нормы или удвоенное исходное значение) респираторный дистресс-синдром по взрослому типу (adult respiratory distress syndrome, ARDS); генерализированное эритематозное высыпание (+образование пузырьков); некрозы мягких тканей (некротизирующий фасциит или миозит); |
|
Надежным считается диагноз при наличии критериев Ia и II (a и b), вероятным при наличии критериев Ia II (a или b) + исключение других причин заболевания |
Анализ клинической симптоматики ССТШ, описываемой в зарубежной литературе, в полной мере соответствует отечественному определению т.н. токсической формы скарлатины, что позволяет на сегодняшний день их рассматривать как своего рода идентичные процессы. Дополнительным подтверждением этого положения может служить факт развития, как ССТШ, так и скарлатины только у лиц, не имевших до заболевания антитоксического иммунитета.
Заслуживает внимания и еще один аспект патогенеза ССТШ. Оказалось, что ряду больных в дебюте заболевания назначались различные нестероидные противовоспалительные препараты (НПВП) по поводу предполагаемого артрита, травмы мышц, флебита. До настоящего времени отсутствуют какие-либо однозначные объяснения связи этих двух явлений. Тем не менее, указание в анамнезе болезни на факт приема НПВП имеет положительное (!) диагностическое значение в оценке клиники болезни.
Начальные симптомы стрептококкового токсического шока в определенной мере зависят от очага первичной инфекции. Примерно в 20% случаев заболевание дебютирует лихорадкой, ознобом, миалгией и диареей. При развитии шока на фоне глубоких инфекций мягких тканей (некротический фасциит, миозит) начальным симптомом является внезапно появившаяся интенсивная боль, которая фактически является основным поводом для обращения за медицинской помощью. При этом какие-либо объективные симптомы (отек, болезненность при надавливании) на первых порах могут отсутствовать, что служит причиной ошибочных диагнозов.
Лихорадка — постоянный признак, наблюдаемый, фактически, в 100% случаев. Практически у каждого второго пациента ССТШ проявляется изменениями со стороны ЦНС по типу инфекционного психоза с общим возбуждением, делирием, потерей ориентации во времени и в пространстве. Достаточно динамично, в течение 3-4 часов развивается артериальная гипотензия. Клинико-лабораторная симптоматика поражения почек — один из ранних (нередко предшествующих системным гемодинамическим расстройствам) и достаточно постоянных признаков развивающегося ССТШ. Тромбо-геморрагический синдром- постоянный «спутник» почечно-печеночной недостаточности характерен для развернутых фаз шока. На фоне нарастающих гемодинамических и гемокоагуляционных расстройств развивается респираторный дистресс-синдром, проявляющийся одышкой, гипоксемией, появлением диффузных легочных инфильтратов и отеком легких.
Достаточно часто при ССТШ формируются характерные изменения со стороны кожи, описываемые как макулярная эритродермия (обширные поля яркой, сливной гиперемии). В отличие от токсического шока стафилококковой этиологии ССТШ в большинстве случаев сопровождается бактериемией и обычно развивается при глубоких воспалительных процессах мягких тканей (некротическом фасциите, миозите).
Поскольку шоковая реакция развивается в ответ на экзотоксинемию (эритрогенные токсины различных типов БГСА), тактика ведения больных, наряду с традиционно проводимой противошоковой терапией, предполагает использование иммуноглобулинов.
Со стрептококковой инфекцией связывают также возникновение ряда неврологических расстройств у детей, проявляющихся обсессивно-компульсивными расстройствами (pediatric autoimmune neuropsychiatric disorders associated with streptococcal infections, т.н. PANDAS-синдром). Клинико-диагностический симптомокомплекс PANDAS сходен с симптоматикой малой хореи — одной из хорошо известных форм острой ревматической лихорадки (ревматизма). Развитие PANDAS типично для детей препубертатного возраста (в отличие от хореи, для которой типичная возрастная группа — дети 5-8 дет). Болезнь начинается и протекает достаточно остро. При всей вариабельности клинического симптомокомплекса общим, как для хореи, так и для PANDAS является наличие обсессивно-компульсивных расстройств. К числу наиболее типичных проявлений PANDAS относятся различные обсессии (навязчивости), по сути — волевые неконтролируемые усилия или действия (компульсии). Подобного рода состояния возникают с определенной периодичностью (средняя продолжительность атаки — в среднем 12-15 недель) и существенно снижают качество жизни больного. Нередко вышеописанная клиническая симптоматика сочетается с такими проявлениями, как двигательная гиперактивность, хорееформные гиперкинезы, импульсивность, рассеянность, эмоциональная лабильность, расстройства внимания, трудности засыпания, синдром Туретта (наследственная патология, характеризующаяся генерализованными двигательными и простыми речевыми тиками), анорексия, что позволяет расценивать их как коморбидные с PANDAS процессы. Диагностическое значение при PANDAS имеет и стойкий эффект антибактериальной противострептококковой терапии.
В публикации из Department of Neurology Great Ormond Street in London в 2001 году были даны описания 10 пациентов со стрептококк-ассоциированным острым рассеянным энцефаломиелитом (ОРЭМ, ADEM). Клинико-лабораторная картина этого процесса характеризовалась динамично протекающим, распространенным поражением белого вещества головного мозга, проявляющимся грубыми общемозговыми расстройствами и очаговыми изменениями, специфичными для зон воспалительного поражения. ADEM ранее описывался как постинфекционный энцефалит (или энцефаломиелит), этиологически связанный с некоторыми бактериальными, вирусными заболеваниями и/или вакцинацией живыми вирусными вакцинами. Неспецифичность данного воспалительного процесса объясняет малую эффективность терапевтических мероприятий, в том числе и глюкокортикоидной терапии.
Диагноз стрептококковой инфекции клинико-лабораторный. По причине большого разнообразия клинических проявлений окончательный диагноз устанавливается лишь после дополнительного лабораторного подтверждения (выделение стрептококка из материала очагов поражения, нарастание титра О-антистрептолизина). Диагностически в амбулаторных условиях требует разграничения гнойно-воспалительные процессы кожи (импетиго) стрептококковой и стафилококковой этиологии. Принципиально важна и своевременная расшифровка этиологии тонзиллофарингита, поскольку, за редким исключением, только ангина стрептококковой этиологии требует антибактериальной терапии. С диагностической целью при СтИ используется классический культуральный метод выделения возбудителя при посевах на искусственные среды. Экспресс-методики ориентированы на получение результата в относительно короткий промежуток времени (до 2-3 часов) с использованием коагглютинационных, хроматографических, латекс-агглютинационных тестов. К сожалению, чувствительность вышеназванных методов при ангине сравнительно невелика (усредненные данные ≈ 26-30%) при специфичности в 73-80%. По этой причине, они имеют те же проблемы, что и культуральный тест: сравнительно невысокая прогностическая значимость, как положительного, так и отрицательного результата теста. Поэтому оценка уровня антистрептолизина-О может считаться в подобных ситуациях методом выбора при определении стрептококковой этиологии заболевания.
2. Показания к госпитализации
Основным показанием к госпитализации пациента является тяжесть основных клинических проявлений независимо от клинической формы заболевания. Генерализованные формы болезни всегда требуют стационарного лечения.
3. Основные принципы ведения больных стрептококковой инфекцией на дому.
Лечение больных стрептококковой инфекцией, вызванной БГСА, с учетом разнообразия клинических форм требует участия широкого круга специалистов (инфекционистов, педиатров, хирургов, ревматологов, психиатров и т.п.), что и определяет комплекс различного рода пособий и лекарственных средств при оказании помощи. В описании клинических форм мы частично коснулись этих вопросов.
Антибиотикотерапия. Является обязательной при всех клинических вариантах болезни. Ее цель — эрадикация БГСА, что способствует не только ликвидации симптомов инфекции, но и предупреждает ранние и поздние осложнения, а также предотвращает распространение инфекции (уровень рекомендаций А), формирование иммунопатологических вариантов БГСА-инфекции (применительно к острой ревматической лихорадке уровень рекомендаций А, к гломерулонефриту — уровень В). До настоящего времени β-гемолитические стрептококки высоко чувствительны к препаратам пенициллина. Все это в значительной мере и определяет выбор антибактериального препарата: бензилпенициллин в дозе 200-300 тыс. МЕ/кг массы ребенка, либо аминопенициллины в среднетерапевтических дозировках. Повышение дозировок необходимо только в случаях развития гнойного менингита. Цефалоспорины при лечении данного заболевания существенного преимущества не имеют. Альтернативными пенициллинам препаратами могут быть макролиды и линкозамиды. При определении схемы антибактериальной терапии следует помнить, что при инвазивных формах эффективность β-лактамных антибиотиков, в первую очередь пенициллина, может оказаться сравнительно невысокой. Дело в том, что в данной ситуации микробная масса в очаге инфекции чрезвычайно высока, и размножение большинства бактерий переходит в т.н. стационарную фазу (в клинике данный феномен получил название «inoculum-эффект»). Основной мишенью действия β-лактамных антибиотиков являются бактериальные ферменты, участвующие в синтезе пептидогликана клеточной стенки (пенициллинсвязывающие белки), экспрессия которых в стационарной фазе значительно снижена. Поэтому применение пенициллинов (особенно при поздно начатом лечении) и оказывается безуспешным. В тоже время, использование антибиотиков из группы линкозамидов позволяет в подобных ситуациях достичь необходимого результата. Хотя препараты этого ряда считаются бактериостатическим антибиотикам, назначение их в высоких дозах оказывает в отношении к БГСА четкое бактерицидное действие.
В настоящее время во всех странах мира отмечается высокая частота встречаемости штаммов возбудителя, устойчивого к ко-тримоксазолу (бисептолу), сульфаниламидам и хлорамфениколу. Поэтому применение этих препаратов должно быть исключено из арсенала антибактериальной терапии (уровень рекомендаций А).
Антибактериальная терапия в лечении токсинопосредованных и инвазивных форм СтИ дополняется использованием внутривенных полиспецифических иммуноглобулинов, которые обычно содержат достаточно широкий спектр антител, блокирующих цитокининдуцированную (провоспалительную) и митогенную активности суперантигенов возбудителя. Введение иммуноглобулинов в дозе 0.2-0.4 г/кг массы пациента достоверно увеличивало выживаемость пациентов, как на ранних сроках, так и после 30 дня болезни. Раннее использование препаратов позволяло также значительно сократить объем оперативного вмешательства (уровень рекомендаций А).
4. Противоэпидемические мероприятия.
Комплекс противоэпидемических мероприятий разработан и используется только с целью предупреждения распространения скарлатины в детских учреждениях.
5. Активная иммунопрофилактика не разработана.
Стрептококковая инфекция, вызываемая стрептоккоками группы В
До середины 60-х годов ХХ века β-гемолитические стрептококки группы В не рассматривались как патоген человека, с их участием связывали различные заболевания животных (в частности, мастит у коров). Последующие исследования показали, что этот возбудитель является ведущей причиной перинатальной бактериальной инфекции, формирующей септические процессы и гнойные менингиты новорожденных. Распространенность инфекции составляет 0.34 на 1000 живорожденных (Phares CR et al.; Active Bacterial Core surveillance/Emerging Infections Program Network. Epidemiology of invasive group B streptococcal disease in the United States, 1999-2005).
Несмотря на широкое использование антибиотиков в лечении этого контингента больных летальность при этих заболеваниях по-прежнему остается достаточно высокой. Со стрептококком в акушерской практике связывают и развитие инфекций мочевых путей беременных, хориоамниониты, послеродовые эндометриты и бактериемию.
Эпидемиологические и патогенетические особенности инфекции, вызванной БГСБ. β-гемолитические стрептококки группы В являются компонентом нормальной микрофлоры слизистой наружных половых органов не менее, чем 20% женщин детородного возраста. Именно эти беременные (а, в последующем, — родильницы) и являются главным источником инфекции для ребенка. Этим же объясняется и наиболее частый путь инфицирования ребенка — интранатальный (внутриутробная инфекция). Однако, не исключена передача инфекции новорожденному и от персонала или другого зараженного ребенка (вариант внутрибольничной инфекции). При достаточно высоком риске инфицирования, частота развития клинически манифестных форм СтИ в таких ситуациях сравнительно невелика. Вероятность развития заболевания у ребенка определяется в первую очередь такими факторами, как низкая масса тела при рождении, недоношенность, клинически явный хориоамнионит у матери, внутриматочная инфекция, повышение температуры тела у родильницы, длительный безводный период (более 12 часов) (уровень рекомендаций В). При этом, интактные плодные оболочки и родоразрешение кесаревым сечением не исключают инфицирования новорожденных. Вторая, не менее важная группа факторов связана напрямую с антистрептококковым иммунитетом ребенка. Его напряженность количественно определяется уровнем «материнских» IgG, попавших в организм новорожденного. Поэтому низкий титр антистрептококковых антител в сыворотке матери — одна из главных причин развития сепсиса у инфицированного ребенка. Достаточно поздняя (начиная только с 37-38 недели беременности) трансплацентарная передача материнских иммуноглобулинов (в том числе, и противострептококковых) объясняет большую частоту развития заболеваний у недоношенного ребенка.
Клинические проявления стрептококковой инфекции, вызванной БГСБ. Принято выделять т.н. сепсис с ранним началом, который чаще всего возникает в первые 48 часов жизни, в основном у недоношенных и маловесных детей, рожденных от матерей с вышеуказанными факторами риска. При этом заболевание сопровождается обязательной бактериемией с возможным развитием токсического шока и ОРДС (см. ССТШ), либо (реже) — формированием менингита и пневмонии.
Сепсис с поздним началом, возникший после первой недели жизни проявляется чаще всего гнойным менингитом (85%). Заболевание проявляется классической картиной: лихорадкой, рвотой и срыгиваниями, общим психомоторным возбуждением, гиперестезией. В последующем появляются достаточно типичные: выбухание большого родничка, судороги, угнетение сознания вплоть до комы. Нередко общемозговой симптоматике предшествуют поражения верхних дыхательных путей, отит, синусит, конъюнктивит, эндофтальмит, артрит, поражения кожи.
БГСБ являются частой причиной послеродовых инфекционных заболеваний у матери, в частности, послеродового эндометрита. Типично повышение температуры тела в первые 12 часов после родов, сопровождающееся тахикардией, ознобом, болезненностью живота в проекции матки. Нередко при этом наблюдаются изменения со стороны мочевыводящих путей.
Лабораторная диагностика. «Золотым» стандартом в лабораторной диагностике стрептококковой инфекции беременных является культуральный метод.
Диагностика инфекций БГСБ у новорожденных представляет серьезную проблему по следующим причинам: во-первых, феномен бактериемии у ребенка, страдающего септической формой инфекции — явление непостоянное; во-вторых, имеются вполне понятные сложности забора необходимого объема крови пациента для проведения посева. Именно эти факторы являются основой сравнительно невысокой чувствительности вышеупомянутого классического бактериологического метода в диагностике стрептококкового сепсиса. В-третьих — диагностическое значение положительного результата теста при взятии материала с кожи или из мекония новорожденного также оставляет желать лучшего: высокая инфицированность БГСБ нестерильных поверхностей ребенка не всегда совпадает с фактом развития болезни. Все это существенно снижает специфичность положительного результата проведенного исследования. Его диагностическая значимость будет существенно выше при выделении возбудителя с кожи околопупочной зоны, наружного слухового прохода, слизистой зева и прямой кишки ребенка (поверхности, рекомендованные для забора материала). Помимо классических бактериологических методик возможно использование полимеразной цепной реакции с выявлением ДНК возбудителя (чувствительность методики в 3 раза выше классического культурального метода).
Лечение. Чувствительность возбудителя к антибиотикам, фактически, соответствует таковой у БГСА. Поэтому комплекс лечения включает антибиотики β-лактамовые антибиотики. В отличие от БГСА-инфекции терапия новорожденного с БГСБ может дополняться аминогликозидами (уровень рекомендаций С).
Профилактические мероприятия. К сожалению, в России отсутствует централизованная система скрининга и антибиотикопрофилактики инфекции БГСБ у беременной женщины. За рубежом предложены 2 стратегии профилактики.
1. Стратегия, основанная на рисках
При данной стратегии матери в родах получают антибиотики, когда присутствует один или несколько из нижеперечисленных факторов :
- Предыдущий ребенок с диагносцированной БГСБ-инфекцией,
- Стрептококковая бактериурия при беременности,
- Угроза преждевременных родов на сроках до 37 недель,
- Массивный рост Streptococcus agalactiae в урогенитальном тракте ко времени родоразрешения,
- Длительный безводный период (более 18 часов).
- Послеродовая лихорадка выше 38oC
2. Стратегия, основанная на проведении скрининга
В основе стратегии лежит бактериальная культура ректо-вагинального посева, взятого в промежутке между 35 и 37 неделей беременности. При выделении БГСБ рекомендовано проведение антибиотикопрофилактики.
Независимо от результата скрининга антибиотики назначаются, если имеется один из 3 основных факторов риска:
- Предыдущий ребенок с диагносцированной БГСБ-инфекцией,
- Стрептококковая бактериурия или
- Угроза преждевременных родов до 37 недели беременности.
В последнем случае в профилактике нет необходимости, если негативная культура получена в промежутке с 35 по 37 неделю беременности.
Антибиотикопрофилактика проводится пенициллином (в начале 5 млн.ед внутривенно с последующим введением 2,5 млн.ед каждые 4 часа вплоть до родов) или ампициллин (в начале 2 г внутривенно с последующим введением 1 г до родов). При непереносимости пенициллина возможно использование клиндамицина или эритромицина.
Профилактическое назначение антибиотиков (в том числе, и местная антисептика) до начала родовой деятельности и/или разрыва плодных оболочек у беременных с колонизацией БГСБ неэффективно.
В.А. Анохин
Казанский государственный медицинский университет
Анохин Владимир Алексеевич — профессор, зав кафедрой детских инфекций Казанского государственного медицинского университета.
Стрептококковая инфекция у детей и подростков | ИД «Практика»
| Поверхностные | Ангина, фарингит, импетиго, рожа (характерны для инфекций, вызванных БГСА), вагинит и эндометрит (характерны для инфекций, вызванных БГСБ) |
| Глубокие (инвазивные) | Некротический фасциит, миозит, эндо- и перикардит (характерны для инфекций, вызванных БГСА), менингит, пневмония, перитонит, сепсис (характерны для инфекций, вызванных преимущественно БГСБ) |
| Токсинопосредованные | Скарлатина, синдром токсического шока (характерны для инфекций, вызванных БГСА) |
| Иммунопатологические | Острая ревматическая лихорадка*, постстрептококковый гломерулонефрит*, реактивный артрит*, васкулиты*, PANDAS-синдром, острый диссеминированный энцефаломиелит (характерны для инфекций, вызванных БГСА) |
| I. Выявление стрептококков группы А |
- Предыдущий ребенок с диагносцированной БГСБ-инфекцией,
- Стрептококковая бактериурия при беременности,
- Угроза преждевременных родов на сроках до 37 недель,
- Массивный рост Streptococcus agalactiae в урогенитальном тракте ко времени родоразрешения,
- Длительный безводный период (более 18 часов).
- Послеродовая лихорадка выше 38oC
- Предыдущий ребенок с диагносцированной БГСБ-инфекцией,
- Стрептококковая бактериурия или
- Угроза преждевременных родов до 37 недели беременности.
Анохин В.А.
Стрептококковые тонзиллофарингиты у детей: диагностика и лечение
Фото носит иллюстративный характер. Из архива «МВ».
Татьяна Самаль,
доцент 1-й кафедры детских болезней БГМУ,
кандидат мед. наук;
Александр Кудин,
заведующий отделением № 5
Городской детской инфекционной клинической больницы Минска,
кандидат мед. наук.
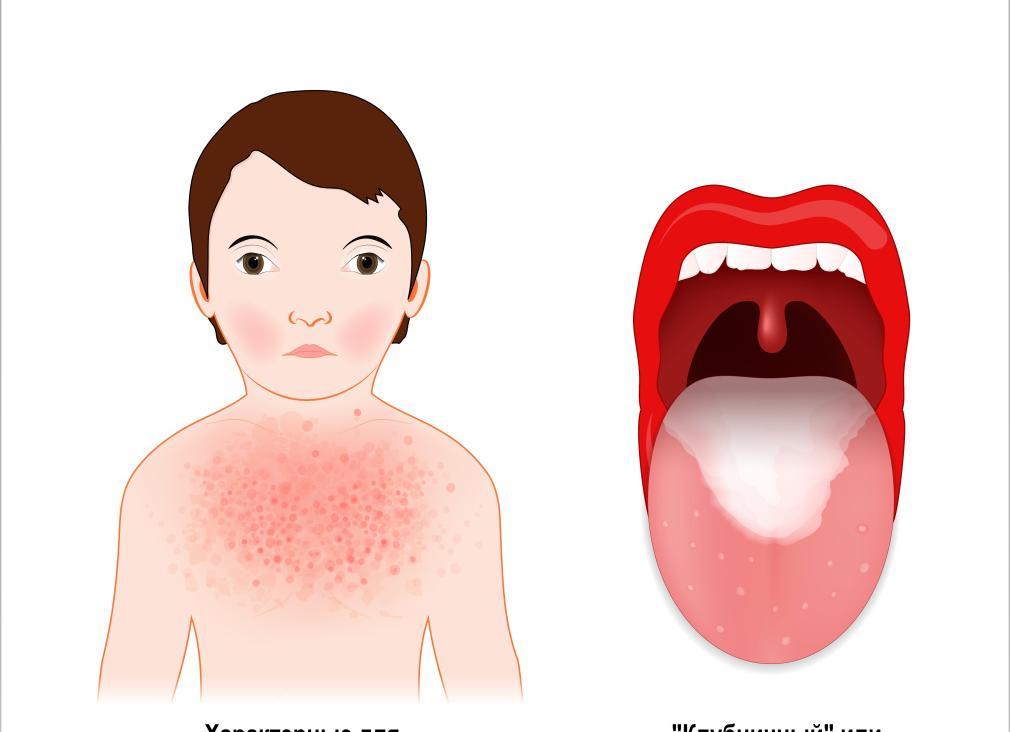
Стрептококковые острые тонзиллофарингиты (ОТФ) являются одной из наиболее распространенных респираторных инфекций в педиатрической практике. Бета-гемолитический стрептококк группы А (БГСА) обнаруживается в 5–10 % случаев ОТФ у детей до 5 лет, 20–37 % — в возрасте 5–15 лет. У малышей первого года жизни пленчатые тонзиллиты встречаются редко в связи с тем, что формирование лакунарных ходов заканчивается только к году.
БГСА вызывает различные варианты инфекции: поверхностные (фарингит, тонзиллофарингит, стрептодермия, рожа), инвазивные (некротизирующий фасциит или миозит, эндокардит, сепсис), токсин-опосредованные (скарлатина, синдром стрептококкового токсического шока); провоцирует развитие иммунно-опосредованных заболеваний у предрасположенных лиц (острый гломерулонефрит, острая ревматическая лихорадка (ОРЛ), постстрептококковый артрит, синдром PANDAS).
Наиболее частая клиническая форма БГСА-инфекции — ОТФ, т. е. острое воспаление лимфоидных образований глоточного кольца (чаще всего небных миндалин) и слизистой оболочки глотки, что имеет место примерно у 30 % всех детей с экссудативными тонзиллитами. Большинство случаев ОТФ у детей и взрослых вызваны вирусами (адено-, рино-, коронавирусы, вирусы гриппа, парагриппа, Эпштейна — Барр, Коксаки и т. д.). Это принципиально важно, т. к. вирусные ОТФ не требуют назначения антибактериальной терапии (АБТ).
В Международной классификации болезней Х пересмотра выделяют «Стрептококковый тонзиллит» (J03.0) и «Стрептококковый фарингит» (J02.0). В зарубежной литературе обычно используется термин «тонзиллофарингит» (считается, что изолированное воспаление этих структур ротоглотки как единого целого невозможно и говорит лишь о преимущественном поражении той или другой).
При диагностике и лечении стрептококковых ОТФ возникает ряд принципиальных вопросов. К сожалению, клинически и фарингоскопически отличить острый вирусный тонзиллит от БГСА непросто. Для стрептококкового ОТФ характерно отсутствие кашля, ринита, конъюнктивита, отмечаются выраженное увеличение и болезненность лимфоузлов в области угла нижней челюсти, насыщенная гиперемия мягкого неба и язычка, часто с петехиями, падение температуры через 12–24 часа после начала АБТ. Что касается налетов на миндалинах, то они с одинаковой частотой присутствуют и при вирусных тонзиллитах, особенно аденовирусной и ВЭБ-инфекции, и при стрептококковой инфекции. Однако при стрептококковых тонзиллитах налеты появляются в первые сутки болезни, а при вирусных обычно на 3–4-й день.
Для более эффективной клинической дифференциальной диагностики вирусного и стрептококкового тонзиллофарингита предложено использовать шкалы R. M. Centor и W. McIsaac (1998). Первая предназначена как для детей, так и для взрослых. По ней оценивают: температуру тела выше 38 °С, отсутствие кашля, увеличение и болезненность шейных лимфатических узлов, отечность миндалин, а также возраст больного (см. табл. 1). Чем выше сумма баллов, тем вероятнее риск БГСА-тонзиллита. Но даже при максимальной оценке по этой шкале вероятность выделения БГСА составляет всего 51–53 %. Несмотря на это детям с оценкой ≥ 3 баллов рекомендовано незамедлительно назначать АБТ из-за риска развития осложнений (см. табл. 2).
Бактериологическое исследование считается «золотым стандартом» диагностики, его чувствительность превышает 90 %, а специфичность 95–99 %. Основной недостаток — длительность (не менее 24–48 часов в случае выявления БГСА). Возможно получение ложноотрицательных результатов посевов по нескольким причинам. Во-первых, выделение стрептококков затруднено в тех случаях, когда наряду с ними в материале встречаются гемолитические стафилококки (Staphylococcus aureus), которые отличаются бурным ростом и «забивают» колонии стрептококков.
Во-вторых, культуральными методами не выделяются стрептококки, персистирующие внутриклеточно, что характерно для хронических тонзиллитов и после неадекватной АБТ. Для их выделения необходимы специальные микробиологические методы. В-третьих, во многих лабораториях для посева микроорганизмов используются питательные среды с добавлением донорской крови, а донорская кровь может содержать антитела к БГСА, которые препятствуют росту этих микроорганизмов. Важно помнить, что использование на амбулаторном этапе антибиотиков (даже их однократный прием) резко уменьшает вероятность выделения возбудителя бактериологическим методом.
На фоне ОРВИ бактериальная колонизация носоглотки возрастает, однако это не требует АБТ, поскольку, как доказано многочисленными исследованиями, при этом количество бактериальных осложнений ОРВИ не только не уменьшается, но, напротив, увеличивается, причем за счет резистентных штаммов. Сапрофитные микроорганизмы защищают глотку от колонизации БГСА и другими патогенами, а антибиотики нарушают этот протективный механизм и повышают частоту рецидивов БГСА-тонзиллитов.
В настоящее время широкое распространение получили методы экспресс-диагностики стрептококкового антигена в мазках с поверхности миндалин и/или задней стенки глотки (Streptatest, STREP-A-CHECK-1, Binax-Strep A), которые позволяют получать результат уже через 15–20 минут. Однако несмотря на высокую специфичность (95–100 %), они характеризуются более низкой чувствительностью (60–80 %), чем культуральное исследование.
Однако ни культуральное исследование, ни экспресс-тесты не позволяют дифференцировать больных с ОТФ стрептококковой этиологии от бессимптомных носителей БГСА с интеркуррентной вирусной инфекцией.
В соответствии с рекомендациями ESCMID (Европейского общества по клинической микробиологии и инфекционным заболеваниям) 2012 года культуральное исследование мазка на БГСА не рекомендуется как рутинное у всех пациентов с острой болью в горле. При высокой вероятности БГСА на основании оценки по клиническим шкалам следует по возможности провести экспресс-диагностику, в случае отрицательного результата экспресс-теста бактериологическое исследование не проводится.
IDSA (Американское общество специалистов по инфекционным болезням) рекомендует более широкое использование экспресс-теста и (или) культурального исследования мазка с задней стенки глотки, поскольку клинические симптомы не считаются надежными критериями при дифференциальной диагностике ОТФ, вызванного вирусами и БГСА, кроме случаев, когда выражены симптомы вирусной инфекции (насморк, кашель, осиплость голоса и/или язвенные поражения слизистой оболочки полости рта).
У детей и подростков отрицательные результаты экспресс-теста должны быть подтверждены культуральным исследованием (у взрослых необязательно в связи с низкой распространенностью БГСА-инфекции и крайне низким риском развития ревматической лихорадки в последующем). При положительном экспресс-тесте культуральное исследование нецелесообразно. У детей младше 3 лет классические стрептококковые ОТФ практически не встречаются, а обследование на БГСА в этой возрастной группе показано только, если она диагностирована у брата или сестры.
Лабораторные данные также не всегда позволяют отличить бактериальную инфекцию от вирусной. Маркерами бактериальной инфекции можно считать лейкоцитоз более 15 х 109/л, нейтрофилез более 10 х 109/л и/или палочкоядерных форм более 10 % или более 1,5 х 109/л, СРБ более 70 мг/л. Более низкие цифры или значительное повышение только одного из этих показателей нередко встречаются при вирусных инфекциях. Так у 1/3 детей с тонзиллитами, вызванными аденовирусами и вирусом Эпштейна — Барр, лейкоцитоз превышает 15 х 109/л, а СРБ 60 мг/л. С другой стороны, низкие цифры маркеров не обязательно позволяют исключить бактериальную инфекцию. Таким образом, лабораторные маркеры воспаления не всегда помогают в диагностике стрептококковой инфекции, их диагностическая ценность ниже, чем у катаральных симптомов, и рутинное исследование биохимического анализа крови при ОТФ не рекомендуется.
Серологическая диагностика БГСА-инфекции получила широкое распространение. Чаще всего в общеклинических лабораториях она ограничивается определением титра антител к стрептолизину О (АСЛ-О). Истинные БГСА-инфекции всегда вызывают специфический иммунный ответ — нарастание титра АСЛ-О. Определение АСЛ-О в венозной крови является высоко чувствительной и специфичной (около 80 %) реакцией, определение АСЛ-О в капиллярной крови значительно менее достоверно.
Синтез антител вообще и АСЛ-О в частности зависит от индивидуальных особенностей иммунного ответа: у одних он выраженный и длительный, у других замедленный. Синтез антител стартует через 1–2 недели от начала стрептококковой инфекции, но даже спустя 8 недель после перенесенного БГСА-тонзиллофарингита титр АСЛ-О может не достигать максимума. АСЛ-О способен сохраняться на очень высоком уровне до года.
Величина АСЛ-О в острый период не дает никакого представления о риске развития иммунных осложнений и не зависит от тяжести болезни. С другой стороны, если у больного уже в первые трое суток от начала тонзиллофарингита АСЛ-О повышен, это исключает острую стрептококковую инфекцию и говорит о том, что пациент перенес ее в сроки от 2 недель до 6–12 месяцев до обследования или страдает хроническим тонзиллитом. Иммунные осложнения (гломерулонефрит, ОРЛ) развиваются спустя 3–8 недель после БГСА-инфекции; если они не возникли в эти сроки, то вряд ли можно предполагать их развитие в дальнейшем (даже несмотря на повышенный уровень АСЛ-О).
Нужно четко понимать, что АСЛ-О представляют собой антитела распознавания антигена, а не его элиминации, и не лечить пациента антибиотиками, добиваясь нормализации этого показателя. Иммунный процесс имеет определенную стадийность, которая развивается, несмотря на гибель патогена. Лечить нужно инфекцию, а не повышенный уровень АСЛ-О! Определение титра АСЛ-О рекомендовано лишь в кардиоревматологии, нефрологии для доказательства стрептококковой этиологии поражения сердца и почек.
Для диагностики стрептококковой этиологии ОТФ определение уровня антител не используется, диагноз верифицируется культуральными методами. Этот тест может использоваться для дифференцировки активной инфекции от состояния носительства. (Достаточно подробно значение определения АСЛ-О описал Александр Лавринович в «МВ» от 5 января 2017 года).
Различают ранние и поздние (иммунные) осложнения БГСА-инфекции.
Ранние осложнения представлены шейным лимфаденитом, паратонзиллитом, парафарингитом, заглоточным и перитонзиллярным абсцессами. Этиология этих осложнений связана с сочетанной флорой (БГСА и анаэробы), проникающей в паратонзиллярную клетчатку и лимфоузлы из глубины лакун при тяжелом тонзиллите или вследствие травмы, например при обработке, тушировании миндалин. При этом у больного, несмотря на проводимое лечение, сохраняется лихорадка, боли при глотании, поворотах головы, открывании рта. При осмотре выявляются асимметрия зева, выбухание стенки глотки.
Иммунные осложнения БГСА-инфекции, к которым относятся постстрептококковый острый гломерулонефрит и острая ревматическая лихорадка, хорошо известны клиницистам. Последнее заболевание развивается у 0,3 % больных с нелеченным БГСА-тонзиллитом, из них у 40 % формируется хроническая ревматическая болезнь сердца. Адекватная АБТ на 80 % снижает риск развития острой ревматической лихорадки (ОРЛ), на 85 % — паратонзиллярного абсцесса.
Так называемые ревматогенные штаммы БГСА обладают рядом определенных свойств. Особое значение имеет М-протеин — типоспецифический антиген, располагающийся в наружном слое клеточной стенки. Антитела к М-протеину перекрестно реагируют с различными тканями организма-хозяина по принципу молекулярной мимикрии как основного патогенетического механизма развития иммунных осложнений БГСА-инфекции. Кроме того, белок М обладает свойствами суперантигена, вызывая поликлональную активацию лимфоцитов и образование низкоаффинных антител, что может привести к нарушению толерантности к собственным тканевым антигенам и развитию аутоагрессии, особенно у генетически предрасположенных больных. Эти свойства отмечены у серотипов М-3, М-5 и М-18.
Иммунопатологические осложнения БГСА-инфекции развиваются в стадии реконвалесценции. Острый гломерулонефрит манифестирует на 7–10-й день болезни, причем адекватная терапия ангины не снижает риска его развития. Клиника ОРЛ появляется через 2–3 недели после купирования симптомов ОТФ, причем лихорадка бывает не более чем у 30 % больных. Однако и в острый период ОТФ выявляются нарушения со стороны внутренних органов. Изменения со стороны сердечно-сосудистой системы характеризуются тахикардией, приглушенностью или ослаблением сердечных тонов.
При нормализации температуры тела тахикардия сменяется брадикардией, глухость сердечных тонов становится еще более выраженной. У 1/3 больных в острой стадии болезни выявляется микрогематурия, исчезающая при купировании синдрома интоксикации. Эти патологические изменения связаны с прямым действием токсинов стрептококка (экзотоксины, стрептокиназа, гиалуронидаза и др.) на органы, не имеют отношения к иммунопатологическим реакциям и не требуют проведения какой-либо противовоспалительной или иммуносупрессивной терапии.