Амилаза и анализы липазы
Одна из причин тяжелой боли в животе — воспаление поджелудочной железы. Это вызвано или острым или хроническим панкреатитом. Однако есть много других потенциальных причин боли в животе, включая аппендицит, внематочную беременность в женщинах и закупорку кишечника среди многих других. Несколько анализов крови могут помочь определить причину боли в животе.Амилаза и липаза — ферменты, произведенные поджелудочной железой, которые помогают переварить еду. Если поджелудочная железа повреждена, высокие уровни этих ферментов могут быть обнаружены в кровотоке. Проверка амилазы и уровней липазы может помочь определить, есть ли у Вас панкреатит.Амилаза и липаза — ферменты. Ферменты — белки, произведенные телом, чтобы сделать особую работу. Поджелудочная железа производит амилазу, чтобы подразделить углеводы еды в простой сахар. Липаза произведена поджелудочной железой, чтобы переварить жиры в жирные кислоты. Сахар и жирные кислоты могут тогда быть поглощены тонкой кишкой. Немного амилазы и липазы могут также быть найдены в слюне и в желудке, но большинство сделано в поджелудочной железе и выпущено в тонкую кишку.В здоровом человеке нормальный уровень амилазы крови — 23-85 U/L (некоторые результаты лаборатории подходят к 140 U/L). Нормальный уровень липазы — 0-160 U/L. Если поджелудочная железа повреждена, эти пищеварительные ферменты могут быть найдены в крови в более высоких уровнях, чем нормально. Уровни в крови больше чем четыре раза нормальные уровни амилазы (450 U/L) и липаза (400 U/L), вероятно, укажет на повреждение поджелудочной железы или панкреатит.Есть много причин, почему у пациента могли бы быть патологические уровни амилазы в их крови. Они включают:острый панкреатитхронический панкреатитложная киста поджелудочной железы (жидкость заполнила мешок в брюшной полости),рак поджелудочной железыхолецистит (воспаление желчного пузыря)тяжелый гастроэнтерит (или “расстройство желудка”)внематочная беременность (имплантация яйца в Маточную трубу)свинка или блокировка слюнной железызакупорка кишечника или блокировка желчного протокамакроамилаза в Вашей кровипроникнувшие язвыТакже-низкие-уровни амилазы могут указать на определенный рак поджелудочной железы, болезнь почек или токсемию беременности.Есть также много лекарств, которые могут увеличить количество амилазы в Вашей крови, даже без любой существующей болезни:аспириннекоторые противозачаточные таблеткикортикостероидынекоторые препараты химиотерапиихолинергические препаратыметилдофатиазид и мочегонные средства петлисимвастатин,опиаты (такие как кодеин и морфий)Патологические уровни липазыУровни липазы могут быть на аномально высоких уровнях, если пациент испытывает:острый панкреатитхронический панкреатитрак поджелудочной железытяжелый гастроэнтерит (или “расстройство желудка”)холецистит (воспаление желчного пузыря)глютеновая болезнь (аллергия на клейковину)язва двенадцатиперстной кишкиПатологические уровни липазы могут также существовать у больных с семейным липопротеиновым дефицитом липазы.Препараты, которые могут оказать влияние на уровни липазы в Вашей крови, включают:некоторые противозачаточные таблеткихолинергические препаратытиазид и мочегонные средства петлиопиаты (такие как кодеин и морфий)О тестировании крови
Когда проверяют Вашу кровь, медицинский работник вставляет иглу в вену в Вашем локте или в конце Вашей руки. Кровь удалена и помещена в пузырек. Небольшое количество боли, возможно, во время вставки иглы. Осложнения возможны на месте, при чрезмерном кровотечении, приводящий к обмороку. Инфекция – возможный риск, но шансы крайне малы.
Категория:Пищеварение
Материалы на сайте имеют рекомендательный характер. Прежде чем использовать приведенные рекомендации, обязательно обращаться за консультацией к квалифицированному специалисту!
Панкреатическая липаза и амилаза: норма в крови
Поджелудочная железа секретирует сок, в нем содержится особый фермент панкреатическая амилаза, призванная расщеплять сложные компоненты на легкоусвояемые соединения. Молекулы амилазы трансформируют крахмал и пектины в сахарозу и мальтозу, при этом не принимают участия в гидролизе клетчатки.
Биологическая ценность энзима достаточно велика, особенно для органов желудочно-кишечной системы. По уровню данного вещества врач может определять, насколько здорова у человека поджелудочная железа. В диагностике ряда патологических состояний и нарушений помогает развернутый анализ на показатели амилазы (повышенная или повышенная).
Чтобы получить максимально точные данные для выявления заболеваний применяют параметры двух исследований, которые показывают количество амилазы в моче и кровотоке. Установление диастазы в моче является трудоемким процессом, биологический материал забирают частями, каждые 3 часа. Несложным анализом на амилазу станет исследование крови, взятой из локтевой вены.
Подобное исследование оправдано для определения степени активности фермента, диагностики различных форм воспалительного процесса в поджелудочной железе. Оно на 40% информативнее, нежели анализ на липазу. Диагностический метод практикуют также для выявления заболеваний у животных, например, кошки.
Показатели отклонения от нормы
Амилаза при остром течении воспаления повышается сразу в несколько раз, обычно подобные изменения говорят о начале патологического состояния или обострения недуга. Показатели растут в течение 3-5 часов, пика достигают спустя 10-24 часа. После чего наблюдается спад, на 6 сутки уровень амилаза снижается до нормы.
Для получения достоверных результатов требуется проводить анализ активности амилазы в суточной моче, что важно при постановке диагноза, однако результат не специфический при острой форме заболевания.
При хроническом панкреатите вне обострения уровень амилазы может быть слегка снижен, когда случается рецидив, количество панкреатических ферментов растет. У некоторых больных не исключается нормальная концентрация вещества даже при обострении.
Панкреатическая липаза и амилаза повышена в таких случаях:
- прерывание беременности;
- травмы брюшной полости;
- другие заболевания.
Причины стремительного увеличения показателей также связанны с камнями в желчном пузыре, почках, онкологическими новообразованиями, непроходимостью желчи.
Бывает, что биохимический анализ дает нулевой результат, это случается при недостаточности функций поджелудочной железы, острой и хронической фазе гепатита. Низкий уровень амилазы – это симптом токсикоза при беременности.
Для постановки точного диагноза потребуется сдать дополнительные анализы, провести тщательное обследование организма.Норматив уровня вещества такой: у детей до одного года показатель амилазы ниже 8, у ребенка 1-10 лет – ниже 31, в подростковом возрасте – ниже 39, у взрослого – ниже 53 Ед/л. Нет разницы, какого пола пациент.
Незначительное превышение – когда анализ показал всего на несколько единиц больше нормы, у человека не нарушено самочувствие, он не предъявляет жалоб на здоровье. В таких случаях врач просто назначает Панкреатин или аналогичные ферментные препараты для поджелудочной железы.
Насторожить должны показатели в два и более раз выше (ниже) нормальных.
Когда результат повышен или понижен?
При панкреатите амилазу определяют благодаря развернутому биохимическому анализу крови, затем оценивают различные изменения, делают заключение и назначают адекватную терапию. Забор крови проводят натощак, после проверяют состав сыворотки. Для анализа мочи биологический материал собирают сутки, утреннюю порцию мочи выливают, остальную собирают в течения дня, сбор заканчивают утренней порцией мочи на следующий день.
Исследование крови на панкреатическую амилазу должен показать ее отсутствие, данный фермент в норме в кровотоке не присутствует.
При попадании вещества в непривычную среду (кровь, моча), говорят о наступлении определенных нарушений.
При повышенном показателе в крови количество амилазы в моче также превышает норму, это является маркером для определения патологий внутренних органов. Рост панкреатической амилазы в крови может становиться признаком:
- паротита;
- недугов слюнной железы;
- холецистита.
Допустимое значение должно оставаться в пределах 28-125 Ед/л (кровь), 1-17 Ед/л (моча). Анализ на панкреатическую амилазу показан при комплексной диагностике, он позволяет своевременно установить заболевание и начать лечение.
Врач назначает анализ на амилазу в первую очередь для установления острой формы панкреатита, других патологий поджелудочной железы, но также для диагностики:
- внематочной беременности;
- гиперамилаземии;
- уровня Р-изофермента;
- почечной недостаточности;
- пептической язвы желудка и двенадцатиперстной кишки.
Помимо этого, анализ покажет нарушение работы почек, почечную недостаточность, непроходимость кишечника, воспалительные процессы в брюшной полости, в частности перитонит, острую форму алкоголизма, недостаточность железы после операционного лечения.
На сниженный уровень амилазы зачастую не обращают особого внимания, однако низкие показатели также должны становиться диагностическим признаком, указывающим на недостаточную работу поджелудочной железы. Вызывать нарушение может заболевание муковисцидоз, поражающее практически любые внутренние органы. Аналогичная картина наблюдается на последних стадиях рака, что указывает на скорую смерть пациента.
Повысить или понизить амилазу крови может высокий холестерин крови, гомоцистеин, это наблюдается, если перед диагностикой пациент принимал определенные лекарственные препараты: противозачаточные, наркотические, мочегонные, Ибупрофен и его производные.
Потребуется учитывать, что изменение общего значения амилазы с низким показателем панкреатической амилазы говорит о нарушениях работы поджелудочной железы, органов дыхания, патологиях яичников.
Как подготовиться к анализу
Для получения наиболее точного результата требуется правильно подготовиться к проведению исследования. Утром перед сдачей крови пациент должен отказаться от употребления пищи и различных напитков, в первую очередь кофе и чая. В неограниченном количестве допускается очищенная и негазированная вода.
Перед обследованием последний прием пищи должен осуществляться не позднее, чем за 12 часов. Существуют правила, ограничивающие прием медикаментов, обычно врачи советуют за 1-2 недели до анализа отказаться от приема лекарств. Если больной все-таки проигнорировал данную рекомендацию, об этом обязательно нужно рассказать доктору.
За сутки до сдачи материала исключают интенсивную физическую нагрузку, употребление спиртных напитков. Отразиться на результате анализа может прохождение физиотерапевтического лечения, в том числе ректальная и флюорографическая рентгеноскопия, ультразвуковое исследование (УЗИ).
Некоторые заболевания способны снизить показатели панкреатической амилазы, отличаться результат может при нарушениях:
- гепатит;
- недостаточный углеводный обмен;
- четвертая стадия злокачественных опухолей поджелудочной железы;
- новообразования в тканях поджелудочной железы;
- тотальное разрушение поджелудочной;
- высокий уровень низкоплотного холестерина крови.
Когда болезнь связана с воспалительным процессом, амилаза панкреатическая продуцируется в огромном количестве, панкреатическая амилаза повышенав десятки раз. Большая концентрация связана с недугами: хронический и острый панкреатит, закупорка протоков, опухоли, непроходимость кишечника, хронический и острый период желчнокаменной болезни, воспаление печени, наличие паразитарной инфекции в органе, острый аппендицит.
Установленные заболевания поджелудочной железы опасно лечить без участия врача, любая самодеятельность скажется на состоянии здоровья. Залогом длительной ремиссии станет строгое соблюдение предписаний доктора, улучшение качества жизни, прием назначенных лекарственных средств.
Информация о ферментах поджелудочной железы предоставлена в видео в этой статье.
Укажите Ваш сахар или выберите пол для получения рекомендацийИдет поискНе найденоПоказатьИдет поискНе найденоПоказатьИдет поискНе найденоПоказать
Биохимический анализ крови, ферменты крови. Амилаза, липаза, АЛТ, АСТ, лактатдегидрогеназа, щелочная фосфатаза — повышение, снижение показателей. Причины нарушений, расшифровка анализа.
В биохимическом анализе крови часто используют определение активности ферментов. Что представляют собой ферменты? Фермент – это белковая молекула, которая ускоряет протекание биохимических реакций в организме человека. Синонимом понятия фермент является термин энзим. В настоящее время оба эти термина используются в одном значении в качестве синонимов. Однако наука, изучающая свойства, строение и функции ферментов, называется энзимологией.
Рассмотрим, что же представляет собой данная сложная структура – фермент. Фермент состоит из двух частей – собственно белковой части и активного центра фермента. Белковая часть называется апофермент, а активный центр – кофермент. Вся молекула фермента, то есть апофермент плюс кофермент носит название голофермент. Апофермент всегда представлен исключительно белком третичной структуры. Третичная структура означает, что линейная цепочка аминокислот преобразуется в структуру сложной пространственной конфигурации. Кофермент может быть представлен органическими веществами (витамин В6, В1, В12, флавин, гем и т.д.) или неорганическими (ионы металлов – Cu, Co, Zn и т.д.). Собственно ускорение биохимической реакции производится именно коферментом.
Что такое фермент? Как работают ферменты?
Вещество, на которое фермент действует, называется субстратом, а вещество, которое получается в результате реакции, называется продуктом. Часто названия ферментов образуются путем прибавления окончания – аза к названию субстрата. Например, сукцинатдегидрогеназа – расщепляет сукцинат (янтарную кислоту), лактатдегидрогеназа – расщепляет лактат (молочную кислоту) и т.д.Ферменты делятся на несколько видов в зависимости от типа реакции, которую они ускоряют. Например, дегидрогеназы проводят окисление или восстановление, гидролазы проводят расщепление химической связи (трипсин, пепсин – пищеварительные ферменты) и т.д.
Каждый фермент ускоряет только одну определенную реакцию и работает в определенных условиях (температура, кислотность среды). Фермент имеет сродство к своему субстрату, то есть может работать только с этим веществом. Узнавание «своего» субстрата обеспечивается апоферментом. То есть процесс работы фермента можно представить таким образом: апофермент узнает субстрат, а кофермент ускоряет реакцию узнанного вещества. Данный принцип взаимодействия был назван лиганд – рецепторным или взаимодействием по принципу ключ – замок.То есть, как и к замку подходит индивидуальный ключ, так и к ферменту подходит индивидуальный субстрат.
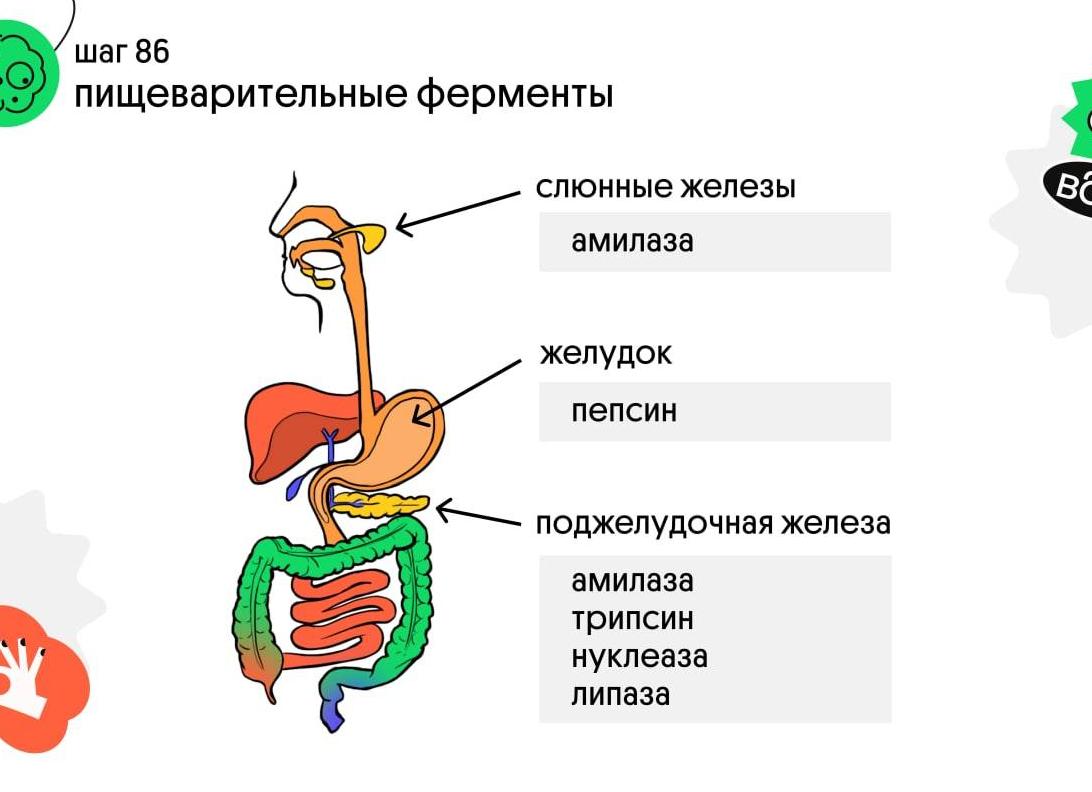
Амилаза вырабатывается поджелудочной железой и участвует в расщеплении крахмала и гликогена до глюкозы. Амилаза – это один из ферментов, участвующих в пищеварении. Наибольшее содержание амилазы определяется в поджелудочной железе и слюнных железах.
Существует несколько видов амилазы – α-амилаза, β-амилаза, γ-амилаза, из которых наибольшее распространение получило определение активности α-амилазы. Именно концентрацию этого вида амилазы определяют в крови в лаборатории.
В крови человека содержится два типа α-амилазы – Р-тип и S-тип. В моче присутствует 65% Р-типа α-амилазы, а в крови до 60% составляет S-тип. Р-тип α-амилазы мочи в биохимических исследованиях называют диастаза, во избежание путаницы.
Активность α-амилазы в моче в 10 раз выше, чем активность α-амилазы в крови. Определение активности α-амилазы и диастазы используют для диагностики панкреатитов и некоторых других заболеваний поджелудочной железы. При хронических и подострых панкреатитах используют определение активности α-амилазы в соке двенадцатиперстной кишки.
| название анализа | норма в мккатал/л | единицы измерения в Ед/л (Е/л) |
| 16-30 мккатал/л | 20-100 Ед/л | |
|
28-100 мккатал/л | до 1000 Ед/л |
Повышение активности α-амилазы в крови называется гиперамилаземия, а повышение активности диастазы мочи – гиперамилазурия.
Повышение амилазы крови выявляется при следующих состояниях:
- в начале острого панкреатита, максимум достигается через 4 часа от начала приступа, а снижается до нормы на 2-6 сутки от начала приступа (повышение активности α-амилазы возможно в 8 раз)
- при обострении хронического панкреатита (при этом активность α-амилазы возрастает в 3-5 раз)
- при наличии опухолей или камней в поджелудочной железе
- острая вирусная инфекция – свинка
- алкогольная интоксикация
- внематочная беременность
Когда амилаза мочи повышена? Повышение концентрации амилазы в моче развивается в следующих случаях:
- при остром панкреатите происходит увеличение активности диастазы в 10-30 раз
- при обострении хронического панкреатита активность диастазы возрастает в 3-5 раз
- при воспалительных заболеваниях печени наблюдается умеренное повышение активности диастазы в 1,5-2 раза
- острый аппендицит
- холецистит
- кишечная непроходимость
- алкогольная интоксикация
- кровотечения из язвы желудочно-кишечного тракта
- при лечении сульфаниламидными препаратами, морфином, мочегонными средствами и оральными контрацептивами
При развитии тотального панкреонекроза, раке поджелудочной железы и хроническом панкреатите активность α-амилазы может не увеличиваться. Существуют состояния организма, при которых активность α-амилазы может снижаться. Низкая активность диастазы мочи выявляется при тяжелом наследственном заболевании – муковисцидозе.
В крови снижение активности α-амилазы возможно после приступа острого панкреатита, при панкреонекрозе, а также при муковисцидозе.
Несмотря на то, что α-амилаза присутствует в почках, печени и поджелудочной железе, определение ее активности в основном используют в диагностике заболеваний поджелудочной железы. Для определения активности амилазы сдается кровь из вены, утром, натощак или средняя порция утренней мочи. Накануне перед сдачей анализа необходимо избегать жирной и острой пищи. При остром приступе панкреатита кровь из вены и моча сдаются в независимости от времени суток.В настоящее время в большинстве лабораторий используются ферментативные методы определения активности амилазы. Этот метод достаточно точен, высоко специфичен и занимает недлинный промежуток времени. Строение, виды и функции липазы Липаза – это один из пищеварительных ферментов, который участвует в расщеплении жиров.Для работы данного фермента необходимо присутствие желчных кислот и кофермента, который называется колипаза. Липаза вырабатывается различными органами человека – поджелудочной железой, легкими, лейкоцитами. Наибольшее диагностическое значение имеет липаза, которая синтезируется в поджелудочной железе. Поэтому определение активности липазы применяют преимущественно в диагностике заболеваний поджелудочной железы.
| 13 — 60 | Ед/мл |
В моче здорового человека липаза отсутствует!
Липаза в диагностике заболеваний поджелудочной железы Для диагностики заболеваний поджелудочной железы липаза является более специфичным тестом, чем амилаза, поскольку ее активность остается нормальной при внематочной беременности, остром аппендиците, свинке и заболеваниях печени. Поэтому при возникновении подозрения на наличие панкреатита целесообразно определять активность липазы и амилазы одновременно.Повышение активности липазы сыворотки крови при остром панкреатите возможно от 2 до 50 раз относительно нормы. Для выявления именно острого алкогольного панкреатита используют соотношение активности липазы и амилазы, причем если данное соотношение больше 2, то данный случай панкреатита, несомненно, алкогольного происхождения.Повышение активности амилазы в крови происходит через 4-5 часов после приступа острого панкреатита, достигает максимума через 12-24 часа и остается повышенной в течение 8-12 дней. При развитии острого панкреатита активность липазы в сыворотке крови может увеличиваться раньше и значительнее, чем активность амилазы. При каких состояниях повышается активность липазы в сыворотке крови: Также повышение активности липазы возможно при травмах, ранениях, операциях, переломах и острой почечной недостаточности. Однако повышенная активность липазы при указанных состояниях не является специфичной для них, поэтому в диагностике данных заболеваний не используется. Снижение активности липазы в сыворотке крови наблюдается при опухолях различной локализации (кроме поджелудочной железы), удаленной поджелудочной железе,неправильном питании или наследственной триглицеридемии. Для определения активности липазы сдается кровь из вены, утром, натощак. Накануне вечером перед сдачей анализа не следует принимать жирную, острую и пряную пищу. В случае экстренной необходимости кровь из вены сдается в независимости от времени суток и предшествовавшей подготовки.В настоящее время для определения активности липазы чаще всего используют иммунохимический метод или ферментативный. Ферментативный метод более быстрый и требует меньшей квалификации персонала. Лактатдегидрогеназа (ЛДГ) – это фермент, который содержится в цитоплазме клеток почек, сердца, печени, мышц, селезенки, поджелудочной железы. Коферментом ЛДГ являются ионы цинка и никотинамидадениндинуклеотид (НАД). ЛДГ участвует в обмене глюкозы, катализируя превращение лактата (молочной кислоты) в пируват (пировиноградную кислоту). В сыворотке крови имеется пять изоформ данного фермента.ЛДГ1 и ЛДГ2 изоформы сердечного происхождения, то есть содержатся преимущественно в сердце. ЛДГ3, ЛДГ4 и ЛДГ5 – печеночного происхождения.
| 0,8-4 мкмоль/ч*л | 140-350 Ед/л | |
| 2,0-8 мкмоль/ч*л | 400-700 Ед/л |
Диагностическое значение изоформ ЛДГ
Для диагностики различных заболеваний большей информативностью обладает определение активности именно изоформ ЛДГ. Например, при инфаркте миокарда наблюдается значительное повышение ЛДГ1. Для лабораторного подтверждения инфаркта миокарда определяют соотношение ЛДГ1/ЛДГ2, и, если данное соотношение больше 1, значит у человека был инфаркт миокарда. Однако такие тесты широко не используютсяввиду их дороговизны и сложности. Обычно проводят определение общей активности ЛДГ, которая складывается из суммарной активности всех изоформ ЛДГ.
ЛДГ в диагностике инфаркта миокарда
Рассмотрим диагностическое значение определения суммарной активности ЛДГ. Определение активности ЛДГ используют для поздней диагностики инфаркта миокарда, поскольку увеличение его активности развивается через 12-24 часа после приступа и может сохраняться на высоком уровне до 10-12 суток. Это очень важное обстоятельство при обследовании больных, поступивших в лечебное учреждение после приступа. Если увеличение активности ЛДГ незначительно, значит, мы имеем дело с мелкоочаговым инфарктом, если, напротив, увеличение активности длительное – значит, речь идет об обширном инфаркте.У больных стенокардией активность ЛДГ увеличена в первые 2-3 дня после приступа.
ЛДГ в диагностике гепатита
Активность суммарной ЛДГ может увеличиваться при остром гепатите (за счет увеличения активности ЛДГ4 и ЛДГ5). При этом активность ЛДГ в сыворотке крови повышается в первые недели желтушного периода, то есть в первые 10 дней. Норма ЛДГ у здоровых людей:
Возможно повышение активности ЛДГ у здоровых людей (физиологическое) после физических нагрузок, во время беременности и после принятия алкоголя. Кофеин, инсулин, аспирин, ацебутолол, цефалоспорины, гепарин, интерферон, пенициллин, сульфаниламиды также вызывает увеличение активности ЛДГ. Поэтому при приеме данных препаратов нужно учитывать возможность повышенной активности ЛДГ, которая не говорит о наличии патологических процессов в организме.
Вообще повышение активности ЛДГ в сыворотке крови может выявляться при следующих патологических состояниях:
- инфаркт миокарда
- острый гепатит (вирусный, токсический)
- цирроз печени
- раковые опухоли различной локализации (тератомы, дисгерминомы яичников)
- травмы мышц (разрывы, переломы и т.д.)
- острый панкреатит
- патология почек (пиелонефрит, гломерулонефрит)
- гемолитическая анемия, В12-дефицитная и фолиево дефицитная анемии
- лейкоз
ЛДГ может иметь сниженную активность на фоне уремии (увеличения концентрации мочевины). Для определения активности ЛДГ сдается кровь из вены, утром, натощак. Особой диеты или ограничений перед сдачей анализа нет. ЛДГ присутствует в эритроцитах, поэтому сыворотка для исследования должна быть свежей, без следов гемолиза. В настоящее время активность ЛДГ чаще всего определяют ферментативным методом, который надежен, специфичен и достаточно быстр. Аланинаминотрансфераза (АЛТ, АлАТ) – фермент, относящийся к аминотрансферазам (трансаминазам), то есть осуществляющим перенос аминокислот с одной биологической молекулы на другую. Поскольку в названии фермента присутствует аминокислота аланин, это означает, что данный фермент переносит именно аминокислоту аланин. Коферментом АСТ является витамин В6. АЛТ синтезируется в клетках, поэтому в норме его активность в крови невысока. Преимущественно синтезируется в клетках печени, но также имеется в клетках почек, сердца, мышцах и поджелудочной железе.
| до 40 | Ед/л | |
| до 32 | Ед/л |
Повышение активности АЛТ у здоровых людей (физиологическое) может быть вызвано приемом некоторых лекарственных препаратов (антибиотиков, барбитуратов,наркотиков, противоопухолевых препаратов, оральных контрацептивов, нестероидных противовоспалительных препаратов, дикумаринов, эхинацеи, валерианы), сильными физическими нагрузками, травмами. Также высокая активность АЛТ наблюдается у подростков в период интенсивного роста.
АЛТ в диагностике заболеваний печени
При диагностике патологических состояний организма повышение активности АЛТ является специфическим признаком острого заболевания печени. Повышение активности АЛТ в крови выявляется за 1-4 недели до проявления симптомов болезни и за 7-10 дней до появления максимального уровня билирубина в крови. Увеличение активности АЛТ при остром заболевании печени составляет 5-10 раз. Повышенная активность АЛТ в течение длительного времени или повышение ее в поздние сроки заболевания свидетельствует о начале массивного некроза печени. Высокая активность АЛТ в крови выявляется при наличии таких патологий:
- острый гепатит
- цирроз
- механическая желтуха
- введение гепатотоксических препаратов (например, некоторые антибиотики, отравление солями свинца)
- распад большой опухоли
- рак печени или метастазы в печени
- ожоговая болезнь
- обширный инфаркт миокарда
- травматические повреждения мышечной ткани
У больных мононуклеозом, алкоголизмом, стеатозом (гепатозом), перенесших операции на сердце, также может наблюдаться небольшое повышение активности АЛТ.
При тяжелых заболеваниях печени (цирроз тяжелой формы, некроз печени), когда сокращается количество активных клеток печени, а также при дефиците витамина В6, в крови наблюдается снижение активности АЛТ.
Кровь для определения активности АЛТ берется из вены, утром, натощак. Специальной диеты не требуется. Однако стоит проконсультироваться с врачом и отменить на несколько дней прием лекарств, которые вызывают изменение активности АЛТ. Активность АЛТ оценивают ферментативным методом, который специфичен, достаточно прост в использовании и не требует длительной и особой пробоподготовки. AСТ — строение и функция фермента Аспартатаминотрансфераза (АСТ, АсАТ) – фермент из группы трансаминаз, который осуществляет перенос аминокислоты аспартата с одной биологической молекулы на другую. Коферментом АСТявляется витамин В6. АСТ является внутриклеточным ферментом, то есть в норме находится в клетках. В клетках фермент может присутствовать в цитоплазме и митохондриях. Наибольшая активность АСТ выявлена в сердце, печени, мышцах и почках. В крови присутствует в основном цитоплазматическая фракция АСТ. Возможны более высокие значения активности АСТ у здоровых людей (физиологические) при чрезмерных мышечных нагрузках, приеме некоторых лекарств, например, эхинацеи,валерианы,алкоголя, больших доз витамина А, парацетамола, барбитуратов, антибиотиков и т.д.
| 15-31 | Ед/л | |
| 20-40 | Ед/л |
Активность АСТ в сыворотке крови повышается в 4-5 раз при инфаркте миокарда и сохраняется таковой в течение 5 дней. Если активность АСТ держится на высоком уровне и не снижается в течение 5 дней после приступа, то это говорит о неблагоприятном прогнозе для больного с инфарктом миокарда. Если наблюдаются ещё повышения активности фермента в крови, то данный факт свидетельствует о расширении зоны инфаркта. При некрозе или повреждении печеночных клеток также повышается активность АСТ. Причем чем выше активность фермента, тем больше степень повреждения. Повышение активности АСТ крови присутствует в следующих случаях:
- гепатиты
- некроз печени
- цирроз
- алкоголизм
- рак печени и метастазы в печени
- инфаркт миокарда
- наследственные и аутоиммунные заболевания мышечной системы (миодистрофия Дюшена)
- мононуклеоз
- гепатоз
- холестаз
Существует еще целый ряд патологических состояний, при которых также происходит увеличение активности АСТ. К таким состояниям относят – ожоги, травмы, тепловой удар, отравление ядовитыми грибами.
Низкая активность АСТ наблюдается при дефиците витамина В6 и наличии обширных повреждений печени (некроз, цирроз).
Однако в клинике используют определение активности АСТ в основном для диагностики повреждений сердца и печени. При других патологических состояниях активность фермента также изменяется, однако ее изменение не является специфичным, следовательно, не представляет высокой диагностической ценности.
Коэффициент де Ритиса. Как отличить инфаркт от повреждения печени
Для дифференциальной диагностики повреждений печени или сердца используют коэффициент де Ритиса. Коэффициент де Ритиса – это соотношение активности АСТ/АЛТ, который в норме составляет 1,3. Увеличение коэффициента де Ритиса выше 1,3 характерно для инфаркта миокарда, и снижение его ниже 1,3 – выявляется при заболеваниях печени. Щелочная фосфатаза (ЩФ) – является мембранным ферментом, который локализован в щеточной каемке желчных канальцев. ЩФ может быть кишечной, плацентарной и неспецифичной (в тканях печени, почек и костей). Данный фермент является ключевым в обмене фосфорной кислоты.
| 30-90 | Ед/л | |
| до 400 | Ед/л | |
| до 250 | Ед/л |
Возрастает активность ЩФ в крови здоровых людей (физиологическое повышение) при передозировке витамина С, недостаточности кальция и фосфора в пищевом рационе, приеме оральных контрацептивов, гормональных препаратов эстрогенов и прогестеронов, антибиотиков, сульфаниламидов, магнезии, омепразола, ранитидина и прочее.
Щелочная фосфатаза в диагностике заболеваний печени и желчных путей
Высокой специфичностью и диагностическим значением обладает определение активности ЩФ при подозрении на заболевания печени. При обтурационной желтухе происходит увеличение активности ЩФ крови в 10 раз относительно нормы. Определение данного показателя используется для лабораторного подтверждения именно этой формы желтухи. В меньшей степени увеличение активности ЩФ происходит при гепатитах, холангитах, язвенном колите, кишечных бактериальных инфекциях и тиреотоксикозе.
Значение щелочной фосфатазыпри заболеваниях костей и в травматологии
ЩФ является маркерным ферментом остеосинтеза, то есть увеличивается активность при заболеваниях костей или метастазах опухолей в кость, а также при заживлении переломов. Высокую активность ЩФ выявляют при следующих патологиях:
- обтурационная желтуха
- опухоли кости или метастазы в кости
- гипертиреоз
- заболевания крови (миеломная болезнь, лимфогранулематоз, мононуклеоз)
- рахит
- деструктивные заболевания печени (цирроз, рак, туберкулез)
- белые инфаркты (почки, легкого)
- амилоидоз
Помимо высокой активности ЩФ в крови имеются состояния, при которых активность фермента снижена.В первую очередь подобное явление развивается при недостатке цинка, магния, витаминов В12 или С (цинга) в рационе питания. Низкая активность ЩФ крови сопровождает также следующие патологические состояния организма человека – анемии, недостаточность формирования плаценты при беременности, гипертиреоз и нарушения роста и формирования костей. Для определения активности ЩФ берется кровь из вены, утром, натощак. Соблюдение специальной диеты не требуется. Нужно обратить внимание на то, что некоторые препараты могут снижать или повышать активность ЩФ, поэтому необходимо проконсультироваться у врача, стоит ли отменить прием данных препаратов на небольшой промежуток времени. В современных лабораториях активность фермента оценивается по скорости протекания ферментативной реакции. Данный метод обладает высокой специфичностью, простотой, надежностью и не требует больших временных затрат на проведение анализа. Итак, мы рассмотрели основные ферменты, активность которых определяют в биохимическом анализе крови. Следует помнить, что постановка диагноза не может основываться лишь на данных лабораторных показателей, необходимо учитывать анамнез, клинику и данные других обследований. Поэтому приведенные данные целесообразно использовать для консультации, но при выявлении каких-либо отклонений от нормы следует обратиться к врачу.
Автор: Наседкина А.К.
Что такое анализ крови на липазу и зачем его нужно сдавать?
Различные заболевания органов пищеварения нередко имеют одинаковые симптомы. Поэтому в процессе диагностики обязательно используется биохимический анализ крови. При проведении этого обследования определяется содержание такого вещества, как липаза. Рассмотрим, что это такое, какова норма содержания вещества в крови и какие причины могут спровоцировать отклонения от нормальных показателей.
В процессе переваривания пищи важная роль отводится ферментам. Это специфические вещества, синтезирующиеся в организме, их функция – ускорение биохимических реакций для перевода питательных веществ в формы, которые могут быть усвоены клетками. Одним из таких ферментов является липаза, он необходим для усвоения жиров.
Функции
Фермент липаза – это растворимое в воде вещество, выступающее в роли катализатора реакций по растворению, разделению на фракции и усвоению жиров, жирных кислот и жирорастворимых витаминов.
Совет! К жирорастворимым веществам относят витамины групп A, E, K, D.
Синтезируется липаза в разных частях организма, в зависимости от места расположения выделяют следующие виды энзимов:
- липаза панкреатическая, вырабатываемая в поджелудочной железе;
- печеночная;
- кишечная;
- легочная.
Совет! У грудных детей вырабатывается еще одна разновидность фермента – лингвальная. Она продуцируется железами, расположенными во рту.
Все виды энзима выполняют одну функцию – усвоение жиров. Однако наиболее активным ферментом считается панкреатическая липаза. Фермент поступает в пищеварительную систему в неактивной форме (пролипаза). При взаимодействии с желчью и другими ферментами он преобразуется в активную форму и принимает участие в процессах пищеварения.
Панкреатическая липаза принимает участие в переработке жиров, которые уже были эмульгированы желчью. Другие виды этого фермента задействованы в расщеплении жиров другого вида.
Показания
Наибольшее диагностическое значение имеет липаза, синтезируемая поджелудочной железой. При обновлении клеток органа некоторая часть ферментов поступает в кровоток. Энзим попадает в почки, а потом снова поступает в кровь.
Если в результате заболевания или травмы ткани поджелудочной железы повреждаются, отмечается существенное повышение содержания липазы в крови. Поэтому, чаще всего, анализ на содержание этого фермента назначается в процессе диагностики острого панкреатита. Для этого заболевания характерны следующие изменения содержания липазы в крови:
- концентрация фермента в крови повышается уже через 4-8 часов после первого приступа;
- максимальное содержание энзима отмечается через сутки после первого проявления болезни;
- высокая концентрация сохраняется на протяжении 6-7 суток, затем начинает постепенно снижаться.
Совет! При диагностике острого панкреатита назначается комплексный биохимический анализ, в процессе которого выявляется концентрация двух ферментов – липазы и амилазы. Этот анализ является высокоинформативным, с его помощью можно диагностировать острый панкреатит в 99% случаев.
Если панкреатит протекает хронически, то анализ на концентрацию липазы в крови является менее информативным. Пораженные хроническим воспалением клетки перестают синтезировать ферменты в необходимых количествах. Поэтому при этом заболевании содержание энзимов нормально или даже снижено.
Кроме того, анализ на содержание этого фермента может быть назначен при проведении диагностики таких заболеваний:
- холецистит в острой форме;
- цирроз печени;
- почечная недостаточность;
- непроходимость тонкого кишечника;
- алкоголизм;
- кетоацидоз диабетический;
- паротит эпидемический (необходим комплексный анализ на амилазу и липазу, при паротите повышается содержание первого фермента, липаза остается в пределах нормы).
Совет! Назначить анализ на содержание липазы могут и при профилактическом обследовании, например, перед помещением в стационар.
Проведение процедуры
Материалом для проведения исследования является венозная кровь. Забор проб производится из периферической вены, как правило, из расположенной на внутреннем сгибе локтя. В лабораториях применяется две методики исследования:
- ферментативный;
- иммунохимический.
Первый метод используется чаще, так как с его помощью можно быстро получить результат, что очень важно в диагностике острых состояний.
Подготовка
Чтобы анализ показал корректные результаты, важно чтобы пациент правильно к нему подготовился. Правила подготовки к нему стандартны для всех биохимических исследований:
- последний прием пищи должен быть за 12 часов до забора проб;
- за сутки до исследования нужно исключить алкоголь, чрезмерно жирную пищу;
- минимум за час до исследования нельзя курить.
Нормы и отклонения
При проведении анализов на липазу, норма содержания фермента не зависит от пола:
- для взрослого населения (мужчины и женщины) норма содержания данного фермента – до 190 ЕД/мл;
- для пациентов моложе 17 лет норма несколько ниже – до 130 ЕД/мл.
Превышение
Если норма повышена, то такое состояние может иметь следующие причины:
- Панкреатит в острой форме. При этом заболевании норма может быть превышена в несколько десятков раз.
- Панкреатит в хронической форме. При этом заболевании липаза бывает повышена не всегда. Обычно, превышение бывает не слишком значительное, оно держится около семи дней, а потом начинает снижаться. Если при хронической форме заболевания норма содержания липазы превышена в 10 и более раз, то это свидетельствует о крайне тяжелом течении заболевания.
- Новообразования в поджелудочной железе. Вызвать изменение состава крови могут кисты и опухоли доброкачественного и злокачественного характера;
- Непроходимость или инфаркт кишечника.
- Заболевания желчного пузыря, холестаз.
- Заболевания, при которых нарушается жировой обмен – ожирение, диабет, подагра.
- Перитонит. При этом заболевание воспаление охватывает все органы брюшной полости, в том числе и поджелудочную железу.
Повышение уровня этого энзима при эпидемическом паротите является свидетельством того, что воспаление распространилось и на поджелудочную железу. Кроме того, резкое повышение уровня фермента отмечается при травмах, приводящих к разрыву внутренних органов.
Низкий уровень
Снижение уровня содержания фермента ниже показателя 7 ЕД/л могут спровоцировать следующие причины:
- наследственные заболевания, связанные с нарушениями обменных процессов: гиперлипидемия, муковисцидоз;
- снижение функций поджелудочной железы из-за патологического изменения тканей органов;
- онкология (опухоль может быть локализована в любом месте, кроме поджелудочной железы).
Итак, пищеварительный фермент липаза – это вещество, которое принимает участие в реакциях расщепления жиров. Анализ на содержание этого энзима назначают, чаще всего, в процессе диагностики острого панкреатита. Однако изменение уровня этого фермента может отмечаться и при других заболеваниях.