Т4 вирус что это
Фаг Т4 - это... Что такое Фаг Т4?
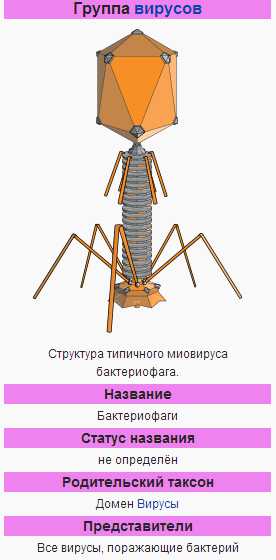
| Строение бактериофага Т4 | ||||||||||||
| ||||||||||||
| Enterobacteria phage T4 | ||||||||||||
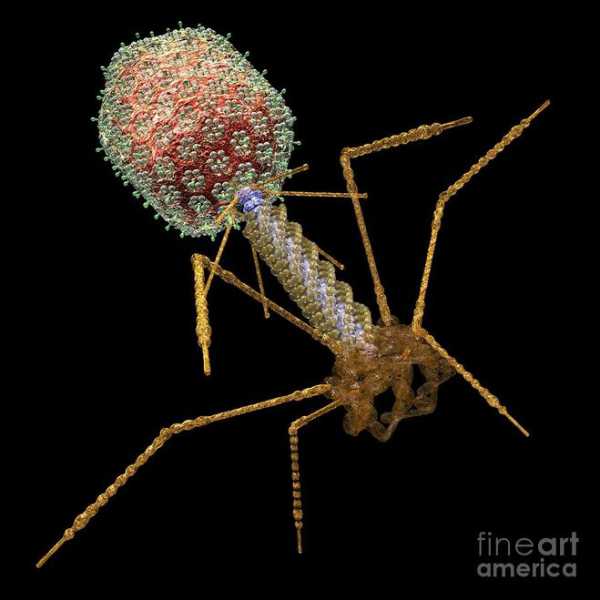
Бактериофаг T4 — один из самых изученных вирусов, бактериофаг, поражающий бактерию E. coli. Имеет геномную ДНК порядка 169—170 тысяч пар нуклеотидов, упакованную в икосаэдрическую головку. Вирион также имеет ствол, основание ствола и стволовые отростки — шесть длинных и шесть коротких.
Бактериофаг T4 использует ДНК-полимеразу кольцевого типа; его скользящая манжетка является тримером, сходным с PCNA, но она не имеет гомологии ни с PCNA, ни с полимеразой β.
T4 является относительно крупным фагом, имеет диаметр около 90 нм и длину около 200 нм. Фаг T4 использует только литический цикл развития, но не лизогенный.
С фагом Т4 или подобными бактериофагами работали лауреаты Нобелевской премии Макс Дельбрюк, Сальвадор Лурия, Альфред Херши, Джеймс Уотсон и Френсис Крик, а также другие известные ученые — Майкл Россманн, Вадим Месянжинов, Фумио Арисака, Сеймур Бензер, Брюс Альбертс.
Литература
- T4 Bacteriophage Infection Process Animations — Copyright © 2004—2009 by Seyet LLC
- Leiman, P.G., Kanamaru, S., Mesyanzhinov, V.V., Arisaka, F., and Rossmann, M.G., «Structure and morphogenesis of bacteriophage T4.»[1]
- Karam, J., Petrov, V., Nolan, J., Chin, D., Shatley, C., Krisch, H., and Letarov, A. The T4-like phages genome project. http://phage.bioc.tulane.edu/. (The T4-like phage full genomic sequence depository)
- Mosig, G., and F. Eiserling. 2006. T4 and related phages: structure and development, R. Calendar and S. T. Abedon (eds.), The Bacteriophages. Oxford University Press, Oxford. (Review of phage T4 biology) ISBN 0-19-514850-9
- Filee J. Tetart F., Suttle C.A., Krisch H.M. (2005). «Marine T4-type bacteriophages, a ubiquitous component of the dark matter of the biosphere». Proc. Natl. Acad. Sci. USA 102 (35): 12471–6. DOI:10.1073/pnas.0503404102. PMID 16116082. (Indication of prevalence and T4-like phages in the wild)
- Chibani-Chennoufi S., Canchaya C., Bruttin A., Brussow H. (2004). «Comparative genomics of the T4-Like Escherichia coli phage JS98: implications for the evolution of T4 phages». J. Bacteriol. 186 (24): 8276–86. DOI:10.1128/JB.186.24.8276-8286.2004. PMID 15576776. (Characterization of a T4-like phage)
- Desplats C, Krisch HM (May 2003). «The diversity and evolution of the T4-type bacteriophages». Res. Microbiol. 154 (4): 259–67. DOI:10.1016/S0923-2508(03)00069-X. PMID 12798230.
- Miller, E.S., Kutter E., Mosig G., Arisaka F., Kunisawa T., Ruger W. (2003). «Bacteriophage T4 genome». Microbiol. Mol. Biol. Rev. 67 (1): 86–156. DOI:10.1128/MMBR.67.1.86-156.2003. PMID 12626685. (Review of phage T4, from the perspective of its genome)
- Desplats C., Dez C., Tetart F., Eleaume H., Krisch H.M. (2002). «Snapshot of the genome of the pseudo-T-even bacteriophage RB49». J. Bacteriol. 184 (10): 2789–2804. DOI:10.1128/JB.184.10.2789-2804.2002. PMID 11976309. (Overview of the RB49 genome, a T4-like phage)
- Malys N, Chang DY, Baumann RG, Xie D, Black LW (2002). «A bipartite bacteriophage T4 SOC and HOC randomized peptide display library: detection and analysis of phage T4 terminase (gp17) and late sigma factor (gp55) interaction». J Mol Biol 319 (2): 289–304. DOI:10.1016/S0022-2836(02)00298-X. PMID 12051907. (T4 phage application in biotechnology for studying protein interaction)
- Tétart F., Desplats C., Kutateladze M., Monod C., Ackermann H.-W., Krisch H.M. (2001). «Phylogeny of the major head and tail genes of the wide-ranging T4-type bacteriophages». J. Bacteriol. 183 (1): 358–366. DOI:10.1128/JB.183.1.358-366.2001. PMID 11114936. (Indication of the prevalence of T4-type sequences in the wild)
- Abedon S.T. (2000). «The murky origin of Snow White and her T-even dwarfs». Genetics 155 (2): 481–6. PMID 10835374. (Historical description of the isolation of the T4-like phages T2, T4, and T6)
- Ackermann HW, Krisch HM (1997). «A catalogue of T4-type bacteriophages». Arch. Virol. 142 (12): 2329–45. DOI:10.1007/s007050050246. PMID 9672598. (Nearly complete list of then-known T4-like phages)
- Monod C, Repoila F, Kutateladze M, Tétart F, Krisch HM (March 1997). «The genome of the pseudo T-even bacteriophages, a diverse group that resembles T4». J. Mol. Biol. 267 (2): 237–49. DOI:10.1006/jmbi.1996.0867. PMID 9096222. (Overview of various T4-like phages from the perspective of their genomes)
- Kutter E., Gachechiladze K., Poglazov A., Marusich E., Shneider M., Aronsson P., Napuli A., Porter D., Mesyanzhinov V. (1995). «Evolution of T4-related phages». Virus Genes 11 (2-3): 285–297. DOI:10.1007/BF01728666. PMID 8828153. (Comparison of the genomes of various T4-like phages)
- Karam, J. D. et al. 1994. Molecular Biology of Bacteriophage T4. ASM Press, Washington, DC. (The second T4 bible, go here, as well as Mosig and Eiserling, 2006, to begin to learn about the biology T4 phage) ISBN 1-55581-064-0
- Eddy, S. R. 1992. Introns in the T-Even Bacteriophages. Ph.D. thesis. University of Colorado at Boulder. (Chapter 3 provides overview of various T4-like phages as well as the isolation of then-new T4-like phages)
- Mathews, C. K., E. M. Kutter, G. Mosig, and P. B. Berget. 1983. Bacteriophage T4. American Society for Microbiology, Washington, DC. (The first T4 bible; not all information here is duplicated in Karam et al., 1994; see especially the introductory chapter by Doermann for a historical overview of the T4-like phages) ISBN 0-914826-56-5
- Russell, R. L. 1967. Speciation Among the T-Even Bacteriophages. Ph.D. thesis. California Institute of Technology. (Isolation of the RB series of T4-like phages)
- Kay D., Fildes P. (1962). «Hydroxymethylcytosine-containing and tryptophan-dependent bacteriophages isolated from city effluents». J. Gen. Microbiol. 27: 143–6. PMID 14454648. (T4-like phage isolation, including that of phage Ox2)
Примечания
Вирус T4. Что это за вирус? какие заболевания он вызывает?
Вирус T4. Что это за вирус? какие заболевания он вызывает?
Вирус Т4 уже не столь опасен, поскольку выявлены все его особенности развития в организме человека. Сейчас же напротив данный вирус используется, как помощник, который моет уничтожить клетки бактерий.
Вирус Т4, называемый иначе как Бактериофаг, является га самом деле полезным для человека вирусом и при этом он очень хорошо изучен. Этот вирус поможет преодолеть организму человека некоторые инфекции: сальмонеллу, кишечные палочки и т.д. Очень широко применим в медицине. Этот вирус пожирает вредные бактерии и помогает обойтись без антибиотиков.
Этот вирус называется бактериофаг T4. Батериофаг переводится как пожиратель бактерий, то есть он живет в теле бактерии и ест своего хозяина, за счет чего и живет. К примеру, Т4 кушает кишечную палочку.
То есть этот вирус не только не вызывает сам никаких заболеваний, но еще и помогает человеку бороться с опасными болезнями. Т4 убивает кишечную палочку, другие бактериофаги поедают туберкулезные палочки или даже бактерии бубонной чумы.
Есть такой давно известный бактериофаг или фаг Т4 - это действительно вирус и он поражает, одним словом пожирает бактерии и изменяет ее, встраивая свой генетический материал в ДНК этой бактерии. Бактериофаги давно известны, еще с начала прошлого века и с помощью этих интересных микроорганизмов нашли лекарство от бубонной чумы, туберкулеза. Когда открыли антибиотики про эти очень интересные микроорганизмы забыли и очень зря. Сейчас ученые вновь с интересом взялись за изучение бактериофагов.

Вирус Т4 самый известный и изученный бактериофаг, который пожирает бактерии. Никаких заболеваний этот вирус у человека не вызывает, а даже наоборот, помогает ему бороться с бактериями. Так что беспокоиться по поводу этого вируса не стоит.
Вот как выглядит вирус T4 на фото, сделанном при помощи электронного микроскопа.
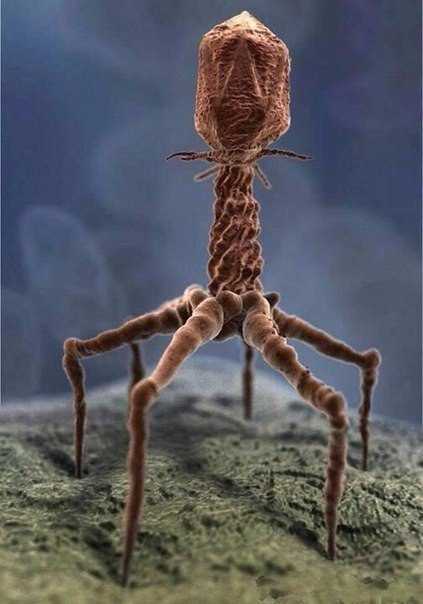
Вирус Т4 или правильное название Бактериофаг. Что же это такое? Бактериофаги(фаги) - это фирус или если быть точнее бактерии, которые пожирают вредные бактерии. Они заменили антибиотики, которые очень сильно влияют на организм человека, а бактериофаги они не вредны для организма человека. В общем еще одна разработка в сфере медицины, которая позволит людям быть сдоровее, а также лечить рак, так как бактериофаги убивают(высасывают) бактерии, которые находятся в раковых клетках. История возникновения бактериофага(вируса Т4)

Страшный на вид, но полезный для человека вирус Т-4 является бактериофагом, то есть поражает энтеробактерии. Он относительно крупный фаг, его изучали нобелевские лауреаты, такие как Сальвадор Лурия, Альфред Херши, Макс Дельбрюк и другие.
Никакой опасности для здоровья человека этот вирус не несет, а только помогает, пожирая бактерии, словно бы высасывая их.

Бактериофаг T4 - один из самых изученных вирусов в мире. Он поражает энтеробактерии, в том числе кишечную палочку, сальмонеллы и чумную палочку.
Этот вирус может стать эффективным способом борьбы с опасными инфекциями. Так что бактериофаг T4 никаких болезней не вызывает, а даже наоборот - помогает с ними бороться. С помощью нитей вирус прикрепляется к клетке болезнетворной бактерии, ДНК вируса попадает в клетку, в следствии чего она разрушается.
Кстати очень полезный для организма этот Бактериофаг T4. Он помогает в борьбе за кишечные инфекции как правило. Сальмонелла тяжело выводится и может жить в организме годами, а Бактериофаг T4 ее уничтожит навсегда. Этот вирус в среде медиков давно знаком, изучен и применяется достаточно широко. Подробнее о вирусе и как он действует можно узнать просмотрев небольшое видео ниже.
Казалось бы страшное слово quot;Вирусquot;, но в данном случае он нужен и полезен.
Т4 - это специальный вирус, который используется для борьбы со многими инфекциями, такими как сальмонелла, чумная палочка и другие. Его не стоит бояться. Он не вредит организму, а лишь уничтожает вредные клетки. На данный момент Т4 уже хорошо изучен и часто применяется в медицине.
Для того, чтобы люди не пили антибиотики, ученые синтезировали лекарства из естественных для иммунитета человека бактериофагов.
Бактериофаги - это пожиратель микробов в организме, чистильщики.
В данном случае бактериофаг Т4 пожирает кишечную палочку при заражении и человек выздоравливает без антибиотиков.
Смертельная красота вирусов
Воображение может иногда быть немного более красочным, чем реальность. Или более страшным. И вирусные образы, изображение которых мы часто встречаем на страницах книг, журналов и газет, это именно тот случай.

Смертельные патогены иллюстрированы в ярко-красных, токсично-зеленых или агрессивно-оранжевых тонах. Уродливые, страшные, почти оружие, они только и ждут, чтобы атаковать наше тело. В конечной цели все сводится к одному – напугать и оказать эмоциональное влияние, в то время как истина в том, что все вирусы – прозрачны.
Этот факт произвел такое большое впечатление на художника из Великобритании Люка Джеррама (Luke Jerram), что он использовал его в качестве основной идеи своего нового арт-проекта — трехмерных скульптур из стекла «Glass Microbiology».

Люк Джеррам родился в 1974 году и окончил Университет Уэльса в 1997 году с отличием первой степени в изобразительном искусстве. Он является изобретателем, исследователем, ученым-любителем. Основная идея всех его работ – изучение пространства и восприятия. Личный взгляд художника на вирусы отражает совершенно иной образ, чем традиционное представление, сформировавшееся в нашем сознании. Его вирусы белые и прозрачные, хрупкие и холодные, но не страшные. Таинственные и величественные и, в то же время, более человеческие, чем когда-либо.
Вирус Эбола

Среди его экспонатов стеклянные копии самых смертельных для человека болезней: ВИЧ, вирус Эбола, птичий грипп, вирус E. Coli, энтеровирус типа EV71, малярия, папиллома, свиной грипп, бактериофаг Т4. Птичий грипп

Каждая деталь, разработанная при помощи вирусолога Эндрю Дэвидсона из Университета Бристоля, изысканное воспроизведение вируса. Хотя скульптуры и могут показаться преувеличенными, с зубцами, жуткими выпуклостями, на самом деле они созданы с удивительной точностью. Конечно, они значительно больше, чем их первоначальный вид: стеклянные вирусы превосходят оригиналы в размерах в миллион раз. Бактериофаг Т4

С помощью своих творений Джеррам изучает взаимосвязь между красотой произведений искусства и тем, как они влияют на человека. Точно так же, как Сьюзен Зонтаг говорит в своей книге «Illness and its metaphors» (Болезнь и ее метафоры), что искусство, как и слова, влияет на то, как мы переносим болезнь. Это означает, что можно вызвать фантазии относительно заболевания, которые иногда более опасны и трудны, чем биологическая действительность. Вот почему работа Люка Джеррама имеет большое значение: он предлагает альтернативное видение заболевания, которое может привести к другому пути его преодоления.
Свиной грипп
Вирус E. coli (Кишечная палочка)

Реакции на работы были весьма удивительны, — рассказывает Джеррам в своем интервью каналу BBC, — скульптуры невероятно красивы, и этим привлекают людей, но, когда они понимают, чем, на самом деле, это является, сразу появляется своего рода элемент отталкивания. Некоторые чувствуют, как будто они могут заразиться, если прикоснутся к ним.
Малярия
Энтеровирус типа EV71

Творения Люка — это вызов нашим собственным представлениям и идеям. Они демонстрируют, что реальность и её восприятие — нечто совершенно субъективное. В одном из писем, опубликованном на веб-сайте художника, анонимный автор сделал признание: Ваша скульптура сделала ВИЧ намного реальнее для меня, чем любая фотография или иллюстрация, которые я когда-либо видел. Это очень странное чувство, видеть своего врага, который, в конечном итоге, станет причиной моей смерти, и находить его таким красивым.
Вич

Вируса t4 что это такое
Ученые установили, как бактериофаг поражает клетку — хозяина бактерию Esherichia Coli.
Исследователи установили, как бактериофаг Т4 атакует клетку-хозяина — Esherichia Coli.
Оглавление:
Это открытие позволит создать революционно новый класс антибиотиков.
В январском выпуске «Nature», 2002г. описывается, как вирус использует иглоподобное биохимическое прокалывающее устройство для инфицирования клетки- хозяина E. Coli. «Мы показали, что это сложная биохимическая машина, позволяющая вирусу эффектио внедряться в клетку-хозяина. Основание ствола вируса играет основную роль в этом процессе, «- говорит Майкл Россман из Purdue University.
Бактериофаг Т4 — настоящий «Tyrannosaurus Rex» среди вирусов, поэтому это наилучший объект для исследований (размеры его составляют порядка 100 нм в длину и ширину). Т4 также «стволовой вирус», так как имеет ствол с прикрепляющимися к нему отростками для захвата бактерии. В 1 мм3 обыкновенной воды существует обычно около биллиона фагов.
Вирус Т4 (см. рис.1) состоит из икосаэдральной головки, содержащей вирусную ДНК, ствола, основания ствола и стволовых отростков — шести длинных и шести коротких. Длинные отростки сперва находят E.Coli, а, затем короткие прочно прикрепляются к клетке. Основание при этом передает импульс в ствол, который сокращается, как мускул, выдавливая из себя вирусную ДНК в клетку-хозяина. Основание вируса управляется как прокалывающим устройством, расположенным у ствола, и энзимом, режущим мембрану клетки E. Coli.
Этот энзим делает отверстие нанометровых размеров в мембране клетки, через которое вирусная ДНК поступает в клетку-хозяина. E. Coli, таким образом, инфицируется и биохимическая машина клетки продуцирует новые фаговые частицы, и, в конце концов, клетка гибнет. «Для начала наше исследование показывает структуру белков, входящих в состав основания вблизи ствола (так называемого биохимического прокалывающего устройства), и их роль в проникновении вирусной ДНК через мембрану клетки, » — сказал Россман.
На рис. 2 представлено строение белков основания, смоделированное с помощью программного обеспечения «SPIDER». Данные для модели получены при исследовании 418 микрофотографий замороженных вирусных частиц. Область, обозначенная (gp27-gp5*-gp5c)3 — биохимическое прокалывающее устройство. Наибольшая активность прокалывающего энзима наблюдается посредине «иглы». Рис. а — стереофотография основания, рис. b — его молекулярная структура. 1 ангстрем = 1/см.
Также было установлено, что при приближении к клеточной мембране основание деформируется — становится похожим на плоскую звезду. Это облегчает контакт с мембраной и сопутствует внедрению в нее «иглы».
Подобные исследования всегда связаны с исследованиями в нанотехнологическом молекулярном производстве. На базе этих знаний можно прогнозировать появление антибиотиков высокой эффективности действия.
Источник: http://imquest.kngraphics.ru/nanomedicine_t4.htm
АРХИВ «Студенческий научный форум»
Полная версия научной работы доступна в формате PDF
Просмотров научной работы: 15286
Комментариев к научной работе: 13
Поделиться с друзьями:
Бактериофаги, или фаги (с древнегреческого — «пожиратели бактерий»), – это вирусы, способные поражать клетки бактерий. Они были открыты еще в начале прошлого века, и уже в то время ученые пришли к выводу, что данный вирус может стать важным средством борьбы с опасными инфекциями. Именно благодаря этим микроорганизмам начали лечить такие тяжелые заболевания, как бубонная чума и туберкулез. Вскоре были открыты антибиотики, и существование фагов было благополучно забыто. Но сегодня интерес к данным микроорганизмам ученых вновь возвращается.
Бактериофаги – наиболее многочисленная и весьма распространенная, а возможно, и самая древняя группа вирусов. Они были обнаружены для большинства бактерий, патогенных, и также сапротрофных. В природе фаги также встречаются там, где есть чувствительные к ним бактерии: в почве и воде, в кишечнике человека и животных, в растениях и т. д. Чем богаче субстрат будет обогащен микроорганизмами, тем намного больше в нем будет бактериофагов.
Модельный объект — бактериофаг очень широко используют для научных исследований. Многие фундаментальные открытия в молекулярной биологии были открыты именно с помощью бактериофага, таковыми являются: генетический код, рекомбинация и репликация нуклеиновых кислот. Его очень легко культивировать самыми примитивными биологическими методами и получать в очень больших количествах.Бактериофаг Т4 очень удобный модельный объект для развития методов молекулярной биологии и выяснения структурных основ инфекционности вируса. Enterobacteriaphage T4— один из самых изученных вирусов, бактериофаг, поражающий бактерию E. coli. Имеет геномную ДНК порядка 169—170 тысяч пар нуклеотидов, упакованную в икосаэдрическую головку. Вирион также имеет ствол, основание ствола и стволовые отростки — шесть длинных и шесть коротких. Enterobacteriaphage T4 является крупным фагом, имеющий диаметр около 90 нм и длину около 200 нм. Фаг T4 использует только литический цикл развития, но не лизогенный. Рассмотрев строение бактериофага, мы выяснили, что все известные бактериофаги состоят из двух основных компонентов: белков и нуклеиновых кислот. По типу нуклеиновой кислоты они делятся на ДНК — и РНК-содержащие.
Базальная пластинка бактериофага – это сложная молекулярная структура, содержащая не менее 15 различных белков, которая узнает рецепторы на поверхности клеток хозяина и осуществляет структурную перестройку хвоста вируса, необходимую для инфицирования клеток. С помощью криоэлектронной микроскопии, удалось реконструировать трехмерную структуру базальной пластинки фага.
Полученная структура имеет форму шатра, обладающего симметрией шестого порядка относительно продольной оси хвоста вируса, в центре которого находится молекулярная игла, которая пронизывает клеточную стенку хозяина в процессе инфицирования. К верхней части базальной пластинки прикреплен хвостовой стержень, который имеет форму полой трубки, по которой осуществляется доставка ДНК вируса в клетку. Заражение бактерии начинается с адсорбции фага, т.е. прикрепления хвостового отростка бактериофага к поверхности клетки. Адсорбцию осуществляют фибриллы хвостового отростка, которые прикрепляются к структурам бактериальной клетки, называемым фагорецепторами. Вслед за адсорбцией базальная пластинка хвоста бактериофага вступает в тесный контакт с клеточной стенкой, в результате чего сократительный чехол хвоста сокращается, а центральный его стержень прокалывает клеточную мембрану и, вероятно, за счет сокращения головки ДНК фага впрыскивается внутрь бактерии. Бактериофаг немедленно, после проникновения ДНК в бактерии, начинает реализовываться генетическая информация, записанная в ДНК фага. В случае Т-четных бактериофагов в клетке синтезируются ферменты, разрушающие ДНК бактерии, и ферменты, необходимые для репродукции ДНК фага. После этого этапа, называемого синтезом ранних белков, в бактерии синтезируются поздние белки, образующие оболочку бактериофага. В результате возникают новые частицы бактериофага, бактерия лизируется, а размножившийся в ней бактериофаг выходит в окружающую среду. Если нанести отдельные бактериофаги на поверхность твердой питательной среды с растущими бактериями, то размножившиеся в бактериях бактериофаги разрушают бактерии, образуя на этом месте так называемые «стерильные пятна».
Бактериофаги, способные репродуцироваться в бактерии, разрушать их и выходить при этом в виде полноценных частиц в среду, называются вирулентными фагами.
Наряду с такими фагами существуют и другие — умеренные фаги. ДНК таких фагов после заражения клетки внедряется в ДНК самих бактерий, не нарушая их жизнедеятельности. Она удваивается и в результате передается потомству. Бактерия, в ДНК которой присутствует ДНК умеренного фага, называется лизогенной, а фаговая ДНК, объединенная с бактериальной ДНК, профагом. Если лизогенную бактерию облучить ультрафиолетовым светом или обработать химическими мутагенами, то можно вызвать превращение профага в фаг, т. е. возбудить в бактериальной клетке воспроизведение полноценных частиц фага, в результате которого клетка погибает. Следовательно, в лизогенной бактерии в составе единой бактериальной хромосомы сосуществуют генетический аппарат бактерии с геном вируса, который передается от родительской клетки потомству и может быть активирован (индуцирован).
Из этого можно сделать вывод, что фаги это не только средства против бактерий, но и главный их помощник. Именно бактериофаги помогают меняться бактериям, встраивая свой генетический материал в ее ДНК. Разработка новых антибиотиков — чрезвычайно дорогой и долгий процесс. Но даже появление нового лекарства не гарантирует того, что микробы не выработают от него защиты. Эти условия заставляют специалистов искать средства, которые на современном этапе могут помочь при лечении бактериальных инфекций и повысить его эффективность. Такими препаратами в настоящий момент называют бактериофаги.
Список использованной литературы:
1. Материалы международной научно-практической конференции «Бактериофаги: Тео-
ретические и практические аспекты применения в медицине, ветеринарии и пищевой про-
мышленности» / — Ульяновск: УГСХА им. П.А. Столыпина, 2013, т. IIс.
2. Раутенштейн Я.И., Бактериофагия, М., 1955
Источник: http://www.scienceforum.ru/2014/609/5291
Вирус T4. Что это за вирус? какие заболевания он вызывает?
Вы не ошиблись ? Может всё-таки не вирус? — более года назад
Бактериофаг T4 — один из самых изученных вирусов в мире. Он поражает энтеробактерии, в том числе кишечную палочку, сальмонеллы и чумную палочку.
Этот вирус может стать эффективным способом борьбы с опасными инфекциями. Так что бактериофаг T4 никаких болезней не вызывает, а даже наоборот — помогает с ними бороться. С помощью нитей вирус прикрепляется к клетке болезнетворной бактерии, ДНК вируса попадает в клетку, в следствии чего она разрушается.
Для того, чтобы люди не пили антибиотики, ученые синтезировали лекарства из естественных для иммунитета человека бактериофагов.
Бактериофаги — это пожиратель микробов в организме, чистильщики.
В данном случае бактериофаг Т4 пожирает кишечную палочку при заражении и человек выздоравливает без антибиотиков.
Вирус Т4 уже не столь опасен, поскольку выявлены все его особенности развития в организме человека. Сейчас же напротив данный вирус используется, как помощник, который моет уничтожить клетки бактерий.
Страшный на вид, но полезный для человека вирус Т-4 является бактериофагом, то есть поражает энтеробактерии. Он относительно крупный фаг, его изучали нобелевские лауреаты, такие как Сальвадор Лурия, Альфред Херши, Макс Дельбрюк и другие.
Никакой опасности для здоровья человека этот вирус не несет, а только помогает, пожирая бактерии, словно бы высасывая их.
Вирус Т4 самый известный и изученный бактериофаг, который пожирает бактерии. Никаких заболеваний этот вирус у человека не вызывает, а даже наоборот, помогает ему бороться с бактериями. Так что беспокоиться по поводу этого вируса не стоит.
Вот как выглядит вирус T4 на фото, сделанном при помощи электронного микроскопа.
Есть такой давно известный бактериофаг или фаг Т4 — это действительно вирус и он поражает, одним словом пожирает бактерии и изменяет ее, встраивая свой генетический материал в ДНК этой бактерии. Бактериофаги давно известны, еще с начала прошлого века и с помощью этих интересных микроорганизмов нашли лекарство от бубонной чумы, туберкулеза. Когда открыли антибиотики про эти очень интересные микроорганизмы забыли и очень зря. Сейчас ученые вновь с интересом взялись за изучение бактериофагов.
Этот вирус называется бактериофаг T4. Батериофаг переводится как пожиратель бактерий, то есть он живет в теле бактерии и ест своего хозяина, за счет чего и живет. К примеру, Т4 кушает кишечную палочку.
То есть этот вирус не только не вызывает сам никаких заболеваний, но еще и помогает человеку бороться с опасными болезнями. Т4 убивает кишечную палочку, другие бактериофаги поедают туберкулезные палочки или даже бактерии бубонной чумы.
Вирус Т4, называемый иначе как Бактериофаг, является га самом деле полезным для человека вирусом и при этом он очень хорошо изучен. Этот вирус поможет преодолеть организму человека некоторые инфекции: сальмонеллу, кишечные палочки и т.д. Очень широко применим в медицине. Этот вирус пожирает вредные бактерии и помогает обойтись без антибиотиков.
Вирус Т4 или правильное название Бактериофаг. Что же это такое? Бактериофаги(фаги) — это фирус или если быть точнее бактерии, которые пожирают вредные бактерии. Они заменили антибиотики, которые очень сильно влияют на организм человека, а бактериофаги они не вредны для организма человека. В общем еще одна разработка в сфере медицины, которая позволит людям быть сдоровее, а также лечить рак, так как бактериофаги убивают(высасывают) бактерии, которые находятся в раковых клетках. История возникновения бактериофага(вируса Т4)
Источник: http://www.bolshoyvopros.ru/questions/virus-t4-chto-eto-za-virus-kakie-zabolevanija-on-vyzyvaet.html
Комментарии
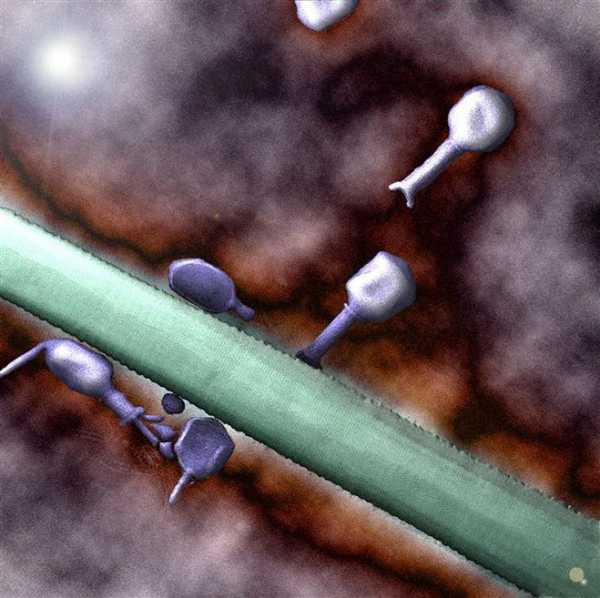
С помощью своих хвостовых нитей фаг прикрепляется к мембране бактериальной клетки, пронзает ее своим «хвостом» и подобно микроскопическому шприцу впрыскивает внутрь клетки содержащуюся в его голове ДНК.
Драматические взаимоотношения вируса и «клетки-хозяина» представляют в раздробленной форме тот механизм синтеза белков, который обычно протекает в живых клетках. Это готовый «экспериментальный прибор», отдельные элементы которого можно тем или иным способом варьировать. И вот были сделаны попытки искусственно воспроизвести этапы этого процесса, для того чтобы выяснить, как он происходит.
Фаг Т4 имеет величину, равную 3 тысячам ангстрем (ангстрем — одна десятимиллионная доля миллиметра), однако структура его частиц относительно сложна, его ДНК насчитывает до 100 генов. Для животных это количество ничтожно; для вируса это уже существенно. Но начнем с еще более простого организма — речь идет об одном из первых изученных вирусов — вирусе табачной мозаики (ВТМ). Он такой же величины, что и Т4, но еще более простой формы. Он похож на цилиндр, ширина которого всего 150 ангстрем. По оси этого цилиндра проходит нить РНК. Эта РНК содержит всего 5 или 6 генов. Белок, из которого построен цилиндр, состоит из одинаковых молекул. Молекула белка образована из 5 или 6 цепей, каждая из которых содержит приблизительно 150 аминокислот. Эти цепи располагаются двойным слоем общей толщиной 23 ангстрема — таким образом, что последовательности молекул, вкладываясь друг в друга в виде спиралей, создают корпус цилиндра.
Источник: http://ok.ru/k.rekord/topic/6
Смертельная красота вирусов
Воображение может иногда быть немного более красочным, чем реальность. Или более страшным. И вирусные образы, изображение которых мы часто встречаем на страницах книг, журналов и газет, это именно тот случай.
Смертельные патогены иллюстрированы в ярко-красных, токсично-зеленых или агрессивно-оранжевых тонах. Уродливые, страшные, почти оружие, они только и ждут, чтобы атаковать наше тело. В конечной цели все сводится к одному – напугать и оказать эмоциональное влияние, в то время как истина в том, что все вирусы – прозрачны.
Этот факт произвел такое большое впечатление на художника из Великобритании Люка Джеррама (Luke Jerram), что он использовал его в качестве основной идеи своего нового арт-проекта — трехмерных скульптур из стекла «Glass Microbiology».
Люк Джеррам родился в 1974 году и окончил Университет Уэльса в 1997 году с отличием первой степени в изобразительном искусстве. Он является изобретателем, исследователем, ученым-любителем. Основная идея всех его работ – изучение пространства и восприятия. Личный взгляд художника на вирусы отражает совершенно иной образ, чем традиционное представление, сформировавшееся в нашем сознании. Его вирусы белые и прозрачные, хрупкие и холодные, но не страшные. Таинственные и величественные и, в то же время, более человеческие, чем когда-либо.
Среди его экспонатов стеклянные копии самых смертельных для человека болезней: ВИЧ, вирус Эбола, птичий грипп, вирус E. Coli, энтеровирус типа EV71, малярия, папиллома, свиной грипп, бактериофаг Т4.
Каждая деталь, разработанная при помощи вирусолога Эндрю Дэвидсона из Университета Бристоля, изысканное воспроизведение вируса. Хотя скульптуры и могут показаться преувеличенными, с зубцами, жуткими выпуклостями, на самом деле они созданы с удивительной точностью. Конечно, они значительно больше, чем их первоначальный вид: стеклянные вирусы превосходят оригиналы в размерах в миллион раз.
С помощью своих творений Джеррам изучает взаимосвязь между красотой произведений искусства и тем, как они влияют на человека. Точно так же, как Сьюзен Зонтаг говорит в своей книге «Illness and its metaphors» (Болезнь и ее метафоры), что искусство, как и слова, влияет на то, как мы переносим болезнь. Это означает, что можно вызвать фантазии относительно заболевания, которые иногда более опасны и трудны, чем биологическая действительность.
Вот почему работа Люка Джеррама имеет большое значение: он предлагает альтернативное видение заболевания, которое может привести к другому пути его преодоления.Вирус E. coli (Кишечная палочка)
Реакции на работы были весьма удивительны, — рассказывает Джеррам в своем интервью каналу BBC, — скульптуры невероятно красивы, и этим привлекают людей, но, когда они понимают, чем, на самом деле, это является, сразу появляется своего рода элемент отталкивания. Некоторые чувствуют, как будто они могут заразиться, если прикоснутся к ним.
Энтеровирус типа EV71
Творения Люка — это вызов нашим собственным представлениям и идеям. Они демонстрируют, что реальность и её восприятие — нечто совершенно субъективное. В одном из писем, опубликованном на веб-сайте художника, анонимный автор сделал признание:
Ваша скульптура сделала ВИЧ намного реальнее для меня, чем любая фотография или иллюстрация, которые я когда-либо видел. Это очень странное чувство, видеть своего врага, который, в конечном итоге, станет причиной моей смерти, и находить его таким красивым.
Источник: http://animalworld.com.ua/news/smertelnaja-krasota-virusov
Фаг Т4
Бактериофаг T4 — один из самых изученных вирусов, бактериофаг, поражающий бактерию E.
Бактериофаг T4 использует ДНК-полимеразу кольцевого типа; его скользящая манжетка является тримером, сходным с PCNA, но она не имеет гомологии ни с PCNA, ни с полимеразой β.
T4 является относительно крупным фагом, имеет диаметр около 90 нм и длину около 200 нм. Фаг T4 использует только литический цикл развития, но не лизогенный.
С фагом Т4 или подобными бактериофагами работали лауреаты Нобелевской премии Макс Дельбрюк, Сальвадор Лурия, Альфред Херши, Джеймс Уотсон и Френсис Крик, а также другие известные ученые — Майкл Россманн, Вадим Месянжинов, Фумио Арисака, Сеймур Бензер, Брюс Альбертс.
Источник: http://dic.academic.ru/dic.nsf/ruwiki/
Рост и развитие. Вирусы
Вирусы — это паразитические нуклеопротеидные комплексы. Наиболее простые вирусы имеют в своем составе только одну молекулу нуклеиновой кислоты (ДНК или РНК, никогда вместе) и оболочку из молекул белка. В вирусах не идут процессы обмена веществ, они размножаются только в клетке-хозяине. Поэтому их не относят к живым организмам. Вирусы, которые при своем размножении повреждают клетку-хозяина, являются возбудителями заболеваний и считаются патогенными. К заболеваниям вирусной этиологии относятся синдром приобретенного иммунодефицита (СПИД), бешенство, полиомиелит, корь, краснуха, оспа, гепатит, грипп и другие инфекции верхних дыхательных путей (простуды).
Из множества известных вирусов на схеме представлены лишь отдельные представители. Все изображения даны при одинаковом увеличении. Вирусы, размножающиеся только в бактериях, носят название бактериофаги (коротко: фаги). Наиболее простое строение имеет фаг М13 ( 1 ). Он состоит из одной однонитевой молекулы ДНК [онДНК (ssDNA)], содержащей примерно 7000 н.о. (н.о. — нуклеиновое основание), окруженной белковой оболочкой из 2700 субъединиц, упакованных по спирали. Оболочка вируса носит название капсид, а структура в целом — нуклеокапсид. M13 используется в генной инженерии в качестве вектора (см. с. 256).
Фаг Т4 ( 1 ), один из наиболее крупных вирусов, имеет более сложное строение. В «головке» вируса содержится двунитевая ДНК [днДНК (dsDNA)], насчитывающаян.о.
Патогенный для растений вирус табачной мозаики ( 2 ) построен аналогично M13, но вместо ДНК содержит онРНК (ssRNA). K РНК-содержащим вирусам относится также вирус полиомиелита (полиовирус), вызывающий детский паралич. Нуклеокапсид вируса гриппа имеет дополнительную оболочку, заимствованную у плазматической мембраны клетки-хозяина ( B ). На липидной оболочке фиксированы вирусные белки, принимающие участие и инфицировании клетки-хозяина.
Б. Капсид риновируса
Риновирусы являются возбудителями так называемых «простудных заболеваний». Капсид этого вируса имеет форму икосаэдра, геометрической фигуры, построенной из 20 равносторонних треугольников. Оболочка сформирована из трех различных белков, расположенных в форме пентамеров и гексамеров.
В. Жизненный цикл вируса иммунодефицита человека (ВИЧ)
Вирус иммунодефицита человека (ВИЧ) известен как возбудитель заболевания, которое носит название синдром приобретенного иммунодефицита (СПИД). В структурном отношении ВИЧ подобен вирусу гриппа ( А ).
Геном ВИЧ состоит из двух молекул однонитевой РНК [онРНК (ssRNA)], каждая молекула содержит 9200 н.о.). Вирус имеет двуслойный капсид и окружен белоксодержащей мембраной. ВИЧ инфицирует главным образом Т-хелперные клетки (см. с. 286), что в итоге может привести к выходу из строя иммунной системы.
При инфекции ( 1 ) мембрана вируса сливается с плазматической мембраной клетки-мишени и ядро нуклеокапсида попадает в цитоплазму ( 2 ). Там вирусная РНК (RNA) вначале образует гибрид РНК/ДНК ( 3 ), а затем транскрибируется с образованием днДНК ( 4 ). Обе реакции катализируются обратной транскриптазой вируса. днДНК интегрируется в геном клетки ( 5 ), где может оставаться в неактивном состоянии. При ее активации вначале с помощью ферментов клетки-хозяина транскрибируется фрагмент ДНК, соответствующий вирусному геному ( 6 ). При этом идет репликация как вирусной онРНК, так и мРНК (mRNA), кодирующей предшественники вирусных белков ( 7 ). Затем белки встраиваются в плазматическую мембрану клетки ( 8, 9 ) и там подвергаются протеолитической модификации ( 10 ). Цикл заканчивается почкованием вновь образованных вирусных частиц ( 11 ).
Группа PHК-содержащих вирусов, к которым принадлежит и ВИЧ, носит название ретровирусы, поскольку их жизненный цикл начинается с синтеза ДНК на РНК-матрице, т. е. с процесса обратного обычной транскрипции, когда матрицей служит ДНК.
Источник: http://www.chem.msu.su/rus/teaching/kolman/390.htm
Бактериофаг Т4 — гораздо более сложный вирус, чем ВТМ. Его двухспиральная ДНК содержит примерно 165 генов по сравнению
Рис. 30.7. Участок РНК ВТМ, обеспечивающий инициирование сборки вирусной частицы ВТМ.
Рис. 30.8. Электронная микрофотография частично реконструированных частиц ВТМ. Видны два хвоста РНК, отходящие от каждого растущего вириона. [Lebeurier G., Nicholaeff A., Richards К. Е., Ргос. Nat. Acad. Sci. USA, 74, 150 (1977).]
Рис. 30.9. Схема сборки ВТМ. А — область инициации в РНК образует петлю и проходит в центральное отверстие белкового диска. диск переходит в спиральную форму «запорной шайбы». В — к тому концу РНК, где расположена петля, присоединяются новые диски. одна из концов РНК все время протаскивается через центральное отверстие и взаимодействует с новыми дисками. схематическое изображение молекулы РНК в частично собранном вирусе. Направление движения РНК, обозначено стрелкой. (Butler P. J.G., Klug A., Sci.Amer., 1978.)
с 6 генами ВТМ. Однако структура, размножение и процесс сборки фага Т4 изучены довольно хорошо, так как он подвергался интенсивному генетическому и биохимическому анализу. Вирион Т4 состоит из головки. отростка и шести нитей (фибрилл) отростка (рис. 30.10). Его молекула ДНК плотно упакована внутри икосаэдрической белковой оболочки и образует головку вируса. Отросток состоит из двух соосных трубок, соединенных с головкой короткой шейкой. В отростке сократительный чехол окружает центральный стержень, через который ДНК вводится в бактерию-хозяина. Отросток несет на конце базальную пластинку с шестью короткими зубцами, от которой отходит шесть длинных тонких нитей.
Концы нитей отростка связываются с определенными участками на клетке E. coli. В результате АТР-зависимого сокращения чехол подтягивает головку фага к базальной пластинке и нитям отростка, и в результате центральный стержень проникает через клеточную стенку, но не через мембрану клетки. Затем обнаженная фаговая ДНК проникает через клеточную мембрану. По истечении несколько минут все реакции синтеза клеточных ДНК, РНК и белка останавливаются и начинается синтез вирусных макромолекул. Другими словами, заразивший клетку вирус овладевает синтетическими механизмами бактериальной клетки и замещает ее гены своими.
В ДНК фага Т4 имеется три группы генов, которые транскрибируются на различных стадиях заражения: предранние, ранние и
Рис. 30.10. Электронная микрофотография фага Т4. (Williams R. С., Fisher Н. W., An electron micrographic atlas of viruses, С. С. Thomas, Springfield,1974. Печатается с любезного разрешения издателя.)
Таблица 30.2. (см. скан) Гены фага Т4 [Wood W.B., Revel H.R., Bacteriol. Rev., 40, 860 (1976)]
поздние. Предранние и ранние гены транскрибируются и транслируются до того, как синтезируется ДНК фага Т4. Некоторые белки, кодируемые этими генами, обеспечивают выключение синтеза клеточных макромолекул. Вскоре после заражения ДНК клетки-хозяина распадается под действием дезоксирибонуклеазы, кодируемой одним из ранних генов фага Т4. ДНК самого фага Т4 не гидролизуется под действием этого фермента, поскольку в ней нет кластеров (сгруппированных остатков) цитозина. В ДНК фага Т4 вместо цитозина находится гидроксиметилцитозин (ГМЦ). К тому же остатки ГМЦ в ДНК Т4 глюкозилированы.
Эти производные цитозина включаются в ДНК бактериофага Т4 благодаря действию нескольких фагоспепифических ферментов, синтезирующихся на ранней стадии заражения. Один из них гидролизует dCTP с образованием dCMP, чтобы воспрепятствовать включению dCTP в ДНК фага Т4. Затем второй фермент вводит в dCMP гидроксиметильную группу, и образуется
-гидроксиметилцитидилат. Третий фермент превращает -гидроксиметилцитидилат в трифосфат, который служит субстратом для ДНК-полимераз. Наконец, четвертый фермент гликозилирует некоторые из содержащихся в ДНК остатки гидрокси-метилцитозина.
Синтез поздних белков сопряжен с репликацией ДНК фага Т4. На этом этапе образуются белки капсида и лизоцим. Когда сборка вирионов потомства завершена, лизоцим гидролизует клеточную стенку бактерии и разрушает ее. Примерно через 20 мин после заражения возникает около двухсот новых вирусных частиц.
Источник: http://know.alnam.ru/book_bio3.php?id=137
Что такое вирусы? Симптомы, диагностика и лечение вирусов
Вирусы — это мельчайшие внутриклеточные паразиты (0,02—0,3 мкм), иногда кристаллизующиеся; центральная часть вирусной частицы состоит из нуклеиновой кислоты (РНК или ДНК), наружная оболочка белковая, иногда с липидами; воспроизведение вирусов возможно только в клетке-хозяине (бактериальной, растительной или животной). Первым этапом инфицирования является прикрепление вируса к клетке-хозяину, затем вирус проникает внутрь клетки и в присутствии специфических ферментов происходит репродукция вирусной РНК или ДНК. Большинство РНК-вирусов реплицируются в цитоплазме, в то время как ДНК-вирусы — в ядре. Пораженные клетки погибают, выделяя новые вирусы, которые инфицируют соседние клетки.
Некоторые инфекции асимптомагичны или латентны. При латентной инфекции вирусная РНК или ДНК присутствует в клетке, но не вызывает заболевания, если не появляются триггерные факторы. Латентность облегчает распространение вируса от человека к человеку. Герпесвирусы проявляют свойство латентности.
Сотни вирусов могут поражать человека. Вирусы, поражающие людей, распространяются преимущественно самим человеком, в основном через выделения из дыхательных путей и кишечника, некоторые — при сексуальном контакте и при переливании крови. Их распространение среди людей ограничивается врожденной невосприимчивостью, приобретенным естественным или искусственным иммунитетом, санитарно-гигиеническими и прочими социальными мероприятиями, а также химиопрофилактикой.
Для многих вирусов основным хозяином служат животные, а человек — лишь вторичным или случайным. Возбудители зоонозов в отличие от специфических человеческих вирусов в своем распространении ограничены географически теми условиями, в которых поддерживается естественный цикл инфекции без участия человека (наличие соответствующих позвоночных, членистоногих или тех и других).
Онкогенные свойства ряда вирусов животных хорошо изучены. Человеческие Т-лимфотропные вирусы типа 1 связывают с некоторыми лейкозами и лимфомами, вирус Эпштейна—Барр вызывает злокачественные новообразования, например назофарингеальную карциному, африканскую лимфому Беркитта, лимфомы у получавших иммунодепрессанты реципиентов пересаженных органов. Гепатиты В и С предрасполагают к развитию гепатокарциномы. Вирус герпеса человека 8-го типа предрасполагает к развитию саркомы Капоши, первичная выпотная лимфома (лимфома полостей тела) и болезнь Кастлемана (лимфопролиферативные расстройства).
Длительный инкубационный период, характерный для некоторых вирусных инфекций, дал основание для термина «медленные вирусы». Ряд хронических дегенеративных заболеваний ранее неизвестной этиологии теперь относят к медленным вирусным инфекциям. Среди них отметим подострый склерозирующий панэнцефалит (вирус кори), прогрессирующий краснушный панэнцефалит и прогрессирующую многоочаговую лейкоэнцефалопатию (JC-вирусы). Болезнь Крейтцфельда—Якоба и губчатая энцефалопатия имеют признаки, сходные с медленными вирусными инфекциями, но вызываются прионами.
Диагностика
Лишь немногие вирусные заболевания, например корь, краснуха, розеола новорожденных, инфекционная эритема, грипп и ветрянка, могут быть диагностированы на основании только клинической картины и эпидемиологических данных.
Следует помнить, что точная диагностика необходима тогда, когда требуется специфическое лечение или когда инфекционный агент представляет потенциальную угрозу для общества (например, атипичная пневмония, SARS).
Быстрая диагностика возможна в специально оснащенных вирусологических лабораториях путем культивирования, ПЦР, определения вирусных антигенов. Может помочь электронная (не световая) микроскопия. Для ряда редких заболеваний (например, бешенство, восточный лошадиный энцефалит и др.) существуют специализированные лаборатории (центры).
Профилактика и лечение
Прогресс в использовании вирусных препаратов очень быстрый. Антивирусная химиотерапия направлена на различные фазы вирусной репликации. Они могут влиять на прикрепление частицы к мембране клетки-хозяина или препятствуют высвобождению нуклеиновых кислот вируса, ингибируют клеточный рецептор или факторы вирусной репликации, блокируют специфические вирусные ферменты и белки, необходимые для репликации вируса, но не влияющие на метаболизм клетки-хозяина. Наиболее часто антивирусные препараты используются в терапевтических и профилактических целях против герпесвирусов (включая цитомегаловирус), респираторных вирусов, и ВИЧ. Тем не менее, отдельные препараты эффективны против многих типов вирусов, например, лекарства против ВИЧ используются при лечении гепатита В.
Интерфероны высвобождаются из инфицированных вирусов или другими антигенами. Существует много разных интерферонов, проявляющих множественные эффекты, включающие ингибирование трансляции и транскрипции вирусной РНК, прекращение вирусной репликации без нарушения функции клетки хозяина. Интерфероны иногда даются в форме, связанной с полиэтиленгликолем (пегилированные интерфероны), что позволяет добиться пролонгированного эффекта.
Интерферонотерапия применяется для лечения гепатита В и С и папилломавируса человека. Интерфероны показаны для лечения пациентов с хроническими гепатитами В, С в сочетании с нарушением функции печени, определенной вирусной нагрузкой и наличием соответствующей гистологической картины. Интерферон-2в используется для лечения гепатита В в дозе 5 млн ЕД подкожно 1 раз в день или 10 млн ЕД подкожно 3 раза в неделю в течение 16 недель. Лечение усиливает клиренс ДНК вируса гепатита В и нВеАg из плазмы, улучшает функцию печени и гистологическую картину.
Гепатит С лечится рибавирином в сочетании с пегилированными интерферонами-2в в дозе 1,5 мкг/кг подкожно 1 раз в неделю или пегилированным интерфероном-2а 180 мкг подкожно 1 раз в неделю. Лечение позволяет снизить уровень вирусной РНК, улучшить функцию печени и гистологическую картину. Интерферон-п3 внутримышечно или непосредственно в пораженную область используется при лечении остроконечных кандилом гениталий и кожи. Оптимальные схемы и длительность эффекта неизвестны. Изучается эффективность применения рекомбинантных форм эндогенного интерферона альфа при волосатоклеточном лейкозе, саркоме Капоши, вирусе папилломы человека и респираторных вирусах.
Побочные эффекты включают лихорадку, ознобы, миалгии, слабость, начинаются через 7—12 часов после первой инъекции и длятся до 12 часов. Также могут быть депрессия, гепатиты и при использовании высоких доз угнетение костного мозга.
Вакцины и иммуноглобулины.
Вакцины стимулируют природный иммунитет. Используются вирусные вакцины против гриппа, кори, паротита, полиомиелита, бешенства, краснухи, гепатитов В и А, опоясывающего лишая и желтой лихорадки. Доступны вакцины против аденовирусов и ветряной оспы, но их используют только в группах высокого риска (например, у призывников).
Иммуноглобулины применяются для пассивной иммунизации в ограниченном ряде случаев, например, для постэкспозиционной профилактики (гепатит, бешенство). Другие могут быть полезны при лечении заболеваний.
Респираторные вирусы
Вирусные инфекции чаще поражают верхние и нижние отделы дыхательного тракта. Респираторные инфекции могут классифицироваться в соответствии с вызвавшими их вирусами (например, грипп), но обычно используют клиническую синдромную классификацию (например, простудные заболевания, бронхиолит, круп). Хотя отдельным патогенам присущи специфические клинические симптомы (например, риновирус и простуда, респираторно-синцитиальный вирус и бронхиолит), каждый вирус способен привести к практически любому симптому.
Тяжесть вирусной инфекции варьирует в широких пределах, причем тяжелее она протекает у детей и пожилых. Смертность определяется прямыми причинами (зависит от характера вирусной инфекции), а также непрямыми (в результате обострений сопутствующей сердечнососудистой патологии, бактериальной суперинфекции легких, придаточных пазух носа, среднего уха).
Лабораторное исследование патогенов (ПЦР, культуральное исследование, серологические тесты) занимает слишком много времени, для того чтобы быть полезным для конкретного больного, но необходимо для анализа эпидемической ситуации. Более быстрое лабораторное обследование возможно в отношении вирусов гриппа и респираторно-синцитиального вируса, значение этих методов в рутинной практике остается неясным. Диагностика основывается на клинических и эпидемиологических данных.
Лечение
Лечение вирусных респираторных инфекций обычно симптоматическое. Антибактериальные средства неэффективны в отношении вирусов, а профилактика против вторичной бактериальной инфекции не рекомендуется: антибиотики назначаются только при уже присоединившейся бактериальной инфекции. У больных с хронической легочной патологией антибиотики назначаются с меньшими ограничениями. У детей не должен применяться аспирин в связи с высоким риском развития синдрома Рея. У некоторых пациентов с вирусными заболеваниями верхних дыхательных путей кашель сохраняется на протяжении многих недель после выздоровления. Симтомы могут поддаваться воздействию бронходилататоров и глюкокортикоидов.
В некоторых случаях важны антивирусные препараты. Амантадин, ремантадин, оселтамавир и занавир эффективны при гриппе. Рибавирин, аналог гуанозина, ингибирует репликацию РНК и ДНК многих вирусов и может назначаться иммуноскомпрометированным больным с риносинцитиальными поражениями нижнего дыхательного тракта.
Простуда
Это острая вирусная инфекция дыхательных путей, саморазрешающаяся и протекающая обычно без температуры, с воспалением верхних отделов дыхательного тракта, включая ринорею, кашель, першение в горле. Диагноз — клинический. Профилактике помогает тщательное мытье рук. Лечение симптоматическое.
В большинстве случаев (30—50 %) возбудителем является какой-либо из более чем 100 серотипов группы риновирусов. Простуда также вызывается вирусами из группы коронаровирусов, гриппа, парагриппа, респираторно-синцитиальными, особенно у больных, переносящих реинфекцию.
Возбудители простуды имеют связь со временем года, чаще это весна и осень, реже — зима. Риновирусы чаще всего распространяются при прямом контакте с зараженным человеком, но могут передаваться и воздушно-капельным путем.
Для развития инфекции наиболее важно присутствие в сыворотке и секретах нейтрализующих специфичных антител, отражающих прежний контакт с данным возбудителем и обеспечивающих относительный иммунитет. На восприимчивость к простуде не влияют длительность холодовой экспозиции, состояние здоровья и питания человека, патология верхнего дыхательного тракта (например, увеличенные миндалины и аденоиды).
Симптомы и диагностика
Заболевание начинается внезапно после короткого инкубационного периода (24—72 часа) с неприятных ощущений в носу и горле, вслед за чем появляются чиханье, насморк и недомогание. Температура обычно остается нормальной, особенно когда причиной является рино- и короновирус. В первые дни выделения из носа водянистые и обильные, затем становятся более густыми и гнойными; слизисто-гнойный характер этих выделений обусловлен присутствием лейкоцитов (в основном гранулоцитов) и не обязательно вторичной бактериальной инфекцией. Покашливание со скудной мокротой часто продолжается в течение 2 недель. Если нет осложнений, симптомы простуды стихают через 4—10 суток. При хронических заболеваниях дыхательных путей (астма и бронхит) после простуды обычно бывают обострения. Гнойная мокрота и симптомы со стороны нижних дыхательных путей не очень характерны для риновирусной инфекции. Гнойный синусит и воспаление среднего уха обычно являются бактериальными осложнениями, но иногда они связаны с первичной вирусной инфекцией слизистых оболочек.
Диагностика обычно клиническая, без диагностических тестов. Для дифференциальной диагностики наиболее важен аллергический ринит.
Лечение и профилактика
Специфического лечения не существует. Обычно применяют антипиретики и анальгетики, которые снижают лихорадку и уменьшают першение в горле. При заложенности носа применяют деконгестанты. Наиболее эффективны местные назальные декогестанты, но их применение более 3—5 дней может привести к усилению назальных выделений. Для лечения ринореи можно применять ангигистаминные препараты первого поколения, (например, хлорфенирамид) или ипратропиум бромид (интраназально 0,03 % раствор 2—3 раза в день). Эти препараты, однако, должны быть исключены у пожилых и лиц с доброкачественной гиперплазией простаты и лиц с глаукомой. Антигистаминные препараты первого поколения вызывают сонливость, однако препараты второго поколения (без седативного эффекта) не эффективны для лечения простуды.
Цинк, эхинацея, витамин С повсеместно применяются для лечения простуды, но их эффекты не доказаны.
Вакцин нет. Поливалентные бактериальные вакцины, цитрусовые, витамины, ультрафиолет, гликолевые аэрозоли и другие народные средства не предотвращают простуду. Мытье рук и использование поверхостных дезинфектантов снижают распространенность инфекции.
Антибиотики назначают только при присоединении вторичной бактериальной инфекции, исключение составляют больные с хроническими заболеваниями легких.
Парагрипп
Респираторные заболевания, вызываемые несколькими близкородственными вирусами, варьирующие от простуды до гриппоподобных симптомов или пневмонии, а в тяжелой форме при высокой температуре проявляющиеся чаще всего как грипп. Диагноз клинический. Лечение симптоматическое.
Вирусы парагриппа представляют собой РНК-содержащие парамиксовирусы четырех серологически различных типов, обозначаемых 1,2,3 и 4. Эти четыре серотипа вызывают заболевания различной тяжести, но имеют общие антигены. Серотип 4 перекрестно реагирует с антигенными детерминантами вируса эпидемического паротита и иногда может являться причиной респираторного заболевания.
Ограниченные вспышки парагриппа бывают в школах, яслях, детских садах, больницах и других учреждениях. Серотипы 1 и 2 вызывают осенние вспышки заболевания. Заболевание, связанное с серотипом 3, эндемично и высококонтагиозно для детей младше 1 года. Возможно повторное инфицирование, тяжесть последующих инфекций снижается и их распространение ограничивается. Таким образом, у иммунокомпетентных лиц инфекция чаще протекает асимптоматично.Наиболее часто у детей поражается верхний дыхательный тракт с или без небольшой лихорадки.
При поражении вирусом парагриппа типа 1 развивается круп (острый ларинго- трахеобронхит), преимущественно у детей в возрасте 6—36 месяцев. Круп начинается с симптомов простуды, затем присоединяются лихорадка и лающий кашель, охриплость голоса, стридор. Дыхательная недостаточность развивается редко, но может иметь фатальный исход.
Вирус парагриппа типа 3 может быть причиной развития пневмонии и бронхиолита у маленьких детей. Заболевание требует дифференциальной диагностики с респираторно-синцитиальной инфекцией, но часто более слабая.
Специфическая лабораторная диагностика не требуется. Лечение симптоматическое.
Респираторно-синцитиальная и метапневмовирусная инфекция
Респираторно-синцитиальный вирус (РСВ) и человеческий метапневмовирус (ЧМВ) вызывают сезонное поражение нижних отделов респираторного тракта, особенно у маленьких детей. Тяжесть заболевания варьирует от бессимптомного течения до тяжелого, а клинические проявления включают бронхиолит и пневмонию. Диагноз обычно клинический, хотя возможности лабораторного тестирования имеются. Лечение симптоматическое.
РСВ — РНК-овый вирус, классифицируемый как пневмовирус, имеет подгруппы А и В. Человеческий метапневмовирус (ЧМВ), сходный, но отдельный вирус, открыт недавно. РСВ распространен повсеместно, почти все дети инфицируются к 4 годам жизни. Вспышки заболевания происходят обычно зимой или ранней весной. Иммунитет у переболевших нестойкий, поэтому контагиозность доходит до 40 %. И все-таки наличие антител против РСВ снижает тяжесть болезни. Эпидемиологические особенности распространения ЧМВ сходны с РСВ, но выраженность вспышек существенно ниже. РСВ — наиболее частая причина заболеваний нижних отделов респираторного тракта у маленьких детей.
Симптомы и диагностика
Наиболее характерные симптомы — бронхиолит и пневмония. В типичных случаях заболевание начинается с лихорадки, респираторных симптомов, которые прогрессируют: через несколько дней присоединяются одышка, кашель, хрипы. У детей младше 6 месяцев первым симптомом может стать апноэ. У здоровых взрослых и старших детей заболевание обычно протекает бессимптомно или в виде бестемпературной простуды. Тяжелая болезнь развивается у пожилых, иммуноскомпрометированных лиц, страдающих сопутствующей легочной и сердечной патологией.
РСВ (возможно, и ЧМВ) следует заподозрить у маленьких детей с симптомами бронхиолита и пневмонии в сезон, характерный для РСВ. Поскольку антивирусное лечение в целом не рекомендуется, потребности в лабораторной диагностике нет. Последняя полезна для внутрибольничного контроля, что позволяет выделить группы детей, пораженных одним вирусом. Для детей имеются высокочувствительные тесты определения антигенов РСВ; в отношении взрослых они нечувствительны.
Лечение и профилактика
Лечение симптоматическое, включает ингаляции кислорода и гидратационную терапию по необходимости. Глюкокортикоиды и бронходилататоры обычно неэффективны. Антибиотики резервируются для пациентов с продолжающейся лихорадкой и подтвержденной при рентгенологическом исследовании пневмонией. Паливизумаб для лечения неэффективен. Риба- верин, обладающий антивирусной активностью, против РСВ неэффективен или малоэффективен, обладает токсичностью и не рекомендуется для длительного приема, за исключением иммуноскомпрометированных лиц.
Пассивная профилактика моноклональными антителами к РСВ (паливизумаб) снижает частоту госпитализаций в группах подростков высокого риска. Экономически вакцинация оправдана для маленьких детей, которым может понадобиться госпитализация (то есть в возрасте менее 2 лет) с врожденными пороками сердца или хроническими заболеваниями легких, требовавшими медикаментозного лечения в последние 6 месяцев, недоношенные дети (менее 29 недель), которые встретили РСВ-сезон в возрасте менее 1 года, либо рожденные в период 29—32 недели гестации и встретившие РСВ-сезон в возрасте менее 6 месяцев). Доза составляет 15 мг/кг внутримышечно. Первая доза назначается только перед наступлением сезона обострений. Последующие дозы даются с интервалом 1 месяц в течение всего эпидемиологического сезона, обычно 5 доз.
Тяжелый острый респираторный синдром
Предикторами летальных исходов являются возраст старше 60 лет, тяжелая сопутствующая патология, повышение уровня ЛДГ и повышение абсолютного числа нейтрофилов. Лечение ТОРС симптоматическое, при необходимости — механическая вентиляция легких. Озельтамивир, рибавирин и глюкокортикоиды могут быть использованы, но данные об их эффективности отсутствуют.
Больные с подозрением на ТОРС должны быть госпитализированы в бокс с отрицательным внутрибоксовым давлением. Должны быть выполнены все мероприятия по предотвращению передачи инфекции респираторным и контактным путем. Персонал должен носить маски N-95, защитные очки, перчатки, халаты.
Люди, которые контактировали с пациентами с САРС (например, члены семьи, стюардессы, медицинский персонал), должны быть предупреждены о симптомах болезни. При отсутствии симптомов они могут работать, посещать школу и т.д. При появлении лихорадки или респираторных симптомов они должны ограничить свою активность и находиться под медицинским наблюдением. Если симптомы не прогрессируют в сторону ТОРС в течение 72 часов, они могут считаться толерантными.
Источник: http://doctoroff.ru/chto-takoe-virusy
Фаг Т4
Строение бактериофага Т4
Enterobacteria phage T4
Бактериофаг T4 — один из самых изученных вирусов, бактериофаг, поражающий энтеробактерии, в том числе Escherichia coli. Имеет геномную ДНК порядка 169—170 тысяч пар нуклеотидов, упакованную в икосаэдрическую головку. Вирион также имеет ствол, основание ствола и стволовые отростки — шесть длинных и шесть коротких.
Бактериофаг T4 использует ДНК-полимеразу кольцевого типа; его скользящая манжетка является тримером, сходным с PCNA, но она не имеет гомологии ни с PCNA, ни с полимеразой β.
T4 является относительно крупным фагом, имеет диаметр около 90 нм и длину около 200 нм. Фаг T4 использует только литический цикл развития, но не лизогенный.
Источник: http://wp.wiki-wiki.ru/wp/index.php/%D0%A4%D0%B0%D0%B3_%D0%A24
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе