Рисунок канальца костной ткани
Рисунок канальца костной ткани
Скелет метаболически активен и постоянно обновляется, и оба процесса регулируются местными и системными факторами. Среди основных функций скелета выделяют структурные (опора, передвижение, дыхание и защита внутренних органов) и метаболические (хранилище для кальция, фосфора и карбоната; карбонатный костный буфер, связывание токсинов и тяжелых металлов). Тесная структурная связь с гемопоэтической системой определяет совместное использование клеток и локальных регулирующих факторов.При нормальном развитии скелета уже в эмбриональном периоде хрящевая ткань замещается более твердой костной тканью (новообразование кости или моделирование). После рождения рост скелета продолжается, но основная клеточная активность направлена на ремоделирование кости, т.е. перестройку уже имеющейся структуры кости. Вновь сформированная на ранних стадиях равития из мезенхимы кость и кость, образующаяся во время быстрого восстановления, могут иметь относительно дезорганизованную структуру коллагеновых волокон в матриксе. Такая кость называется «тканой» (woven) костью. В то же время все другие кости закладываются организованным способом с последовательными слоями хорошо организованного коллагена и называется пластинчатой костью.
Типы костной ткани.
У взрослого человека различают 2 главных типа кости (рисунок 1):
1. Кортикальная кость (плотная и компактная) составляет внешнюю часть всех скелетных структур. На поперечном срезе компактной кости можно видеть, что она состоит из многочисленных цилиндров, образованных концентрическими костными пластинками, в центре каждого такого цилиндра имеется гаверсов канал, вместе с которым он составляет гаверсову систему или остеон. Через каждый гаверсов канал проходят одна артерия, вена, лимфатический сосуд и нервные волокна. До 80 % скелета состоит из кортикальной кости, главной функцией которой является обеспечение механической силы и защиты, но она может участвовать и в метаболическом ответе при тяжелом или длительном минеральном дефиците.
2. Трабекулярная или губчатая кость находится внутри длинных костей, особенно в концевых частях, в телах позвонков и во внутренних частях таза и в других крупных плоских костях. Она представляет собой сеть из тонких анастомозирующих костных элементов, называемых трабекулами. В ее основном веществе содержится меньше неорганического материала (60-65 %), чем в основном веществе компактной кости. Органическое вещество состоит главным образом из коллагеновых волокон. Пространства между трабекулами заполнены мягким костным мозгом. Трабекулярная кость обеспечивает механическую поддержку, особенно в позвоночнике. Метаболически она более активна, чем кортикальная кость и обеспечивает начальные поставки солей в условиях их острого дефицита.
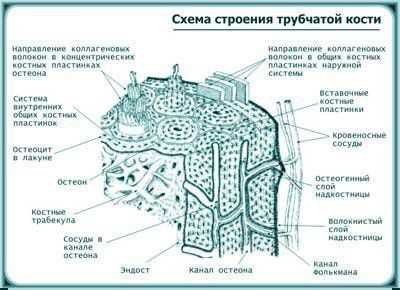
Рисунок 1. Анатомия кости.
Состав кости.
Кость — это обызвествленная соединительная ткань, состоящая из клеток, погруженных в твердое основное вещество. Около 30 % основного вещества составляют органические соединения, преимущественно в форме коллагеновых волокон, а остальные 70 % — неорганические. Главный неорганический компонент кости представлен гидроксиапатитом, т.е. 3[Ca3(PO4)] Ca(OH)2, образованным из кальция и фосфата; но в кости также содержатся в различных количествах натрий, магний, калий, хлор, фтор, карбонат и цитрат.
Костный матрикс.
Органический матрикс в свою очередь состоит из коллагеновых волокон (90-95 %) и основного вещества, которое контролирует отложение солей в кость. Костные соли представлены преимущественно кальцием и фосфатом. Коллагеновые волокна дают кости прочность на разрыв, а соли основного вещества — прочность на сжатие. Коллаген откладывается пластинчатым способом и усилен множественными поперечными связями («прошивками») внутри и между трехспиральными молекулами коллагена (рисунок 2). Эти поперечные связи представляют собой трехвалентные пиридинолины, которые стойки к деградации и высвобождаются во время резорбции кости в свободной или пептидной форме и могут определяться в сыворотке и моче.
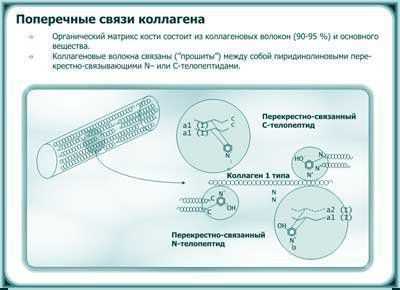
Рисунок 2. Схема коллагеновых поперечных связей в кости. Адаптировано из Eyre D.R., 1996.
Матрикс содержит также неколлагеновые белки, которые важны для регуляции минерализации и укрепления основы коллагена. Кальцийсвязывающие белки включают остеокальцин (костный Gla-протеин) и матриксный Gla-протеин, которые содержат γ-карбоксиглютаминовую кислоту и витамин К зависимы подобно многим факторам свертывающей системы крови. Эти белки могут задерживать минерализацию и позволяют созреть костному матриксу. Даже при том, что остеокальцин является наиболее специфическим белковым продуктом остеобластов, подавление гена остеокальцина не ухудшает рост и минерализацию скелета. Костный сиалопротеин и остеопонтин связываются с кальцием и коллагеном и могут играть роль в процессе прилипания остеокластов к поверхности кости. Неорганическая основа кости представлена кристаллами гидроксиапатита. Эти кристаллы могут содержать карбонат, фторид и различные другие минералы в следовых количествах в зависимости от окружающей среды.
Соли фосфата кальция в костях находятся в 2 формах:
1. Легко обмениваемый пул, который находится в равновесии с внеклеточной жидкостью. Этот запас обеспечивает легкий обмен между костями и внеклеточной жидкостью. Таким образом, если концентрация Ca или фосфата во внеклеточной жидкости увеличивается, соли легко откладываются или, если эти концентрации снижаются, тогда соли легко мобилизуются из этого запаса.
2. Старая структурная кость, где соли фосфата кальция находятся в виде кристаллов гидроксиапатита. Эти кристаллы с трудом мобилизуются или обмениваются с внеклеточной жидкостью и для их мобилизации — резорбции необходим паратгормон.
Клетки костной ткани.
Костные клетки — остеоциты, находятся в лакунах, распределенных по всему основному веществу. Лакуны соединяются между собой тонкими канальцами, содержащими отростки остеоцитов. Через эти канальцы проходят кровеносные сосуды. От каждой лакуны отходит наподобие лучей много тонких канальцев, содержащих цитоплазму (отростки остеоцитов), которые могут соединяться с центральным гаверсовым каналом, с другими лакунами или тянуться от одной костной пластинки к другой.
Остеобласты.
Остеобласты образуются из мезенхимальных стволовых клеток, изначально плюрипотентных, которые могут также дифференцироваться в клетки мышечной, хрящевой и фиброзной ткани, а также в адипоциты. Вероятно имеются клетки предшественники, которые могут далее дифференцироваться только в остеобласты. Эти клетки предшественники остеобластов присутствуют в надкостнице и строме костного мозга.
Как только продукция остеобластами коллагеновых и неколлагеновых белков завершается, некоторые остеобласты внедряются в толщу матрикса и становятся остеоцитами. Остеобласты и остеоциты соединяются друг с другом многими клеточными отростками, которые лежат в канальцах в пределах кости. Этот синцитий взаимосвязанных клеток вероятно важен для ощущения механических сил. Большинство остеобластов либо остается на поверхности кости и рассредоточивается в виде расплющенных клеток, либо подвергается запрограммированной клеточной смерти (апоптозу). Остеобласты сохраняют соединения с остеоцитами, которые могут быть необходимы для передачи сигналов активации во время ремоделирования.
Остеобласты функционально и морфологически гетерогенны. Они имеют рецепторы для факторов (ПТГ, кальцитриол, глюкокортикоиды, половые гормоны, соматотропин и тиреотропин, интерлейкин-1, фактор некроза опухоли альфа, простагландины, инсулиноподобные факторы роста, трансформирующий фактор роста бета, факторы роста фибробластов), которые влияют на ремоделирование кости, и сами продуцируют много регуляторов роста кости.
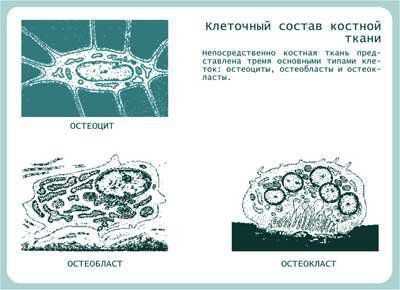
Рисунок 3. Клетки костной ткани. Адаптировано из Афанасьев Ю.И., Елисеев В.Г., 1989.
Остеокласты.
Остеокласты — это крупные многоядерные клетки, которые резорбируют кость, растворяя соли и разрушая матрикс. Активные остеокласты обычно имеют от 2 до 5 ядер, но могут иметь и больше. Они богаты цитоплазмой, имеют множество аппаратов Гольджи и много митохондрий и лизосом. Активно резорбирующие остеокласты крепко прикреплены к кости зоной мембраны, которая относительно лишена субклеточных частиц. Эта область называется «чистой» зоной, хотя лучший термин — зона «изолирования»; так как она как бы герметизирует область действия ферментов. Вторая (внутренняя) зона — наиболее обширная, богатая цитоплазматическими выростами (гофрированная каемка), является областью абсорбции и секреции гидролитических ферментов, где имеет место резорбция кости. В том месте, где остеокласт соприкасается с костным веществом, образуется лакуна. Часто наблюдаются группы остеокластов, которые либо располагаются на поверхности лакун Хоушипа, либо образуют туннели в кортикальной кости, формируя гаверсовы каналы. Продолжительность жизни остеокластов может составлять от 3 до 4 недель, затем они теряют ядро апоптозом и становятся неактивными. Остеокласты связаны с моноцитарно-макрофагальными клетками и образуются из гранулоцит — макрофагальных колониеобразующих единиц. Макрофагальный колониестимулирующий фактор необходим для начала дифференциации остеокластов. Клетки предшественники остеокластов присутствуют в костном мозге, селезенке, и в небольшом количестве в циркуляции. Во время развития предшественники остеокластов вероятно мигрируют в кость из экстрамедуллярных участков гемопоэза.
Ремоделирование кости.
В костной ткани в течение всей жизни человека происходят взаимосвязанные процессы разрушения и созидания, объединяемые термином ремоделирование костной ткани. Цикл ремоделирования кости начинается с активации, опосредованной клетками остеобластного происхождения (рисунок 15). Активация может включать остеоциты, «обкладочные клетки» (отдыхающие остеобласты на поверхности кости), и преостеобласты в костном мозге. Точно ответственные клетки остеобластного происхождения не были полностью определены. Эти клетки подвергаются изменениям формы и секретируют коллагеназу и другие ферменты, которые лизируют белки на поверхности кости; они также выделяют фактор, который назван остеокласт дифференцирующим фактором (ОДФ). Последующий цикл ремоделирования состоит из трех фаз: резорбция, реверсия и формирование (рисунок 4).
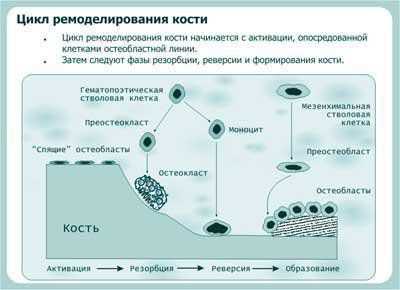
Рисунок 4. Схема ремоделирования кости. Адаптировано из Raisz L.G., 1999.
Резорбция кости.
Резорбция костной ткани связана с активностью остеокластов, которые являются фагоцитами для кости. Энзимы из остеокластов растворяют органический матрикс, а кислоты растворяют костные соли. Остеокласты регулируются ПТГ; увеличение ПТГ вызывает увеличение количества и активности остеокластов, и таким образом, увеличение костной резорбции; снижение ПТГ производит обратный эффект. Постоянный обмен костных солей обеспечивает ремоделирование кости для поддержания прочности ее на протяжении жизни. Остеокластическая резорбция per se может начинаться с миграции частично дифференцированных мононуклеарных преостеобластов к поверхности кости, которые затем сливаются с образованием крупных многоядерных остеокластов, которые требуются для резорбции кости. Остеокласты удаляют минералы и матрикс до ограниченной глубины на трабекулярной поверхности или в пределах кортикальной кости; в результате пластинки остеона разрушаются и на его месте образуется полость. Пока неясно, что останавливает этот процесс, но вероятно могут вовлекаться высокие местные концентрации кальция или веществ, высвобождаемых из матрикса.
Реверсия кости.
После завершения остеокластической резорбции имеется фаза реверсии, во время которой мононуклеарные клетки (МК), возможно моноцитарно/макрофагального происхождения, появляются на поверхности кости. Эти клетки готовят поверхность для новых остеобластов, чтобы начать образование кости ( остеогенез ). Слой богатого гликопротеидами вещества откладывается на резорбированной поверхности, так называемая «цементирующая линия», к которой могут приклеиваться новые остеобласты. Остеопонтин может быть ключевым белком в этом процессе. Клетки на месте реверсирования могут также обеспечивать сигналы для дифференциации и миграции остеобластов.
Образование кости.
Фаза формирования продолжается до полного замещения резорбированной кости и пока полностью не сформируется новая костная структурная единица. Когда эта фаза завершена, поверхность покрывается сглаженными выравнивающими клетками, и имеется длительный период отдыха с небольшой клеточной деятельностью на поверхности кости, пока новый цикл ремоделирования не начинается. Основные этапы образования кости представлены ниже:
Шаги кальцификации кости.
— Остеокласты секретируют молекулы коллагена и основного вещества.
— Молекулы коллагена образуют коллагеновые волокна, называемые остеоидом.
— Остеобласты секретируют энзим — щелочную фосфатазу (ЩФ), которая увеличивает локальную концентрацию фосфата, активирует коллагеновые волокна, вызывая отложение солей фосфата кальция.
— Соли фосфата кальция преципитируют на коллагеновых волокнах и окончательно становятся кристаллами гидроксиапатита.
Стадии цикла моделирования имеют различную продолжительность. Резорбция вероятно продолжается приблизительно две недели. Фаза реверсии может длиться до четырех или пяти недель, в то время как фаза формирования может продолжаться в течение четырех месяцев до тех пор пока новая структурная единица полностью не сформируется.
Регуляция функции костных клеток.
В норме процессы отложения и резорбции солей находятся в равновесии, и костная масса остается постоянной. Обычно процессы ремоделирования оккупируют 10-15 % поверхности кости. ПТГ является одним из важнейших факторов, влияющих на количество участков ремоделирования и может увеличивать оборот кости в 7-10 раз, увеличивая поверхность ремоделирования до 100 % всей поверхности кости.
Существует как системная, так и местная регуляция функции костной клетки. Главные системные регуляторы — кальций регулирующие гормоны, ПТГ и кальцитриол; в меньшей степени кальцитонин. Другие системные гормоны также оказывают влияние на скелет, особенно соматотропин, глюкокортикоиды, гормоны щитовидной железы и половые гормоны. Более того, некоторые факторы, такие как ИПФР, имеют, и системные и местные эффекты, а другие имеют главным образом или исключительно местные эффекты, особенно простагландины, ТФР-БЕТА, отдельные морфогенные белки, и цитокины.
Паратгормон (ПТГ) — наиболее важный регулятор гомеостаза кальция. Он поддерживает сывороточную концентрацию кальция, стимулируя резорбцию кости остеокластами, увеличивая почечную канальцевую реабсорбцию кальция, и увеличивая почечную продукцию кальцитриола. ПТГ также стимулирует экспрессию генов и увеличивает производство нескольких местных факторов, включая ИЛ-6, ИФР-1 и ИФР-связывающегоглобулина, IGF-BP-5, и простагландинов.
Кальцитриол — увеличивает кишечную абсорбцию кальция и фосфатов, таким образом поддерживая минерализацию кости. В высоких концентрациях, при условиях дефицита кальция и фосфора, он также стимулирует резорбцию кости, таким образом помогая поддерживать поставку этих ионов к другим тканям. Кальцитриол стимулирует остеокластогенез в культурах клеток, но животные, испытывающие недостаток витамина Д, имеют относительно нормальный рост костей и ремоделирование во время своего развития.
Кальцитонин — ингибирует остеокласты и поэтому резорбцию костей в фармакологических дозах. Однако, его физиологическая роль минимальна. Его эффекты являются преходящими, вероятно из-за сниженной регуляции рецепторов. В результате, он только кратковременно эффективен для коррекции гиперкальцемии из-за чрезмерной резорбции кости.
Соматотропин и ИФР — Системы Ст/ИФР-1 и ИФР-2 важны для роста скелета, особенно роста конечной пластинки хряща и эндохондрального остеогенеза . Действия ИФР определяются в частности наличием различных IGF-BP: IGF-BP-3 — главная детерминанта сывороточных концентраций ИФР, в то время как IGF-BP-5 может облегчать, а IGF-BP-4 может ингибировать локальные действия ИФР.
Глюкокортикоиды — имеют и стимулирующие, и подавляющие эффекты на клетки кости. Они важны для дифференцировки остеобластов, и они сенсибилизируют костные клетки к регуляторам ремоделирования кости, включая ИФР-1 и ПТГ. Ингибиция остеогенеза — главная причина индуцированного глюкокортикоидами остеопороза. Гормоны щитовидной железы — стимулируют и резорбцию, и формирование кости.
Таким образом, оборот кости увеличивается при гипертиреозе и могут происходить потери кости.
Половые гормоны — оказывают глубокое влияние на кость. Эстрогены влияют на развитие скелета как у мужчин, так и у женщин. В позднем пубертатном периоде эстрогены уменьшают оборот кости, ингибируя резорбцию кости; они необходимы для эпифизарного закрытия у юношей и девушек. Таким образом, мужчины с генетической потерей эстрогеновых рецепторов или фермента ароматазы, который преобразует андрогены в эстрогены, имеют задержку развития кости и остеопороз, и запаздывание эпифизарного закрытия. Многие местные факторы также находятся под влиянием эстрогенов, включая цитокины и простагландины. Андрогены могут стимулировать остеогенез как прямо, так и посредством их влияния на примыкающие мышечные ткани.
Цитокины — Как описано выше, цитокины, продуцируемые костными клетками и прилегающими гематопоэтическими и сосудистыми клетками, имеют множественные регулирующие эффекты на скелет. Многие из этих факторов вовлечены в потери кости, связанные с овариэктомией у грызунов. Регулирование может происходить в результате изменяющегося производства агонистов и изменений рецепторов или связывающих белков (антагонисты рецептора) для этих факторов.
Другие — Множество других факторов играет важную роль в метаболизме кости:
— Простагландины, лейкотриены и окись азота могут быть важны в быстрых ответах клеток кости на воспаление и механические силы. Простагландины имеют бифазные эффекты на резорбцию и образование кости, но доминирующими эффектами in vivo является стимуляция. Образование простагландинов может увеличиваться под влиянием нагрузки и воспалительных цитокинов. Окись азота может ингибировать функцию остеокластов, в то время как лейкотриены стимулируют резорбцию кости.
— ТФР-бета и семейство костных морфогенных белков, состоящее, по крайней мере, из десяти белков, которые продуцируются множеством различных клеток, и которые оказывают множественное влияние на рост и развитие. ТФР-бета может регулироваться эстрадиолом и может замедлять резорбцию кости и стимулировать остеогенез. Костные морфогенный белок — 2 и другие члены этого семейства увеличивают дифференциацию остеобластов и остеогенез, когда вводятся подкожно или внутримышечно.
Факторы роста фибробластов — другое семейство белков, вовлеченных в развитие скелета. Мутации рецепторов для этих факторов приводят к патологическим скелетным фенотипам, таким как ахондроплазия. В костной ткани образуются другие факторы роста, такие как эндотелиальный фактор роста, который может играть роль в ремоделировании кости.
Лашутин С.В., 27.05.01 г.
Строение костной ткани рисунок
Скелет метаболически активен и постоянно обновляется, и оба процесса регулируются местными и системными факторами. Среди основных функций скелета выделяют структурные (опора, передвижение, дыхание и защита внутренних органов) и метаболические (хранилище для кальция, фосфора и карбоната; карбонатный костный буфер, связывание токсинов и тяжелых металлов). Тесная структурная связь с гемопоэтической системой определяет совместное использование клеток и локальных регулирующих факторов.При нормальном развитии скелета уже в эмбриональном периоде хрящевая ткань замещается более твердой костной тканью (новообразование кости или моделирование). После рождения рост скелета продолжается, но основная клеточная активность направлена на ремоделирование кости, т.е. перестройку уже имеющейся структуры кости. Вновь сформированная на ранних стадиях равития из мезенхимы кость и кость, образующаяся во время быстрого восстановления, могут иметь относительно дезорганизованную структуру коллагеновых волокон в матриксе. Такая кость называется «тканой» (woven) костью. В то же время все другие кости закладываются организованным способом с последовательными слоями хорошо организованного коллагена и называется пластинчатой костью.
Типы костной ткани.
У взрослого человека различают 2 главных типа кости (рисунок 1):
1. Кортикальная кость (плотная и компактная) составляет внешнюю часть всех скелетных структур. На поперечном срезе компактной кости можно видеть, что она состоит из многочисленных цилиндров, образованных концентрическими костными пластинками, в центре каждого такого цилиндра имеется гаверсов канал, вместе с которым он составляет гаверсову систему или остеон. Через каждый гаверсов канал проходят одна артерия, вена, лимфатический сосуд и нервные волокна. До 80 % скелета состоит из кортикальной кости, главной функцией которой является обеспечение механической силы и защиты, но она может участвовать и в метаболическом ответе при тяжелом или длительном минеральном дефиците.
2. Трабекулярная или губчатая кость находится внутри длинных костей, особенно в концевых частях, в телах позвонков и во внутренних частях таза и в других крупных плоских костях. Она представляет собой сеть из тонких анастомозирующих костных элементов, называемых трабекулами. В ее основном веществе содержится меньше неорганического материала (60-65 %), чем в основном веществе компактной кости. Органическое вещество состоит главным образом из коллагеновых волокон. Пространства между трабекулами заполнены мягким костным мозгом. Трабекулярная кость обеспечивает механическую поддержку, особенно в позвоночнике. Метаболически она более активна, чем кортикальная кость и обеспечивает начальные поставки солей в условиях их острого дефицита.

Рисунок 1. Анатомия кости.
Состав кости.
Кость — это обызвествленная соединительная ткань, состоящая из клеток, погруженных в твердое основное вещество. Около 30 % основного вещества составляют органические соединения, преимущественно в форме коллагеновых волокон, а остальные 70 % — неорганические. Главный неорганический компонент кости представлен гидроксиапатитом, т.е. 3[Ca3(PO4)] Ca(OH)2, образованным из кальция и фосфата; но в кости также содержатся в различных количествах натрий, магний, калий, хлор, фтор, карбонат и цитрат.
Костный матрикс.
Органический матрикс в свою очередь состоит из коллагеновых волокон (90-95 %) и основного вещества, которое контролирует отложение солей в кость. Костные соли представлены преимущественно кальцием и фосфатом. Коллагеновые волокна дают кости прочность на разрыв, а соли основного вещества — прочность на сжатие. Коллаген откладывается пластинчатым способом и усилен множественными поперечными связями («прошивками») внутри и между трехспиральными молекулами коллагена (рисунок 2). Эти поперечные связи представляют собой трехвалентные пиридинолины, которые стойки к деградации и высвобождаются во время резорбции кости в свободной или пептидной форме и могут определяться в сыворотке и моче.

Рисунок 2. Схема коллагеновых поперечных связей в кости. Адаптировано из Eyre D.R., 1996.
Матрикс содержит также неколлагеновые белки, которые важны для регуляции минерализации и укрепления основы коллагена. Кальцийсвязывающие белки включают остеокальцин (костный Gla-протеин) и матриксный Gla-протеин, которые содержат γ-карбоксиглютаминовую кислоту и витамин К зависимы подобно многим факторам свертывающей системы крови. Эти белки могут задерживать минерализацию и позволяют созреть костному матриксу. Даже при том, что остеокальцин является наиболее специфическим белковым продуктом остеобластов, подавление гена остеокальцина не ухудшает рост и минерализацию скелета. Костный сиалопротеин и остеопонтин связываются с кальцием и коллагеном и могут играть роль в процессе прилипания остеокластов к поверхности кости. Неорганическая основа кости представлена кристаллами гидроксиапатита. Эти кристаллы могут содержать карбонат, фторид и различные другие минералы в следовых количествах в зависимости от окружающей среды.
Соли фосфата кальция в костях находятся в 2 формах:
1. Легко обмениваемый пул, который находится в равновесии с внеклеточной жидкостью. Этот запас обеспечивает легкий обмен между костями и внеклеточной жидкостью. Таким образом, если концентрация Ca или фосфата во внеклеточной жидкости увеличивается, соли легко откладываются или, если эти концентрации снижаются, тогда соли легко мобилизуются из этого запаса.
2. Старая структурная кость, где соли фосфата кальция находятся в виде кристаллов гидроксиапатита. Эти кристаллы с трудом мобилизуются или обмениваются с внеклеточной жидкостью и для их мобилизации — резорбции необходим паратгормон.
Клетки костной ткани.
Костные клетки — остеоциты, находятся в лакунах, распределенных по всему основному веществу. Лакуны соединяются между собой тонкими канальцами, содержащими отростки остеоцитов. Через эти канальцы проходят кровеносные сосуды. От каждой лакуны отходит наподобие лучей много тонких канальцев, содержащих цитоплазму (отростки остеоцитов), которые могут соединяться с центральным гаверсовым каналом, с другими лакунами или тянуться от одной костной пластинки к другой.
Остеобласты.
Остеобласты образуются из мезенхимальных стволовых клеток, изначально плюрипотентных, которые могут также дифференцироваться в клетки мышечной, хрящевой и фиброзной ткани, а также в адипоциты. Вероятно имеются клетки предшественники, которые могут далее дифференцироваться только в остеобласты. Эти клетки предшественники остеобластов присутствуют в надкостнице и строме костного мозга.
Как только продукция остеобластами коллагеновых и неколлагеновых белков завершается, некоторые остеобласты внедряются в толщу матрикса и становятся остеоцитами. Остеобласты и остеоциты соединяются друг с другом многими клеточными отростками, которые лежат в канальцах в пределах кости. Этот синцитий взаимосвязанных клеток вероятно важен для ощущения механических сил. Большинство остеобластов либо остается на поверхности кости и рассредоточивается в виде расплющенных клеток, либо подвергается запрограммированной клеточной смерти (апоптозу). Остеобласты сохраняют соединения с остеоцитами, которые могут быть необходимы для передачи сигналов активации во время ремоделирования.
Остеобласты функционально и морфологически гетерогенны. Они имеют рецепторы для факторов (ПТГ, кальцитриол, глюкокортикоиды, половые гормоны, соматотропин и тиреотропин, интерлейкин-1, фактор некроза опухоли альфа, простагландины, инсулиноподобные факторы роста, трансформирующий фактор роста бета, факторы роста фибробластов), которые влияют на ремоделирование кости, и сами продуцируют много регуляторов роста кости.

Рисунок 3. Клетки костной ткани. Адаптировано из Афанасьев Ю.И., Елисеев В.Г., 1989.
Остеокласты.
Остеокласты — это крупные многоядерные клетки, которые резорбируют кость, растворяя соли и разрушая матрикс. Активные остеокласты обычно имеют от 2 до 5 ядер, но могут иметь и больше. Они богаты цитоплазмой, имеют множество аппаратов Гольджи и много митохондрий и лизосом. Активно резорбирующие остеокласты крепко прикреплены к кости зоной мембраны, которая относительно лишена субклеточных частиц. Эта область называется «чистой» зоной, хотя лучший термин — зона «изолирования»; так как она как бы герметизирует область действия ферментов. Вторая (внутренняя) зона — наиболее обширная, богатая цитоплазматическими выростами (гофрированная каемка), является областью абсорбции и секреции гидролитических ферментов, где имеет место резорбция кости. В том месте, где остеокласт соприкасается с костным веществом, образуется лакуна. Часто наблюдаются группы остеокластов, которые либо располагаются на поверхности лакун Хоушипа, либо образуют туннели в кортикальной кости, формируя гаверсовы каналы. Продолжительность жизни остеокластов может составлять от 3 до 4 недель, затем они теряют ядро апоптозом и становятся неактивными. Остеокласты связаны с моноцитарно-макрофагальными клетками и образуются из гранулоцит — макрофагальных колониеобразующих единиц. Макрофагальный колониестимулирующий фактор необходим для начала дифференциации остеокластов. Клетки предшественники остеокластов присутствуют в костном мозге, селезенке, и в небольшом количестве в циркуляции. Во время развития предшественники остеокластов вероятно мигрируют в кость из экстрамедуллярных участков гемопоэза.
Ремоделирование кости.
В костной ткани в течение всей жизни человека происходят взаимосвязанные процессы разрушения и созидания, объединяемые термином ремоделирование костной ткани. Цикл ремоделирования кости начинается с активации, опосредованной клетками остеобластного происхождения (рисунок 15). Активация может включать остеоциты, «обкладочные клетки» (отдыхающие остеобласты на поверхности кости), и преостеобласты в костном мозге. Точно ответственные клетки остеобластного происхождения не были полностью определены. Эти клетки подвергаются изменениям формы и секретируют коллагеназу и другие ферменты, которые лизируют белки на поверхности кости; они также выделяют фактор, который назван остеокласт дифференцирующим фактором (ОДФ). Последующий цикл ремоделирования состоит из трех фаз: резорбция, реверсия и формирование (рисунок 4).

Рисунок 4. Схема ремоделирования кости. Адаптировано из Raisz L.G., 1999.
Резорбция кости.
Резорбция костной ткани связана с активностью остеокластов, которые являются фагоцитами для кости. Энзимы из остеокластов растворяют органический матрикс, а кислоты растворяют костные соли. Остеокласты регулируются ПТГ; увеличение ПТГ вызывает увеличение количества и активности остеокластов, и таким образом, увеличение костной резорбции; снижение ПТГ производит обратный эффект. Постоянный обмен костных солей обеспечивает ремоделирование кости для поддержания прочности ее на протяжении жизни. Остеокластическая резорбция per se может начинаться с миграции частично дифференцированных мононуклеарных преостеобластов к поверхности кости, которые затем сливаются с образованием крупных многоядерных остеокластов, которые требуются для резорбции кости. Остеокласты удаляют минералы и матрикс до ограниченной глубины на трабекулярной поверхности или в пределах кортикальной кости; в результате пластинки остеона разрушаются и на его месте образуется полость. Пока неясно, что останавливает этот процесс, но вероятно могут вовлекаться высокие местные концентрации кальция или веществ, высвобождаемых из матрикса.
Реверсия кости.
После завершения остеокластической резорбции имеется фаза реверсии, во время которой мононуклеарные клетки (МК), возможно моноцитарно/макрофагального происхождения, появляются на поверхности кости. Эти клетки готовят поверхность для новых остеобластов, чтобы начать образование кости ( остеогенез ). Слой богатого гликопротеидами вещества откладывается на резорбированной поверхности, так называемая «цементирующая линия», к которой могут приклеиваться новые остеобласты. Остеопонтин может быть ключевым белком в этом процессе. Клетки на месте реверсирования могут также обеспечивать сигналы для дифференциации и миграции остеобластов.
Образование кости.
Фаза формирования продолжается до полного замещения резорбированной кости и пока полностью не сформируется новая костная структурная единица. Когда эта фаза завершена, поверхность покрывается сглаженными выравнивающими клетками, и имеется длительный период отдыха с небольшой клеточной деятельностью на поверхности кости, пока новый цикл ремоделирования не начинается. Основные этапы образования кости представлены ниже:
Шаги кальцификации кости.
— Остеокласты секретируют молекулы коллагена и основного вещества.
— Молекулы коллагена образуют коллагеновые волокна, называемые остеоидом.
— Остеобласты секретируют энзим — щелочную фосфатазу (ЩФ), которая увеличивает локальную концентрацию фосфата, активирует коллагеновые волокна, вызывая отложение солей фосфата кальция.
— Соли фосфата кальция преципитируют на коллагеновых волокнах и окончательно становятся кристаллами гидроксиапатита.
Стадии цикла моделирования имеют различную продолжительность. Резорбция вероятно продолжается приблизительно две недели. Фаза реверсии может длиться до четырех или пяти недель, в то время как фаза формирования может продолжаться в течение четырех месяцев до тех пор пока новая структурная единица полностью не сформируется.
Регуляция функции костных клеток.
В норме процессы отложения и резорбции солей находятся в равновесии, и костная масса остается постоянной. Обычно процессы ремоделирования оккупируют 10-15 % поверхности кости. ПТГ является одним из важнейших факторов, влияющих на количество участков ремоделирования и может увеличивать оборот кости в 7-10 раз, увеличивая поверхность ремоделирования до 100 % всей поверхности кости.
Существует как системная, так и местная регуляция функции костной клетки. Главные системные регуляторы — кальций регулирующие гормоны, ПТГ и кальцитриол; в меньшей степени кальцитонин. Другие системные гормоны также оказывают влияние на скелет, особенно соматотропин, глюкокортикоиды, гормоны щитовидной железы и половые гормоны. Более того, некоторые факторы, такие как ИПФР, имеют, и системные и местные эффекты, а другие имеют главным образом или исключительно местные эффекты, особенно простагландины, ТФР-БЕТА, отдельные морфогенные белки, и цитокины.
Паратгормон (ПТГ) — наиболее важный регулятор гомеостаза кальция. Он поддерживает сывороточную концентрацию кальция, стимулируя резорбцию кости остеокластами, увеличивая почечную канальцевую реабсорбцию кальция, и увеличивая почечную продукцию кальцитриола. ПТГ также стимулирует экспрессию генов и увеличивает производство нескольких местных факторов, включая ИЛ-6, ИФР-1 и ИФР-связывающегоглобулина, IGF-BP-5, и простагландинов.
Кальцитриол — увеличивает кишечную абсорбцию кальция и фосфатов, таким образом поддерживая минерализацию кости. В высоких концентрациях, при условиях дефицита кальция и фосфора, он также стимулирует резорбцию кости, таким образом помогая поддерживать поставку этих ионов к другим тканям. Кальцитриол стимулирует остеокластогенез в культурах клеток, но животные, испытывающие недостаток витамина Д, имеют относительно нормальный рост костей и ремоделирование во время своего развития.
Кальцитонин — ингибирует остеокласты и поэтому резорбцию костей в фармакологических дозах. Однако, его физиологическая роль минимальна. Его эффекты являются преходящими, вероятно из-за сниженной регуляции рецепторов. В результате, он только кратковременно эффективен для коррекции гиперкальцемии из-за чрезмерной резорбции кости.
Соматотропин и ИФР — Системы Ст/ИФР-1 и ИФР-2 важны для роста скелета, особенно роста конечной пластинки хряща и эндохондрального остеогенеза . Действия ИФР определяются в частности наличием различных IGF-BP: IGF-BP-3 — главная детерминанта сывороточных концентраций ИФР, в то время как IGF-BP-5 может облегчать, а IGF-BP-4 может ингибировать локальные действия ИФР.
Глюкокортикоиды — имеют и стимулирующие, и подавляющие эффекты на клетки кости. Они важны для дифференцировки остеобластов, и они сенсибилизируют костные клетки к регуляторам ремоделирования кости, включая ИФР-1 и ПТГ. Ингибиция остеогенеза — главная причина индуцированного глюкокортикоидами остеопороза. Гормоны щитовидной железы — стимулируют и резорбцию, и формирование кости.
Таким образом, оборот кости увеличивается при гипертиреозе и могут происходить потери кости.
Половые гормоны — оказывают глубокое влияние на кость. Эстрогены влияют на развитие скелета как у мужчин, так и у женщин. В позднем пубертатном периоде эстрогены уменьшают оборот кости, ингибируя резорбцию кости; они необходимы для эпифизарного закрытия у юношей и девушек. Таким образом, мужчины с генетической потерей эстрогеновых рецепторов или фермента ароматазы, который преобразует андрогены в эстрогены, имеют задержку развития кости и остеопороз, и запаздывание эпифизарного закрытия. Многие местные факторы также находятся под влиянием эстрогенов, включая цитокины и простагландины. Андрогены могут стимулировать остеогенез как прямо, так и посредством их влияния на примыкающие мышечные ткани.
Цитокины — Как описано выше, цитокины, продуцируемые костными клетками и прилегающими гематопоэтическими и сосудистыми клетками, имеют множественные регулирующие эффекты на скелет. Многие из этих факторов вовлечены в потери кости, связанные с овариэктомией у грызунов. Регулирование может происходить в результате изменяющегося производства агонистов и изменений рецепторов или связывающих белков (антагонисты рецептора) для этих факторов.
Другие — Множество других факторов играет важную роль в метаболизме кости:
— Простагландины, лейкотриены и окись азота могут быть важны в быстрых ответах клеток кости на воспаление и механические силы. Простагландины имеют бифазные эффекты на резорбцию и образование кости, но доминирующими эффектами in vivo является стимуляция. Образование простагландинов может увеличиваться под влиянием нагрузки и воспалительных цитокинов. Окись азота может ингибировать функцию остеокластов, в то время как лейкотриены стимулируют резорбцию кости.
— ТФР-бета и семейство костных морфогенных белков, состоящее, по крайней мере, из десяти белков, которые продуцируются множеством различных клеток, и которые оказывают множественное влияние на рост и развитие. ТФР-бета может регулироваться эстрадиолом и может замедлять резорбцию кости и стимулировать остеогенез. Костные морфогенный белок — 2 и другие члены этого семейства увеличивают дифференциацию остеобластов и остеогенез, когда вводятся подкожно или внутримышечно.
Факторы роста фибробластов — другое семейство белков, вовлеченных в развитие скелета. Мутации рецепторов для этих факторов приводят к патологическим скелетным фенотипам, таким как ахондроплазия. В костной ткани образуются другие факторы роста, такие как эндотелиальный фактор роста, который может играть роль в ремоделировании кости.
Лашутин С.В., 27.05.01 г.
Костная ткань рисунок
Скелет метаболически активен и постоянно обновляется, и оба процесса регулируются местными и системными факторами. Среди основных функций скелета выделяют структурные (опора, передвижение, дыхание и защита внутренних органов) и метаболические (хранилище для кальция, фосфора и карбоната; карбонатный костный буфер, связывание токсинов и тяжелых металлов). Тесная структурная связь с гемопоэтической системой определяет совместное использование клеток и локальных регулирующих факторов.При нормальном развитии скелета уже в эмбриональном периоде хрящевая ткань замещается более твердой костной тканью (новообразование кости или моделирование). После рождения рост скелета продолжается, но основная клеточная активность направлена на ремоделирование кости, т.е. перестройку уже имеющейся структуры кости. Вновь сформированная на ранних стадиях равития из мезенхимы кость и кость, образующаяся во время быстрого восстановления, могут иметь относительно дезорганизованную структуру коллагеновых волокон в матриксе. Такая кость называется «тканой» (woven) костью. В то же время все другие кости закладываются организованным способом с последовательными слоями хорошо организованного коллагена и называется пластинчатой костью.
Типы костной ткани.
У взрослого человека различают 2 главных типа кости (рисунок 1):
1. Кортикальная кость (плотная и компактная) составляет внешнюю часть всех скелетных структур. На поперечном срезе компактной кости можно видеть, что она состоит из многочисленных цилиндров, образованных концентрическими костными пластинками, в центре каждого такого цилиндра имеется гаверсов канал, вместе с которым он составляет гаверсову систему или остеон. Через каждый гаверсов канал проходят одна артерия, вена, лимфатический сосуд и нервные волокна. До 80 % скелета состоит из кортикальной кости, главной функцией которой является обеспечение механической силы и защиты, но она может участвовать и в метаболическом ответе при тяжелом или длительном минеральном дефиците.
2. Трабекулярная или губчатая кость находится внутри длинных костей, особенно в концевых частях, в телах позвонков и во внутренних частях таза и в других крупных плоских костях. Она представляет собой сеть из тонких анастомозирующих костных элементов, называемых трабекулами. В ее основном веществе содержится меньше неорганического материала (60-65 %), чем в основном веществе компактной кости. Органическое вещество состоит главным образом из коллагеновых волокон. Пространства между трабекулами заполнены мягким костным мозгом. Трабекулярная кость обеспечивает механическую поддержку, особенно в позвоночнике. Метаболически она более активна, чем кортикальная кость и обеспечивает начальные поставки солей в условиях их острого дефицита.

Рисунок 1. Анатомия кости.
Состав кости.
Кость — это обызвествленная соединительная ткань, состоящая из клеток, погруженных в твердое основное вещество. Около 30 % основного вещества составляют органические соединения, преимущественно в форме коллагеновых волокон, а остальные 70 % — неорганические. Главный неорганический компонент кости представлен гидроксиапатитом, т.е. 3[Ca3(PO4)] Ca(OH)2, образованным из кальция и фосфата; но в кости также содержатся в различных количествах натрий, магний, калий, хлор, фтор, карбонат и цитрат.
Костный матрикс.
Органический матрикс в свою очередь состоит из коллагеновых волокон (90-95 %) и основного вещества, которое контролирует отложение солей в кость. Костные соли представлены преимущественно кальцием и фосфатом. Коллагеновые волокна дают кости прочность на разрыв, а соли основного вещества — прочность на сжатие. Коллаген откладывается пластинчатым способом и усилен множественными поперечными связями («прошивками») внутри и между трехспиральными молекулами коллагена (рисунок 2). Эти поперечные связи представляют собой трехвалентные пиридинолины, которые стойки к деградации и высвобождаются во время резорбции кости в свободной или пептидной форме и могут определяться в сыворотке и моче.

Рисунок 2. Схема коллагеновых поперечных связей в кости. Адаптировано из Eyre D.R., 1996.
Матрикс содержит также неколлагеновые белки, которые важны для регуляции минерализации и укрепления основы коллагена. Кальцийсвязывающие белки включают остеокальцин (костный Gla-протеин) и матриксный Gla-протеин, которые содержат γ-карбоксиглютаминовую кислоту и витамин К зависимы подобно многим факторам свертывающей системы крови. Эти белки могут задерживать минерализацию и позволяют созреть костному матриксу. Даже при том, что остеокальцин является наиболее специфическим белковым продуктом остеобластов, подавление гена остеокальцина не ухудшает рост и минерализацию скелета. Костный сиалопротеин и остеопонтин связываются с кальцием и коллагеном и могут играть роль в процессе прилипания остеокластов к поверхности кости. Неорганическая основа кости представлена кристаллами гидроксиапатита. Эти кристаллы могут содержать карбонат, фторид и различные другие минералы в следовых количествах в зависимости от окружающей среды.
Соли фосфата кальция в костях находятся в 2 формах:
1. Легко обмениваемый пул, который находится в равновесии с внеклеточной жидкостью. Этот запас обеспечивает легкий обмен между костями и внеклеточной жидкостью. Таким образом, если концентрация Ca или фосфата во внеклеточной жидкости увеличивается, соли легко откладываются или, если эти концентрации снижаются, тогда соли легко мобилизуются из этого запаса.
2. Старая структурная кость, где соли фосфата кальция находятся в виде кристаллов гидроксиапатита. Эти кристаллы с трудом мобилизуются или обмениваются с внеклеточной жидкостью и для их мобилизации — резорбции необходим паратгормон.
Клетки костной ткани.
Костные клетки — остеоциты, находятся в лакунах, распределенных по всему основному веществу. Лакуны соединяются между собой тонкими канальцами, содержащими отростки остеоцитов. Через эти канальцы проходят кровеносные сосуды. От каждой лакуны отходит наподобие лучей много тонких канальцев, содержащих цитоплазму (отростки остеоцитов), которые могут соединяться с центральным гаверсовым каналом, с другими лакунами или тянуться от одной костной пластинки к другой.
Остеобласты.
Остеобласты образуются из мезенхимальных стволовых клеток, изначально плюрипотентных, которые могут также дифференцироваться в клетки мышечной, хрящевой и фиброзной ткани, а также в адипоциты. Вероятно имеются клетки предшественники, которые могут далее дифференцироваться только в остеобласты. Эти клетки предшественники остеобластов присутствуют в надкостнице и строме костного мозга.
Как только продукция остеобластами коллагеновых и неколлагеновых белков завершается, некоторые остеобласты внедряются в толщу матрикса и становятся остеоцитами. Остеобласты и остеоциты соединяются друг с другом многими клеточными отростками, которые лежат в канальцах в пределах кости. Этот синцитий взаимосвязанных клеток вероятно важен для ощущения механических сил. Большинство остеобластов либо остается на поверхности кости и рассредоточивается в виде расплющенных клеток, либо подвергается запрограммированной клеточной смерти (апоптозу). Остеобласты сохраняют соединения с остеоцитами, которые могут быть необходимы для передачи сигналов активации во время ремоделирования.
Остеобласты функционально и морфологически гетерогенны. Они имеют рецепторы для факторов (ПТГ, кальцитриол, глюкокортикоиды, половые гормоны, соматотропин и тиреотропин, интерлейкин-1, фактор некроза опухоли альфа, простагландины, инсулиноподобные факторы роста, трансформирующий фактор роста бета, факторы роста фибробластов), которые влияют на ремоделирование кости, и сами продуцируют много регуляторов роста кости.

Рисунок 3. Клетки костной ткани. Адаптировано из Афанасьев Ю.И., Елисеев В.Г., 1989.
Остеокласты.
Остеокласты — это крупные многоядерные клетки, которые резорбируют кость, растворяя соли и разрушая матрикс. Активные остеокласты обычно имеют от 2 до 5 ядер, но могут иметь и больше. Они богаты цитоплазмой, имеют множество аппаратов Гольджи и много митохондрий и лизосом. Активно резорбирующие остеокласты крепко прикреплены к кости зоной мембраны, которая относительно лишена субклеточных частиц. Эта область называется «чистой» зоной, хотя лучший термин — зона «изолирования»; так как она как бы герметизирует область действия ферментов. Вторая (внутренняя) зона — наиболее обширная, богатая цитоплазматическими выростами (гофрированная каемка), является областью абсорбции и секреции гидролитических ферментов, где имеет место резорбция кости. В том месте, где остеокласт соприкасается с костным веществом, образуется лакуна. Часто наблюдаются группы остеокластов, которые либо располагаются на поверхности лакун Хоушипа, либо образуют туннели в кортикальной кости, формируя гаверсовы каналы. Продолжительность жизни остеокластов может составлять от 3 до 4 недель, затем они теряют ядро апоптозом и становятся неактивными. Остеокласты связаны с моноцитарно-макрофагальными клетками и образуются из гранулоцит — макрофагальных колониеобразующих единиц. Макрофагальный колониестимулирующий фактор необходим для начала дифференциации остеокластов. Клетки предшественники остеокластов присутствуют в костном мозге, селезенке, и в небольшом количестве в циркуляции. Во время развития предшественники остеокластов вероятно мигрируют в кость из экстрамедуллярных участков гемопоэза.
Ремоделирование кости.
В костной ткани в течение всей жизни человека происходят взаимосвязанные процессы разрушения и созидания, объединяемые термином ремоделирование костной ткани. Цикл ремоделирования кости начинается с активации, опосредованной клетками остеобластного происхождения (рисунок 15). Активация может включать остеоциты, «обкладочные клетки» (отдыхающие остеобласты на поверхности кости), и преостеобласты в костном мозге. Точно ответственные клетки остеобластного происхождения не были полностью определены. Эти клетки подвергаются изменениям формы и секретируют коллагеназу и другие ферменты, которые лизируют белки на поверхности кости; они также выделяют фактор, который назван остеокласт дифференцирующим фактором (ОДФ). Последующий цикл ремоделирования состоит из трех фаз: резорбция, реверсия и формирование (рисунок 4).

Рисунок 4. Схема ремоделирования кости. Адаптировано из Raisz L.G., 1999.
Резорбция кости.
Резорбция костной ткани связана с активностью остеокластов, которые являются фагоцитами для кости. Энзимы из остеокластов растворяют органический матрикс, а кислоты растворяют костные соли. Остеокласты регулируются ПТГ; увеличение ПТГ вызывает увеличение количества и активности остеокластов, и таким образом, увеличение костной резорбции; снижение ПТГ производит обратный эффект. Постоянный обмен костных солей обеспечивает ремоделирование кости для поддержания прочности ее на протяжении жизни. Остеокластическая резорбция per se может начинаться с миграции частично дифференцированных мононуклеарных преостеобластов к поверхности кости, которые затем сливаются с образованием крупных многоядерных остеокластов, которые требуются для резорбции кости. Остеокласты удаляют минералы и матрикс до ограниченной глубины на трабекулярной поверхности или в пределах кортикальной кости; в результате пластинки остеона разрушаются и на его месте образуется полость. Пока неясно, что останавливает этот процесс, но вероятно могут вовлекаться высокие местные концентрации кальция или веществ, высвобождаемых из матрикса.
Реверсия кости.
После завершения остеокластической резорбции имеется фаза реверсии, во время которой мононуклеарные клетки (МК), возможно моноцитарно/макрофагального происхождения, появляются на поверхности кости. Эти клетки готовят поверхность для новых остеобластов, чтобы начать образование кости ( остеогенез ). Слой богатого гликопротеидами вещества откладывается на резорбированной поверхности, так называемая «цементирующая линия», к которой могут приклеиваться новые остеобласты. Остеопонтин может быть ключевым белком в этом процессе. Клетки на месте реверсирования могут также обеспечивать сигналы для дифференциации и миграции остеобластов.
Образование кости.
Фаза формирования продолжается до полного замещения резорбированной кости и пока полностью не сформируется новая костная структурная единица. Когда эта фаза завершена, поверхность покрывается сглаженными выравнивающими клетками, и имеется длительный период отдыха с небольшой клеточной деятельностью на поверхности кости, пока новый цикл ремоделирования не начинается. Основные этапы образования кости представлены ниже:
Шаги кальцификации кости.
— Остеокласты секретируют молекулы коллагена и основного вещества.
— Молекулы коллагена образуют коллагеновые волокна, называемые остеоидом.
— Остеобласты секретируют энзим — щелочную фосфатазу (ЩФ), которая увеличивает локальную концентрацию фосфата, активирует коллагеновые волокна, вызывая отложение солей фосфата кальция.
— Соли фосфата кальция преципитируют на коллагеновых волокнах и окончательно становятся кристаллами гидроксиапатита.
Стадии цикла моделирования имеют различную продолжительность. Резорбция вероятно продолжается приблизительно две недели. Фаза реверсии может длиться до четырех или пяти недель, в то время как фаза формирования может продолжаться в течение четырех месяцев до тех пор пока новая структурная единица полностью не сформируется.
Регуляция функции костных клеток.
В норме процессы отложения и резорбции солей находятся в равновесии, и костная масса остается постоянной. Обычно процессы ремоделирования оккупируют 10-15 % поверхности кости. ПТГ является одним из важнейших факторов, влияющих на количество участков ремоделирования и может увеличивать оборот кости в 7-10 раз, увеличивая поверхность ремоделирования до 100 % всей поверхности кости.
Существует как системная, так и местная регуляция функции костной клетки. Главные системные регуляторы — кальций регулирующие гормоны, ПТГ и кальцитриол; в меньшей степени кальцитонин. Другие системные гормоны также оказывают влияние на скелет, особенно соматотропин, глюкокортикоиды, гормоны щитовидной железы и половые гормоны. Более того, некоторые факторы, такие как ИПФР, имеют, и системные и местные эффекты, а другие имеют главным образом или исключительно местные эффекты, особенно простагландины, ТФР-БЕТА, отдельные морфогенные белки, и цитокины.
Паратгормон (ПТГ) — наиболее важный регулятор гомеостаза кальция. Он поддерживает сывороточную концентрацию кальция, стимулируя резорбцию кости остеокластами, увеличивая почечную канальцевую реабсорбцию кальция, и увеличивая почечную продукцию кальцитриола. ПТГ также стимулирует экспрессию генов и увеличивает производство нескольких местных факторов, включая ИЛ-6, ИФР-1 и ИФР-связывающегоглобулина, IGF-BP-5, и простагландинов.
Кальцитриол — увеличивает кишечную абсорбцию кальция и фосфатов, таким образом поддерживая минерализацию кости. В высоких концентрациях, при условиях дефицита кальция и фосфора, он также стимулирует резорбцию кости, таким образом помогая поддерживать поставку этих ионов к другим тканям. Кальцитриол стимулирует остеокластогенез в культурах клеток, но животные, испытывающие недостаток витамина Д, имеют относительно нормальный рост костей и ремоделирование во время своего развития.
Кальцитонин — ингибирует остеокласты и поэтому резорбцию костей в фармакологических дозах. Однако, его физиологическая роль минимальна. Его эффекты являются преходящими, вероятно из-за сниженной регуляции рецепторов. В результате, он только кратковременно эффективен для коррекции гиперкальцемии из-за чрезмерной резорбции кости.
Соматотропин и ИФР — Системы Ст/ИФР-1 и ИФР-2 важны для роста скелета, особенно роста конечной пластинки хряща и эндохондрального остеогенеза . Действия ИФР определяются в частности наличием различных IGF-BP: IGF-BP-3 — главная детерминанта сывороточных концентраций ИФР, в то время как IGF-BP-5 может облегчать, а IGF-BP-4 может ингибировать локальные действия ИФР.
Глюкокортикоиды — имеют и стимулирующие, и подавляющие эффекты на клетки кости. Они важны для дифференцировки остеобластов, и они сенсибилизируют костные клетки к регуляторам ремоделирования кости, включая ИФР-1 и ПТГ. Ингибиция остеогенеза — главная причина индуцированного глюкокортикоидами остеопороза. Гормоны щитовидной железы — стимулируют и резорбцию, и формирование кости.
Таким образом, оборот кости увеличивается при гипертиреозе и могут происходить потери кости.
Половые гормоны — оказывают глубокое влияние на кость. Эстрогены влияют на развитие скелета как у мужчин, так и у женщин. В позднем пубертатном периоде эстрогены уменьшают оборот кости, ингибируя резорбцию кости; они необходимы для эпифизарного закрытия у юношей и девушек. Таким образом, мужчины с генетической потерей эстрогеновых рецепторов или фермента ароматазы, который преобразует андрогены в эстрогены, имеют задержку развития кости и остеопороз, и запаздывание эпифизарного закрытия. Многие местные факторы также находятся под влиянием эстрогенов, включая цитокины и простагландины. Андрогены могут стимулировать остеогенез как прямо, так и посредством их влияния на примыкающие мышечные ткани.
Цитокины — Как описано выше, цитокины, продуцируемые костными клетками и прилегающими гематопоэтическими и сосудистыми клетками, имеют множественные регулирующие эффекты на скелет. Многие из этих факторов вовлечены в потери кости, связанные с овариэктомией у грызунов. Регулирование может происходить в результате изменяющегося производства агонистов и изменений рецепторов или связывающих белков (антагонисты рецептора) для этих факторов.
Другие — Множество других факторов играет важную роль в метаболизме кости:
— Простагландины, лейкотриены и окись азота могут быть важны в быстрых ответах клеток кости на воспаление и механические силы. Простагландины имеют бифазные эффекты на резорбцию и образование кости, но доминирующими эффектами in vivo является стимуляция. Образование простагландинов может увеличиваться под влиянием нагрузки и воспалительных цитокинов. Окись азота может ингибировать функцию остеокластов, в то время как лейкотриены стимулируют резорбцию кости.
— ТФР-бета и семейство костных морфогенных белков, состоящее, по крайней мере, из десяти белков, которые продуцируются множеством различных клеток, и которые оказывают множественное влияние на рост и развитие. ТФР-бета может регулироваться эстрадиолом и может замедлять резорбцию кости и стимулировать остеогенез. Костные морфогенный белок — 2 и другие члены этого семейства увеличивают дифференциацию остеобластов и остеогенез, когда вводятся подкожно или внутримышечно.
Факторы роста фибробластов — другое семейство белков, вовлеченных в развитие скелета. Мутации рецепторов для этих факторов приводят к патологическим скелетным фенотипам, таким как ахондроплазия. В костной ткани образуются другие факторы роста, такие как эндотелиальный фактор роста, который может играть роль в ремоделировании кости.
Лашутин С.В., 27.05.01 г.
Соединительная ткань костная рисунок
Образование Тк. Дендритные АПК и зараженные вирусами или опухолевые клетки-мишени подвергают процессингу эндогенные АГ и экспрессируют их на своей поверхности в виде комплекса ЭАГ/МНС I. Тк (CD8+) связываются с этим комплексом посредством ТКР и молекулы CD8 (двойное иммунное распознавание). Последующие активация, БТП и дифференцировка Тк требуют помощи со стороны Тх1, выделяющих соответствующие цитокины. Активированные Тк выделяют цитокины и уничтожают клетки-мишени, распознавая комплекс АГ/МНС I на их поверхности (не показано), прикрепляясь к ним и выделяя цитотоксические вещества, накопленные в цитоплазматических гранулах. Часть Тк превращаются в ТкП.
ГУМОРАЛЬНЫЙ ИММУНИТЕТ. В-лимфоциты специфически связывают экзогенные АГ с помощью поверхностных иммуноглобулиновых рецепторов, поглощают их, подвергают процессингу и экспрессируют на своей поверхности в виде комплекса ЭАГ/МНС II. Тх2 (CD4+) связываются с этим комплексом посредством ТКР и молекулы CD4 (двойное иммунное распознавание), выделяя цитокины, которые активируют В-лимфоциты, стимулируют их БТП и дифференцировку вплазматические клетки, секретирующие иммуноглобулины (антитела). При воздействии АГ формируются также В-клетки памяти.
Представленная схема соответствует антиген-зависимому этапу лимфоцитопоэза

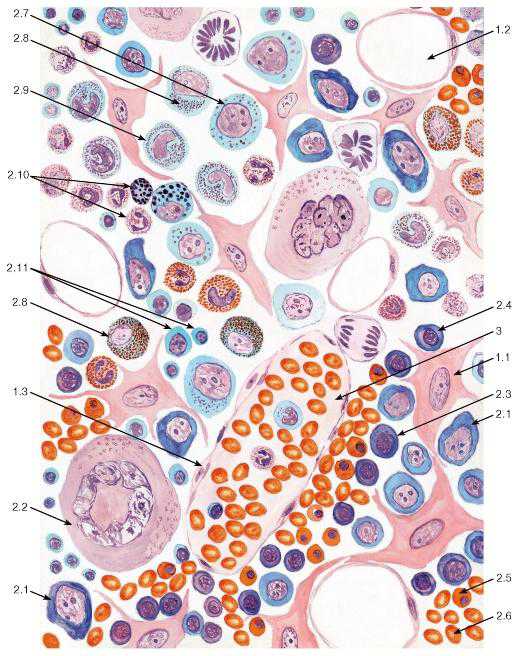
Рис. 68. Миелоидная ткань (красный костный мозг)
Окраска: азур II-эозин
1 — клетки стромы: 1.1 — ретикулярная клетка, 1.2 — жировая клетка (адипоцит), 1.3 — макрофаг; 2 — гемопоэтические клетки: 2.1 — бластные формы, 2.2 — мегакариоцит, 2.3 — эритробласт базофильный, 2.4 — эритробласт полихроматофильный, 2.5 — эритробласт ортохроматофильный, 2.6 — зрелый эритроцит, 2.7 — промиелоцит, 2.8 — миелоцит, 2.9 — метамиелоцит (юный), 2.10 — зрелые гранулоциты, 2.11 — лимфоциты; 3 — синусоид, содержащий зрелые форменные элементы крови
Волокнистые соединительные ткани
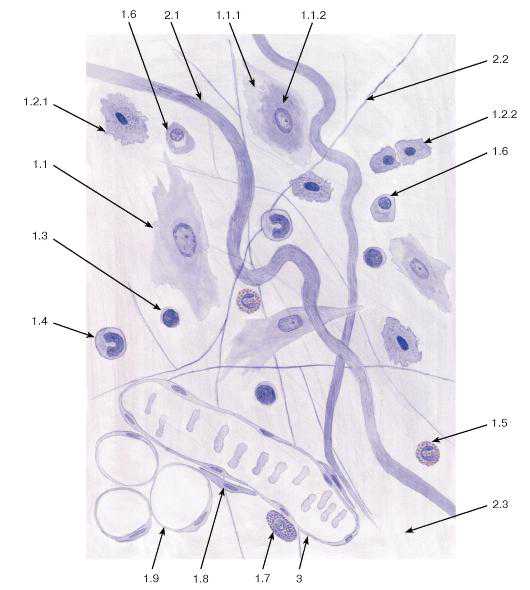
Рис. 69. Рыхлая волокнистая соединительная ткань (пленочный препарат)
Окраска: железный гематоксилин
1 — клетки: 1.1 — фибробласт, 1.1.1 — эктоплазма, 1.1.2 — эндоплазма, 1.2 — гистиоцит (макрофаг), 1.2.1 — активированный гистиоцит, 1.2.2 — неактивные гистиоциты, 1.3 — лимфоцит, 1.4 — моноцит, 1.5 — эозинофил, 1.6 — плазмоцит, 1.7 — тучная клетка, 1.8 — адвентициальная клетка, 1.9 — адипоцит;
2 — межклеточное вещество: 2.1 — коллагеновое волокно, 2.2 — эластическое волокно, 2.3 — основное (аморфное) вещество; 3 — кровеносный сосуд
Рис. 70. Ультраструктурная организация клеток соединительной ткани
Рисунки с ЭМФ
А — фибробласт; Б — гистиоцит; В — тучная клетка
1 — ядро: 1.1 — ядрышко; 2 — цитоплазма: 2.1 — цистерна гранулярной эндоплазматической сети, 2.2 — комплекс Гольджи, 2.3 — митохондрии, 2.4 — лизосомы, 2.5 — фаголизосомы, 2.6 — секреторные гранулы, 2.7 — отростки
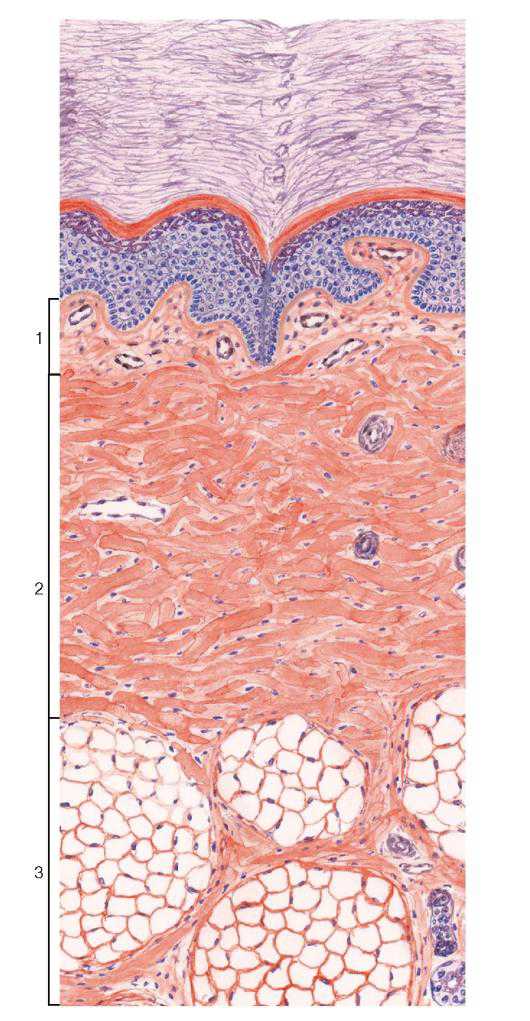
Рис. 71. Различные виды соединительных тканей (кожа пальца)
Окраска: гематоксилин-эозин
1 — рыхлая волокнистая соединительная ткань; 2 — плотная волокнистая неоформленная соединительная ткань; 3 — жировая ткань
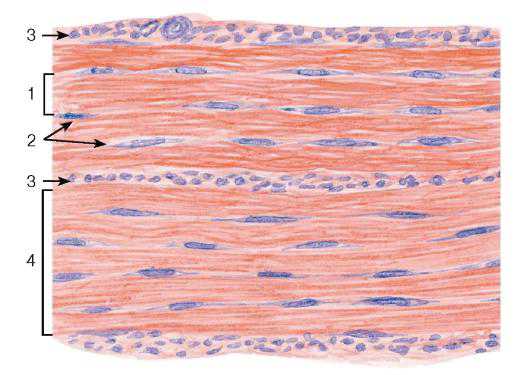
Рис. 72. Плотная волокнистая оформленная соединительная ткань (сухожилие, продольный срез)
Окраска: гематоксилин-эозин
1 — первичный сухожильный пучок; 2 — сухожильные клетки (фиброциты); 3 — эндотендиний; 4 — вторичный сухожильный пучок
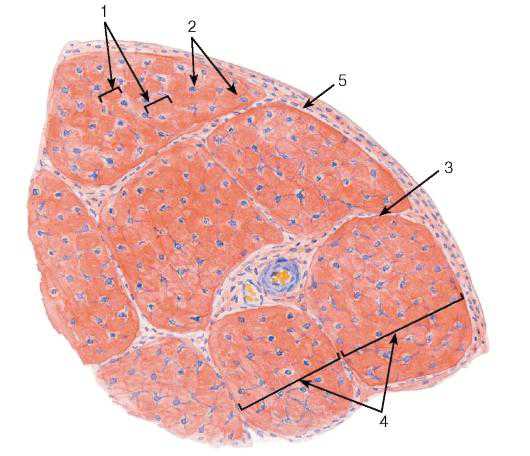
Рис. 73. Плотная волокнистая оформленная соединительная ткань (сухожилие, поперечный срез)
Окраска: гематоксилин-эозин
1 — первичные сухожильные пучки; 2 — сухожильные клетки (фиброциты); 3 — эндотендиний; 4 — вторичные сухожильные пучки; 5 — перитендиний
Скелетные соединительные ткани
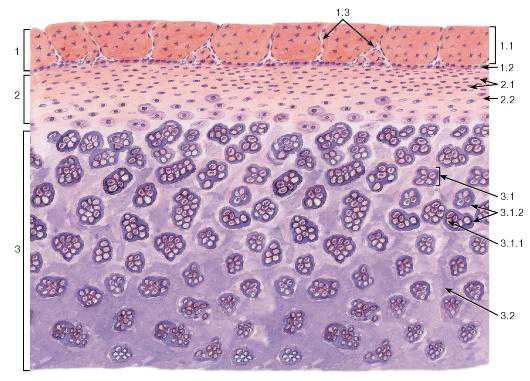
Рис. 74. Гиалиновая хрящевая ткань (участок гиалинового хряща)
Окраска: гематоксилин-эозин
1 — надхрящница: 1.1 — наружный фиброзный слой, 1.2 — внутренний (хондрогенный) клеточный слой, 1.3 — кровеносные сосуды; 2 — зона молодого хряща: 2.1 — хондроциты, 2.2 — межклеточное вещество (хрящевой матрикс); 3 — зона зрелого хряща: 3.1 — клеточная территория, 3.1.1 — изогенная группа хондроцитов, 3.1.2 — территориальный матрикс, 3.2 — интертерриториальный матрикс
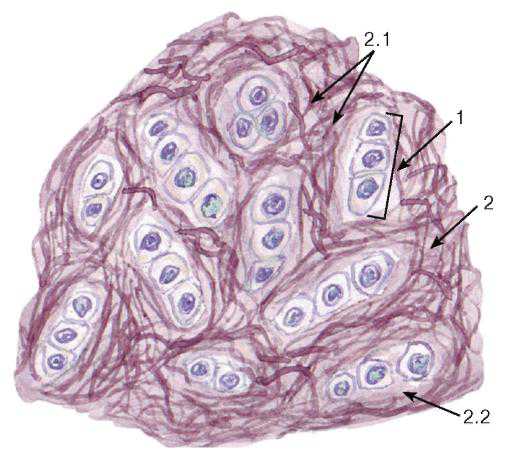
Рис. 75. Эластическая хрящевая ткань (участок эластического хряща)
Окраска: орсеин-гематоксилин
1 — изогенная группа хондроцитов; 2 — межклеточное вещество (хрящевой матрикс): 2.1 — эластические волокна, 2.2 — основное вещество
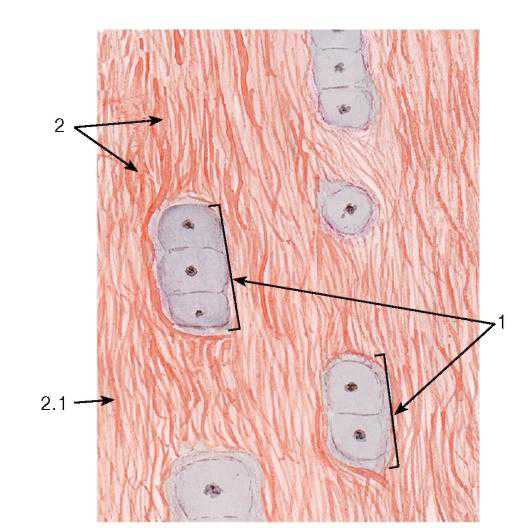
Рис. 76. Волокнистая (фиброзная) хрящевая ткань (участок волокнистого хряща)
Окраска: гематоксилин-эозин
1 — изогенные группы хондроцитов; 2 — межклеточное вещество (хрящевой матрикс): 2.1 — коллагеновые волокна
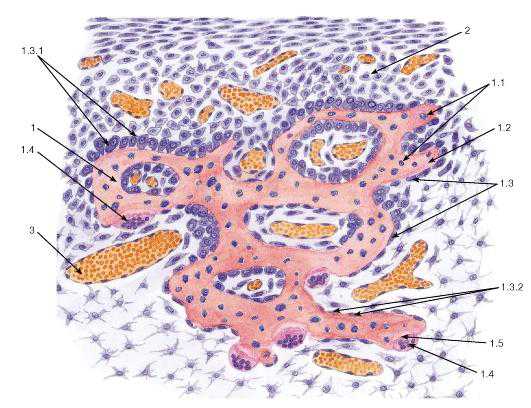
Рис. 77. Развитие костной ткани непосредственно из мезенхимы (прямой остеогенез)
Окраска: гематоксилин-эозин
1 — костная трабекула: 1.1 — лакуны остеоцитов, 1.2 — обызвествленное межклеточное вещество, 1.3 — остеобласты, 1.3.1 — активные остеобласты, 1.3.2 — неактивные остеобласты, 1.4 — остеокласты, 1.5 — эрозионная лакуна; 2 — клетки остеогенной (дифференцирующейся из мезенхимы) соединительной ткани; 3 — кровеносный сосуд
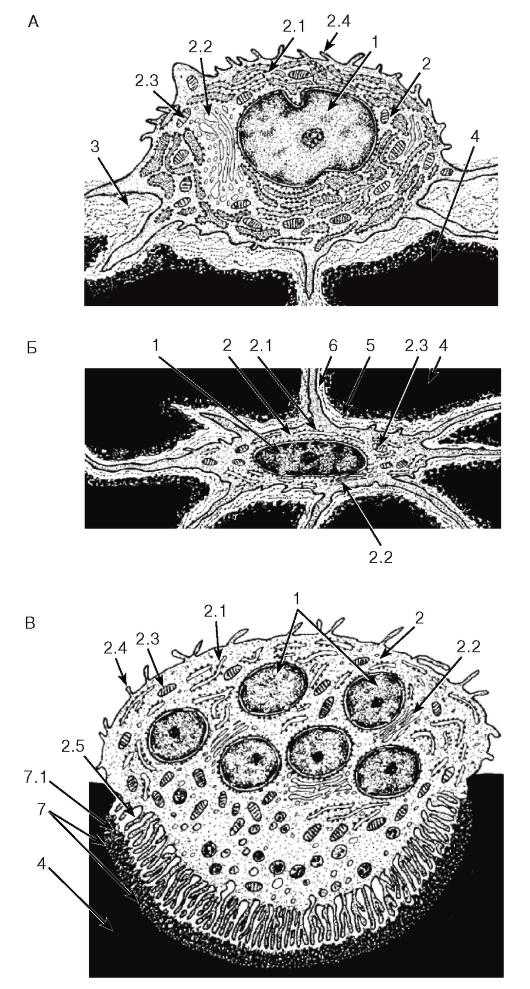
Рис. 78. Ультраструктурная организация клеток костной ткани
Рисунки с ЭМФ
А — остеобласт; Б — остеоцит; В — остеокласт
1 — ядро (ядра); 2 — цитоплазма: 2.1 — цистерны гранулярной эндоплазматической сети, 2.2 — комплекс Гольджи, 2.3 — митохондрии, 2.4 — микроворсинки, 2.5 — микроскладчатая кайма (цитоплазматические отростки); 3 — остеоид; 4 — обызвествленное межклеточное вещество; 5 — лакуна остеоцита (содержит тело клетки); 6 — костные канальцы с отростками остеоцита; 7 — эрозионная лакуна: 7.1 — эрозионный фронт
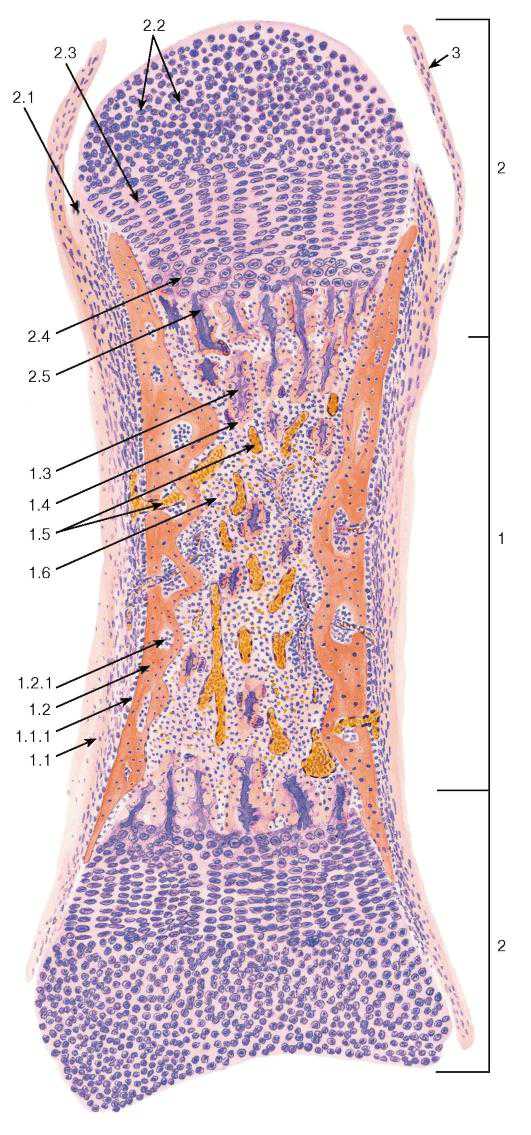
Рис. 79. Развитие кости на месте хряща (непрямой остеогенез)
Окраска: гематоксилин-эозин
1 — диафиз: 1.1 — надкостница, 1.1.1 — осте огенный слой (внутренний слой надкостницы), 1.2 — перихондральное костное кольцо, 1.2.1 — отверстие, 1.3 — остатки обызвествленного хряща, 1.4 — эндохондральная кость, 1.5 — кровеносные сосуды, 1.6 — формирующийся костный мозг; 2 — эпифизы: 2.1 — надхрящница, 2.2 — зона покоя, 2.3 — зона пролиферации (с колонками хондроцитов), 2.4 — зона гипертрофии, 2.5 — зона кальцификации; 3 — суставная сумка
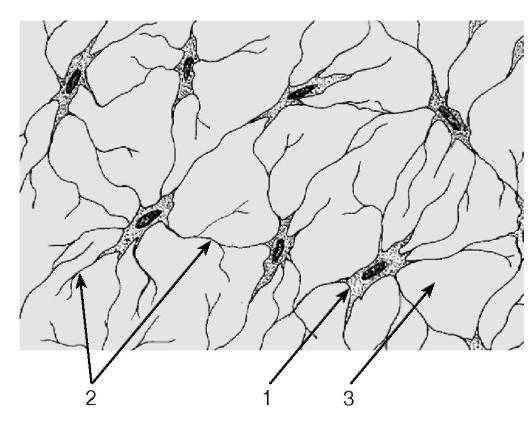
Рис. 80. Грубоволокнистая костная ткань (тотальный плоскостной препарат)
Не окрашен
1 — лакуна остеоцита (место расположения тела клетки); 2 — костные канальцы (содержащие отростки остеоцитов); 3 — межклеточное вещество
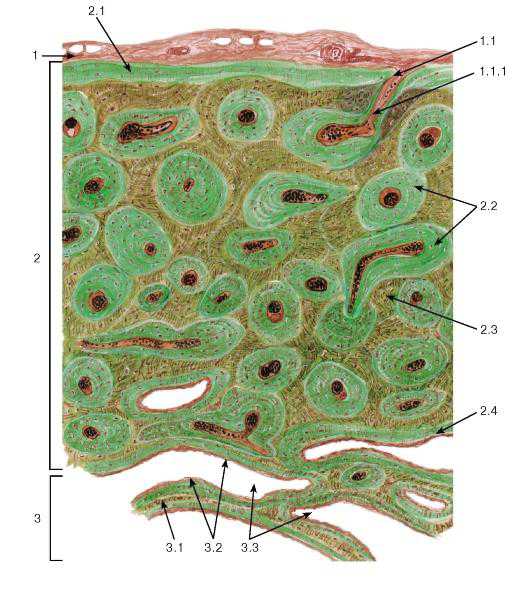
Рис. 81. Пластинчатая костная ткань (поперечный срез диафиза декальцинированной трубчатой кости)
Окраска: тионин-пикриновая кислота
1 — надкостница: 1.1 — перфорирующий (фолькмановский) канал, 1.1.1 — кровеносный сосуд;
2 — компактное вещество кости: 2.1 — наружные опоясывающие пластинки, 2.2 — остеоны, 2.3 — интерстициальные пластинки, 2.4 — внутренние опоясывающие пластинки; 3 — губчатое вещество кости: 3.1 — костные трабекулы, 3.2 — эндост, 3.3 — межтрабекулярные пространства
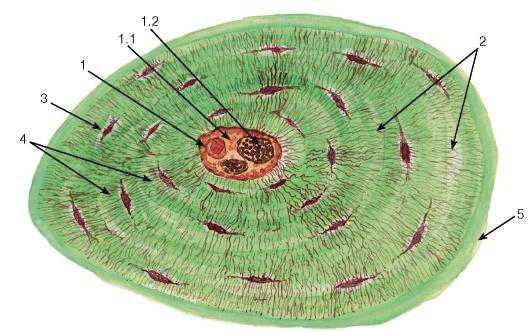
Рис. 82. Поперечный срез остеона
(диафиз декальцинированной трубчатой кости)
Окраска: тионин-пикриновая кислота
1 — канал остеона: 1.1 — соединительная ткань, 1.2 — кровеносные сосуды; 2 — концентрические костные пластинки; 3 — лакуна остеоцита, содержащее его тело; 4 — костные канальцы с отростками остеоцитов; 5 — цементирующая линия
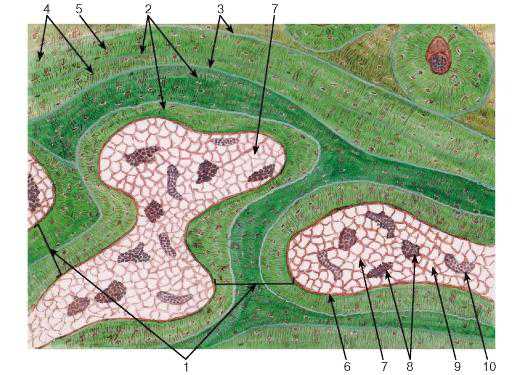
Рис. 83. Пластинчатая костная ткань. Участок губчатого вещества (диафиз декальцинированной трубчатой кости)
Окраска: тионин-пикриновая кислота
1 — костные трабекулы; 2 — пакеты костных пластинок; 3 — цементирующие линии; 4 — лакуны остеоцитов, содержащие их тела; 5 — костные канальцы с отростками остеоцитов; 6 — эндост; 7 — межтрабекулярные пространства; 8 — костный мозг; 9 — жировая ткань; 10 — кровеносный сосуд
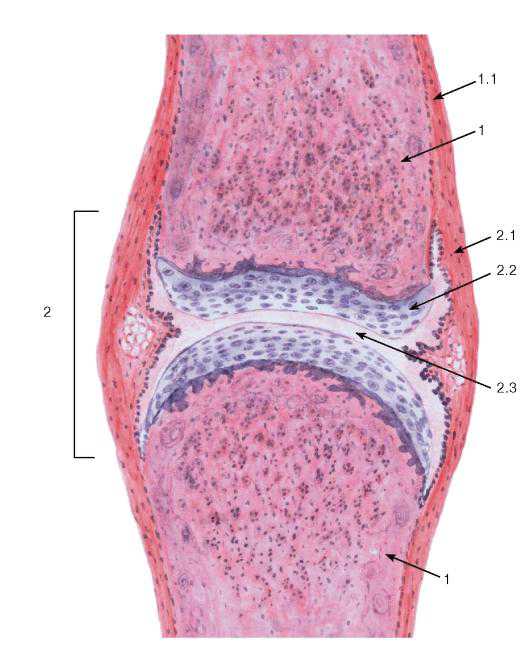
Рис. 84. Синовиальное соединение (сустав). Общий вид
Окраска: гематоксилин-эозин
1 — кость: 1.1 — надкостница; 2 — синовиальное соединение (сустав): 2.1 — суставная капсула (сумка), 2.2 — суставной хрящ (гиалиновый), 2.3 — суставная полость (содержит синовиальную жидкость)
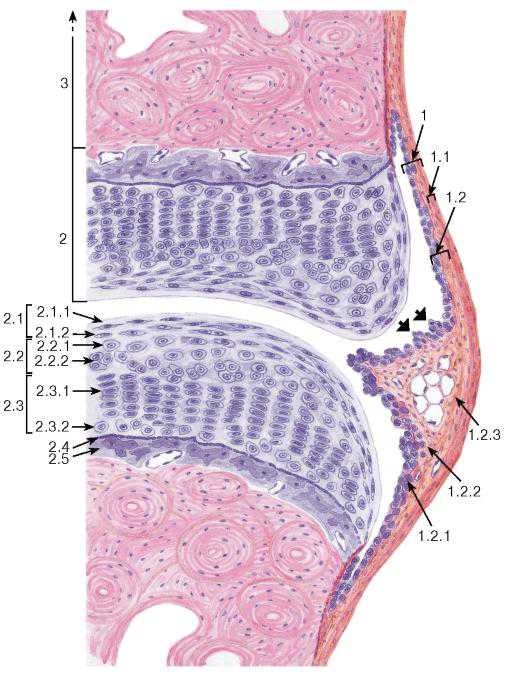
Рис. 85. Участок синовиального соединения (сустава)
Окраска: гематоксилин-эозин
1 — суставная капсула (сумка): 1.1 — волокнистый слой, 1.2 — синовиальный слой, образующий синовиальные ворсинки (показаны жирными стрелками),1.2.1 — синовиальная интима (синовиоциты), 1.2.2 — глубокая часть субинтимального фиброваскулярного слоя, 1.2.3 — поверхностная часть субинтимального фиброваскулярного слоя; 2 — суставной хрящ (гиалиновый): 2.1 — тангенциальная зона, 2.1.1 — бесклеточная пластинка, 2.1.2 — уплощенные хондроциты, 2.2 — промежуточная зона, 2.2.1 — округлые хондроциты, 2.2.2 — изогенные группы хондроцитов, 2.3 — радиальная зона, 2.3.1 — колонки хондроцитов, 2.3.2 — слой гипертрофированных (дистрофически измененных) хондроцитов, 2.4 — пограничная линия (фронт минерализации), 2.5 — кальцифицированный гиалиновыйхрящ; 3 — субхондральная костная ткань
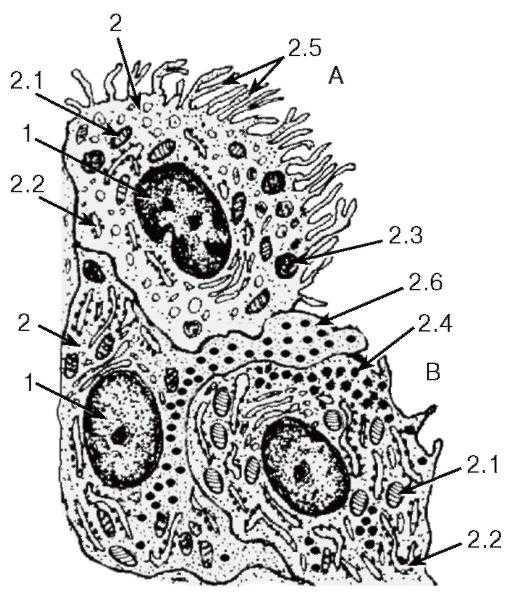
Рис. 86. Ультраструктурная организация синовиальных клеток (синовиоцитов)
Рисунок с ЭМФ
A — синовиоцит A (фагоцитирующая синовиальная клетка);
B — синовиоциты В (секреторные синовиальные клетки):
1 — ядро, 2 — цитоплазма: 2.1 — митохондрии, 2.2 — цистерны гранулярной эндоплазматической сети, 2.3 — лизосомы, 2.4 — секреторные гранулы, 2.5 — микроворсинки, 2.6 — цитоплазматический отросток
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе