Рентгеновский компьютерный томограф
Рентгеновская компьютерная томография в онкологии
04 Октября в 8:52 4049
В течение 70 лет после открытия Рентгена медицинская радиология развивалась в основном по пути модернизации рентгеновского оборудования, усиливающих экранов, фотоматериалов, усилителей изображения и телевизионных систем. Вместе с тем неизмененным оставался сам принцип получения диагностического изображения — генерация рентгеновского пучка и фиксация его изменений после прохождения через пациента на экране монитора, пленке или селеновой пластине.Изобретение Г. Хаунсфилдом [G. Hounsfield] в начале семидесятых годов рентгеновской компьютерной томографии (РКТ) было воспринято многими как самый крупный шаг вперед в радиологии с момента открытия рентгеновских лучей. Г. Хаунсфилду вместе с А. Кормаком [A. Cormack] за это достижение в 1979 г. была присуждена Нобелевская премия.
Первые РКТ-аппараты были спроектированы только для обследования головы, однако вскоре появились и сканеры для всего тела. В настоящее время РКТ можно использовать для визуализации любой части тела.
Все методики визуализации с использованием рентгеновских лучей используют проекционные технологии (излучение проецируется на пленку после прохождения через массив тканей) и основываются на факте, что разные ткани ослабляют рентгеновские лучи в различной степени. Однако рентгеновская пленка не может четко отобразить различия и структурные детали тканей из-за их частичного перекрытия. При традиционной томографии рентгеновская трубка и кассета с рентгеновской пленкой во время исследования перемещаются вместе таким образом, что проекция всех точек в интересующей плоскости остаются на пленке неподвижными. Поэтому точка 1, расположенная в данной плоскости, визуализируется четко, точка 2 находится вне этой плоскости и на изображении расплывается из-за нерезкости, вызванном перемещениями (рис. 8.3). 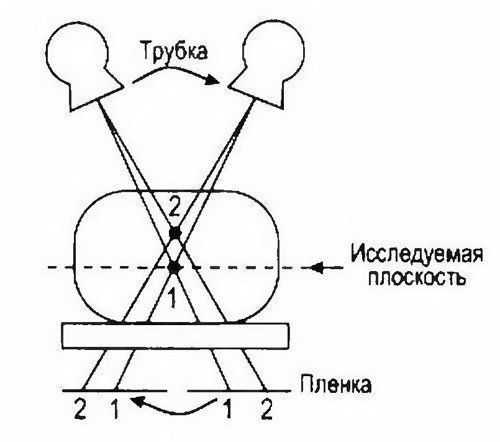
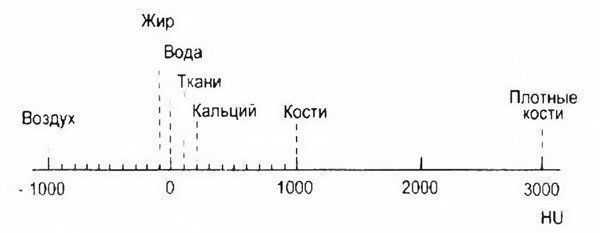
Так, для костей он составляет от +200 до +1000 ед. HU, печени — от +40 до +75, почек — от +25 до +50, поджелудочной железы — от +10 до +50, селезенки — от +35 до +75, матки и предстательной железы — от + 35 до +70, крови — от +25 до +60. Ткани, обладающие меньшей чем у воды плотностью, характеризуются отрицательными значениями: жир от -50 до -150 ед. HU, легкие — от -100 до -1000.
Рентгеновская компьютерная томография позволяет дифференцировать отдельные органы и ткани по плотности в пределах до 0,2%. Минимальная величина патологического очага, определяемого с помощью РКТ, составляет 5-10 мм при условии, что КТ-число пораженной ткани отличается от такового здоровой на 10-15 ед. HU. Необходимо отметить, однако, что точность измерений сильно страдает от несоответствий, вызываемых артефактами Поэтому для дифференциально-диагностических целей единицы HU следует использовать с осторожностью. Хотя КТ-томограммы имеют значительно более высокое разрешение по контрастности по сравнению с традиционной рентгенографией, их пространственное разрешение ниже Обычно толщина среза составляет 5-10 мм, но может равняться и 1 мм. Тонкие срезы хороши по пространственному разрешению, но для сохранения качества изображения они требуют более высокой дозы излучения. Такие тонкие срезы непрактичны при исследовании больших анатомических областей, поскольку число срезов будет весьма большим, что повлечет увеличение получаемой пациентом общей дозы облучения. С увеличением количества срезов возрастает также и продолжительность обследования. Таким образом, толщина среза — это компромисс между требованиями высокого пространственного разрешения, низкой дозой облучения и малой продолжительностью обследования.Для повышения разрешающей способности компьютерной томографии (КТ) предложена методика «усиления» изображения. Она основана на внутривенном введении рентгеноконтрастных препаратов, в результате чего увеличивается денситометрическая разность между здоровой тканью и патологическим образованием вследствие их разного кровоснабжения.
Методика усиления широко используется в дифференциальной диагностике доброкачественных и злокачественных опухолей, для выявления опухоли и метастазов в печени, гемангиом, патологических образований головного мозга, средостения и малого таза.Спиральная КТ — это недавно появившаяся новая концепция сканирования. Она значительно увеличила эффективность диагностики в плане скорости и качества исследования выбранной анатомической области. В процессе спиральной КТ стол постоянно линейно движется через первичный веерообразный луч с одновременным постоянным вращением трубки и массива детекторов.
Результатом является спиралевидное движение веерообразного луча через тело пациента Поэтому больший объем тканей (анатомическая область) может быть просканирована за один период задержки дыхания пациентом. Вместе с тем, обеспечивая получение тонких соприкасающихся «срезов» (расположенных по спирали), спиральная КТ может обеспечить создание высококачественных трехмерных реконструкций (3D).
В комбинации с внутривенным болюсным контрастированием можно реконструировать КТ-ангиограммы, воспроизводящие проекционные трехмерные изображения сосудистого русла, выполнять исследования больших анатомических зон в различные фазы прохождения контраста.Электронно-лучевая томография — разновидность КТ с очень малым временем получения изображения одного среза, что дает возможность одновременно получать динамические изображения нескольких параллельных срезов без артефактов от дыхания, сокращений сердца и пульсации сосудов.
Это дает возможность изучать быстро протекающие процессы (например, перфузия сердца, головного мозга и др.). Метод идеально подходит для выполнения КТ-ангиографии.В заключение необходимо указать, что на компьютерных томографах последних поколений при исследовании всего тела при максимальном количестве срезов, включая получение сагиттального изображения, суммарная поглощенная доза составляет 0,07 Гр.
Подготовка пациентов для обследования на компьютерном томографе: 1. РКТ головного мозга, органов грудной клетки, костной системы, головы и шеи специальной подготовки не требует. 2. Рентгеновская компьютерная томография органов брюшной полости: за 70-90 минут до обследования пациенту дают внутрь 200 мл 1,5% раствора йодсодержащего контрастного вещества (например, 5 мл 76% раствора верографина на 200 мл воды) и укладывают на правый бок. За 15 мин до исследования пациенту опять дают такую же дозу контрастного вещества. 3. После рентгеновского исследования желудочно-кишечного тракта РКТ органов брюшной полости может проводиться не ранее, чем через 7-10 суток. 4. РКТ органов малого таза: за 24 часа и за 60-70 мин до обследования пациенту дают 200 мл 2% раствора контрастного вещества, накануне — очистительная клизма. Женщинам во влагалище вводят тампон с контрастным веществом для обозначения шейки матки. Исследование производится с наполненным мочевым пузырем. 5. Для выявления конкрементов в почках рентгеновской компьютерной томографии проводится через 10 суток после внутривенной урографии. 6. Для всех категории больных в выписке из истории болезни или направлении за подписью врача должен быть указан аллергологический анамнез с результатами пробы на переносимость йодсодержащих контрастных веществ. 7. Беспокойные больные и дети до 5 лет направляются на РКТ с анестезиологом. 8. Пациенты свыше 100 кг на РКТ исследование не принимаются.Современные томографы обеспечивают возможность уточненной диагностики заболеваний практически всех органов, тканей и систем человека.
Наибольшее практическое значение рентгеновской компьютерной томографии имеет в диагностике внутримозговых опухолей, распознавание которых основывается на выявлении прямых и косвенных признаков. Прямым признаком опухоли является изменение плотности ткани (повышенная, пониженная и гетерогенная). К вторичным признакам относятся «объемный» эффект (смещение структур мозга относительно срединной линии, сдавление и деформация боковых желудочков, блокада ликворопроводящих путей с развитием гидроцефалии) и отек мозга как вблизи опухоли, так и по периферии. Методика «усиления» изображения в значительной степени повышает контрастность опухоли, особенно при наличии перифокального отека. Метастатические опухоли диагностируются с помощью КТ с наиболее высокой достоверностью по сравнению с другими методами исследования. При этом весьма эффективно используется методика «усиления» изображения: метастатические очаги быстро и интенсивно накапливают контрастное вещество. Плотность метастазов в зависимости от их морфологических особенностей может быть выше, ниже и равной плотности мозга. Однако даже в последнем случае они хорошо контрастируются на фоне локального отека. Кальцификация метастазов наблюдается весьма редко и лишь при остеогенной саркоме. Опухоли гипофиза в большинстве случаев с высокой точностью диагностируются при КТ и более чем у 90% больных имеют непосредственное изображение. Плотность опухоли по сравнению с окружающим мозгом чаще повышена или же наблюдается чередование участков повышенной и пониженной плотности.Весьма характерно отсутствие перифокального отека, а также повышение плотности опухоли на 10-30 ед. HU после введения контрастного вещества. Из непрямых признаков наиболее постоянным является изменение размеров и формы турецкого седла.
В диагностике болезней легких и особенно средостения КТ предоставляет информацию, которая не может быть получена другими методами. КТ позволяет получать изображение практически всех органов брюшной полости, забрюшинного пространства и таза. Злокачественные новообразования печени характеризуются снижением плотности до +25-35 ед. HU. В зависимости от типа роста, раковые опухоли отображаются в виде узла или множественных очагов, нередко сливающихся друг с другом и имеющих гомогенную или негомогенную структуру. Независимо от типа роста, развитие опухоли постоянно сопровождается расширением внутрилеченочных протоков, хорошо дифференцирующихся на томограммах. Благодаря высокой разрешающей способности КТ удается диагностировать опухоли до 0,5-1 см. Метастатические поражения печени, как и первичные опухоли, вызывают очаговое снижение плотности печеночной ткани. Форма метастазов чаще округлая, контуры четкие. Методика «усиления» изображения, как правило, улучшает их визуализацию.Поджелудочная железа выявляется при РКТ у 80% больных. Исследования проводят на фоне контрастирования 12-перстной кишки 5% р-ром гастрографина. позволяющего дифференцировать головку железы. При злокачественном процессе определяются неравномерное увеличение и изменение структуры поджелудочной железы, исчезновение перипанкреатической жировой клетчатки, а также отек. Плотность опухолей обычно составляет от +20 до +40 ед. HU и возрастает после «усиления» изображения.
Большое значение имеет КТ при злокачественных поражениях органов забрюшинного пространства и в первую очередь лимфатических узлов, а также внеорганных опухолей. Как первичные, так и метастатические опухоли характеризуются увеличением размеров лимфоузлов и их слиянием с образованием конгломератов, нередко вызывающих смещение сосудов и деформацию их контуров. Особенно ценно КТ при злокачественных лимфомах. так как позволяет не только оценивать состояние практически всех групп лимфатических узлов, но и выявлять поражение других органов. КТ дополняет и уточняет УЗИ в распознавании различной патологии и внеорганных опухолей забрюшинного пространства.Почки и надпочечники обычно хорошо дифференцируются на томограммах. Чувствительность КТ в диагностике опухолей почек или метастазов в них достигает 9з-99%. При РКТ надпочечников выявляются новообразования размерами до 1 см.
При неорганных опухолях КТ по диагностической эффективности превосходит все другие методы, которые в основном позволяют выявить лишь их косвенные признаки. С помощью КТ с высокой достоверностью определяются опухоли нервной, жировой, мышечной и соединительной тканей, а также кисты и новообразования, исходящие из кровеносных и лимфатических сосудов. При этом чувствительность КТ достигает 95-98%, а специфичность — 70-75% . С помощью КТ диагностируют уже на самых ранних стадиях опухоли матки, яичников, предстательной железы, мочевого пузыря. При опухолях органов малого таза КТ имеет некоторые методические особенности. Накануне исследования больному делают очистительную клизму. За 3-4 ч до томографии назначают прием внутрь 200 мл 0,5% р-ра урографина для контрастирования кишечника, а за 30 мин — 400-500 мл воды для наполнения мочевого пузыря.Непосредственно перед исследованием целесообразно контрастировать прямую кишку 100-150 мл 0,5% р-ра верографина, а у женщин для маркировки шейки матки — во влагалище ввести смоченный урографином тампон. При исследовании мочевого пузыря в него после удаления мочи с помощью катетера вводят 100-200 мл кислорода.
Несмотря на то. что костно-суставной аппарат является традиционным объектом рутинной рентгенографии, применение КТ открыло принципиально новые возможности в изучении его патологических состояний. КТ-признаки первично-злокачественных новообразований костей разнообразны и зависят от гистологического строения, локализации и распространенности опухоли. Наиболее постоянными из них являются деструкция костной ткани, периостальная реакция и наличие мягкотканного компонента. Сопоставление результатов КТ с данными рентгенологического и радионуклидного исследований показывает, что она с большей точностью выявляет как внутрикостную распространенность опухоли, так и объем мягкотканного компонента. Необходимо отметить, что при определении распространенности злокачественного процесса КТ несколько уступает магнитно-резонансной томографии КТ имеет большое значение в диагностике костных метастазов.Для дифференциальной диагностики первично-злокачественных и метастатических поражений кости применяется пункционная биопсия под контролем КТ с высокой точностью и без осложнении.
Программное обеспечение современных томографов позволяет с высокой эффективностью проводить топографическое планирование лучевой терапии. При этом обеспечивается оптимальное распределение дозы в опухоли с минимальным повреждением окружающих тканей. Кроме того, КТ позволяет осуществлять контроль за эффективностью лечения в процессе и после его окончания.Противопоказания к проведению рентгеновской компьютерной томографии:
1. Беременность всех сроков. 2. Агонирующее состояние. 3. Наличие меноррагий. 4. Психические расстройства в фазе обострения. 5. Клаустрофобия.6 Наличие металлов в обследуемой зоне.
КТ у нас в стране еще недостаточно доступна и одновременно — дорогое исследование (цена его на Западе выражается в сотнях долларов). Учитывая экономические соображения, ограниченную обеспеченность КТ и связанную с ней лучевую нагрузку, остро стоит вопрос об ее рациональном использовании. Угляница К.Н., Луд Н.Г., Угляница Н.К.Рентгеновская компьютерная томография в онкологии
04 Октября в 8:52 4016
В течение 70 лет после открытия Рентгена медицинская радиология развивалась в основном по пути модернизации рентгеновского оборудования, усиливающих экранов, фотоматериалов, усилителей изображения и телевизионных систем. Вместе с тем неизмененным оставался сам принцип получения диагностического изображения — генерация рентгеновского пучка и фиксация его изменений после прохождения через пациента на экране монитора, пленке или селеновой пластине.Изобретение Г. Хаунсфилдом [G. Hounsfield] в начале семидесятых годов рентгеновской компьютерной томографии (РКТ) было воспринято многими как самый крупный шаг вперед в радиологии с момента открытия рентгеновских лучей. Г. Хаунсфилду вместе с А. Кормаком [A. Cormack] за это достижение в 1979 г. была присуждена Нобелевская премия.
Первые РКТ-аппараты были спроектированы только для обследования головы, однако вскоре появились и сканеры для всего тела. В настоящее время РКТ можно использовать для визуализации любой части тела.
Все методики визуализации с использованием рентгеновских лучей используют проекционные технологии (излучение проецируется на пленку после прохождения через массив тканей) и основываются на факте, что разные ткани ослабляют рентгеновские лучи в различной степени. Однако рентгеновская пленка не может четко отобразить различия и структурные детали тканей из-за их частичного перекрытия. При традиционной томографии рентгеновская трубка и кассета с рентгеновской пленкой во время исследования перемещаются вместе таким образом, что проекция всех точек в интересующей плоскости остаются на пленке неподвижными. Поэтому точка 1, расположенная в данной плоскости, визуализируется четко, точка 2 находится вне этой плоскости и на изображении расплывается из-за нерезкости, вызванном перемещениями (рис. 8.3). 


Так, для костей он составляет от +200 до +1000 ед. HU, печени — от +40 до +75, почек — от +25 до +50, поджелудочной железы — от +10 до +50, селезенки — от +35 до +75, матки и предстательной железы — от + 35 до +70, крови — от +25 до +60. Ткани, обладающие меньшей чем у воды плотностью, характеризуются отрицательными значениями: жир от -50 до -150 ед. HU, легкие — от -100 до -1000.
Рентгеновская компьютерная томография позволяет дифференцировать отдельные органы и ткани по плотности в пределах до 0,2%. Минимальная величина патологического очага, определяемого с помощью РКТ, составляет 5-10 мм при условии, что КТ-число пораженной ткани отличается от такового здоровой на 10-15 ед. HU. Необходимо отметить, однако, что точность измерений сильно страдает от несоответствий, вызываемых артефактами Поэтому для дифференциально-диагностических целей единицы HU следует использовать с осторожностью. Хотя КТ-томограммы имеют значительно более высокое разрешение по контрастности по сравнению с традиционной рентгенографией, их пространственное разрешение ниже Обычно толщина среза составляет 5-10 мм, но может равняться и 1 мм. Тонкие срезы хороши по пространственному разрешению, но для сохранения качества изображения они требуют более высокой дозы излучения. Такие тонкие срезы непрактичны при исследовании больших анатомических областей, поскольку число срезов будет весьма большим, что повлечет увеличение получаемой пациентом общей дозы облучения. С увеличением количества срезов возрастает также и продолжительность обследования. Таким образом, толщина среза — это компромисс между требованиями высокого пространственного разрешения, низкой дозой облучения и малой продолжительностью обследования.Для повышения разрешающей способности компьютерной томографии (КТ) предложена методика «усиления» изображения. Она основана на внутривенном введении рентгеноконтрастных препаратов, в результате чего увеличивается денситометрическая разность между здоровой тканью и патологическим образованием вследствие их разного кровоснабжения.
Методика усиления широко используется в дифференциальной диагностике доброкачественных и злокачественных опухолей, для выявления опухоли и метастазов в печени, гемангиом, патологических образований головного мозга, средостения и малого таза.Спиральная КТ — это недавно появившаяся новая концепция сканирования. Она значительно увеличила эффективность диагностики в плане скорости и качества исследования выбранной анатомической области. В процессе спиральной КТ стол постоянно линейно движется через первичный веерообразный луч с одновременным постоянным вращением трубки и массива детекторов.
Результатом является спиралевидное движение веерообразного луча через тело пациента Поэтому больший объем тканей (анатомическая область) может быть просканирована за один период задержки дыхания пациентом. Вместе с тем, обеспечивая получение тонких соприкасающихся «срезов» (расположенных по спирали), спиральная КТ может обеспечить создание высококачественных трехмерных реконструкций (3D).
В комбинации с внутривенным болюсным контрастированием можно реконструировать КТ-ангиограммы, воспроизводящие проекционные трехмерные изображения сосудистого русла, выполнять исследования больших анатомических зон в различные фазы прохождения контраста.Электронно-лучевая томография — разновидность КТ с очень малым временем получения изображения одного среза, что дает возможность одновременно получать динамические изображения нескольких параллельных срезов без артефактов от дыхания, сокращений сердца и пульсации сосудов.
Это дает возможность изучать быстро протекающие процессы (например, перфузия сердца, головного мозга и др.). Метод идеально подходит для выполнения КТ-ангиографии.В заключение необходимо указать, что на компьютерных томографах последних поколений при исследовании всего тела при максимальном количестве срезов, включая получение сагиттального изображения, суммарная поглощенная доза составляет 0,07 Гр.
Подготовка пациентов для обследования на компьютерном томографе: 1. РКТ головного мозга, органов грудной клетки, костной системы, головы и шеи специальной подготовки не требует. 2. Рентгеновская компьютерная томография органов брюшной полости: за 70-90 минут до обследования пациенту дают внутрь 200 мл 1,5% раствора йодсодержащего контрастного вещества (например, 5 мл 76% раствора верографина на 200 мл воды) и укладывают на правый бок. За 15 мин до исследования пациенту опять дают такую же дозу контрастного вещества. 3. После рентгеновского исследования желудочно-кишечного тракта РКТ органов брюшной полости может проводиться не ранее, чем через 7-10 суток. 4. РКТ органов малого таза: за 24 часа и за 60-70 мин до обследования пациенту дают 200 мл 2% раствора контрастного вещества, накануне — очистительная клизма. Женщинам во влагалище вводят тампон с контрастным веществом для обозначения шейки матки. Исследование производится с наполненным мочевым пузырем. 5. Для выявления конкрементов в почках рентгеновской компьютерной томографии проводится через 10 суток после внутривенной урографии. 6. Для всех категории больных в выписке из истории болезни или направлении за подписью врача должен быть указан аллергологический анамнез с результатами пробы на переносимость йодсодержащих контрастных веществ. 7. Беспокойные больные и дети до 5 лет направляются на РКТ с анестезиологом. 8. Пациенты свыше 100 кг на РКТ исследование не принимаются.Современные томографы обеспечивают возможность уточненной диагностики заболеваний практически всех органов, тканей и систем человека.
Наибольшее практическое значение рентгеновской компьютерной томографии имеет в диагностике внутримозговых опухолей, распознавание которых основывается на выявлении прямых и косвенных признаков. Прямым признаком опухоли является изменение плотности ткани (повышенная, пониженная и гетерогенная). К вторичным признакам относятся «объемный» эффект (смещение структур мозга относительно срединной линии, сдавление и деформация боковых желудочков, блокада ликворопроводящих путей с развитием гидроцефалии) и отек мозга как вблизи опухоли, так и по периферии. Методика «усиления» изображения в значительной степени повышает контрастность опухоли, особенно при наличии перифокального отека. Метастатические опухоли диагностируются с помощью КТ с наиболее высокой достоверностью по сравнению с другими методами исследования. При этом весьма эффективно используется методика «усиления» изображения: метастатические очаги быстро и интенсивно накапливают контрастное вещество. Плотность метастазов в зависимости от их морфологических особенностей может быть выше, ниже и равной плотности мозга. Однако даже в последнем случае они хорошо контрастируются на фоне локального отека. Кальцификация метастазов наблюдается весьма редко и лишь при остеогенной саркоме. Опухоли гипофиза в большинстве случаев с высокой точностью диагностируются при КТ и более чем у 90% больных имеют непосредственное изображение. Плотность опухоли по сравнению с окружающим мозгом чаще повышена или же наблюдается чередование участков повышенной и пониженной плотности.Весьма характерно отсутствие перифокального отека, а также повышение плотности опухоли на 10-30 ед. HU после введения контрастного вещества. Из непрямых признаков наиболее постоянным является изменение размеров и формы турецкого седла.
В диагностике болезней легких и особенно средостения КТ предоставляет информацию, которая не может быть получена другими методами. КТ позволяет получать изображение практически всех органов брюшной полости, забрюшинного пространства и таза. Злокачественные новообразования печени характеризуются снижением плотности до +25-35 ед. HU. В зависимости от типа роста, раковые опухоли отображаются в виде узла или множественных очагов, нередко сливающихся друг с другом и имеющих гомогенную или негомогенную структуру. Независимо от типа роста, развитие опухоли постоянно сопровождается расширением внутрилеченочных протоков, хорошо дифференцирующихся на томограммах. Благодаря высокой разрешающей способности КТ удается диагностировать опухоли до 0,5-1 см. Метастатические поражения печени, как и первичные опухоли, вызывают очаговое снижение плотности печеночной ткани. Форма метастазов чаще округлая, контуры четкие. Методика «усиления» изображения, как правило, улучшает их визуализацию.Поджелудочная железа выявляется при РКТ у 80% больных. Исследования проводят на фоне контрастирования 12-перстной кишки 5% р-ром гастрографина. позволяющего дифференцировать головку железы. При злокачественном процессе определяются неравномерное увеличение и изменение структуры поджелудочной железы, исчезновение перипанкреатической жировой клетчатки, а также отек. Плотность опухолей обычно составляет от +20 до +40 ед. HU и возрастает после «усиления» изображения.
Большое значение имеет КТ при злокачественных поражениях органов забрюшинного пространства и в первую очередь лимфатических узлов, а также внеорганных опухолей. Как первичные, так и метастатические опухоли характеризуются увеличением размеров лимфоузлов и их слиянием с образованием конгломератов, нередко вызывающих смещение сосудов и деформацию их контуров. Особенно ценно КТ при злокачественных лимфомах. так как позволяет не только оценивать состояние практически всех групп лимфатических узлов, но и выявлять поражение других органов. КТ дополняет и уточняет УЗИ в распознавании различной патологии и внеорганных опухолей забрюшинного пространства.Почки и надпочечники обычно хорошо дифференцируются на томограммах. Чувствительность КТ в диагностике опухолей почек или метастазов в них достигает 9з-99%. При РКТ надпочечников выявляются новообразования размерами до 1 см.
При неорганных опухолях КТ по диагностической эффективности превосходит все другие методы, которые в основном позволяют выявить лишь их косвенные признаки. С помощью КТ с высокой достоверностью определяются опухоли нервной, жировой, мышечной и соединительной тканей, а также кисты и новообразования, исходящие из кровеносных и лимфатических сосудов. При этом чувствительность КТ достигает 95-98%, а специфичность — 70-75% . С помощью КТ диагностируют уже на самых ранних стадиях опухоли матки, яичников, предстательной железы, мочевого пузыря. При опухолях органов малого таза КТ имеет некоторые методические особенности. Накануне исследования больному делают очистительную клизму. За 3-4 ч до томографии назначают прием внутрь 200 мл 0,5% р-ра урографина для контрастирования кишечника, а за 30 мин — 400-500 мл воды для наполнения мочевого пузыря.Непосредственно перед исследованием целесообразно контрастировать прямую кишку 100-150 мл 0,5% р-ра верографина, а у женщин для маркировки шейки матки — во влагалище ввести смоченный урографином тампон. При исследовании мочевого пузыря в него после удаления мочи с помощью катетера вводят 100-200 мл кислорода.
Несмотря на то. что костно-суставной аппарат является традиционным объектом рутинной рентгенографии, применение КТ открыло принципиально новые возможности в изучении его патологических состояний. КТ-признаки первично-злокачественных новообразований костей разнообразны и зависят от гистологического строения, локализации и распространенности опухоли. Наиболее постоянными из них являются деструкция костной ткани, периостальная реакция и наличие мягкотканного компонента. Сопоставление результатов КТ с данными рентгенологического и радионуклидного исследований показывает, что она с большей точностью выявляет как внутрикостную распространенность опухоли, так и объем мягкотканного компонента. Необходимо отметить, что при определении распространенности злокачественного процесса КТ несколько уступает магнитно-резонансной томографии КТ имеет большое значение в диагностике костных метастазов.Для дифференциальной диагностики первично-злокачественных и метастатических поражений кости применяется пункционная биопсия под контролем КТ с высокой точностью и без осложнении.
Программное обеспечение современных томографов позволяет с высокой эффективностью проводить топографическое планирование лучевой терапии. При этом обеспечивается оптимальное распределение дозы в опухоли с минимальным повреждением окружающих тканей. Кроме того, КТ позволяет осуществлять контроль за эффективностью лечения в процессе и после его окончания.Противопоказания к проведению рентгеновской компьютерной томографии:
1. Беременность всех сроков. 2. Агонирующее состояние. 3. Наличие меноррагий. 4. Психические расстройства в фазе обострения. 5. Клаустрофобия.6 Наличие металлов в обследуемой зоне.
КТ у нас в стране еще недостаточно доступна и одновременно — дорогое исследование (цена его на Западе выражается в сотнях долларов). Учитывая экономические соображения, ограниченную обеспеченность КТ и связанную с ней лучевую нагрузку, остро стоит вопрос об ее рациональном использовании. Угляница К.Н., Луд Н.Г., Угляница Н.К.РКТ - это... Что такое РКТ?
Компьютерная томография — метод был предложен в 1972 г Годфри Хаунсфилдом и Алланом Кормаком, удостоенными за эту разработку Нобелевской премии. Метод основан на измерении и сложной компьютерной обработке разности ослабления рентгеновского излучения различными по плотности тканями.
Компьютерная томография (КТ) — в широком смысле, синоним термина томография (так как все современные томографические методы реализуются с помощью компьютерной техники); в узком смысле (в котором употребляется значительно чаще), синоним термина рентгеновская компьютерная томография, так как именно этот метод положил начало современной томографии.
Рентгеновская компьютерная томография — томографический метод исследования внутренних органов человека с использованием рентгеновского излучения.
Появление компьютерных томографов
Первые математические алгоритмы для КТ были разработаны в 1917 г. австрийским математиком И. Радоном (см. преобразование Радона). Физической основой метода является экспоненциальный закон ослабления излучения, который справедлив для чисто поглощающих сред. В рентгеновском диапазоне излучения экспоненциальный закон выполняется с высокой степенью точности, поэтому разработанные математические алгоритмы были впервые применены именно для рентгеновской компьютерной томографии.
В 1963 г. американский физик А. Кормак повторно (но отличным от Радона способом) решил задачу томографического восстановления, а в 1969 году английский инженер-физик Г. Хаунсфилд из фирмы EMI Ltd. сконструировал «ЭМИ-сканер» (EMI-scanner) — первый компьютерный рентгеновский томограф, чьи клинические испытания прошли в 1972 году. В 1979 году Кормак и Хаунсфилд «за разработку компьютерной томографии» были удостоены Нобелевской премии по физиологии и медицине.
Предпосылки метода в истории медицины
Изображения, полученные методом рентгеновской компьютерной томографии, имеют свои аналоги в истории изучения анатомии. В частности, Николай Иванович Пирогов разработал новый метод изучения взаиморасположения органов оперирующими хирургами, получивший название топографической анатомии. Сутью метода было изучение замороженных трупов, послойно разрезанных в различных анатомических плоскостях («анатомическая томография»). Пироговым был издан атлас под названием «Топографическая анатомия, иллюстрированная разрезами, проведёнными через замороженное тело человека в трёх направлениях». Фактически, изображения в атласе предвосхищали появление подобных изображений, полученных лучевыми томографическими методами исследования.
Разумеется, современные способы получения послойных изображений имеют несравнимые преимущества: нетравматичность, позволяющая прижизненную диагностику заболеваний; возможность аппаратной реконструкции однократно полученных изображений в различных анатомических плоскостях (проекциях), а также трёхмерной реконструкции; возможность не только оценивать размеры и взаиморасположение органов, но и детально изучать их структурные особенности и даже некоторые физиологические характеристики, основываясь на показателях рентгеновской плотности и их изменении при внутривенном контрастном усилении.
Шкала Хаунсфилда
Для визуальной и количественной оценки плотности визуализируемых методом компьютерной томографии структур используется шкала ослабления рентгеновского излучения, получившая название шкалы Хаунсфилда (её визуальным отражением на мониторе аппарата является чёрно-белый спектр изображения). Диапазон единиц шкалы («денситометрических показателей, англ. Hounsfield units»), соответствующих степени ослабления рентгеновского излучения анатомическими структурами организма, составляет в среднем от — 1024 до + 1024 (в практическом применении эти величины могут несколько отличаться на разных аппаратах). Средний показатель в шкале Хаунсфилда (0 HU) соответствует плотности воды, отрицательные величины шкалы соответствуют воздуху и жировой ткани, положительные — мягким тканям, костной ткани и более плотному веществу (металл).
Следует отметить, что «рентгеновская плотность» — усредненное значение поглощения тканью излучения; при оценке сложной анатомо-гистологической структуры измерение её «рентгеновской плотности» не всегда позволяет с точностью утверждать, какая ткань визуализируется (например, насыщенные жиром мягкие ткани имеют плотность, соответствующую плотности воды).
Изменение окна изображения
Обычный компьютерный монитор способен отображать до 256 градаций серого цвета, некоторые специализированные медицинские аппараты способны показывать до 1024 градаций. В связи со значительной шириной шкалы Хаунсфилда и неспособностью существующих мониторов отразить весь её диапазон в черно-белом спектре, используется программный перерасчет серого градиента в зависимости от интересуемого интервала шкалы. Черно-белый спектр изображения можно применять как в широком диапазоне («окне») денситометрических показателей (визуализируются структуры всех плотностей, однако невозможно различить структуры, близкие по плотности), так и в более-менее узком с заданным уровнем его центра и ширины («легочное окно», «мягкотканное окно» и т. д.; в этом случае теряется информация о структурах, плотность которых выходит за пределы диапазона, однако хорошо различимы структуры, близкие по плотности). Проще говоря, изменение центра окна и его ширины можно сравнить с изменением яркости и контрастности изображения соответственно.
Средние денситометрические показатели
КТ-скан грудной клетки в легочном и мягкотканном окнах (на изображениях указаны параметры центра и ширины окна)
| Воздух | −1000 |
| Жир | −120 |
| Вода | 0 |
| Мягкие ткани | +40 |
| Кости | +400 и выше |
Развитие современного компьютерного томографа
Современный компьютерный томограф фирмы Siemens Medical Solutions
Современный компьютерный томограф представляет собой сложный программно-технический комплекс. Механические узлы и детали выполнены с высочайшей точностью. Для регистрации прошедшего через среду рентгеновского излучения используются сверхчувствительные детекторы, конструкция и материалы, применяемые при изготовлении которых постоянно совершенствуются. При изготовлении КТ томографов предъявляются самые жесткие требования к рентгеновским излучателям. Неотъемлемой частью аппарата является обширный пакет программного обеспечения, позволяющий проводить весь спектр компьютерно-томографических исследований (КТ-исследований) с оптимальными параметрами, проводить последующую обработку и анализ КТ-изображений. Как правило, стандартный пакет программного обеспечения может быть значительно расширен с помощью узкоспециализированных программ, учитывающих особенности сферы применения каждого конкретного аппарата.
Поколения компьютерных томографов: от первого до четвёртого
Прогресс КТ томографов напрямую связан с увеличением количества детекторов, то есть с увеличением числа одновременно собираемых проекций.
Аппарат 1-го поколения появился в 1973 г. КТ аппараты первого поколения были пошаговыми. Была одна трубка направленная на один детектор. Сканирование производилось шаг за шагом делая по одному обороту на слой. Один слой изображения обрабатывлся около 4 минут.
Во 2-ом поколении КТ аппаратов использовался веерный тип конструкции. На кольце вращения напротив рентгеновской трубки устанавливалось несколько детекторов. Время обработки изображения составило 20 секунд.
3-ее поколение компьютерных томографов ввело понятие спиральной компьютерной томографии. Движение трубки и детекторов, за один шаг стола синхронно осуществляла полное вращение по часовой стрелке, что значительно уменьшило время исследования. Увеличилось и количество детекторов. Время обработки и реконструкций заметно уменьшилось.
4-ое поколение имеет 1088 люминисцентных датчика расположенных по всему кольцу гантри. Вращается лишь рентгеновская трубка. Благодаря этому методу время вращения сократилось до 0,7 секунд. Но существенного отличия в качестве изображений с КТ аппаратами 3-го поколения не имеет.
Спиральная компьютерная томография
Спиральная КТ используется в клинической практике с 1988 года, когда компания рентгеновской трубки, генерирующей излучение, вокруг тела пациента, и непрерывного поступательного движения стола с пациентом вдоль продольной оси сканирования z через апертуру гантри. В этом случае траектория движения рентгеновской трубки, относительно оси z — направления движения стола с телом пациента, примет форму спирали.
В отличие от последовательной КТ скорость движения стола с телом пациента может принимать произвольные значения, определяемые целями исследования. Чем выше скорость движения стола, тем больше протяженность области сканирования. Важно то, что скорость движения стола может быть в 1,5-2 раза больше толщины томографического слоя без ухудшения пространственного разрешения изображения.
Технология спирального сканирования позволила значительно сократить время, затрачиваемое на КТ-исследование и существенно уменьшить лучевую нагрузку на пациента.
Многослойная компьютерная томография
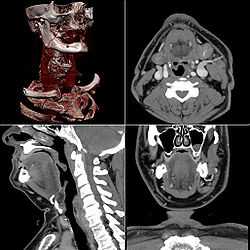
Многослойная («мультиспиральная») компьютерная томография с внутривенным контрастным усилением и трёхмерной реконструкцией изображения.
Многослойная («мультиспиральная», «мультисрезовая» компьютерная томография — мсКТ) была впервые представлена компанией Elscint Co. в 1992 году. Принципиальное отличие мсКТ томографов от спиральных томографов предыдущих поколений в том, что по окружности гантри расположены не один, а два и более ряда детекторов. Для того, чтобы рентгеновское излучение могло одновременно приниматься детекторами, расположенными на разных рядах, была разработана новая — объёмная геометрическая форма пучка. В 1992 году появились первые двухсрезовые (двухспиральные) МСКТ томографы с двумя рядами детекторов, а в 1998 году — четырёхсрезовые (четырёхспиральные), с четырьмя рядами детекторов соответственно. Кроме вышеотмеченных особенностей, было увеличено количество оборотов рентгеновской трубки с одного до двух в секунду. Таким образом, четырёхспиральные мсКТ томографы пятого поколения на сегодняшний день в восемь раз быстрее, чем обычные спиральные КТ томографы четвертого поколения. В 2004—2005 годах были представлены 32-, 64- и 128-срезовые мсКТ томографы, в том числе — с двумя рентгеновскими трубками. Сегодня же в некоторых немецких, американских и канадских больницах уже имеются [1] 320-срезовые компьютерные томографы. Эти томографы, впервые представленные в 2007 году компанией Toshiba, являются новым витком эволюции рентгеновской компьютерной томографии. Они позволяют не только получать изображения, но и дают возможность наблюдать почти что «в реальном» времени физиологические процессы, происходящие в головном мозге и в сердце [2]! Особенностью подобной системы является возможность сканирования целого органа (сердце, суставы, головной мозг и т.д.)за один оборот лучевой трубки, что значительно сокращает время обследования, а так же возможность сканировать сердце даже у пациентов, страдающих аритмиями. Шесть 320-ти срезовых сканеров уже установлены и функционируют в России. Один из них установлен в Московской Медицинской Академии.
Контрастное усиление
Для улучшения дифференцировки органов друг от друга, а также нормальных и патологических структур, используются различные методики контрастного усиления (чаще всего, с применением йодсодержащих контрастных препаратов).
Двумя основными разновидностями введения контрастного препарата являются пероральное (пациент с определенным режимом выпивает раствор препарата) и внутривенное (производится медицинским персоналом). Главной целью первого метода является контрастирование полых органов желудочно-кишечного тракта; второй метод позволяет оценить характер накопления контрастного препарата тканями и органами через кровеносную систему. Методики внутривенного контрастного усиления во многих случаях позволяют уточнить характер выявленных патологических изменений (в том числе достаточно точно указать наличие опухолей, вплоть до предположения их гистологической структуры) на фоне окружающих их мягких тканей, а также визуализировать изменения, не выявляемые при обычном («нативном») исследовании.
В свою очередь внутривенное контрастирование делится на два метода: обычное внутривенное контрастирование и болюсное контрастирование.
При первом методе контраст вводится от руки рентген-лаборантом, время и скорость введения не регулируются, после введения контрастного вещества начинается само исследование.
При втором методе контраст так же вводится внутривенно, но вводит в вену контраст уже специальный аппарат, разграничивающий время подачи. Метод заключается в том, чтобы разграничить фазы контрастирования. Примерно через 20 секунд после начала введения аппаратом контраста, начинается сканирование, при котором визуализируется наполнение артерий. Затем аппарат через определенное время сканирует этот же участок второй раз для выделения венозной фазы, в которой визуализируется наполнение вен. В венозной фазе различают множество подфаз, в зависимости от изучаемого органа. Так же различают паренхиматозную фазу, при которой наблюдается равномерное повышение показателей плотности паренхиматозных органов.
КТ-ангиография
КТ-ангиография позволяет получить послойную серию изображений кровеносных сосудов; на основе полученных данных посредством компьютерной постобработки с 3D-реконструкцией строится трёхмерная модель кровеносной системы.
Спиральная КТ-ангиография — одно из последних достижений рентгеновской компьютерной томографии. Исследование проводится в амбулаторных условиях. В локтевую вену вводится йодсодержащий контрастный препарат в объеме ~100 мл. В момент введения контрастного вещества делают серию сканирований исследуемого участка.
Преимущества метода
Исключён риск возникновения осложнений от хирургических манипуляций, необходимых при обычной ангиографии. КТ-ангиография позволяет уменьшить лучевую нагрузку на пациента.
Преимущества МСКТ перед обычной спиральной КТ
- улучшение временного разрешения
- улучшение пространственного разрешения вдоль продольной оси z
- увеличение скорости сканирования
- улучшение контрастного разрешения
- увеличение отношения сигнал/шум
- эффективное использование рентгеновской трубки
- большая зона анатомического покрытия
- уменьшение лучевой нагрузки на пациента
Все эти факторы значительно повышают скорость и информативность исследований.
Основным недостатком метода остается высокая лучевая нагрузка на пациента, несмотря на то, что за время существования КТ её удалось значительно снизить.
- Улучшение временного разрешения достигается за счёт уменьшения времени исследования и количества артефактов из-за непроизвольного движения внутренних органов и пульсации крупных сосудов.
- Улучшение пространственного разрешения вдоль продольной оси z, связано с использованием тонких (1-1.5 мм) срезов и очень тонких, субмиллиметровых (0.5 мм) срезов. Чтобы реализовать эту возможность, разработаны два типа расположения массива детекторов в МСКТ томографах:
- матричные детекторы (matrix detectors), имеющие одинаковую ширину вдоль продольной оси z;
- адаптивные детекторы (adaptive detectors), имеющие неодинаковую ширину вдоль продольной оси z.
Все вышеотмеченные нововведения не только повышают пространственное разрешение, но благодаря специально разработанным алгоритмам реконструкции позволяют значительно уменьшить количество и размеры артефактов (посторонних элементов) КТ-изображений. Основным преимуществом МСКТ по сравнению с односрезовой СКТ является возможность получения изотропного изображения при сканировании с субмиллиметровой толщиной среза (0,5 мм). Изотропное изображение возможно получить если грани вокселя матрицы изображения равны, то есть воксель принимает форму куба. В этом случае пространственное разрешение в поперечной плоскости x-y и вдоль продольной оси z становится одинаковым.
- Увеличение скорости сканирования достигается уменьшением времени оборота рентгеновской трубки, по сравнению с обычной спиральной КТ, в два раза — до 0,45-0,50 с.
- Улучшение контрастного разрешения достигается вследствие увеличения дозы и скорости введения контрастных средств при проведении ангиографии или стандартных КТ-исследований, требующих контрастного усиления. Различие между артериальной и венозной фазой введения контрастного средства прослеживается более чётко.
- Увеличение отношения сигнал/шум достигнуто благодаря конструктивным особенностям исполнения новых детекторов и используемых при этом материалов; улучшения качества исполнения электронных компонентов и плат; увеличению тока накала рентгеновской трубки до 400 мА при стандартных исследованиях или исследованиях тучных пациентов.
- Эффективное использование рентгеновской трубки достигается за счет меньшего времени работы трубки при стандартном исследовании. Конструкция рентгеновских трубок претерпела изменения для обеспечения лучшей устойчивости при больших центробежных силах, возникающих при вращении за время, равное или менее 0,5 с. Использование генераторов большей мощности (до 100 кВт), конструктивные особенности исполнения рентгеновских трубок, лучшее охлаждение анода и повышение его теплоёмкости до 8’000’000 единиц также позволяют продлить срок службы трубок.
- Зона анатомического покрытия увеличена благодаря одновременной реконструкции нескольких срезов полученных за время одного оборота рентгеновской трубки. Для МСКТ томографа зона анатомического покрытия зависит от количества каналов данных, шага спирали, толщины томографического слоя, времени сканирования и времени вращения рентгеновской трубки. Зона анатомического покрытия может быть в несколько раз больше за одно и то же время сканирования по сравнению с обычным спиральным компьютерным томографом.
- Лучевая нагрузка при мультиспиральном КТ-исследовании при сопоставимых объёмах диагностической информации меньше на 30 % по сравнению с обычным спиральным КТ-исследованием. Для этого улучшается фильтрация спектра рентгеновского излучения и производится оптимизация массива детекторов. Разработаны алгоритмы, позволяющие в реальном масштабе времени автоматически уменьшать ток и напряжение на рентгеновской трубке в зависимости от исследуемого органа, размеров и возраста каждого пациента.
Показания к компьютерной томографии
Компьютерная томография широко используется в медицине для нескольких целей:
- Как скрининговый тест. Скрининг (screening) — просмотр, отбор, в медицине используется для исключения потенциально серьезного диагноза в группах риска. Компьютерная томография часто используется, как скрининг при следующих состояниях:
- Головная боль
- Травма головы, не сопровождающаяся потерей сознания
- Обморок
- Исключение рака легких. В случае использования компьютерной томографии для скрининга, исследование делается в плановом порядке.
- Для диагностики по экстренным показаниям — экстренная компьютерная томография
- Тяжелые травмы
- Подозрение на кровоизлияние в мозг
- Подозрение на повреждение сосуда (например, расслаивающая аневризма аорты)
- Подозрение на некоторые другие острые повреждения полых и паренхиматозных органов (осложнения как основного заболевания, так и в результате проводимого лечения)
- Компьютерная томография для плановой диагностики
- Большинство КТ исследований делается в плановом порядке, по направлению врача, для окончательного подтверждения диагноза. Как правило, перед проведением компьютерной томографии, делаются более простые исследования — рентген, УЗИ, анализы и т. д.
- Для контроля результатов лечения.
- Для проведения лечебных и диагностических манипуляций, например пункция под контролем компьютерной томографии и др.[3]
Компьютерная томография с двумя источниками
DSCT — Dual Source Computed Tomography. Русскоязычной аббревиатуры в настоящее время нет.
В 2005 году компанией 1979 году, но технически его реализация в тот момент была невозможно.
По сути он является одним из логичных продолжений технологии МСКТ. Дело в том, что при исследовании сердца (КТ-коронарография) необходимо получение изображений объектов находящихся в постоянном и быстром движении, что требует очень короткого периода сканирования. В МСКТ это достигалось синхронизацией ЭКГ и обычного исследования при быстром вращении трубки. Но минимальный промежуток времени, требуемый для регистрации относительно неподвижного среза для МСКТ при времени обращения трубки, равном 0,33 с (≈3 оборота в секунду), равен 173 мс, то есть время полуоборота трубки. Такое временное разрешение вполне достаточно для нормальной частоты сердечных сокращений (в исследованиях показана эффективность при частотах менее 65 ударов в минуту и около 80, с промежутком малой эффективности между этими показателями и при больших значениях). Некоторое время пытались увеличить скорость вращения трубки в гентри томографа. В настоящее время достигнут предел технических возможностей для ее увеличения, так как при обороте трубки в 0,33 с ее вес возрастает в 28 раз (перегрузки 28 g). Чтобы получить временное разрешение менее 100 мс, требуется преодоление перегрузок более чем 75 g.
Использование же двух рентгеновских трубок, расположенных под углом 90°, дает временное разрешение, равное четверти периода обращения трубки (83 мс при обороте за 0,33 с). Это позволило получать изображения сердца независимо от частоты сокращений.
Также такой аппарат имеет еще одно значительное преимущество: каждая трубка может работать в своем режиме (при различных значениях напряжения и тока, кВ и мА соответственно). Это позволяет лучше дифференцировать на изображении близкорасположенные объекты различных плотностей. Особенно это важно при контрастировании сосудов и образований, находящихся близко от костей или металлоконструкций. Данный эффект основан на различном поглощении излучения при изменении его параметров у смеси кровь + йодсодержащее контрастное вещество при неизменности этого параметра у гидроксиапатита (основа кости) или металлов.
В остальном аппараты являются обычными МСКТ аппаратами и обладают всеми их преимуществами.
Массовое внедрение новых технологий и компьютерных вычислений позволили внедрить в практику такие методы, как виртуальная эндоскопия, в основе которых лежит РКТ и МРТ.
Литература
См. также
- Томография
- Компьютерная томография высокого разрешения
Wikimedia Foundation. 2010.
Интересный мир
 Независимые друг от друга исследования физика-теоретика и инженера-электрика привели к созданию компьютерного рентгеновского томографа. За великий прорыв они оба были удостоены Нобелевской премии.
Независимые друг от друга исследования физика-теоретика и инженера-электрика привели к созданию компьютерного рентгеновского томографа. За великий прорыв они оба были удостоены Нобелевской премии.
Господин Кормак
Известный американский физик Аллан Маклеод Кормак появился на свет 23 февраля 1924 года в Йоханнесбурге (ЮАР) в семье инженера Джорджа Кормака и учительницы Амелии Кормак. Во время учебы его особенно интересовали астрономия, физика и математика. Окончив же школу, он поступил в Кейптаунский университет для изучения электротехники. Через два года Аллан понял, что ему больше интересна физика, и в 1944 году он получил степень бакалавра, а уже в следующем году – степень магистра.
В 1956 году он устроился работать в госпиталь Гроте-Шур по совместительству в области медицинской физики. Кормак наблюдал за использованием радиоизотопов и занимался калибровкой специальных пластинок, по которым можно судить о дозе радиации, которую получает персонал госпиталя. И именно эти наблюдения за лучевым лечением больных с различными злокачественными опухолями постепенно привели его к той работе, за которую он и получил Нобелевскую премию.
Кормак понял, что для расчета дозы облучения для лечения опухолей, нужно точно знать, сколько рентгеновских лучей поглощают различные ткани тела. Думая о том, как же измерить такие характеристики поглощения, Кормак сделал вывод, что эти характеристики могут иметь и диагностическое значение, например, для уточнения локализации опухолей.
Рентгеновские лучи
Рентгеновская техника зародилась в конце ХIХ века, после того как Вильгельм Рентген обнаружил лучи, которые он назвал Х-излучением, с их помощью он смог получить первый рентгеновский снимок. На этом снимке было изображение кисти руки его жены. Но рентгенограммы способны отобразить лишь общее поглощение лучей на пути каждого пучка. И по ним невозможно узнать, какое же участие в этом общем поглощении приняли конкретные ткани, через которые этот пучок последовательно проходит. Это вызывает определенные трудности, например, при рентгенографии головы, ведь кости черепа сильно поглощают лучи и скрывают изображение мягких тканей. Кормака осенило, что если сделать несколько рентгеновских измерений, при которых лучи будут проходить через объект под разным углом, то при этом будет можно будет получить информацию о том, сколько лучей поглощают отдельные внутренние участки.
Опыты на «железном человеке»
В Кейптауне и Медфорде Кормак продолжил опыты, проверяющие его математический метод. В своих первых экспериментах он использовал гамма-излучение кобальта-60, характеризующегося теми же закономерностями, что и для рентгеновские лучи. Физик собирал лучи в тонкий линейный пучок и пропускал через муляж человеческого тела. В качестве детектора использовался счетчик Гейгера, который располагался позади муляжа. В Кейптауне это был муляж из концентрических алюминиевых цилиндров, заключенных в деревянную оболочку. Позже, в Медфорде, Кормак повторил эксперименты на более сложном муляже. Тот состоял из алюминиевой оболочки, представлявшей череп, внутри нее находилась пластмасса, соответствующая мягким тканям – мозгу, и плюс два алюминиевых диска, так называемые опухоли. Эксперименты вновь увенчались успехом.
Разработки Годфри Хаунсфилда и первый компьютерный томограф
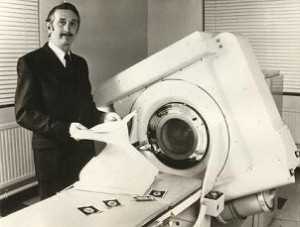 На рубеже 70-х годов Годфри Хаунсфилду, являющимуся научным сотрудником английского объединения «Электрикал энд мьюзикал инструменте лимитед» (ЕМI), удалось разработать сходный, но более практичный метод компьютерно-томографического сканирования. И значительную роль в этой разработке сыграли современные компьютеры, появившиеся в то время. В 1971 году в больнице Аткинсона Морли в Уимблдоне в Великобритании установили первый клинический компьютерный томограф, и началось исследование больных, которые страдали опухолями, а также другими заболеваниями головного мозга. В апреле 1972 года ЕМI объявило о начале производства первого коммерческого компьютерного томографа – ЕМIСТ-1000. Его первые клинические испытания сразу же показали, что компьютерная томография – значительный шаг вперед по сравнению с другими методиками, позволяющими получить рентгеновские изображения тканей человека.
На рубеже 70-х годов Годфри Хаунсфилду, являющимуся научным сотрудником английского объединения «Электрикал энд мьюзикал инструменте лимитед» (ЕМI), удалось разработать сходный, но более практичный метод компьютерно-томографического сканирования. И значительную роль в этой разработке сыграли современные компьютеры, появившиеся в то время. В 1971 году в больнице Аткинсона Морли в Уимблдоне в Великобритании установили первый клинический компьютерный томограф, и началось исследование больных, которые страдали опухолями, а также другими заболеваниями головного мозга. В апреле 1972 года ЕМI объявило о начале производства первого коммерческого компьютерного томографа – ЕМIСТ-1000. Его первые клинические испытания сразу же показали, что компьютерная томография – значительный шаг вперед по сравнению с другими методиками, позволяющими получить рентгеновские изображения тканей человека.
Эффективность томографа
По мнению Годфри Хаунсфилда, компьютерный томограф работает в сто раз эффективнее, чем обычный рентгеновский аппарат. Он способен к обработке всей получаемой информации, а обычная же рентгеновская установка обрабатывает лишь около 1% информации. Главным же преимуществом томографа является то, что он помогает четко отличать мягкие ткани от окружающих их тканей, даже если разница в поглощении лучей совсем невелика. И поэтому прибор позволяет отличить здоровые ткани организма от пораженных.
Нобелевская премия
В 1979 году Кормак и Хаунсфилд получили Нобелевскую премию по физиологии и медицине «за разработку компьютерной томографии».
Годфри Ньюболд Хаунсфилд
Английский ученый-физик Годфри Ньюболд Хаунсфилд родился 28 августа 1919 года в Ньюарке. В юности Годфри сконструировал планер, запускаемый им с крыши амбара; фонтан с насосом, приводившимся в действие ацетиленовым двигателем, а также патефон и радиоприемник. В школе Ньюарка интерес Хаунсфилда вызывали в основном физика и математика. В 1939 году он прошел курс обучения в Сити-Гилд-колледже в Лондоне, а в самом начале Второй мировой войны был призван в Королевские воздушные силы, где служил инструктором по радарной технике в Королевском колледже в Южном Кенсингтоне.
Первая в Англии стационарная транзисторная ЭВМ
Через год после увольнения Хаунсфилд получил субсидию, позволившую ему поступить в лондонский электротехнический инженерный колледж Фарадея. Окончив его в 1951 году, он начал работать в компании ЕМI, проводившей исследования в области электроники для коммерческого использования. Во время службы в ВВС, Хаунсфилд имел дело с радарами и системами слежения за воздушными объектами и заинтересовался электронно-вычислительной техникой. В 1958-1959 годах группа специалистов, в состав которой он входил, сконструировала первую в Англии стационарную транзисторную ЭВМ. Ранние транзисторные ЭВМ не имели каких-либо особых преимуществ перед ламповыми. Хаунсфилд же смог увеличить их быстродействие и мощность за счет системы, которую он создал на основе управления транзисторами с помощью магнитных полей.
Компьютер, поглощающий рентгеновские лучи
В начале 60-х годов Хаунсфилд работал в ряде главных исследовательских лабораторий ЕМI над разработкой тонкопленочной технологии, целью которой было увеличение объема памяти компьютеров ЕМI. Также Хаунсфилд принимал участие в создании компьютерных программ в области идентификации. Именно эти опыты и натолкнули его на мысль о разработке компьютера, способного определять степень поглощения рентгеновских лучей биологическими тканями организма и тем самым наиболее полно использовать возможности лучей.
Исследование Хаунсфилда параллельно с Кормаком
В 1967 году Хаунсфилд независимо от работ и исследований Кормака начал работу над своей КАТ-системой, и ему удалось разработать схему, аналогичную схеме Кормака. Для гамма-лучей сохраняется тот же принцип, что и для лучей рентгеновских. Хаунсфилд смог разработать немного иную математическую модель, используя большой компьютер для обработки полученных данных, и благодаря своему инженерному складу ума внедрил метод томографического исследования в практику.
Первый клинический КАТ-сканер
Вначале время, которое требовалось для сканирования объекта, составляло целых 9 дней, и это было связано с низкоинтенсивным источником гамма-лучей, что требовало длительных экспозиций. Мощная же рентгеновская трубка позволила снизить время исследования до 9 часов. Удачные изображения были получены при обследовании головного мозга человека, головного мозга живого теленка и области почек свиньи. Контрастность полученных снимков была достаточно четкой и с их помощью можно было оценить ткани головного мозга и других органов, однако не было полной уверенности, что этот метод поможет отличить пораженные ткани от здоровых и, например, выявить опухоль. И чтобы достичь эту цель в 1971 году в госпитале Аткинсона Морли в Уимблдоне сконструировали и смонтировали быстрый и сложный аппарат – первый клинический КАТ-сканер.
Первая сканограмма головного мозга
В 1972 году была сделана первая сканограмма головного мозга женщины с подозрением на его поражение, и на полученном изображении отчетливо была видна темная округлая киста. Постепенно были сделаны более крупные и более быстрые сканеры, позволявшие уменьшить время процедуры сканирования сначала до 18 секунд, а затем всего до 3 секунд и менее, и дающие изображения различных органов с высокой разрешающей способностью.
Именно тогда стало очевидно, что применение компьютерного рентгеновского томографа представляет значительный прогресс по сравнению с использованием других методов получения изображений биологических тканей.
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе