Этапы бактериологического исследования
Бактериологический метод исследования: этапы, цели, характеристика
Исследование бактерий имеет большое практическое значение для человека. На сегодняшний день открыто большое количество прокариот, которые отличаются друг от друга по патогенности, области распространения, форме, размерам, количеству жгутиков и другим параметрам. Чтобы детально изучить данный штамм, применяется бактериологический метод исследования.
Какие существуют методы анализа бактериальных клеток?
Чтобы определить, являются ли бактерии патогенными, проводят исследование культуры различными способами. Среди них:
1. Бактериоскопический метод.
2. Бактериологический метод.
3. Биологический метод.
Бактериоскопический и бактериологический методы исследования основаны непосредственно на работе с клетками прокариот, когда биологический анализ требуется для изучения влияния таких клеток на живой организм подопытных животных. По степени проявления тех или иных признаков заболевания ученый может сделать вывод о наличии или отсутствии патогенных бактерий в пробе, а также естественно их размножить в организме животного для получения их культуры и использования в других работах.
Бактериологический метод исследования отличается от бактериоскопического. В первом для анализа используется специально подготовленная культура живых прокариот, когда во втором проводится работа с мертвыми или живыми клетками на предметном стекле.
Этапы бактериологического метода исследования. Микробиология
Принцип изучения свойств бактериальной культуры может пригодиться как для ученых-микробиологов, которые поставили цель исследовать прокариотические клетки, так и для лаборантов, задача которых заключается в установлении патогенности или непатогенности бактерий, а затем диагноза пациента.
Методика изучения бактерий делится на три этапа:
1. Выделение бактерий из первоначальной пробы.
2. Высевание бактерий и выращивание чистой культуры, изучение ее свойств.
3. Детальное исследование бактериальных клеток.
Первый этап
Проба, или мазок, берется со свободной поверхности среды или у пациента. Таким образом мы получаем «коктейль» из множества видов бактерий, которые должны высеять на питательную среду. Иногда появляется возможность выделить сразу необходимые бактерии, зная их очаги распространения в организме.
Через двое-трое суток отбираются нужные колонии и высеваются на твердые среды чашек Петри с помочью стерильной петли. Во множестве лабораторий работают с пробирками, где может находиться твердая или жидкая питательная среда. Так и проводится бактериологический метод исследования в микробиологии.
Второй этап
После получения отдельных колоний бактерий проводится непосредственный макро- и микроанализ. Измеряются все параметры колоний, определяется цвет и форма каждой из них. Нередко проводится подсчет колоний на чашке Петри, а затем в исходном материале. Это имеет значение при анализе патогенных бактерий, от числа которых зависит степень заболевания.
Бактериологический метод исследования, 2 этап которого заключается в изучении отдельных колоний микроорганизмов, может быть сопряжен с биологическим способом анализа бактерий. Еще одна цель работы на этом этапе – увеличить количество исходного материала. Это можно сделать на питательной среде, а можно провести эксперимент в естественных условиях на живых подопытных организмах. Патогенные бактерии будут размножаться, и в результате кровь будет содержать миллионы клеток прокариот. Из взятой крови легко приготовить необходимый рабочий материал бактерий.
Третий этап
Самая важная часть исследования – это определение морфологических, биохимических, токсигенных и антигенных свойств культуры бактерий. Работа ведется с заранее «очищенными» культурами на питательной среде, а также с препаратами (зачастую окрашенными) под микроскопом.
Установить принадлежность патогенных или условно-патогенных бактерий к той или иной систематической группе, а также определить их устойчивость к лекарствам позволяет бактериологический метод исследования. 3 этап – антибиотики, т. е. анализ поведения клеток бактерий в условиях содержания лекарственных препаратов в окружающей среде.
Исследование устойчивости культуры к антибиотику имеет важное практическое значение, когда необходимо прописать для конкретного пациента необходимые, а главное, действенные препараты. Здесь и может помочь бактериологический метод исследования.
Что такое питательная среда?
Для развития и размножения бактерии должны находиться в заранее подготовленных питательных средах. По консистенции они могут быть жидкие или твердые, а по происхождению – растительные или животные.
Основные требования к питательным средам:
1. Стерильность.
2. Максимальная прозрачность.
3. Оптимальные показатели кислотности, осмотического давления, активности воды и других биологических величин.
Получение изолированных колоний
1. Метод Дригальского. Он заключается в том, что на бактериальную петлю наносится мазок с различными видами микроорганизмов. Этой петлей проводят по первой чашке Петри с питательной средой. Далее, не меняя петлю, методом остаточного материала проводят по второй и третьей чашкам Петри. Так, на последних образцах колонии бактерии будут засеваться не слишком плотно, тем самым упрощается возможность найти необходимые для работы бактерии.
2. Метод Коха. В нем используются пробирки с расплавленной питательной средой. Туда помещается петля или пипетка с мазком бактерий, после чего содержимое пробирки выливается на специальную пластинку. Агар (или желатин) застывает через какое-то время, а в его толще легко обнаружить нужные колонии клеток. Важно перед началом работы развести смесь бактерий в пробирках, чтобы концентрация микроорганизмов не была очень большой.
Бактериологический метод исследования, этапы которого основаны на выделении нужной культуры бактерий, не обходится без этих двух способов нахождения изолированных колоний.
Антибиотикограмма
Визуально реакцию бактерий на препараты можно заметить двумя практическими способами:
1. Метод бумажных дисков.
2. Разведение бактерий и антибиотика в жидкостной среде.
Метод бумажных дисков требует наличия культуры микроорганизмов, которые были выращены на твердой питательной среде. На такую среду кладут несколько бумажек округлой формы, пропитанных антибиотиками. Если препарат успешно справляется с нейтрализацией бактериальных клеток, после такой обработки останется участок, лишенный колоний. Если же реакция на антибиотик отрицательная, бактерии выживут.
В случае использования жидкой питательной среды сперва готовят несколько пробирок с культурой бактерий разных степеней разведения. В эти пробирки добавляют антибиотики, и в течение суток наблюдают за процессом взаимодействия вещества и микроорганизмов. В конечном итоге получается качественная антибиотикограмма, по которой можно судить об эффективности препарата для данной культуры.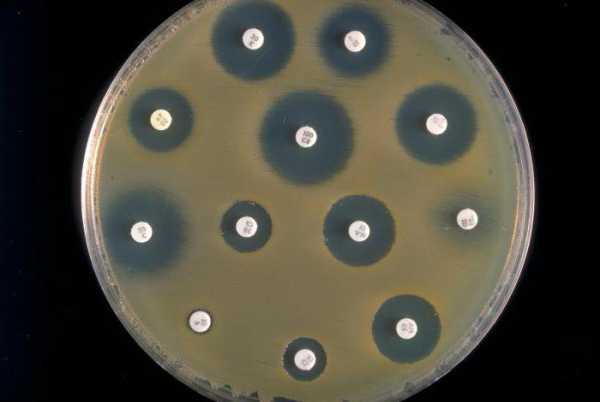
Основные задачи анализа
Здесь перечислены по пунктам цели и этапы бактериологического метода исследования.
1. Получить исходный материал, который будет использоваться для выделения колоний бактерий. Это может быть мазок с поверхности любого предмета, слизистой оболочки или полости органа человека, анализ крови.
2. Выращивание культуры на твердой питательной среде. Через 24-48 часов на чашке Петри можно обнаружить колонии бактерий разных видов. Отбираем по морфологическим и/или биохимическим критериям нужную и проводим уже с ней дальнейшую работу.
3. Размножение полученной культуры. Бактериологический метод исследования может опираться на механический или биологический способ увеличения численности культуры бактерии. В первом случае ведется работа с твердыми или жидкими питательными средами, на которых в термостате размножаются бактерии и образуют новые колонии. Биологический способ требует естественных условий увеличения численности бактерий, поэтому здесь микроорганизмами заражается подопытное животное. Через несколько суток в пробе крови или мазке можно обнаружить множество прокариот.
4. Работа с очищенной культурой. Чтобы определить систематическое положение бактерий, а также их принадлежность к возбудителям заболеваний, необходимо провести тщательный анализ клеток по морфологическим и биохимическим признакам. При исследовании патогенных групп микроорганизмов важно знать, насколько эффективно действие антибиотиков.
Это была общая характеристика бактериологического метода исследования.
Особенности проведения анализа
Главное правило проведения бактериологического исследования – это максимальная стерильность. Если идет работа с пробирками, посевы и пересевы бактерий должны проводиться только над нагретой спиртовкой.
Все этапы бактериологического метода исследования требуют использования специальной петли или пастеровской пипетки. Оба инструмента должны быть предварительно обработаны в пламени спиртовки. Что касается пастеровской пипетки, то тут перед термической стерилизацией необходимо отломать кончик пипетки пинцетом.
Техника посева бактерий тоже имеет свои особенности. Во-первых, при посеве на твердые среды проводят бактериальной петлей по поверхности агара. Петля, конечно же, уже должна иметь на поверхности образец микроорганизмов. Также практикуется посев внутрь питательной среды, и в этом случае петля или пипетка должны достичь дна чашки Петри.
При работе с жидкими средами используются пробирки. Здесь важно следить, чтобы жидкости не касались краев лабораторной посуды или пробки, а используемые инструменты (пипетка, петля) не дотрагивались до посторонних предметов и поверхностей.
Значение биологического метода исследования
Анализ пробы бактерий имеет свое практическое применение. Прежде всего бактериологический метод исследования может использоваться в медицине. К примеру, необходимо изучить микрофлору больного, чтобы установить правильный диагноз, а также выработать правильный ход лечения. Здесь помогает антибиотикограмма, которая покажет активность лекарственных препаратов против возбудителя заболеваний.
Анализ бактерий используется в лаборатории для определения таких опасных заболеваний, как туберкулез, возвратный тиф или гонорея. Также он применяется для изучения бактериального состава миндалин, полостей органов.
Бактериологический метод исследования можно использовать для определения загрязненности среды. По данным о количественном и качественном составе мазка с поверхности какого-либо предмета определяется степень заселенности данной среды микроорганизмами.
4. Физиология микроорганизмов. Бактериологический (культуральный) метод исследования
ЗАНЯТИЕ № 4
ТЕМА: ФИЗИОЛОГИЯ МИКРООРГАНИЗМОВ. БАКТЕРИОЛОГИЧЕСКИЙ (КУЛЬТУРАЛЬНЫЙ) МЕТОД ИССЛЕДОВАНИЯ. БИОХИМИЧЕСКИЕ СВОЙСТВА МИКРООРГАНИЗМОВ.
ПЕРЕЧЕНЬ КОНТРОЛЬНЫХ ВОПРОСОВ
Питание бактерий. Питательные вещества – источники углерода и азота. Классификация бактерий по типам питания Аутотрофы и хемоорганотрофы
Факторы роста и их источники. Источники минеральных элементов.
Способы и механизмы переноса питательных веществ через мембрану.
Энергетические потребности бактерий. Пути получения энергии у аутотрофов (фотосинтез, хемосинтез). Источники и пути получения энергии у хемоорганотрофов.
Аэробный и анаэробный типы биологического окисления у бактерий. Аэробные, анаэробные, факультативно анаэробные и микроаэрофильные бактерии. Способы создания анаэробных условий.
Задачи, этапы, преимущества и недостатки бактериологического (культурального) метода исследования.
Рост и размножение микроорганизмов. Способы размножения. Бинарное (простое) деление, механизм. Размножение бактериальных популяций.
Принципы и методы культивирования бактерий. Питательные потребности микробов.
Питательные среды для культивирования бактерий. Требования к питательным средам. Классификация питательных сред.
Условия и техника культивирования бактерий. Техника посева на питательные среды. Закономерности и характер роста бактерий на плотных и жидких питательных средах.
Способы выделения чистых культур аэробных и анаэробных бактерий.
Свойства, используемые для идентификации выделенных культур.
САМОСТОЯТЕЛЬНАЯ И ЛАБОРАТОРНАЯ РАБОТА
Бактериологический метод (этапы):
1► 1-й этап выделения чистой культуры аэробных бактерий: А) Микроскопия патологического материала.
Окраска мазков из патологического материала по Граму. Зарисовка препарата.
|
| Мазок из патологического материала Окраска по Граму Увеличение 7х90=630 раз |
Посев патологического материала бактериологической петлей на пластинчатый мясопептонный агар (МПА) для получения изолированных колоний.
Классификация питательных сред (указать области применения)
1. По консистенции:жидкие (мясо- пептонный бульон, желчный, сахарный бульон), плотные (2- 3% агара) и полужидкие (0,15- 0,7 % агара) среды.
2. По происхождению:естественные - из молока, мяса. яиц, картофеля, сыворотки крови человека, животных и др продуктов; искусственные – 1)натуральные сбалансированные смеси питательных веществ в концентрациях и сочетаниях, необходимых для роста и размножения микроорганизмов, универсальный источник азота и углерода - пептоны - продукты неполного расщепления белков с помощью пепсина или различные гидролизаты (рыбный, казеиновый, дрожжевой и др.).2) синтетические c точным химическим составом Сотона для микобактерий, 199 для клеток.
3. По составу: простые питательные среды (мясо- пептонный бульон- МПБ, мясо- пептонный агар- МПА) и сложные (КА = МПА +5- 10% крови животных)
4. По назначению:
А) Общего назначения - универсальные , предназначенные для культивирования любых микроорганизмов (МПА,КА )
Б) Специальные для выращивания микроорганизмов не растущих на универсальных средах, дифференциации видов и избирательного выделения отдельных видов микроорганизмов:
элективные (селективные) для выделения определенных видов микроорганизмов и подавления роста сопутствующих – (солевой агар для стафилококков).
дифференциально-диагностические (ДДС)-среды, позволяющие различать виды бактерий по ферментативной активности; Они содержат: 1) универсальную питательную среду ( МПА, КА); 2)дифферецирующий фактор - химический субстрат (например, углевод), различное отношение к которому является диагностическим признаком для данного микроба.3) Индикатор, изменение цвета которого свидетельствует о биохимической реакции. (среды Эндо, Плоскирева, Гисса и другие).
дифференциально-селективные (ДС) - среды, позволяющие выделять бактерии определенного вида по их физиологическим особенностям и дифференцировать от других видов по ферментативной активности Они содержат: 1) МПА 2) элективный химический субстрат, препятствующий росту других видов бактерий. 3)дифферецирующий фактор - субстрат, отношение к которому является диагностическим признаком для данного микроба;) 4.) Индикатор, изменение цвета которого свидетельствует о биохимической реакции. (среды ЖСА для стафилококков, ВСА для сальмонелл, Плоскирева для шигелл и сальмонелл).
В) Обогащения среды для размножения и накопления бактерий определенного вида в клиническом материале (кровь в 20% желчном бульоне =сальмонеллы, отделяемое зева в 10 % сывороточном+ 2 % теллурита = коринебактерии.)
Г) Транспортные среды для забора и доставки (консервации) клинического материала =48 часов (Среда Амиеса –полужидкий агар+уголь активированный).)
Питательные среды (примеры):
Среда Эндо Тип среды дифференциально-диагностическая для энтеробактерий Питательная основа МПА Дифференцирующий фактор лактоза 1% Индикатор основной фуксин, обесцвеченный сульфитом натрия. Е.сoli разлагают лактозу до кислоты –колонии красные с металлическим блеском, патогенные бесцветные;
Солевой агар Тип среды элективная для выделения стафилококков Питательная основа МПА Элективный фактор хлористый натрий 10%
Среда Плоскирева Тип среды дифференциально-селективная для энтеробактерий
Питательная основа МПА Элективный фактор соли желчных кислот Дифференцирующий фактор лактоза
Индикатор нейтральный красный
Желточно-солевой агар Тип среды дифференциально-селективная для S. aureus_
Питательная основа МПА Элективный фактор хлористый натрий 10%
Дифференцирующий фактор яичный желток
Индикатор нет
2► 2 этап бактериологического метода исследования (выделение чистой культуры):
А) Изучение изолированных колоний (эшерихий, стафилококка) на пластинчатом МПА.
| Изучаемые культуральные свойства | 1 тип колоний | 2 тип колоний |
| - форма колонии | Правильной формы, круглые | Правильной формы |
| - консистенция | однородные | однородные |
| - размер колонии | средние (размером 2-4 мм) | Крупные, |
| - цвет | белые | серые |
| - характер края | с ровными краями | с ровными краями |
| - характер поверхности | выпуклые | плоские |
Б) Приготовление мазков из отобранных колоний (окраска по Граму).
| 2. Морфология микроорганизмов из изолированных колоний (окраска по Граму)
|
В) Пересев изолированных колоний на скошенный МПА для накопления чистой культуры.
3►Выделение чистой культуры анаэробных бактерий: посев суспензии почвы на среду Китта-Тароцци для выделения патогенных клостридий
Среда Китт— Тароцци состоит из питательного бульона, 0,5% глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20 — 30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина или вазелинового масла для изоляции от доступа кислорода.
Методы создания анаэробиоза:
1.Физический- откачивание воздуха, введение специальной газовой безкислородной смеси (чаще- N2- 85%, CO2- 10%, h3- 5%), предварительное кипячение питательных сред, посев в глубокий столбик агара, заливка сред вазелиновым маслом для сокращения доступа кислорода, использование герметически закрывающихся флаконов и пробирок, шприцев и лабораторной посуды с инертным газом, использование плотно закрывающихся эксикаторов с горящей свечой
2.Химический- применяют химические поглотители кислорода.
3.Биологический - совместное культивирование строгих аэробов и анаэробов (аэробы поглощают кислород и создают условия для размножения анаэробов – метод Фортнера).
Среда Китт — Тароцци состоит из питательного бульона, 0,5 % глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20 — 30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина или вазелинового масла для изоляции от доступа кислорода.
4.Смешанный- используют несколько разных подходов.
Используются специальные приборы для создания анаэробных условий - анаэростаты. В настоящее время наиболее простым и эффективным оборудованием для создания анаэробных и микроаэрофильных условий является химический метод со специальными пакетами, действующими по принципу поглощения атмосферного кислорода в герметически закрытых емкостях.
Среда Вильсона-Блера (пробирки,чашки):
Питательная основа МПА Дыхательный субстрат глюкоза
Редуцирующий фактор сульфит натрия и двуххлористое железо сульфит-натрия Na2SO3 →Na2S
Для среды Вильсона — Блера базой является агар с добавлением глюкозы, Клостридии образуют на этой среде колонии чёрного цвета за счет восстановления сульфита до сульфид — аниона, который соединяясь с катионами железа (II) дает соль чёрного цвета. Как правило, черные на этой среде образования колонии, появляются в глубине агарового столбика.
Тиогликолевая среда (среда для контроля стерильности): (пробирки):
Питательная основа МПБ Дыхательный субстрат глюкоза Редуцирующий фактор тиогликолят натрия
Индикатор резазурин
Глюкозо-кровяной агар Цейсслера: (чашки): Питательная основа МПА, кровь
Дыхательный субстрат глюкоза Редуцирующий фактор гемоглобин
Термин «анаэробы» ввел Луи Пастер, открывший в 1861 году бактерии маслянокислого брожения.
А Лекция 3 Физиология микроорганизмов. Метаболизм бактерий.
Физиология микроорганизмов включает:
типы питания;
типы дыхания;
культивирование (условия, среды, характер и скорость роста);
биохимическую активность;
изменчивость;
выделение биологически активных веществ, токсинов и других факторов патогенности;
чувствительность к антибиотикам, бактериофагам, бактериоцинам;
другие биологические свойства.
Метаболизм бактерий – совокупность физико-химических процессов (химических превращений и реакций), направленных на воспроизводство структур и обеспечение жизненных функций микробной клетки, таких как:
рост и размножение;
отложение резервного пищевого материала;
транспорт питательных веществ в микробную клетку;
выделение продуктов метаболизма (токсинов, ферментов, антибиотиков и других биологически активных веществ);
движение;
спорообразование;
адгезия на чувствительных рецепторах клеток хозяина и проникновение в них;
различных адаптивных реакций на изменение внешней среды.
Анаболизм — совокупность биохимических реакций, осуществляющих синтез компонентов клетки.
Катаболизм — совокупность реакций, обеспечивающих клетку энергией.
Схема изучения метаболизма – этапы:
1. Начальный (периферический) метаболизм – проникновение веществ в клетку извне и распад до промежуточных продуктов.
2. Амфиболизм (промежуточный метаболизм) – образование промежуточных продуктов метаболизма, общих для катаболических и анаболических путей.
3. Конечные, строго специализированные этапы конструктивного метаболизма (ведут к построению структур клетки) и энергетического метаболизма (образование АТФ).
Механизмы проникновения питательных веществ в клетку:
Простая диффузия (для истинных растворов). Энергонезависимый процесс.
Облегченная диффузия («паром по течению») – в направлении градиента концентрации с участием белков – переносчиков. Энергозависимый процесс.
Активный транспорт – против концентрационного и электрохимического градиента с участием пермеаз (амино-, оксикислотных, ионных и др.). Процесс идет с затратой энергии АТФ, зависит от заряда веществ и их трансформации в процессе переноса.
Микроорганизмы по способности усваивать источники углерода делятся на две группы: автотрофы (лат. autos — сам,trophe — питание) синтезируют все углеродсодержащие компоненты клетки из СО2как единственного источника углерода и гетеротрофы (лат.heteros — другой, «питающийся за счет других») используют разнообразные органические углеродсодержащие соединения.
В зависимости от источников энергии и микроорганизмы подразделяют на фототрофы (фотосинтезирующие), способные использовать солнечную энергию, и хемотрофы (хемосинтезирующие), получающие энергию за счет окислительно-восстановительных реакций.
В зависимости от используемых доноров электронов бактерии разделяют на литотрофы (используют неорганические доноры электронов) и органотрофы (используют органические соединения).
Прототрофы- микроорганизмы, способные синтезировать все необходимые им органические соединения из глюкозы и солей аммония.
Ауксотрофы- микроорганизмы, не способные синтезировать какие-либо органические соединения. Они получают эти соединения в готовом виде из окружающей среды или организма человека.
Ферменты(от греч.fermentum-закваска ) -высокоспецифические белковые катализаторы, присутствующие во всех живых клетках, без которых не возможны жизнь и размножение. Ферменты распознают соответствующие им метаболиты (субстраты), вступают с ними во взаимодействие и ускоряют химические реакции. Ферменты являются белками.
Ферментный состав микроорганизма определяется геномом и является достаточно стабильным признаком. Определение ферментов широко применяется для биохимической идентификации бактерий.
Эндоферменты катализируют метаболизм проходящий внутри клетки.
Экзоферменты выделяются клеткой в окружающую среду.
Конститутивныеферменты постоянно синтезируются в определенных концентрациях.
Индуцибельныеферменты – это ферменты, концентрация которых увеличивается при поступлении соответствующего субстрата.
Ферменты агрессии: гиалуронидаза, фибринолизин, нейраминидаза, коллагеназа, лецитиназа (лицитовителлаза), коагулаза, уреаза, аминокислотные декарбоксилазы, дезоксирибонуклеаза.
Культивирование – получение культур микроорганизмов в условиях искусственной питательной среды.
Цели культивирования:
получение чистых культур патогенных микроорганизмов и их идентификация;
накопление биомассы продуцентов БАВ (витаминов, гормонов, аминокислот, антибиотиков и др.);
получение диагностических и профилактических препаратов (вакцин, диагностикумов);
хранение эталонных музейных культур;
в санитарной микробиологии для определения санитарно-показательных микроорганизмов – индикаторов загрязненности окружающей среды.
Культура – популяция микроорганизмов, выращенная на питательной среде.
Чистая культура– популяция одного вида микроорганизмов, выращенная из изолированной колонии на питательной среде.
Большинство патогенных микробов выращивают на питательных средах при температуре 37°С в течение 1-2 сут.
Классификация питательных сред
По консистенции: жидкие, полужидкие, плотные.
По происхождению: естественные (молоко, картофель), искусственные, полусинтетические, синтетические
По составу: простые (МПА, МПБ, овощи, молоко), сложные (1% глюкозы, 10-20% сыворотки крови, 20-30% асцитической жидкости,5-10% дефибринированной крови).
По назначению:
универсальные — среды, на которых хорошо растут многие виды бактерий. К ним относятся мясо-пептонный бульон (МПБ) и мясо-пептонный агар (МПА);
специальные - среды, специально приготовленные для получения роста бактерий, которые не растут на универсальных средах;
дифференциально-диагностические - среды, позволяющие отличать одни виды бактерий от других по ферментативной активности;
селективные — среды, содержащие вещества, используемые микроорганизмами определенных видов и препятствующие росту других микроорганизмов. Селективные среды позволяют направленно отбирать из исследуемого материала определенные виды бактерий;
дифференциально-селективные — среды, сочетающие в себе свойства дифференциально-диагностических и селективных сред;
консервирующие;
обогатительные.
Размножение бактерий на жидких и плотных питательных средах.
Рост координированное воспроизведение всех компонентов бактериальной клетки и увеличение ее биомассы.Размножение– воспроизводство и увеличение количества клеток, приводящее к образованию бактериальной популяции.
Бактерии характеризуются высокой скоростью размножения. Скорость размножения зависит от видовой принадлежности, состава питательной среды, рН, температуры, аэрации.
На плотных питательных средах бактерии образуют скопления клеток, называемые колониями. Колонии разных видов отличаются по размерам, форме, консистенции, окраске, характеру краев, характеру поверхности, прозрачности.
Характер роста на жидких питательных средах: пленочный (образованием пленки на поверхности питательной среды), диффузное помутнение, придонный (образование осадка).
Фазы развития бактериальной популяции
Исходная стационарная фаза (~ 1-2 ч.). Число бактерий не увеличивается, клетки не растут.
Лаг-фаза или фаза задержки размножения (~ 2ч.).
Log-фаза - логарифмическая или экспоненциальная фаза (~ 3-5ч). Популяция делится с максимальной скоростью и идет увеличение особей в геометрической прогрессии.
Фаза отрицательного ускорения (~ 2ч.). Связана с истощением лимитирующего метаболита или накоплением токсических продуктов метаболизма.
Стационарная фаза максимума. Количество образующихся и отмирающих клеток одинаково.
Фаза ускоренной гибели (~ 3 ч.).
Логарифмическая фаза гибели (~ 5 ).
Фаза уменьшения скорости отмирания – остающиеся живые особи переходят в состояние покоя.
Энергетический метаболизм бактерий
Аэробы -микроорганизмы, использующих аэробный (окислительный) тип биологоческого окисления субстратов. Метаболизм аэробов осуществляется только при наличии в среде обитания высокой концентрации свободного кислорода, который выполняет функцию конечного акцептора отнятых от субстрата электронов. Культивирование аэробов осуществляют на средах с полным доступом кислорода воздуха.
Облигатные анаэробы- микроорганизмы, использующая анаэробный тип биологического окисления (брожение). Метаболизм осуществляется только в средах с низким окислительно-востановительным потенциалом при отсутствии кислорода.
Повышение концентрации кислорода в среде ведет к гибели вегетативных форм.
Количество извлекаемой в процессе брожения энергии невелико, поэтому облигатные анаэробы вынуждены сбраживать большое количество субстрата.
Факультативные анаэробы- микроорганизмы, способные извлекать энергию из субстратов аэробным (окислительным) и анаэробным (бродильным) путями биологического окисления. Метаболизм может осуществляться как в условиях полного доступа кислорода в среду, так и в условиях анаэробиоза.
Методы создания анаэробиоза
Физические
посев в столбик сахарного МПА;
кипячение (регенерация) жидких питательных сред с последующим масляным покрытием;
механическое удаление кислорода в анаэростатах;
замена кислорода индиферентным газом;
трубки Вейона-Виньяля.
Химические
аппарат Аристовского;
свеча Омелянского (щелочной р-р пирогаллола);
использование химических акцепторов кислорода: глюкозы, пировиноградной кислоты, муравьинокислого натрия и др.
Биологические
среда Китта-Тароцци
метод Фортнера
Анаэробы — организмы, получающие энергию при отсутствии доступа кислорода путем субстратного фосфорилирования, конечные продукты неполного окисления субстрата при этом могут быть окислены с получением большего количества энергии в виде АТФ в присутствии конечного акцептора протонов организмами, осуществляющими окислительное фосфорилирование.
Анаэробное дыхание— совокупностьбиохимических реакций, протекающих в клетках живых организмов при использовании в качестве конечного акцептора протонов некислорода, а других веществ (например,нитратов) и относится к процессамэнергетического обмена(катаболизм,диссимиляция), которые характеризуютсяокислениемуглеводов,липидовиаминокислотдо низкомолекулярных соединений.
Аэробные и анаэробные бактерии предварительно идентифицируются в жидкой питательной среде по градиенту концентрации O2:
1. Облигатные аэробные(нуждающихся в кислороде) бактерии в основном собираются в верхней части пробирки, чтобы поглощать максимальное количество кислорода. (Исключение: микобактерии — рост пленкой на поверхности из-за восколипидной мембраны.)
2. Облигатные анаэробныебактерии собираются в нижней части, чтобы избежать кислорода (либо не дают роста). 3.Факультативные бактериисобираются в основном в верхнем (окислительное фосфорилированиеявляется наиболее выгодным, чем гликолиз), однако они могут быть найдены на всем протяжении среды, так как от O2не зависят. 4. Микроаэрофилысобираются в верхней части пробирки, но их оптимум — малая концентрация кислорода. 5.Аэротолерантные анаэробы не реагируют на концентрации кислорода и равномерно распределяются по пробирке.
Д ля измеренияпотенциаласредыМ. Кларкпредложил использовать величину ph30 — отрицательныйлогарифмпарциального давлениягазообразноговодорода. Диапазон [0-42,6] характеризует все степени насыщения водного раствора водородом и кислородом. Аэробы растут при более высоком потенциале [14-20], факультативные анаэробы [0-20], а облигатные — при наиболее низком [0-10].)[2]
ля измеренияпотенциаласредыМ. Кларкпредложил использовать величину ph30 — отрицательныйлогарифмпарциального давлениягазообразноговодорода. Диапазон [0-42,6] характеризует все степени насыщения водного раствора водородом и кислородом. Аэробы растут при более высоком потенциале [14-20], факультативные анаэробы [0-20], а облигатные — при наиболее низком [0-10].)[2]
Классификация анаэробов, различают:
Факультативные анаэробы
Капнеистические анаэробы и микроаэрофилы
Аэротолерантные анаэробы
Умеренно-строгие анаэробы
Облигатные анаэробы
Если организм способен переключаться с одного метаболического пути на другой (например, с анаэробного дыхания на аэробноеи обратно), то его условно относят к факультативным анаэробам[3].
До 1991 года в микробиологии выделяли класс капнеистических анаэробов, требовавших пониженной концентрации кислородаи повышенной концентрации углекислоты (Бруцеллы бычьего типа — B. abortus)[2]
Этапы бактериологического исследования
| 1. Забор материала: 1) выбор материала определяется клинической картиной: при заболеваниях верхних дыхательных путей – слизь из носа и зева, мокрота, ликвор; при заболеваниях желудочно-кишечного тракта – испражнения, промывные воды, рвотные массы; при генерализованных формах – кровь; 2) материал берут до начала лечения; 3) в разные стадии заболевания берут разный материал |
| 2. Транспортировка: 1) необходимы специальные транспортные среды, 2) важно соблюдать условия транспортировки |
| 3. Посев материала на плотные питательные среды для получения изолированных колоний (см. табл. 54, 55) |
| 4. Изучение культуральных признаков (см. табл. 56) |
Окончание табл. 53
| 5. Изучение морфологических и тинкториальных (отношение к окраске) признаков = приготовление мазка и окраска по Граму |
| 6. Выделение чистой культуры и накопление биомассы = посев на скошенный столбик элективной питательной среды |
| 7. Проверка чистоты культуры = мазок, окраска по Граму |
| 8. Идентификация выделенной чистой культуры = изучение биохимических и серологических свойств бактерий (см. табл. 57) |
Таблица 54
Особенности выделения чистых культур аэробных бактерий
| 1. Механическое разобщение клеток: а) метод Коха: готовят десятикратные разведения материала в хлориде натрия, из каждого разведения 1 петлю вносят в пробирку с агаром (400) и выливают его в чашку Петри; б) метод Дригальского: 1 петлю материала наносят на поверхность агара в чашку Петри и растирают шпателем, затем, не прожигая его, растирают по поверхности агара второй, а затем третьей чашки и т.д; в) механическое разобщение петлей; г) количественный метод Голда: 1 мл жидкого или 1 г твердого материала вносят в 9 мл NaCl, затем 1 петлю материала наносят на чашку = делают 40 штрихов (сектор А), задевая штрихи сектора А, проводят 4 штриха (1-й сектор), аналогично засевают 2-й и 3-й секторы |
| 2. Предварительная обработка материала с помощью физических или химических факторов. Например: 1) неспорообразующие бактерии уничтожают прогреванием при 80 0С 20 мин, споры при этом сохраняются; 2) для выделения микобактерий материал обрабатывают кислотой, при этом сопутствующая флора погибает |
| 3. Избирательное подавление сопутствующих бактерий физическими или химическими факторами во время инкубации посевов. Например: для выделений иерсиний чумы посевы инкубируют при Т=5 0С |
Окончание табл. 54
| 4. Заражение чувствительных животных = для выделения возбудителя чумы из трупов грызунов |
| 5. Использование биологических свойств бактерий. Например: метод Шукевича для выделения протея (ползучий рост) |
Таблица 55
Особенности выделения чистых культур анаэробных бактерий
| 1. Применение специальных сред = Китта – Тароцци (питательный бульон, глюкоза, 0,15% агара, кусочек мяса, рН=7,4) |
| 2. Механическая защита = сверху наливают вазелиновое масло |
| 3. Культивирование в анаэростатах |
| 4. Культивирование в толще питательной среды по Вейнбергу: 1 петлю материала вносят в бульон, оттуда пастеровской пипеткой переносят в агар (450) и готовят 10-тикратные разведения |
| 5. Метод Виньяла – Вейона = культивирование в запаянных ампулах или пастеровских пипетках |
| 6. Посев в высокий столбик питательной среды: 10-15 мл плотной среды, материал засевают уколом |
| 7. Химическая защита: в пробирку с питательной средой вносят химические вещества = поглотители кислорода: щелочной раствор пирогаллола, гидрокарбонат натрия и гидросульфит натрия |
| 8. Биологический метод Фортнера: на чашку с питательной средой засевают одновременно аэробы и анаэробы, после чего чашку герметизируют парафином |
| Ход выделения: 1) материал первоначально засевают на среды обогащения = в 2 пробирки со средой Китта – Тароцци, одну – выдерживают при 80 0С 30 мин для уничтожения вегетативных форм и сопутствующей флоры, вторую – нет. Обе пробирки затем инкубируют в термостате; 2) делают пересев из среды Китта – Тароцци по методу Цейсслера: материал петлей наносят на 1 чашку и растирают шпателем последовательно в 1, 2 и 3-й чашке...; 3) выделяют чистую культуру и идентифицируют |
Таблица 56
Культуральные признаки бактерий
(характер колоний на плотной питательной среде)
| Величина | Крупные, средние, мелкие |
| Форма | Круглые, овальные, розеткообразные, напоминающие гриву льва, яичницу и т.п. |
| Цвет | Белые, желтые, красные, бесцветные |
| Консистенция | Сухие, влажные, слизистые |
| Поверхность | Гладкая, морщинистая, плоская, выпуклая |
| Край | Ровный, волнистый, фестончатый |
| Структура | Аморфная, зернистая, волокнистая |
Таблица 57
Изучение биохимических признаков бактерий
(«пестрый ряд»)
| Определение сахаролитических ферментов = посев на «пестрый ряд» (среды Гисса – включают в себя углевод и индикатор Андреде). Для сбора газообразных продуктов в пробирки помещают поплавок | |
| Короткий «пестрый ряд»включает углеводы: глюкоза, лактоза, мальтоза, сахароза, маннит | Длинный «пестрый ряд»включает те же углеводы, что и короткий ряд: глюкоза, лактоза, мальтоза, сахароза, маннит и дополнительно в его состав входят: 1) моносахариды: арабиноза, ксилоза, рамноза, галактоза; 2) полисахариды: инулин, крахмал, гликоген; 3) спирты: глицерин, дульцит, инозит |
| Учет результатов: 1. Если цвет среды изменился, бактерии ферментируют этот углевод до кислых продуктов (ставят в таблице букву К). 2. Если наряду с изменением цвета среды в поплавке обнаруживается газ, бактерии ферментируют этот углевод до кислоты и газа (ставят – КГ). 3. Если цвет среды не изменился, бактерии не ферментируют этот углевод |
Окончание табл. 57
| Определение протеолитических ферментов = посев бактерий уколом в столбик 10-20% желатины и пептонную воду (в пробирку к пробке прикрепляют индикаторные бумажки на индол, сероводород, аммиак). Для обнаружения каталазы на стекло наносят культуру и каплю 1-3% р-ра Н2О2 |
| Учет результатов: 1. При наличии протеолитических ферментов бактерии разжижают желатин, образуя «воронку» или «елочку». 2. При образовании газообразных продуктов разложения пептона бумажки меняют цвет: бумажка на аммиак – синеет, бумажка на сероводород - чернеет, бумажка на индол – розовеет. |
Таблица 58
Протокол выделения чистой культуры и идентификации бактерий
| Морфология бактерий | |||||
| Окраска по Граму и другими методами | |||||
| Характер роста (культуральные признаки) | Колонии на плотной среде | ||||
| Рост на жидкой среде | |||||
| Биохимические признаки | ферментация | глюкозы | |||
| лактозы | |||||
| сахарозы | |||||
| мальтозы | |||||
| маннита | |||||
| образование | индола | ||||
| сероводорода | |||||
| аммиака | |||||
| каталазы | |||||
| Наименование рода и вида культуры | |||||
Таблица 59
Особенности культивирования риккетсий и хламидий
| Риккетсии и хламидии = внутриклеточные паразиты – на питательных средах не растут | |
| Риккетсии культивируют в: 1) куриных эмбрионах, 2) культурах клеток, 3) организме чувствительных животных, 4) организме переносчиков болезней: вшей, блох, клещей | Хламидии культивируют в: 1) куриных эмбрионах, 2) культурах клеток, 3) организме чувствительных животных |
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Борисов Л.Б. Медицинская микробиология, вирусология, иммунология. М.: МИА, 2002. 736 с.
2. Борисов Л.Б. с соавт. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии. М. : Медицина, 1993. 240 с.
3. Медицинская микробиология, вирусология и иммунология /Под ред. А.А. Воробьева. М.: Медицинское информационное агентство, 2008. 464 с.
4. Райкис Б. Н. с соавт. Общая микробиология с вирусологией и иммунологией (в графическом изображении). М.: Триада-Х, 2002. 352 с.
ОГЛАВЛЕНИЕ
Принципы классификации микроорганизмов……..……………4
Систематика и морфология болезнетворных бактерий………..7
Микроскопические методы изучения морфологии бактерий…18
Физиология болезнетворных бактерий…..……………………..26
Принципы и методы культивирования бактерий.
Бактериологическое исследование…..………………………….35
Список рекомендуемой литературы.……………………………46
ОСНОВЫ ОБЩЕЙ БАКТЕРИОЛОГИИ (В ТАБЛИЦАХ)
Методические указания
Редактор З.М. Порфирьева
Подписано в печать--- .---.16. Форма 60Х84/16. Бумага газетная. Гарнитура Times. Печать оперативная. Усл. печ.л. 2,79.
Уч.-изд. л. 2,13. Тираж 500 экз. Заказ № ____.
Чувашский государственный университет
Типография университета
428015 Чебоксары, Московский просп., 15
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Основные принципы и этапы бактериологического исследования
1. Квалифицированный выбор материала, подлежащего исследованию: для клинических образцов — с учетом характера и локализации патологического процесса, патогенеза заболевания и его стадии; для объектов окружающей среды — с учетом возможного значения их в качестве путей и факторов передачи микроорганизмов — возбудителей инфекций.
2. Отбор проб материала для исследования в необходимом и достаточном объеме. Обеспечение своевременной доставки материала для сохранения жизнеспособности искомых бактерий.
3. Выбор оптимального набора соответствующих питательных сред для первичного посева и накопления возбудителя с учетом характера материала, свойств искомого микроорганизма и посевных доз.
4. Соблюдение классических принципов тщательного изучения посевов.
5. Изучение фенотипических характеристик выделенных чистых культур, в первую очередь, биохимических свойств с максимально возможной стандартизацией условий их определения.
6. Определение согласно классификационным таблицам таксономического положения выделенной культуры в соответствии с задачами исследования (родовой, видовой, внутривидовой принадлежности). Бактериологическое исследование проводится в несколько этапов:
1. Посев доставленного материала на среды обогащения. Для некоторых видов материалов осуществляют предварительную подготовку их для посева, а затем инкубацию посевов для всех видов при условиях, соответствующих свойствам искомых бактерий.
2. Изучение чашек с посевами. Выделение чистых культур из намеченных колоний для дальнейшего изучения с использованием для этого комбинированных сред для первичной идентификации.
3. Учет результатов посева в комбинированные среды пос-'' ле 18—20 часов инкубации. Изучение морфологических и тинкториальных свойств. Посевы для воспроизведения тестов минимального дифференцирующего ряда. I Ориентировочное изучение культур в реакциях агглю - j тинации.
4. Определение рода и вида микроорганизмов на основании учета результатов посевов в среды минимального дифференцирующего ряда. При необходимости проводить посевы для определения дополнительных биохимических признаков.
5. Учет дополнительных биохимических тестов.
Схема бактериологической диагностики колиэнтеритов
Бактериологическому исследованию на содержание эн-теропатогенных кишечных палочек подвергают испражнения, рвотные массы, слизь из зева и носа, при исследовании секционного материала — кровь из сердца, кусочек легкого, печени, селезенки, почек, отрезки тонких и толстых кишок.
Если испражнения не могут быть доставлены в лабораторию в первые два часа с момента взятия, их сохраняют в леднике при температуре + 4°С, но не дольше суток или консервируют в глицериновой смеси.
Учитывая, что при колиэнтеритах поражается преимущественно тонкий кишечник, целесообразней исследовать последние порции кала.
1-й день: материал, поступивший на исследование, засевают на плотные накопительные питательные среды: Эндо, Левина, ВСА.
При посеве испражнений небольшое количество материала эмульгируют в физиологическом растворе. После оседания крупных частиц с поверхности жидкости берут 1—2 капли приготовленной взвеси, вносят ее в чашку Петри и на небольшом участке питательной среды растирают стерильным стеклянным шпателем. Затем шпатель отрывают от поверхности агара, и не прожигая его, распределяют остаток материала по остальной поверхности чашки.
2-й день: просматривают посевы, сделанные накануне. Колонии энтеропатогенных кишечных палочек не отличаются от колоний непатогенных кишечных палочек. На чашках со средой Эндо они имеют круглую форму, ровный край, матовую поверхность, малиново-красный цвет.
Из 10 изолированных колоний с культурально-морфоло-гическими признаками, характерными для кишечной палочки, берут часть материала для пробной агглютинации на стекле так, чтобы оставшаяся часть колонии в случае надобности могла быть использована для дальнейшего исследования. С материалом каждой колонии отдельно ставят реакцию агглютинации на стекле с неразведенной агглютинирующей комплексной ОВ-коли-сывороткой.
При положительном результате реакции агглютинации исследуемая культура в первую же минуту наблюдения образует хорошо видимые простым глазом крупные хлопья аг-глютината. Материал из 3—5 колоний, бактерии которых агглютинировались смесью сывороток на предметном стекле, отсевают в пробирки со скошенным мясопептонным агаром (МПА) для дальнейшего изучения чистой культуры.
3-й день: просматривают посевы на скошенном МПА. На поверхности агара кишечная палочка образует влажный, блестящий налет сероватого цвета. Культуры, выросшие на МПА, проверяют повторно в реакции агглютинации на стекле.
Микробную культуру, выращенную на скошенном МПА и давшую повторно реакцию агглютинации на стекле, пересевают:
а) для изучения сахаролитических свойств в среды Гиса с глюкозой, лактозой, маннитом, мальтозой, сахарозой; б) для выявления индола в пробирку с бульоном Хот-тингера; в) для выявления сероводорода в мясопептонный бульон; г) для выявления активной подвижности производят посев в полужидкий питательный агар.
4-й день: регистрируют в протоколе проведенные исследования.
Схема микробиологического исследования сальмонелл
Наиболее ранним и достоверным методом диагностики брюшного тифа и паратифов следует считать выделение гемокультуры, так как бактериемия у больных возникает с конца инкубационного периода и продолжается в течение всего лихорадочного периода болезни. Частота выделения возбудителя из крови больного в 1-ю неделю заболевания достигает 100%. Со 2-й недели процент положительных результатов уменьшается. Кровь для посева берут из вены локтевого сгиба: на 1-й неделе в количестве 10 мл, на 2-й и 3-й неделе — 15—20 мл.
С 3-й недели заболевания, в связи с тем, что патологический процесс и соответственно возбудитель заболевания сосредотачиваются в лимфатическом аппарате кишечника, начинается интенсивное выделение бактерий из испражнений.
Выделение бактерий брюшного тифа из крови 1-й день: кровь больного засевают немедленно после взятия во флаконе 10—20% желчным бульоном. Желчь, содержащаяся в питательных средах, способствует росту сальмонелл и предотвращает свертывание крови.
2-й день: просматривают колбы с посевами, сделанными накануне. Размножение бактерий в желчном бульоне в первые 2—3 дня после произведенного посева не всегда сопровождается помутнением среды. Поэтому независимо оттого, помутнела среда или нет, делают высев на чашки с висмут-сульфитным агаром и среду Плоскирева. Засеянные среды ставят в термостат вместе с первичным посевом крови. Последний сохраняют для повторных высевов на тот случай, если на плотных питательных средах не обнаружатся колонии, характерные для сальмонелл. Повторные высевы со сред обогащения производят на 2-е, 3-й, 5-е, 7-е и 10-е сутки. При отсутствии характерных колоний после высева, произведенного на 10-е сутки, лаборатория дает отрицательный ответ и прекращает исследование.
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе