Анализ на ферменты
Анализ крови на ферменты
Главная » Анализ крови » Анализ крови на ферменты
Анализ крови на ферменты является основной частью методов установления патологий и болезней, который основан на выяснении степени активности энзимов. Эти исследования проводятся под четким руководством науки под названием энзимодиагностика. Отдельной группой среди методов этой науки являются диагностики различных иммунных ферментов.
Суть данного метода заключается во внедрении в организм человека антител, которые с помощью химических связей соединяются с ферментом, образуют с антителом антиген, с легкостью потом выявляющийся в биологических жидкостях. Этот метод способствует качественному и количественному определению наличия тех или иных ферментов в организме. Основной задачей энзимологии является определение очагов, где сконцентрировано патологическое количество ферментов. Это место и является болезнетворным в организме.
Также выделяют ряд энзимов, которые слишком активны при наличии отмирающих клеток. Такими ферментами являются некротические вещества, остро реагирующие на наличие очагов поражения тканей и органов. Еще анализ на ферменты включает в себя тест, который выявляет изменение нормальной активности этих веществ, что свидетельствует о расстройствах в функционировании органов или их систем.
При диагностировании и обнаружении дисфункции ферментов или отклонений от норм, необходимо сразу же обратиться к специалистам и начинать лечение.
Среди основных жизненно важных ферментов следует выделить следующие: амилаза, липаза, лактатдегидрогеназа, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза. Анализы на все вышеперечисленные энзимы делают утром натощак. Для диагностики берут пробу крови с вены или с первой утренней мочи. Данные ферменты вырабатывают различные железы внутренней секреции нашего организма.
Отклонения от нормы распознают с помощью специальных лабораторных расшифровок в течении 1-2-х недель. В случае рецидивов и острых болей анализы берут в любое время суток, результаты оглашают в течение нескольких часов в экстренном порядке. В случае получения результатов теста, необходимо тут же обратиться к специалисту.
Диагностика активности амилазы
Начать следует с амилазы крови, которая производится поджелудочной железой и способствует быстрому протеканию процессов пищеварения. Основной функцией амилазы является расщепление крахмала или гликогена с образованием конечного продукта реакции — глюкозы. Наиболее распространенной в силу своей активности стала альфа-амилаза.
Нормальными показателями амилазы в человеческом теле считаются: • в крови 16-30 мк катал/л;
• в моче 28-100 мк катал/л
Цифры по активности амилазы показывают ряд патологий поджелудочной железы и разных форм панкреатита. При пониженных показателях амилазы в моче и крови больному можно диагностировать муковисцидоз или перенесенный приступ панкреатита. Повышение показателей амилазы свидетельствуют о сильном алкогольном отравлении, свинке, внематочной беременности, обострении панкреатита, о камнях, опухолях в поджелудочной железе.
А повышенная амилаза в моче оповещает о холецистите, аппендиците, панкреатите или о язве желудочно-кишечного тракта.
Диагностика активности липазы
Липазой называют фермент, который участвует в трансформации жиров. Этот энзим проявляет свою активность только в присутствии кофермента колипазы и желчных кислот. В выработке липазы организм задействует поджелудочную железу, форменные клетки крови — лейкоциты и легкие. Нормальными показателями активности липазы в крови являются 13-60 ЕД/мл. Тест на липазу более специфичен, чем на амилазу. Гиперсодержание липазы в крови свидетельствует о холестазе, язвах, сахарном диабете, холециститах, ожирении и подагре. Гипосодержание липазы говорит о различных опухолях, в основном поражающих поджелудочную железу, о неправильном питании или триглицеридемии.
Основным местом нахождения лактат дегидрогеназы является сердце, клетки тканей мышц, печень, селезенка, почки и поджелудочная железа. Лактат дегидрогеназа проявляется свою активность с ионами цинка и никотин-амидадениндинуклеотидом. Лактат дегидрогеназа превращает молочную кислоту в пировиноградную.
В организме человека существует 5 фракций данного энзима. Именно по наличию того или юного вида и диагностируются болезни.
Так, например, при повышении лактат дегидрогеназы 1 можно диагностировать инфаркт миокарда, а за счет выявления сильной активности фракций 4 и 5 можно определить гепатит. Нормой лактат дегидрогеназы в организме взрослого человека является 140-350 Ед/л, а у новорожденных — 400-700 Ед/л. Причинами повышенной лактат дегидрогеназы в организме можно считать инфаркт миокарда, цирроз печени, опухоли, лейкоз, панкреатит, заболевания почек, анемию и гепатит.
Диагностика активности аланинаминотрансферазы и аспартатаминотрансферазы
Аланинаминотрансфераза является ферментом, который способствует перемещению аминокислот с одной молекулы на другую. Этот энзим работает в присутствии витамина В6 и синтезируется в основном в клетках почек, печени, мышц, сердца и поджелудочной железы. Отсюда следует, что содержание данного фермента в крови приравнивается к нулю. Нормальным содержанием этого фермента у мужчин считается до 40 Ед/л, а у женщин до 32 Ед/л.
Высокое содержание аланинаминотрансферазы свидетельствует о циррозе, желтухе, раке печени, ожогах, инфаркте и гепатите. Пониженная активность говорит о циррозах и некрозах печени.
С данным аспартатаминотрансферазой в паре также работает витамин В6. Аспартатаминотрансфераза находится в основном в митохондриях и цитоплазме клеток. Нормальным содержанием этого энзима считается: у мужчин 15-31 Ед/л, а у женщин 20-40 Ед/л.
Аспартатаминотрансфераза повышена в случаях гепатита, алкоголизма, мононуклеоза, рака печени, цирроза, холестаза и инфаркте миокарда. кроме того, повышение активности данного фермента вызывают ожоги, тепловые удары, травмы, отравления, а понижение — при повреждениях печени и недостатке витамина В6.
Диагностика активности щелочной фосфатазы
Щелочная фосфатаза представляет собой фермент мембран клеток, которые находятся в основном в желчных каналах. Основное участие этот фермент принимает в обмене фосфорной кислоты. Он имеет различные формы: плацентарную, неспецифичную и кишечную. Щелочная кислота помогает диагностировать передозировку витамином С, недостаток кальция и фосфора, заболевания желчных путей и печени, расстройства в поджелудочной железе и заболевания костей.
Нормой содержания этого фермента в человеческом организме является: у взрослых 30-90 Ед/л, у подростков 400 и меньше Ед/л, а у беременных до 250 Ед/л. Повышение щелочной фосфатазы свидетельствует о гипертиреозе, болезнях крови, рахите, желтухе, опухолях костей и заболеваниях печени, почек и легких. Низкая активность щелочной фосфатазы свидетельствует об анемии, недостатке полезных веществ, гипертиреозе и нарушении костей скелета.
Помните, что данные анализы сдаются на голодный желудок с соблюдением некоторой диеты за 24 часа перед посещением больницы.Она заключается в отсутствии жирной, острой и жаренной пищи в рационе питания.
В случае каких-либо отклонений после получения расшифрованных результатов следует немедленно обратиться к врачу.
Будьте здоровы!
Оцените статью:
(Нет голосов) Загрузка...tvoianalizy.ru
Биохимический анализ крови, ферменты крови. Амилаза, липаза, АЛТ, АСТ, лактатдегидрогеназа, щелочная фосфатаза - повышение, снижение показателей. Причины нарушений, расшифровка анализа.
В биохимическом анализе крови часто используют определение активности ферментов. Что представляют собой ферменты? Фермент – это белковая молекула, которая ускоряет протекание биохимических реакций в организме человека. Синонимом понятия фермент является термин энзим. В настоящее время оба эти термина используются в одном значении в качестве синонимов. Однако наука, изучающая свойства, строение и функции ферментов, называется энзимологией.Рассмотрим, что же представляет собой данная сложная структура – фермент. Фермент состоит из двух частей – собственно белковой части и активного центра фермента. Белковая часть называется апофермент, а активный центр – кофермент. Вся молекула фермента, то есть апофермент плюс кофермент носит название голофермент. Апофермент всегда представлен исключительно белком третичной структуры. Третичная структура означает, что линейная цепочка аминокислот преобразуется в структуру сложной пространственной конфигурации. Кофермент может быть представлен органическими веществами (витамин В6, В1, В12, флавин, гем и т.д.) или неорганическими (ионы металлов – Cu, Co, Zn и т.д.). Собственно ускорение биохимической реакции производится именно коферментом.
Что такое фермент? Как работают ферменты?
Вещество, на которое фермент действует, называется субстратом, а вещество, которое получается в результате реакции, называется продуктом. Часто названия ферментов образуются путем прибавления окончания – аза к названию субстрата. Например, сукцинатдегидрогеназа – расщепляет сукцинат (янтарную кислоту), лактатдегидрогеназа – расщепляет лактат (молочную кислоту) и т.д.Ферменты делятся на несколько видов в зависимости от типа реакции, которую они ускоряют. Например, дегидрогеназы проводят окисление или восстановление, гидролазы проводят расщепление химической связи (трипсин, пепсин – пищеварительные ферменты) и т.д.
Каждый фермент ускоряет только одну определенную реакцию и работает в определенных условиях (температура, кислотность среды). Фермент имеет сродство к своему субстрату, то есть может работать только с этим веществом. Узнавание «своего» субстрата обеспечивается апоферментом. То есть процесс работы фермента можно представить таким образом: апофермент узнает субстрат, а кофермент ускоряет реакцию узнанного вещества. Данный принцип взаимодействия был назван лиганд – рецепторным или взаимодействием по принципу ключ – замок.То есть, как и к замку подходит индивидуальный ключ, так и к ферменту подходит индивидуальный субстрат.
Амилаза вырабатывается поджелудочной железой и участвует в расщеплении крахмала и гликогена до глюкозы. Амилаза – это один из ферментов, участвующих в пищеварении. Наибольшее содержание амилазы определяется в поджелудочной железе и слюнных железах.Существует несколько видов амилазы – α-амилаза, β-амилаза, γ-амилаза, из которых наибольшее распространение получило определение активности α-амилазы. Именно концентрацию этого вида амилазы определяют в крови в лаборатории.
В крови человека содержится два типа α-амилазы – Р-тип и S-тип. В моче присутствует 65% Р-типа α-амилазы, а в крови до 60% составляет S-тип. Р-тип α-амилазы мочи в биохимических исследованиях называют диастаза, во избежание путаницы.Активность α-амилазы в моче в 10 раз выше, чем активность α-амилазы в крови. Определение активности α-амилазы и диастазы используют для диагностики панкреатитов и некоторых других заболеваний поджелудочной железы. При хронических и подострых панкреатитах используют определение активности α-амилазы в соке двенадцатиперстной кишки.
| название анализа | норма в мккатал/л | единицы измерения в Ед/л (Е/л) |
| 16-30 мккатал/л | 20-100 Ед/л | |
| 28-100 мккатал/л | до 1000 Ед/л |
Повышение амилазы крови выявляется при следующих состояниях:
- в начале острого панкреатита, максимум достигается через 4 часа от начала приступа, а снижается до нормы на 2-6 сутки от начала приступа (повышение активности α-амилазы возможно в 8 раз)
- при обострении хронического панкреатита (при этом активность α-амилазы возрастает в 3-5 раз)
- при наличии опухолей или камней в поджелудочной железе
- острая вирусная инфекция – свинка
- алкогольная интоксикация
- внематочная беременность
- при остром панкреатите происходит увеличение активности диастазы в 10-30 раз
- при обострении хронического панкреатита активность диастазы возрастает в 3-5 раз
- при воспалительных заболеваниях печени наблюдается умеренное повышение активности диастазы в 1,5-2 раза
- острый аппендицит
- холецистит
- кишечная непроходимость
- алкогольная интоксикация
- кровотечения из язвы желудочно-кишечного тракта
- при лечении сульфаниламидными препаратами, морфином, мочегонными средствами и оральными контрацептивами
В крови снижение активности α-амилазы возможно после приступа острого панкреатита, при панкреонекрозе, а также при муковисцидозе.
Несмотря на то, что α-амилаза присутствует в почках, печени и поджелудочной железе, определение ее активности в основном используют в диагностике заболеваний поджелудочной железы. Для определения активности амилазы сдается кровь из вены, утром, натощак или средняя порция утренней мочи. Накануне перед сдачей анализа необходимо избегать жирной и острой пищи. При остром приступе панкреатита кровь из вены и моча сдаются в независимости от времени суток.В настоящее время в большинстве лабораторий используются ферментативные методы определения активности амилазы. Этот метод достаточно точен, высоко специфичен и занимает недлинный промежуток времени. Строение, виды и функции липазы Липаза – это один из пищеварительных ферментов, который участвует в расщеплении жиров.Для работы данного фермента необходимо присутствие желчных кислот и кофермента, который называется колипаза. Липаза вырабатывается различными органами человека – поджелудочной железой, легкими, лейкоцитами. Наибольшее диагностическое значение имеет липаза, которая синтезируется в поджелудочной железе. Поэтому определение активности липазы применяют преимущественно в диагностике заболеваний поджелудочной железы.| 13 - 60 | Ед/мл |
В моче здорового человека липаза отсутствует!
Липаза в диагностике заболеваний поджелудочной железы Для диагностики заболеваний поджелудочной железы липаза является более специфичным тестом, чем амилаза, поскольку ее активность остается нормальной при внематочной беременности, остром аппендиците, свинке и заболеваниях печени. Поэтому при возникновении подозрения на наличие панкреатита целесообразно определять активность липазы и амилазы одновременно.Повышение активности липазы сыворотки крови при остром панкреатите возможно от 2 до 50 раз относительно нормы. Для выявления именно острого алкогольного панкреатита используют соотношение активности липазы и амилазы, причем если данное соотношение больше 2, то данный случай панкреатита, несомненно, алкогольного происхождения.Повышение активности амилазы в крови происходит через 4-5 часов после приступа острого панкреатита, достигает максимума через 12-24 часа и остается повышенной в течение 8-12 дней. При развитии острого панкреатита активность липазы в сыворотке крови может увеличиваться раньше и значительнее, чем активность амилазы. При каких состояниях повышается активность липазы в сыворотке крови: Также повышение активности липазы возможно при травмах, ранениях, операциях, переломах и острой почечной недостаточности. Однако повышенная активность липазы при указанных состояниях не является специфичной для них, поэтому в диагностике данных заболеваний не используется. Снижение активности липазы в сыворотке крови наблюдается при опухолях различной локализации (кроме поджелудочной железы), удаленной поджелудочной железе,неправильном питании или наследственной триглицеридемии. Для определения активности липазы сдается кровь из вены, утром, натощак. Накануне вечером перед сдачей анализа не следует принимать жирную, острую и пряную пищу. В случае экстренной необходимости кровь из вены сдается в независимости от времени суток и предшествовавшей подготовки.В настоящее время для определения активности липазы чаще всего используют иммунохимический метод или ферментативный. Ферментативный метод более быстрый и требует меньшей квалификации персонала. Лактатдегидрогеназа (ЛДГ) – это фермент, который содержится в цитоплазме клеток почек, сердца, печени, мышц, селезенки, поджелудочной железы. Коферментом ЛДГ являются ионы цинка и никотинамидадениндинуклеотид (НАД). ЛДГ участвует в обмене глюкозы, катализируя превращение лактата (молочной кислоты) в пируват (пировиноградную кислоту). В сыворотке крови имеется пять изоформ данного фермента.ЛДГ1 и ЛДГ2 изоформы сердечного происхождения, то есть содержатся преимущественно в сердце. ЛДГ3, ЛДГ4 и ЛДГ5 – печеночного происхождения.| 0,8-4 мкмоль/ч*л | 140-350 Ед/л | |
| 2,0-8 мкмоль/ч*л | 400-700 Ед/л |
Для диагностики различных заболеваний большей информативностью обладает определение активности именно изоформ ЛДГ. Например, при инфаркте миокарда наблюдается значительное повышение ЛДГ1. Для лабораторного подтверждения инфаркта миокарда определяют соотношение ЛДГ1/ЛДГ2, и, если данное соотношение больше 1, значит у человека был инфаркт миокарда. Однако такие тесты широко не используютсяввиду их дороговизны и сложности. Обычно проводят определение общей активности ЛДГ, которая складывается из суммарной активности всех изоформ ЛДГ.
ЛДГ в диагностике инфаркта миокарда
Рассмотрим диагностическое значение определения суммарной активности ЛДГ. Определение активности ЛДГ используют для поздней диагностики инфаркта миокарда, поскольку увеличение его активности развивается через 12-24 часа после приступа и может сохраняться на высоком уровне до 10-12 суток. Это очень важное обстоятельство при обследовании больных, поступивших в лечебное учреждение после приступа. Если увеличение активности ЛДГ незначительно, значит, мы имеем дело с мелкоочаговым инфарктом, если, напротив, увеличение активности длительное – значит, речь идет об обширном инфаркте.У больных стенокардией активность ЛДГ увеличена в первые 2-3 дня после приступа.ЛДГ в диагностике гепатита
Активность суммарной ЛДГ может увеличиваться при остром гепатите (за счет увеличения активности ЛДГ4 и ЛДГ5). При этом активность ЛДГ в сыворотке крови повышается в первые недели желтушного периода, то есть в первые 10 дней. Норма ЛДГ у здоровых людей:Возможно повышение активности ЛДГ у здоровых людей (физиологическое) после физических нагрузок, во время беременности и после принятия алкоголя. Кофеин, инсулин, аспирин, ацебутолол, цефалоспорины, гепарин, интерферон, пенициллин, сульфаниламиды также вызывает увеличение активности ЛДГ. Поэтому при приеме данных препаратов нужно учитывать возможность повышенной активности ЛДГ, которая не говорит о наличии патологических процессов в организме.
Вообще повышение активности ЛДГ в сыворотке крови может выявляться при следующих патологических состояниях:- инфаркт миокарда
- острый гепатит (вирусный, токсический)
- цирроз печени
- раковые опухоли различной локализации (тератомы, дисгерминомы яичников)
- травмы мышц (разрывы, переломы и т.д.)
- острый панкреатит
- патология почек (пиелонефрит, гломерулонефрит)
- гемолитическая анемия, В12-дефицитная и фолиево дефицитная анемии
- лейкоз
| до 40 | Ед/л | |
| до 32 | Ед/л |
Повышение активности АЛТ у здоровых людей (физиологическое) может быть вызвано приемом некоторых лекарственных препаратов (антибиотиков, барбитуратов,наркотиков, противоопухолевых препаратов, оральных контрацептивов, нестероидных противовоспалительных препаратов, дикумаринов, эхинацеи, валерианы), сильными физическими нагрузками, травмами. Также высокая активность АЛТ наблюдается у подростков в период интенсивного роста.
АЛТ в диагностике заболеваний печени
При диагностике патологических состояний организма повышение активности АЛТ является специфическим признаком острого заболевания печени. Повышение активности АЛТ в крови выявляется за 1-4 недели до проявления симптомов болезни и за 7-10 дней до появления максимального уровня билирубина в крови. Увеличение активности АЛТ при остром заболевании печени составляет 5-10 раз. Повышенная активность АЛТ в течение длительного времени или повышение ее в поздние сроки заболевания свидетельствует о начале массивного некроза печени. Высокая активность АЛТ в крови выявляется при наличии таких патологий:- острый гепатит
- цирроз
- механическая желтуха
- введение гепатотоксических препаратов (например, некоторые антибиотики, отравление солями свинца)
- распад большой опухоли
- рак печени или метастазы в печени
- ожоговая болезнь
- обширный инфаркт миокарда
- травматические повреждения мышечной ткани
При тяжелых заболеваниях печени (цирроз тяжелой формы, некроз печени), когда сокращается количество активных клеток печени, а также при дефиците витамина В6, в крови наблюдается снижение активности АЛТ.
Кровь для определения активности АЛТ берется из вены, утром, натощак. Специальной диеты не требуется. Однако стоит проконсультироваться с врачом и отменить на несколько дней прием лекарств, которые вызывают изменение активности АЛТ. Активность АЛТ оценивают ферментативным методом, который специфичен, достаточно прост в использовании и не требует длительной и особой пробоподготовки. AСТ - строение и функция фермента Аспартатаминотрансфераза (АСТ, АсАТ) – фермент из группы трансаминаз, который осуществляет перенос аминокислоты аспартата с одной биологической молекулы на другую. Коферментом АСТявляется витамин В6. АСТ является внутриклеточным ферментом, то есть в норме находится в клетках. В клетках фермент может присутствовать в цитоплазме и митохондриях. Наибольшая активность АСТ выявлена в сердце, печени, мышцах и почках. В крови присутствует в основном цитоплазматическая фракция АСТ. Возможны более высокие значения активности АСТ у здоровых людей (физиологические) при чрезмерных мышечных нагрузках, приеме некоторых лекарств, например, эхинацеи,валерианы,алкоголя, больших доз витамина А, парацетамола, барбитуратов, антибиотиков и т.д.| 15-31 | Ед/л | |
| 20-40 | Ед/л |
- гепатиты
- некроз печени
- цирроз
- алкоголизм
- рак печени и метастазы в печени
- инфаркт миокарда
- наследственные и аутоиммунные заболевания мышечной системы (миодистрофия Дюшена)
- мононуклеоз
- гепатоз
- холестаз
Низкая активность АСТ наблюдается при дефиците витамина В6 и наличии обширных повреждений печени (некроз, цирроз).
Однако в клинике используют определение активности АСТ в основном для диагностики повреждений сердца и печени. При других патологических состояниях активность фермента также изменяется, однако ее изменение не является специфичным, следовательно, не представляет высокой диагностической ценности.Коэффициент де Ритиса. Как отличить инфаркт от повреждения печени
Для дифференциальной диагностики повреждений печени или сердца используют коэффициент де Ритиса. Коэффициент де Ритиса – это соотношение активности АСТ/АЛТ, который в норме составляет 1,3. Увеличение коэффициента де Ритиса выше 1,3 характерно для инфаркта миокарда, и снижение его ниже 1,3 – выявляется при заболеваниях печени. Щелочная фосфатаза (ЩФ) – является мембранным ферментом, который локализован в щеточной каемке желчных канальцев. ЩФ может быть кишечной, плацентарной и неспецифичной (в тканях печени, почек и костей). Данный фермент является ключевым в обмене фосфорной кислоты.| 30-90 | Ед/л | |
| до 400 | Ед/л | |
| до 250 | Ед/л |
Щелочная фосфатаза в диагностике заболеваний печени и желчных путей
Высокой специфичностью и диагностическим значением обладает определение активности ЩФ при подозрении на заболевания печени. При обтурационной желтухе происходит увеличение активности ЩФ крови в 10 раз относительно нормы. Определение данного показателя используется для лабораторного подтверждения именно этой формы желтухи. В меньшей степени увеличение активности ЩФ происходит при гепатитах, холангитах, язвенном колите, кишечных бактериальных инфекциях и тиреотоксикозе.Значение щелочной фосфатазыпри заболеваниях костей и в травматологии
ЩФ является маркерным ферментом остеосинтеза, то есть увеличивается активность при заболеваниях костей или метастазах опухолей в кость, а также при заживлении переломов. Высокую активность ЩФ выявляют при следующих патологиях:- обтурационная желтуха
- опухоли кости или метастазы в кости
- гипертиреоз
- заболевания крови (миеломная болезнь, лимфогранулематоз, мононуклеоз)
- рахит
- деструктивные заболевания печени (цирроз, рак, туберкулез)
- белые инфаркты (почки, легкого)
- амилоидоз
Автор: Наседкина А.К.
www.polismed.com
Анализ на ферменты печени. Анализ кала. Биохимический анализ.
В этой статье описаны методы диагностики заболеваний печени. Приводятся нормы концентрации ферментов по результатам биохимического анализа.
Анализ на Ферменты печени
Печень – особый орган. Это один из самых больших внутренних органов человека. Печень имеет свойство регенерации, она очищает наш организм от ядов, помогает справляться с обменом веществ. Выполняя огромный объем работы, печень может прийти в негодность. Поэтому очень важно отслеживать уровень концентрации ферментов печени – это и есть показатели ее функциональности.
Фермент или энзим – это молекула белка, позволяющая повысить темп протекания химических реакций, происходящих в человеческом теле. Ученых, которые занимаются исследованием ферментов, называют энзимологами.
Анализ кала
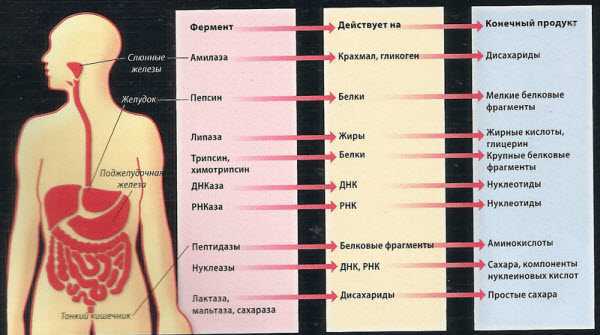
Анализ кала помогает определить отклонения ферментативной функции желудка, печени, поджелудочной железы.
Оттенок кала придает ему особый пигиент – стекробилин. Изменение цвета кала – один из главных симптомов болезней. При изменении структурного состава кала в анализе можно выявить гной, кров и даже паразитов. Обнаружение в анализе кала значительного количества белковых соединений означает дисфункцию поджелудочной железы либо проблем с желудком. При микроскопическом исследовании кала определяют основные элементы кала: мышечные волокна, растительную клетчатку, нейтральный жир, жирные кислоты и их соли, лейкоциты, эритроциты, клетки кишечного эпителия, клетки злокачественных новообразований, а также слизь, простейших, яйца гельминтов.
Биохимический анализ на ферменты. Какие ферменты на что влияют
С помощью биохимического анализа можно определить состояние эндокринной системы (по уровню концентрации гормонов), активность внутренних органов (по уровню концентрации ферментов), а также выявить недостаток витаминов в организме.
АЛТ (аланинаминотрансфераза), АСТ (аспартатаминотрансфераза), ПТ, щелочная фосфатаза, холиэнстераза – вот показатели биохимического анализа, по которым выявляют дисфункцию печени. Скачок содержания амилазы скажет специалисту о дисфункции поделудочной системы, увеличенная концентрация креатина укажет на заболевания мочевыводящей системы, увеличенное содержание ДЦГ, КФК-МВ – симптомы сердечнососудистых болезней.
АЛАНИНАМИНОТРАНСФЕРАЗА (АлАТ)
Сердечные и скелетные мышцы, а также печень выделяют фермент аланинаминотрансферазу.
Причинами увеличенного содержания алат могут быть:
- деструкция печеночной ткани вследствие различных заболеваний (цирроз, некроз) и злоупотребление алкогольными веществами;
- инфаркт сердечной мышцы;
- мышечная дистрофия как последствие перенесенных болезней, серьезных травм;
- получение ожогов;
- передозировка лекарств (печень не успевает справляться с нагрузками).
Концентрация АлАТ уменьшена при недостаточном поступлении витамина В6 в организм.
Нормальные показатели концентрации АЛТ:
- мужской пол – не более 31 единицы
- женский пол – не более 41 единицы.
Аспартатаминотрансфераза (АсАТ)
Сердечные и скелетные мышцы, а также печень и клетки крови выделяют фермент аспартатаминотрансферазу.
Причинами увеличенного содержания АсАТ могут быть:
- разрушение печени в результате заболевания гепатитом, появления образований в печени, злоупотребление алкоголем, передозировка лекарств;
- высокий уровень интенсивности и продолжительности физических нагрузок;
- инфаркт, общие проблемы сердечно-сосудистой системы;
- перегрев тела, ожоги.
Нормальные показатели концентрации АсАТ:
мужской пол – не более 31 единицы
женский пол – не более 41 единицы.
Гамма-глутамилтрансфераза (гамма-гт)
Гт выделяют клетки печени, щитовидной, предстательной и поджелудочной железы.
Причинами увеличенного содержания ГТ могут быть:
- разрушение печени в результате заболевания гепатитом, появления образований в печени, злоупотребление алкоголем, передозировка лекарств;
- заболевания поджелудочной железы (панкреатит, сахарный диабет);
- дисфункция щитовидной железы;
- онкологические проблемы предстательной железы.
- уменьшенная концентрация гт характерна при заболевании гипотерозом (разладом щитовидной железы)
Нормальные показатели концентрации гт:
- мужской пол – не более 32 единицы
- женский пол – не более 49 единицы.
Для малышей до года нормальными считаются показатели гт в несколько раз превышающие показатели взрослого.
Амилаза
Амилаза вырабатывается в процессе работы поджелудочной и околоушной слюнной желез.
Причинами увеличенного содержания амилазы могут быть:
- панкреатит (воспаление поджелудочной железы);
- паротит (воспаление околоушной слюнной железы).
- уменьшенная концентрация амилазы свидетельствует о:
- заболевании мусковисцидозом;
- дисфункции поджелудочной системы.
Нормальные показатели концентрации альфа-амилазы от 30 до 100 единиц. для панкреатической амилазы нормой считается не более 50 единиц.
Лактат
Лактат или молочна кислота — это ферменты, какие вырабатываются в процессе жизнедеятельности клеток, в основном в мышечной ткани. молочная кислота откладывается в случае нехватки мышцам кислорода (гипоксии), провоцируя ощущение физического изнеможения. если кислорода достаточно, лактат разлагается на простые вещества и естественным способом удаляется из организма.
Причины повышенной концентрации молочной кислоты в мышцах:
- несбалансированное и нерегулярное питание;
- передозировка лекарств;
- частые физические нагрузки;
- инсулиновые инъекции;
- заболевание гипоксией;
- заболевание пиелонефритом (инфекционное заболевание песени);
- заключительная стадия беременности;
- продолжительное злоупотребление алкогольных веществ.
Нормальные показатели:
- дети до полугода – не более 2000 единиц;
- дети от 0,5 до 2 лет – не более 430 единиц;
- дети от 2 до 12 лет – не более 295 единиц;
- дети и взрослые – до 250 единиц.
Креатинкиназа
Этот фермент выделяют мышцы опорно-двигательной и сердечно-сосудистой системы, в некоторых случаях — гладкие мышцы половых органов и органов желудочно-кишечного тракта
Фермент, содержащийся в скелетных мышцах, сердечной, реже — в гладких мышцах — матке, органах желудочно-кишечного тракта.
Причины возрастания концентрации креатинкиназы:
- инфаркт сердечной мышцы;
- разрушение мышечной ткани (вследствие серьезных травм, операций, болезней мышц);
- поздние сроки беременности;
- серьезные травмы головы;
- злоупотребление алкоголем.
- уменьшение концентрации креатинкиназы наблюдается в случаях:
- недостаточно развитой мускулатуры тела;
- сидячей работой, пассивным, неспортивным образом жизни.
Нормой считают уровень концентрации не более 24 единиц.
Лактатдегидрогеназа (ЛДГ)
Этот фермент продуцируют клетки большинства тканей организма.
Внутриклеточный фермент, образующийся во всех тканях организма.
Причины увеличенной концентрации лдг:
- деструкция кровяносных телец (при заболевании анемией);
- инфекционные болезни печени (цирроз, гепатиты, желтуха);
- инфаркт сердечной мышцы;
- образование злокачественных опухолей, рак крови.
- поражение инфекцией внутренних органов.
Нормальные показатели ЛДГ:
- у младенцев – не более 2000 единиц;
- у детей до 2 лет – 430 единиц:
- дети от 2 д 12 лет – 295 единиц:
- дети и взрослые старше 12 лет – 250 единиц.
testanaliz.ru
Анализы на ферменты поджелудочной железы
Как определить недостаточность, и с чего начать лечение?
Анализ на ферменты поджелудочной железы – один из первых этапов диагностики органа. Неполадки в работе пищеварительной системы не терпят попустительского отношения. За банальным, на первый взгляд, отравлением может скрываться куда более ужасающее явление: панкреатит, рак, проблемы с кишечником, желчным пузырем, селезенкой, желудком и пр. Любое из этих нарушений может проявиться рвотой, поносом, тошнотой, запором – вот в чем таится основная сложность постановки диагноза. Схожая симптоматика требует более глубокого исследования. Прояснить картину призван и анализ на ферменты. Повышение или понижение показателей подскажет доктору не только возможные причины случившегося, но и как действовать далее.
Лабораторные анализы – помощь в раскрытии секретов работы поджелудочной железы
Роль ферментов в здоровье поджелудочной железы
Несмотря на то, что орган находится позади желудка, именуется он поджелудочной железой. Своему названию она обязана факту, что в лежащем положении действительно оказывается внизу, то есть под желудком. На нее возложены важнейшие функции экзокринной и эндокринной направленности.
-
Внешне секреторная часть органа синтезирует и секретирует ферменты, с помощью которым обеспечивается переваривание жиров и белков.
-
Железа вырабатывает липолитические и протеолитические ферменты, а также бикарбонаты, которые подавляют кислотность желудочного сока.
-
Островковая ткань реализует эндокринный характер. В ней происходит выработка и секреция соматостатина и панкреатического полипептида, а также инсулина и глюкагона, регулирующих показатель глюкозы и транспортировку по тканям.
Воспаление поджелудочной приводит к сбоям пищеварительной системы. Когда панкреатит обретает хронический характер, начинают развиваться эндокринные патологии, например, сахарный диабет.
Среди основных причин воспалительного процесса поджелудочной:
-
Наследственные и аутоиммунные заболевания;
-
Вирусные инфекции, травмы, интоксикация;
-
Лекарственные средства, такие так эстрогены, фуросемид, азатиоприн и пр.
-
Дисфункция печени, желчного пузыря.
-
Чрезмерное употребление алкоголя.
При остром и хроническом панкреатите, повреждении органа пациенты испытывают чувство жжения и болезненность в области под мечевидным отростком и спине, испытывают рвотные позывы, отмечают повышение температуры. Как следствие наблюдается панкреатическая недостаточность, снижение массы тела, асцит.
Ферменты, продуцируемые поджелудочной железой
Человеческая поджелудочная железа вырабатывает следующие ферменты:
-
Амилазу, входящую в состав панкреатического сока и расщепляющую углеводы.
-
Липазу – составляющую панкреатического сока, расщепляющую жиры.
-
Протеазы – группа ферментов, расщепляющих пептидную связь меж аминокислот в белках (эластазы, химотрипсин, трипсин, карбоксипептидаза)
-
Нуклеазы, отвечающие за распад нуклеиновых кислот;
-
Стеапсин, провоцирующий распад жиров.
Референсные значения: каковы нормы?
Норма С-пептида варьируется на отметке в: 0,8 — 7,2 нг/мл.
Хорошие показатели глюкозы в плазме (ммоль/л.):
Аланинаминотрансфераза (МЕ/л.):
-
1 дня – 0 – 34
загрузка...
Гамма-глютамилтранспептидаза (Ед/л.):
Липаза (МЕ/л.):
Общая амилаза в сыворотке в норме составляет от 29 до 99 Ед/л.
С-реактивный белок, количественно (высокочувствительный метод): 0 — 1 мг/л.
CA 19-9: 0 — 34 Ед/мл.
Билирубин общий (мкмоль/л.):
Холинэстераза в сыворотке (Ед/мл.):
-
Мужчины: 3,94 — 11,4
-
Женщины: 4,63 — 11,4
Вышеприведенные значения могут немного отличаться в различных лабораториях. Ориентируйтесь на показатели, указанные в конкретном исследовательском центре.
О чем говорят отклонения от нормы?
Если в крови зафиксировано увеличение амилазы, липазы и С-реактивного белка, это указывает на острый панкреатит. Об эндокринном нарушении свидетельствует изменение показателя глюкозы и С-пептида – это верный знак того, что панкреатическая ткань травмирована. Это уже характерно для хронического воспалительного процесса. При увеличении СА 19-9 онкомаркера и переменах в биохимии возникают подозрения о раке железы. Реактивный панкреатит и камень в желчном протоке проявляются повышенной концентрацией билирубина, липазы, амилазы, гамма-ГТ, АЛТ, холинэстеразы.
Когда какие-то из вышеуказанных показателей отклоняются от нормы, рано говорить о достоверном диагнозе. Прежде, чем приступать к лечению в обязательном порядке назначают и ряд других исследований.
Лабораторная диагностика состояния поджелудочной железы включает:
-
Общий анализ крови. Если воспаление имеет место быть, повышенными оказываются СОЭ, сегментоядерные и палочкоядерные нейтрофилы, лейкоциты.
-
Биохимию крови. Желтушный панкреатит подтверждает завышенный прямой или общий билирубин. Также воспалительный процесс подтверждает повышенный показатель серомукоида, сиаловых кислот, гамма-глобулинов.
-
Анализы на уровень альфа-амилаза, трипсина, липаза, глюкозы.
-
Мочу на амилазу, пробу Ласуса.
-
Копрограмму. При дефиците ферментов найдутся жиры, крахмал, мышечные волокна и клетчатка.
-
Гликоамилаземическую пробу.
-
Прозериновый тест.
-
Йодолиполовый тест.
-
Секретин-панкреозиминовую пробу.
-
Тест на толерантность к глюкозе.
Кроме того, при необходимости могут быть назначены рентгенологические и ультразвуковые методы, магнитно-резонансная томография и пр.
pankreotit-med.com
Анализ на ферменты печени. Анализ кала. Биохимический анализ.
В этой статье описаны методы диагностики заболеваний печени. Приводятся нормы концентрации ферментов по результатам биохимического анализа.
Анализ на Ферменты печени
Печень – особый орган. Это один из самых больших внутренних органов человека. Печень имеет свойство регенерации, она очищает наш организм от ядов, помогает справляться с обменом веществ. Выполняя огромный объем работы, печень может прийти в негодность. Поэтому очень важно отслеживать уровень концентрации ферментов печени – это и есть показатели ее функциональности.
Фермент или энзим – это молекула белка, позволяющая повысить темп протекания химических реакций, происходящих в человеческом теле. Ученых, которые занимаются исследованием ферментов, называют энзимологами.
Анализ кала
Анализ кала помогает определить отклонения ферментативной функции желудка, печени, поджелудочной железы.
Оттенок кала придает ему особый пигиент – стекробилин. Изменение цвета кала – один из главных симптомов болезней. При изменении структурного состава кала в анализе можно выявить гной, кров и даже паразитов. Обнаружение в анализе кала значительного количества белковых соединений означает дисфункцию поджелудочной железы либо проблем с желудком. При микроскопическом исследовании кала определяют основные элементы кала: мышечные волокна, растительную клетчатку, нейтральный жир, жирные кислоты и их соли, лейкоциты, эритроциты, клетки кишечного эпителия, клетки злокачественных новообразований, а также слизь, простейших, яйца гельминтов.
Биохимический анализ на ферменты. Какие ферменты на что влияют
С помощью биохимического анализа можно определить состояние эндокринной системы (по уровню концентрации гормонов), активность внутренних органов (по уровню концентрации ферментов), а также выявить недостаток витаминов в организме.
АЛТ (аланинаминотрансфераза), АСТ (аспартатаминотрансфераза), ПТ, щелочная фосфатаза, холиэнстераза – вот показатели биохимического анализа, по которым выявляют дисфункцию печени. Скачок содержания амилазы скажет специалисту о дисфункции поделудочной системы, увеличенная концентрация креатина укажет на заболевания мочевыводящей системы, увеличенное содержание ДЦГ, КФК-МВ – симптомы сердечнососудистых болезней.
АЛАНИНАМИНОТРАНСФЕРАЗА (АлАТ)
Сердечные и скелетные мышцы, а также печень выделяют фермент аланинаминотрансферазу.
Причинами увеличенного содержания алат могут быть:
- деструкция печеночной ткани вследствие различных заболеваний (цирроз, некроз) и злоупотребление алкогольными веществами;
- инфаркт сердечной мышцы;
- мышечная дистрофия как последствие перенесенных болезней, серьезных травм;
- получение ожогов;
- передозировка лекарств (печень не успевает справляться с нагрузками).
Концентрация АлАТ уменьшена при недостаточном поступлении витамина В6 в организм.
Нормальные показатели концентрации АЛТ:
- мужской пол – не более 31 единицы
- женский пол – не более 41 единицы.
Аспартатаминотрансфераза (АсАТ)
Сердечные и скелетные мышцы, а также печень и клетки крови выделяют фермент аспартатаминотрансферазу.
Причинами увеличенного содержания АсАТ могут быть:
- разрушение печени в результате заболевания гепатитом, появления образований в печени, злоупотребление алкоголем, передозировка лекарств;
- высокий уровень интенсивности и продолжительности физических нагрузок;
- инфаркт, общие проблемы сердечно-сосудистой системы;
- перегрев тела, ожоги.
Нормальные показатели концентрации АсАТ:
мужской пол – не более 31 единицы
женский пол – не более 41 единицы.
Гамма-глутамилтрансфераза (гамма-гт)
Гт выделяют клетки печени, щитовидной, предстательной и поджелудочной железы.
Причинами увеличенного содержания ГТ могут быть:
- разрушение печени в результате заболевания гепатитом, появления образований в печени, злоупотребление алкоголем, передозировка лекарств;
- заболевания поджелудочной железы (панкреатит, сахарный диабет);
- дисфункция щитовидной железы;
- онкологические проблемы предстательной железы.
- уменьшенная концентрация гт характерна при заболевании гипотерозом (разладом щитовидной железы)
Нормальные показатели концентрации гт:
- мужской пол – не более 32 единицы
- женский пол – не более 49 единицы.
Для малышей до года нормальными считаются показатели гт в несколько раз превышающие показатели взрослого.
Амилаза
Амилаза вырабатывается в процессе работы поджелудочной и околоушной слюнной желез.
Причинами увеличенного содержания амилазы могут быть:
- панкреатит (воспаление поджелудочной железы);
- паротит (воспаление околоушной слюнной железы).
- уменьшенная концентрация амилазы свидетельствует о:
- заболевании мусковисцидозом;
- дисфункции поджелудочной системы.
Нормальные показатели концентрации альфа-амилазы от 30 до 100 единиц. для панкреатической амилазы нормой считается не более 50 единиц.
Лактат
Лактат или молочна кислота — это ферменты, какие вырабатываются в процессе жизнедеятельности клеток, в основном в мышечной ткани. молочная кислота откладывается в случае нехватки мышцам кислорода (гипоксии), провоцируя ощущение физического изнеможения. если кислорода достаточно, лактат разлагается на простые вещества и естественным способом удаляется из организма.
Причины повышенной концентрации молочной кислоты в мышцах:
- несбалансированное и нерегулярное питание;
- передозировка лекарств;
- частые физические нагрузки;
- инсулиновые инъекции;
- заболевание гипоксией;
- заболевание пиелонефритом (инфекционное заболевание песени);
- заключительная стадия беременности;
- продолжительное злоупотребление алкогольных веществ.
Нормальные показатели:
- дети до полугода – не более 2000 единиц;
- дети от 0,5 до 2 лет – не более 430 единиц;
- дети от 2 до 12 лет – не более 295 единиц;
- дети и взрослые – до 250 единиц.
Креатинкиназа
Этот фермент выделяют мышцы опорно-двигательной и сердечно-сосудистой системы, в некоторых случаях — гладкие мышцы половых органов и органов желудочно-кишечного тракта
Фермент, содержащийся в скелетных мышцах, сердечной, реже — в гладких мышцах — матке, органах желудочно-кишечного тракта.
Причины возрастания концентрации креатинкиназы:
- инфаркт сердечной мышцы;
- разрушение мышечной ткани (вследствие серьезных травм, операций, болезней мышц);
- поздние сроки беременности;
- серьезные травмы головы;
- злоупотребление алкоголем.
- уменьшение концентрации креатинкиназы наблюдается в случаях:
- недостаточно развитой мускулатуры тела;
- сидячей работой, пассивным, неспортивным образом жизни.
Нормой считают уровень концентрации не более 24 единиц.
Лактатдегидрогеназа (ЛДГ)
Этот фермент продуцируют клетки большинства тканей организма.
Внутриклеточный фермент, образующийся во всех тканях организма.
Причины увеличенной концентрации лдг:
- деструкция кровяносных телец (при заболевании анемией);
- инфекционные болезни печени (цирроз, гепатиты, желтуха);
- инфаркт сердечной мышцы;
- образование злокачественных опухолей, рак крови.
- поражение инфекцией внутренних органов.
Нормальные показатели ЛДГ:
- у младенцев – не более 2000 единиц;
- у детей до 2 лет – 430 единиц:
- дети от 2 д 12 лет – 295 единиц:
- дети и взрослые старше 12 лет – 250 единиц.
Анализ крови на ферменты
Анализ крови на ферменты являются основной частью методов установления патологий и болезней, который основан на выяснении степени активности энзимов. Эти исследования проводятся под четким руководством науки под названием ензимодиагностика. Отдельной группой среди методов этой науки является диагностики различных иммунных ферментов.
Суть данного метода заключается во внедрении в организм человека антител, которые с помощью химических связей соединяются с ферментом, образуют с антителом антиген, с легкостью потом что обнаруживаются в биологических жидкостях. Этот метод способствует качественному и количественному определению наличия тех или иных ферментов в организме. Основной задачей энзимологии является определение очагов, где сконцентрировано патологическое количество ферментов. Это место и является болезнетворным в организме.
Также выделяют ряд энзимов, которые слишком активны при наличии отмерших клеток. Такими ферментами являются некротические вещества, остро реагируют на наличие очагов поражения тканей и органов. Еще анализ на ферменты включает в себя тест, который выявляет изменение нормальной активности этих веществ, что свидетельствует о расстройствах в функционировании органов или их систем.
При диагностировании и выявлении дисфункции ферментов или отклонений от норм, необходимо сразу же обратиться к специалистам и начинать лечение.
Среди основных жизненно важных ферментов следует выделить следующие: амилаза, липаза, лактатдегидрогеназа, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза. Анализы на все перечисленные выше энзимы делают утром натощак. Для диагностики берут пробу крови из вены или из первой утренней мочи. Данные ферменты вырабатывают различные железы внутренней секреции нашего организма.
Отклонения от нормы распознают с помощью специальных лабораторных расшифровок на протяжении 1-2-х недель. В случае рецидивов и острой боли анализы берут в любое время суток, результаты объявляют в течение нескольких часов в экстренном порядке. В случае получения результатов теста, необходимо тут же обратиться к специалисту.
Диагностика активности амилазы
Начать следует с амилазы крови, которая вырабатывается поджелудочной железой и способствует быстрому протеканию процессов пищеварения. Основной функцией амилазы является расщепления крахмала или гликогена с образованием конечного продукта реакции — глюкозы. Наиболее распространенной в силу своей активности стала альфа-амилаза.
Нормальными показателями амилазы в человеческом теле считаются:• в крови 16-30 мк катал / л-
• в моче 28-100 мк катал / л
Цифры по активности амилазы показывают ряд патологий поджелудочной железы и различных форм панкреатита. При пониженных показателях амилазы в моче и крови больному можно диагностировать муковисцидоз или перенесенный приступ панкреатита. Повышение показателей амилазы свидетельствуют о сильном алкогольном отравлении, свинке, внематочной беременности, обострении панкреатита, о камнях, опухолях в поджелудочной железе.
А повышенная амилаза в моче извещает о холецистите, аппендиците, панкреатите или язву желудочно-кишечного тракта.
Вернуться к змистуДиагностика активности липазы
Липазой называют фермент, который участвует в трансформации жиров. Этот фермент проявляет свою активность только в присутствии кофермента колипази и желчных кислот. В выработке липазы организм задействует поджелудочную железу, форменные клетки крови — лейкоциты и легкие. Нормальными показателями активности липазы в крови является 13-60 ЕД / мл. Тест на липазу более специфический, чем на амилазу. Гиперсодержание липазы в крови свидетельствует о холестазе, язвах, сахарном диабете, холециститах, ожирении и подагре. Гипосодержание липазы говорит о различных опухолях, в основном поражают поджелудочную железу, о неправильном питании или триглицеридемии.
Вернуться к змистуДиагностика активности лактатдегидрогеназы
Основным местом нахождения лактатдегидрогеназы есть сердце, клетки тканей мышц, печень, селезенка, почки и поджелудочная железа. Лактат дегидрогеназа проявляется свою активность с ионами цинка и никотин-амидадениндинуклеотидом. Лактат дегидрогеназа превращает молочную кислоту в пировиноградную.
В организме человека существует 5 фракций данного энзима. Именно по наличию того или юного вида и диагностируются болезни.
Так, например, при повышении лактатдегидрогеназы 1 можно диагностировать инфаркт миокарда, а за счет выявления сильной активности фракций 4 и 5 можно определить гепатит. Нормой лактатдегидрогеназы в организме взрослого человека является 140-350 Ед / л, а у новорожденных — 400-700 Ед / л. Причинами повышенной лактатдегидрогеназы в организме можно считать инфаркт миокарда, цирроз печени, опухоли, лейкоз, панкреатит, заболевания почек, анемию и гепатит.
Вернуться к змистуДиагностика активности аланинаминотрансферазы и аспартатаминотрансферазы
Аланинаминотрансфераза является ферментом, который способствует перемещению аминокислот с одной молекулы на другую. Этот энзим работает в присутствии витамина В6 и синтезируется в основном в клетках почек, печени, мышц, сердца и поджелудочной железы. Отсюда следует, что содержание данного фермента в крови приравнивается к нулю. Нормальным содержанием этого фермента у мужчин считается до 40 Ед / л, а у женщин до 32 Ед / л.
Высокое содержание аланинаминотрансферазы свидетельствует о циррозе, желтухе, раке печени, ожогах, инфаркте и гепатите. Пониженная активность говорит о циррозах и некрозах печени.
По данным Аспартатаминотрансфераза в паре работает также витамин В6. Аспартатаминотрансфераза находится в основном в митохондриях и цитоплазме клеток. Нормальным содержанием этого энзима считается: у мужчин 15-31 Ед / л, а у женщин 20-40 Ед / л.
Аспартатаминотрансфераза повышена в случаях гепатита, алкоголизма, мононуклеоза, рака печени, цирроза, холестаза и инфаркте миокарда. кроме того, повышение активности данного фермента вызывают ожоги, тепловые удары, травмы, отравления, а снижение — при повреждениях печени и недостатке витамина В6.
Вернуться к змистуДиагностика активности щелочной фосфатазы
Щелочная фосфатаза является фермент мембран клеток, которые находятся в основном в желчных каналах. Основное участие этот фермент принимает в обмене фосфорной кислоты. Он имеет различные формы: плацентарную, неспецифическую и кишечную. Щелочная кислота помогает диагностировать передозировки витамином С, недостаток кальция и фосфора, заболевания желчных путей и печени, расстройства в поджелудочной железе и заболевания костей.
Нормой содержания этого фермента в человеческом организме есть: у взрослых 30-90 Ед / л, у подростков 400 и менее Ед / л, а у беременных до 250 Ед / л. Повышение лужноїфосфатази свидетельствует о гипертиреозе, болезнях крови, рахите, желтухе, опухолях костей и заболеваниях печени, почек и легких. Низкая активность щелочной фосфатазы свидетельствует об анемии, нехватке полезных веществ, гипертиреозе и нарушениях костей скелета.
Помните, что данные анализы сдаются на голодный желудок с соблюдением определенной диеты за 24 часа перед посещением больницы.Она заключается в отсутствии жирной, острой и жареной пищи в рационе питания.
В случае любых отклонений после получения расшифрованных результатов следует немедленно обратиться к врачу.
Будьте здоровы!
Назначение анализа на ферменты поджелудочной – определение главных помощников пищеварения
Сдать анализ на ферменты рекомендовано всем, кто имеет частые нарушения в работе пищеварительной системы, дискомфорт после приёма некоторых продуктов. Часто симптомы интоксикации, принятые за банальное пищевое отравление, могут свидетельствовать о панкреатите, онкологии и других опасных патологиях.
Поставить диагноз на одной только симптоматике невозможно – потребуется более детальная диагностика, которая помимо аппаратного исследования будет включать сдачу анализов на ферменты поджелудочной железы. Отклонение от нормы в большую или меньшую степень помогут специалисту разобраться в причине нарушения и назначить квалифицированную терапию.
Проведение лабораторной диагностики
Анализы на ферменты поджелудочной железы входят в комплекс других лабораторных исследований, которые помогают увидеть полную картину происходящих изменений. Исследуют при этом комплексно кровь, урину и кал (более точная картина и большая вероятность получения достоверных результатов), реже проводится только анализ крови. Чтобы определить тяжесть патологии, дополнительно исследуют печень.
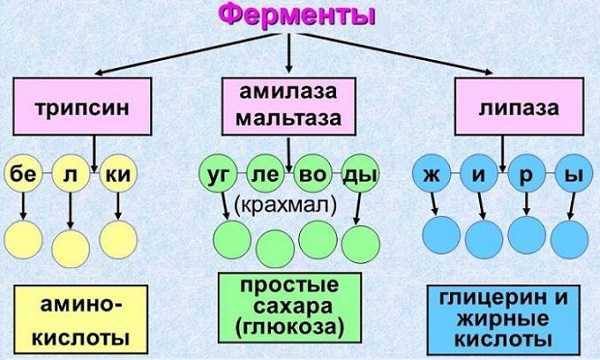
Диагностику железистого органа проводят с помощью:
- Общего анализа крови. Если в поджелудочной протекает острый или хронический процесс, повышаются лейкоциты, палочкоядерные и сегментоядерные нейтрофилы.
- Биохимического исследования крови. Можно увидеть наличие билирубина и его количество, повышение уровня гамма-глобулинов и других веществ.
- Специальные анализы крови для поджелудочной берут с целью выявить насколько хорошо работает орган. Для этого исследуют альфа-амилазу (в норме она должна быть в пределах 29 г/л в час), трипсин, липазу, глюкозу, которая повышается на фоне воспалительного или деструктивного процесса эндокринного сегмента органа.
Как определить ферменты для поджелудочной железы? Трипсин, липазу и амилазу выявляют первично натощак через содержимое в двенадцатиперстной кишке, после вводят разведённый раствор кислоты соляной и проводят исследование повторно. При нормальном состоянии и функционировании органа количество ферментов будет немного выше в последнем исследовании, если есть хроническая форма панкреатита – ферменты будут одинаково снижены.
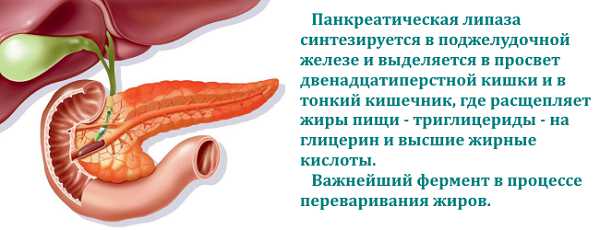
Сдать анализ урины рекомендовано на определение амилазы и аминокислоты. Поражение органа проявится повышением данных веществ. Копрограмму назначают для определения в кале жиров, крахмала, не переваренной клетчатки и мышечных волокон.
Раннее кровь на ферменты брали с целью выявить количество амилазы. Острый и хронический процесс в органе сопровождается повышением вещества до 35 г/л в час. Панкреонекроз, при котором происходит отмирание сегментов органа, характеризуется снижением количества амилазы в крови (от 15 г/л в час и ниже).
Сейчас проводят определение уровня эластазы. В случае неправильной работы эндокринного органа панкреатическая эластаза снижается до 190 мкг/г, при патологическом процессе ниже 99 мкг/г.
Помимо исследования биологических материалов назначают УЗИ, МРТ, рентген.
Подготовка к процедуре
Чтобы получить правильные результаты исследования, перед тем, как сдать анализ на ферменты поджелудочной железы, следует немного подготовиться. Исключение составляет только подозрение на серьёзный патологический процесс, требующий немедленной диагностики и лечения.
Правила подготовки к сдаче анализа:
- кровь на исследование сдаётся утром, на голодный желудок – пить или есть за несколько часов до анализа запрещено;
- в течение нескольких суток до процедуры запрещено употреблять жирные и острые блюда;
- обязательно врач перед забором крови должен быть осведомлён о принимаемых препаратах;
- сдавать анализ поджелудочной железы на ферменты следует в спокойном состоянии – физическом и эмоциональном;
- обязательно нужно исключить курение и употребление кофе до процедуры;
- в течение 24 часов накануне исследования исключается приём спиртных напитков.
Чтобы определить уровень амилазы (данная процедура проводится, но реже, чем выявление эластазы), специалист возьмёт кровь из вены. После во взятый материал введётся определённое количество углеводов. По тому, как быстро они будут расщепляться, выявляют количество фермента. Определить уровень амилазы можно, сдав на анализ урину.
Патологические причины отклонения от нормы
Анализ на ферменты для поджелудочной железы поможет определить наличие нарушений. В частности повышение амилазы может наблюдаться на фоне:
- воспаления органа, протекающего в хронической или острой форме;
- онкологии поджелудочной железы (опасное состояние, требующее незамедлительного лечения);
- перитонита;
- патологий мочевыделительных органов;
- паротита;
- воспалительного процесса в аппендиксе;
- «сахарной» болезни;
- сбоя в работе желчного пузыря;
- цитомегалии;
- нарушения работы печени;
- кетоацидоза;
- стенозирующего папиллита.
Повыситься фермент может в результате вредного питания – употребление жирных и острых блюд, жареной, кислой, солёной пищи. Частые некачественные перекусы, замещающие полноценный приём пищи, могут стать причиной нарушений в работе пищеварительных органов, в том числе поджелудочной железы. Не последнюю роль в развитии патологии играет злоупотребление спиртными напитками.
Понижение амилазы наблюдается в результате онкозаболеваний железистого органа, острого или хронического гепатита, панкреонекроза, холецистита, муковисцидоза, патологического процесса в печени, при котором наблюдается большая часть поражения органа. При инфаркте миокарда часто понижается выработка фермента.
Функциональные и органические нарушения
Отклонение от нормы ферментов может произойти как следствие определённого процесса, протекающего в организме. В большинстве случаев при выявлении и устранении причины поджелудочная железа начинает работать в нормальном режиме, за исключением тех моментов, когда происходит необратимый процесс. Отклонение от нормы фермента может наблюдаться в результате:
- внематочной беременности;
- непроходимости кишечника;
- травм в области брюшной полости;
- инфекционных заболеваний вирусного происхождения;
- интоксикации;
- вируса герпеса 4-го типа;
- шокового состояния;
- макроамилаземии;
- генетического сбоя;
- удаления железистого органа.
Повышение или понижение амилазы может быть вызвано приёмом некоторых лекарственных препаратов. Обычно при отмене лекарства функциональность органа восстанавливается.
Своевременное обращение к врачу при возникновении неприятных симптомов (острых болей в области пупка, тошноты, рвоты) поможет не только наладить работу органов пищеварительной системы, но и спасти жизнь.
Сдать анализы на ферменты поджелудочной железы можно в любой специализированной или обычной клинике, где есть лаборатория и нужные реактивы. Стоимость такой процедуры будет зависеть от комплекса исследований, региона проживания и других моментов. Если человек находится на стационарном лечении, то возможен бесплатный вариант прохождения процедуры.
 Диагностическая лаборатория в Уфе
Диагностическая лаборатория в Уфе